魔芋根域优势真菌鉴定和化感作用及其生防放线菌的筛选
何 斐,张忠良,崔 鸣,薛泉宏
(1 西北农林科技大学 a 生命科学学院,b 林学院,c 资源环境学院,陕西 杨凌 712100;2 秦巴魔芋研究开发中心,陕西 安康 725000)
魔芋根域优势真菌鉴定和化感作用及其生防放线菌的筛选
何斐1a,张忠良1b,崔鸣2,薛泉宏1c
(1 西北农林科技大学 a 生命科学学院,b 林学院,c 资源环境学院,陕西 杨凌 712100;2 秦巴魔芋研究开发中心,陕西 安康 725000)
[摘要]【目的】 探索魔芋软腐病株根区、根表土壤及根系大量存在的优势真菌F3和F8是否具有致病性和化感活性;筛选针对该优势真菌及魔芋软腐病原细菌的高效广谱生防放线菌。【方法】 从魔芋健株和病株中分离F3和F8菌株,根据菌落形态及rDNA-ITS序列分析对2株真菌进行鉴定;离体侵染法测定菌株对魔芋球茎及胡萝卜离体组织的致病性;测定真菌粗毒素溶液对甜瓜种子萌发、幼苗生长的化感活性;采用琼脂块和发酵滤液法筛选能拮抗优势病原真菌和魔芋软腐病原细菌的生防放线菌。【结果】 ①在魔芋软腐病株根区、根表土壤及根系中存在大量的F3和F8,经鉴定,2株真菌分别为腐皮镰刀菌(Fusarium solani)和尖孢镰刀菌(Fusarium oxysporum),其发酵粗滤液对魔芋离体球茎及胡萝卜有致病性,其粗毒素溶液能抑制甜瓜种子萌发和幼苗生长。②筛选得到6株对优势病原真菌镰刀菌和魔芋软腐病原细菌均有较强拮抗作用的生防放线菌。【结论】 魔芋软腐病株根区、根表土壤及根系大量存在的优势真菌腐皮镰刀菌和尖孢镰刀菌具有致病性和化感抑制活性,是魔芋软腐病发生时的复合侵染有害菌之一;以2株镰刀菌为靶标菌筛选到的6株生防放线菌对魔芋软腐病株根域大量存在的优势有害真菌及软腐病原细菌均有较强的拮抗作用。
[关键词]魔芋;软腐病;腐皮镰刀菌;尖孢镰刀菌;化感作用;复合侵染
魔芋是重要的经济作物,目前我国魔芋种植面积居世界第一。随着种植面积及连作年限增加,魔芋病虫害日益严重。软腐病是普遍发生、危害最严重的魔芋土传和种传病害[1-2]。软腐病害的发生与软腐病原细菌致病有直接关系,也与魔芋根区、根表土壤和根系微生物区系异常密切相关。研究发现,在同一田块,生态条件及农艺措施基本相同,但魔芋软腐病株与健株根域的微生物区系存在显著差异(拟另文报道),其中有2株优势真菌F3和F8在病株根区、根表土壤及根系中大量存在,但在健株的相同部位未检出或数量很少。本研究拟对F3和F8 2株真菌进行分类鉴定,探索其是否具有致病性及化感活性,并筛选出对该菌及软腐细菌具有较强拮抗作用的放线菌,以期为魔芋软腐病发生的微生态机制研究提供科学依据,并为魔芋软腐病的防治提供生防菌株。
1材料与方法
1.1材料
供试放线菌:共662株,其中638株分离自陕西省岚皋县与镇安县农田魔芋、刺槐林魔芋根域土壤,24株来自本研究室的拮抗放线菌种质资源库。
软腐病原细菌:菊果胶杆菌(Pectobacteriumchrysanthemi,编号CZS-B6)、菊欧文氏菌(Dickeyadadantii,编号CZS-B4)及菊欧氏杆菌(Erwiniachrysanthemi,编号分别为CDS1-B1、CDS1-B2、CDS2-B1及CDS2-B2)[3]。以上6株菌均由西北农林科技大学资源环境学院微生物资源研究室分离鉴定并保存,其16S rRNA基因序列在GenBank的登录号依次为KJ145869、KJ145868、KJ145864、KJ145865、KJ145866及KJ145867。
培养基:牛肉膏蛋白胨琼脂培养基(BPA)、马铃薯蔗糖琼脂培养基(PDA)、高氏1号琼脂培养基(GA)和高氏1号液体培养基[4]。
1.2魔芋根域优势真菌的分离、鉴定及化感作用
1.2.1真菌分离2011-08在陕西省岚皋县蔺河乡立新村刺槐林下及魔芋农田,选取健康(Healthy plant,HP)和具有典型软腐症状(Diseased plant,DP)的魔芋植株,分别采集魔芋全植株及根际土壤带回实验室及时分离。参照文献[5]进行样品处理和根区、根表土壤及根系优势真菌的分离。病株(DP)优势真菌数量、比例较健株(HP)的增率均用ΔHP表示,按公式(1)计算:

(1)
1.2.2优势真菌鉴定对于分离得到的2株优势真菌F3和F8进行培养特征观察,将真菌于PDA培养基上28 ℃培养5 d,观察菌落颜色等特征。
rDNA-ITS序列分析:CTAB法[6]提取F3和F8菌株DNA,用真菌通用引物(ITS1:5′-TCCGTAGGTGAACCTGCGG-3′;ITS4:5′-TCCTCCGC-TTATTGATATGC-3′)进行PCR扩增。扩增产物送南京金斯瑞生物科技有限公司测序。用Blast方法从GenBank数据库中调取相关同源性高的序列,采用ClustalX 2.0软件对获得的序列进行序列同源性分析,用Mega 5.0软件中Neighbor-Joining法构建rDNA-ITS序列系统发育树。
1.2.3真菌致病性检测真菌粗滤液制备:将斜面上活化的优势真菌F3和F8接种至100 mL液体PDA培养基,28 ℃、150 r/min 摇床培养7 d,双层无菌纱布过滤得粗滤液,4 ℃保存备用。
真菌致病性:挑选健康魔芋和胡萝卜用自来水冲洗干净,750 mL/L 乙醇浸泡30 s,1 g/L升汞消毒3 min,无菌水冲洗6次。用直径1.5 cm无菌打孔器切取魔芋圆柱块;用无菌手术刀将胡萝卜切成厚度约1 cm的组织片,再用直径7 mm的无菌打孔器在胡萝卜片中央打孔,孔深度约为胡萝卜组织片厚度的4/5。将魔芋圆柱块和胡萝卜片用无菌水反复冲洗10次,分别置于装有无菌水保湿的双层滤纸培养皿中,每皿3个组织片(3个组织片分别来自不同的魔芋或胡萝卜个体),每处理3次重复。用无菌枪头吸取30 μL真菌粗滤液穿刺接种魔芋圆柱块[7],取100 μL真菌粗滤液接种至胡萝卜片中央小孔,以无菌水为对照,28 ℃保湿培养,观察记录发病情况[8]。
1.2.4真菌粗毒素的化感作用真菌粗毒素溶液的制备:将斜面上活化好的真菌F3和F8分别接种于100 mL液体PDA培养基的250 mL三角瓶中,28 ℃、150 r/min摇床振荡培养7 d,无菌双层纱布过滤。滤液经121 ℃高温湿热灭菌20 min,得到真菌粗毒素溶液,4 ℃保存备用。试验时将供试粗毒素溶液用无菌水依次稀释1,10,102,103和104倍,以无菌水(CK1)和液体PDA培养基无菌滤液(CK2)为对照[9]。
以甜瓜为指示植物进行种子萌发试验。选取颗粒饱满、大小一致的甜瓜种子,经100 g/L NaOCl消毒2 min,用无菌水反复冲洗5次后置于装有5 mL不同稀释倍数真菌粗毒素溶液的试管中。每处理重复3个试管,每试管10粒种子,以无菌水(CK1)和液体PDA培养基无菌滤液(CK2)为对照。于28 ℃避光浸种24 h后,无菌水反复冲洗种子5次,用无菌滤纸吸干表面水分。将种子按照不同处理分别放入加有1 mL无菌水浸润灭菌滤纸的培养皿中,28 ℃培养96 h后统计种子发芽率,测量甜瓜幼苗胚根、胚轴长度,称取鲜质量。根据下式分别计算发芽率、发芽指数[10]、简明活力指数[11]、侧根数及处理较对照的增幅ΔCK。
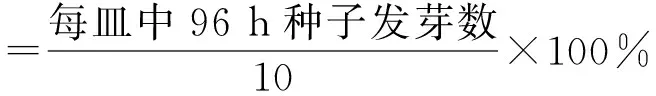
(2)

(3)
式中:Gt为每天发芽数;Dt为与Gt相对应的天数。
简明活力指数=发芽率×胚根长度(mm);
(4)
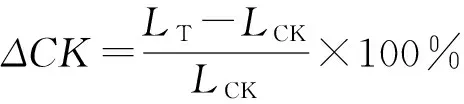
(5)
式中:LT为处理的各指标,LCK为对照的相应指标。
1.3拮抗放线菌的筛选
1.3.1拮抗性放线菌对优势真菌的拮抗作用放线菌琼脂块制备:挑取少量活化的放线菌,于已滴加0.1 mL无菌水的高氏1号培养皿上,涂布均匀,28 ℃培养7 d,用直径5 mm打孔器制成菌饼,备用。
优势真菌菌悬液的制备:向已培养4 d的优势真菌斜面中加入5 mL无菌水,用灭菌竹签将菌丝刮下、磨碎,搅匀制成菌悬液备用。
拮抗放线菌琼脂块初筛:采用琼脂块法进行初筛[12]。用1 mL无菌吸管吸取0.1 mL优势真菌菌悬液于PDA平皿上,涂布均匀,将已制备的放线菌琼脂块菌面向上接种于平皿中央。28 ℃培养4 d,待优势真菌均匀长满整个平皿后,采用十字交叉法测定拮抗环宽度(Width,W),观察拮抗圈透明度(Transparence,T)。拮抗圈的透明程度表示靶标菌(优势真菌)被抑制的程度:完全被抑制,表现为透明,用“++”表示;部分被抑制,表现为出现抑菌圈,但其中仍有菌丝生长,呈半透明,用“+”表示。按公式(6)计算拮抗环宽度(W):

(6)
式中:D为抑菌圈直径。
拮抗放线菌无菌发酵滤液的制备[12]:将初筛得到的拮抗放线菌于高氏1号斜面培养7 d,加无菌水5 mL,用无菌竹签将孢子刮下,搅匀制成孢子悬液。用无菌吸管吸1 mL孢子悬液于装有60 mL高氏1号液体培养基的250 mL三角瓶中,4层纱布封口,重复3瓶。28 ℃、150 r/min摇床振荡培养7 d,依次用滤纸过滤、0.45 μm微孔滤膜真空抽滤、0.45 μm灭菌微孔滤膜过滤除菌得无菌发酵滤液。
优势真菌琼脂块的制备:向已培养4 d的优势真菌斜面加入5 mL无菌水,用灭菌竹签将菌丝刮下、搅匀。用1 mL无菌吸管吸取0.1 mL菌悬液于PDA平皿上,用刮铲涂布均匀,28 ℃培养4 d后,用打孔器制成5 mm菌饼。
拮抗放线菌无菌发酵滤液的抑菌试验:将放线菌无菌发酵滤液与冷却至50 ℃的PDA培养基按体积比1∶4混匀后倒平板,以无菌水代替放线菌无菌发酵滤液为对照。用灭菌竹签挑取优势真菌琼脂块菌面向下接种于平皿中央,每处理重复3次。28 ℃培养,分别于培养24,48,72 h后采用十字交叉法测量菌落直径,按公式(7)计算抑菌率:

(7)
1.3.2拮抗放线菌对软腐病原菌的拮抗作用将初筛得到的拮抗放线菌于高氏1号斜面培养7 d,加无菌水5 mL,用无菌竹签将孢子刮下,搅匀制成孢子悬液,均匀涂布于高氏1号平皿,28 ℃倒置培养8 d,用打孔器制成7 mm菌饼。
软腐病菌菌悬液制备:将单个病原细菌克隆接种到牛肉膏蛋白胨液体培养基中,于28 ℃、150 r/min摇床振荡培养24 h后,4 ℃、12 000 r/min离心10 min,弃上清,加无菌水悬浮细菌。用A600光密度比浊法制备密度为108CFU/mL的菌悬液,备用。
拮抗放线菌对软腐病菌的拮抗作用:用1 mL无菌吸管吸取0.1 mL软腐病菌菌悬液于PDA平皿上,用刮铲涂布均匀。再将制成的放线菌菌饼菌面向上接种于靶标病原细菌平皿上,28 ℃正置培养1 d,观察拮抗圈透明度(Transparence,T)。拮抗圈的透明程度表示病原菌被抑制的程度:完全被抑制,表现为透明,用“++”表示;部分被抑制,表现为出现抑菌圈,但其中仍有病原菌生长,呈半透明,用“+”表示。采用十字交叉法测量拮抗圈直径(Diameter,D),按公式(8)计算拮抗环宽度(Width,W)[13]:

(8)
2结果与分析
2.1优势真菌在魔芋根域的分布
根域指根系密集分布的区域,包括作物根系及根区、根表土壤[4]。本研究从健康和软腐病魔芋植株根域土壤中发现2株优势真菌F3和F8。由表1可知,真菌F3和F8在魔芋软腐病株与健株根区、根表土壤及根系的分布存在明显差异。其中,真菌F3在软腐病株根区土壤中的检出量较农田和刺槐林健株分别增加216.7%和1 325.0%,差异均显著(P<0.05);在病株根表土壤中的数量较农田健株增加37.8%,差异显著(P<0.05),但刺槐林健株未检出。病株根表土壤真菌F8的数量较农田和刺槐林健株分别增加97.9%和330.3%,差异显著(P<0.05),且病株真菌F8在根区土壤及根系中的检出量分别为33.8×102和0.7×102CFU/g,但在农田和刺槐林健株根区土壤及根系均未检出。由此推测,魔芋软腐病株发病与其根区、根表土壤和根系中存在的真菌F3和F8有关,2株真菌可能具有一定的致病性。
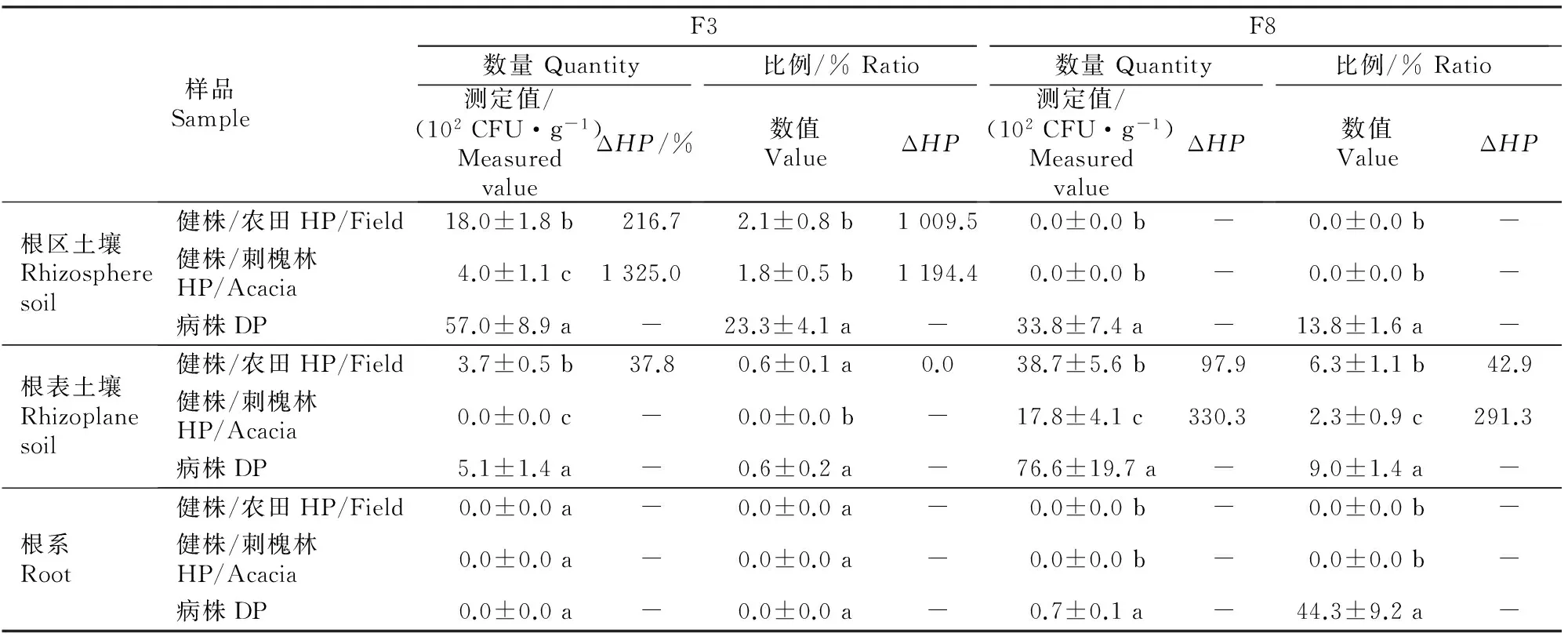
表 1 菌株F3和F8在魔芋根区、根表土壤及根系中的分布
注:同列数据后标不同小写字母表示差异显著(P<0.05)。
Note:Different lowercase letters in each column indicate significant difference (P<0.05).
2.2魔芋根域优势真菌的鉴定
对从魔芋根域分离得到的2株优势真菌F3和F8进行培养特征观察,结果见图1。由图1可见,魔芋根域优势真菌F3和F8在PDA培养基上生长5 d后,菌株F3菌丝平铺致密茂盛,气丝白色、中间微浅黄色,基丝黄色。菌株F8菌落突起呈絮状,菌丝微黄色致密茂盛,基丝浅黄色。

图 1 菌株F3(左)和F8(右)的形态特征观察
从图2可以看出,菌株F3与丛赤壳属(Nectria)和镰刀菌属(Fusarium)真菌聚在同一分支,其与腐皮镰刀菌(F.solani)相似度最大(100.0%),结合其菌落形态特征,将菌株F3鉴定为腐皮镰刀菌。菌株F8与镰刀菌属(Fusarium)相关菌株聚在同一分支,其与尖孢镰刀菌(F.oxysporum)的相似度最大(100.0%),结合形态特征,将菌株F8鉴定为尖孢镰刀菌。优势真菌F3和F8 的rDNA-ITS序列GenBank登录号分别为KJ145882和KJ145886。

图 2基于rDNA-ITS序列构建的真菌系统发育树
Fig.2Phylogenetic tree of fungi based on rDNA-ITS sequence
2.3魔芋根域优势真菌的致病性
由表2和图3可以看出,供试真菌腐皮镰刀菌(F3)和尖孢镰刀菌(F8)对魔芋球茎和胡萝卜组织具有一定的致病性。接种镰刀菌的魔芋球茎腐烂变软,有酒味和恶臭味,接种镰刀菌的胡萝卜病变组织呈黑褐色软腐,未接种对照无病症。2株镰刀菌对魔芋球茎侵染速度基本一致,尖孢镰刀菌(F8)对胡萝卜组织的致病作用较腐皮镰刀菌(F3)明显。

表 2 优势真菌菌株F3和F8的致病性检测
注:“-、+、++及+++”分别表示未侵染、1/3以下软腐、1/3~2/3软腐及2/3以上软腐。
Note:“-, +, ++ and +++” represent uninfected,soft rot area less than 1/3,soft rot area from 1/3 to 2/3 and soft rot area more than 2/3,respectively.

图 3菌株F3和F8的致病性表现
A1-A3.分别为无菌水对照、F3和F8对魔芋球茎的致病性;B1-B3.分别为无菌水对照、F3和F8对胡萝卜的致病性
Fig.3Pathogenicity of isolates F3 and F8
A1-A3.Pathogenicity of sterile water (control),F3 and F8 onA.konjaccorm,respectively;B1-B3.Pathogenicity of sterile water (control),F3 and F8 on carrot,respectively
2.4镰刀菌毒素的化感作用
2.4.1对甜瓜种子萌发的抑制作用由表3可以看出,腐皮镰刀菌(F3)、尖孢镰刀菌(F8)不同稀释倍数毒素滤液处理甜瓜种子萌发均受到抑制。F3毒素滤液不同稀释倍数处理甜瓜种子发芽率、发芽指数、简明活力指数及幼苗侧根数分别较对照降低3.7%~33.3%,2.6%~28.8%,7.9%~41.7%及2.0%~18.7%。F8毒素滤液不同稀释倍数处理甜瓜种子发芽率、发芽指数、简明活力指数及幼苗侧根数较对照分别降低3.7%~11.1%,1.9%~14.1%,5.7%~18.0%及2.9%~9.3%。
2.4.2对甜瓜幼苗生长的抑制作用由表4可以看出,腐皮镰刀菌(F3)毒素滤液不同稀释倍数处理甜瓜幼苗胚根长度、胚根鲜质量、胚轴长度及胚轴鲜质量分别较对照降低4.4%~21.3%,0.2%~3.3%,2.4%~18.0%及0.2%~11.1%。尖孢镰刀菌(F8)毒素对甜瓜幼苗生长也有抑制作用,F8毒素溶液不同稀释液处理,其幼苗胚根长度、胚根鲜质量、胚轴长度及胚轴鲜质量较对照的降幅分别为1.3%~14.9%,0.3%~5.8%,3.5%~30.3%及1.7%~7.1%。

表 3 镰刀菌菌株F3和F8毒素对甜瓜种子萌发的抑制作用
注:CK1为无菌水对照,CK2为液体PDA培养基无菌滤液对照;由于CK1和CK2无显著差异,因此采用无菌水对照计算各指标增幅。表中同列相同菌株各项数值后标不同小写字母表示该菌株不同稀释度处理与对照差异显著(P<0.05)。表4同。
Note:CK1represents distilled water control.CK2represents liquid PDA filtrate control.Since there was no significant difference between CK1and CK2,distilled water was used to calculate theΔCK.Different letters in each column of same strain indicate significant difference among the same fungal toxin dilutions and the control (P<0.05).The same for Table 4.

表 4 镰刀菌菌株F3和F8毒素对甜瓜幼苗生长的抑制作用
2.5拮抗放线菌的筛选
2.5.1放线菌对镰刀菌的拮抗作用利用琼脂块法从供试的662株放线菌中筛选得到7株对腐皮镰刀菌(F3)和尖孢镰刀菌(F8)均有拮抗活性的菌株,其对2种致病真菌具有不同程度的拮抗作用(表5)。
2.5.2放线菌无菌发酵滤液对镰刀菌的抑菌活性由表6可知,筛选获得的7株放线菌无菌发酵滤液对供试2种镰刀菌均有抑菌活性。另外,本研究室种质资源库中还有4株放线菌的无菌发酵滤液也表现出较强的抗真菌作用。其中,培养24 h,放线菌468、C27无细胞发酵滤液对尖孢镰刀菌的抑菌率均达100.0%;培养72 h,放线菌D74、Act12无细胞发酵滤液对腐皮镰刀菌的抑菌率分别为54.1%和40.3%。放线菌D74、Act12、C27及468无菌发酵滤液对镰刀菌也有明显抑菌效果(图4)。

表 5 放线菌对2种镰刀菌F3和F8的拮抗作用
注:-表示无抑菌活性;+、++分别表示拮抗环半透明、完全透明。表7同。
Note:- indicates no antagonistic activity;+ and ++ indicate semi-transparent and complete transparent,respectively.The same for Table 7.
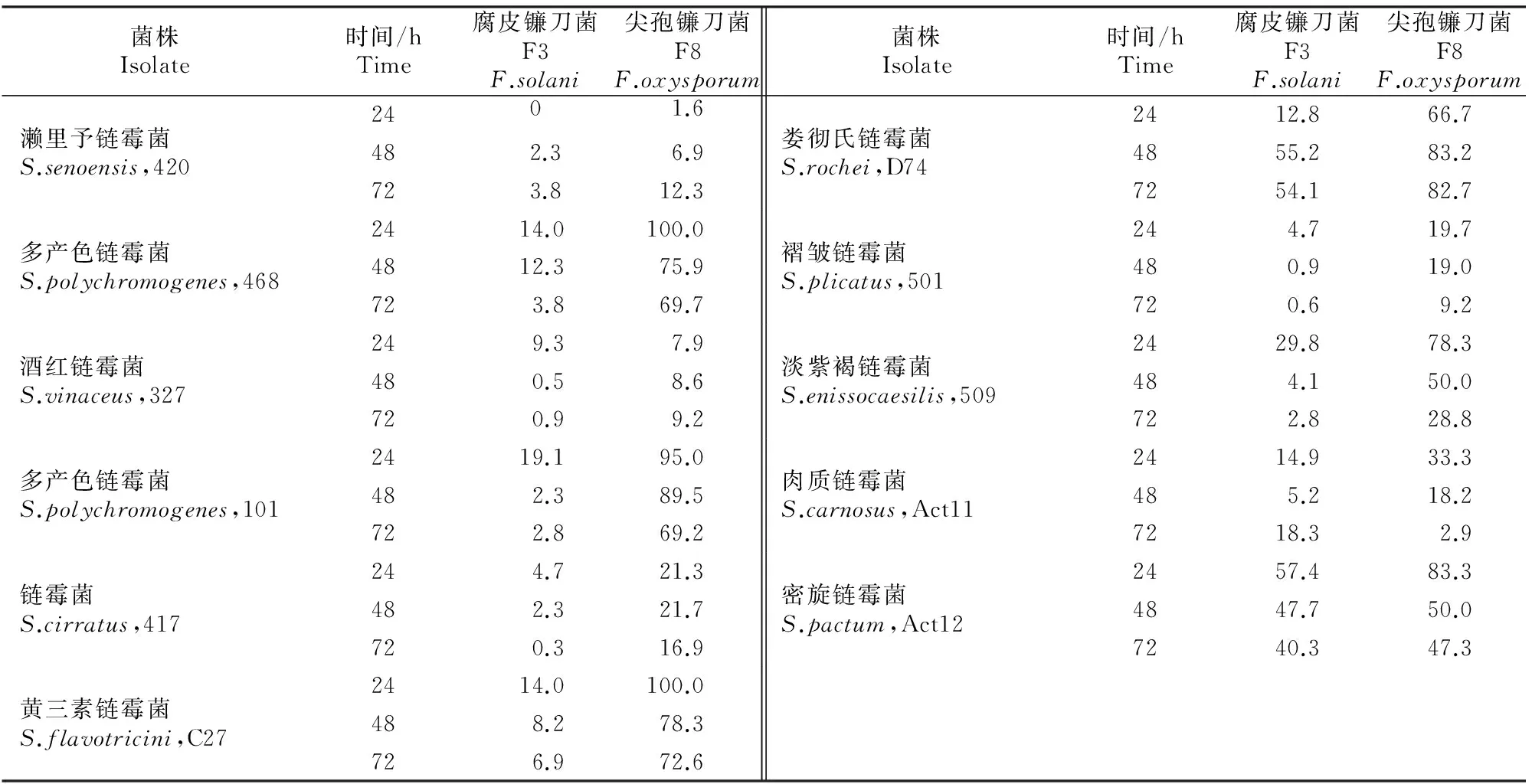
表 6 放线菌无菌发酵滤液对2种镰刀菌F3和F8的抑菌率
图 4放线菌无菌发酵滤液对腐皮镰刀菌(F3)和尖孢镰刀菌(F8)的抑制作用
Fig.4Inhibition of ferment fluid of actinomycetes againstF.solani(F3) andF.oxysporum(F8)
2.5.3放线菌对软腐病原菌的拮抗性从表7可以看出,对2种致病菌有拮抗和抑菌作用的11株放线菌中,有6株对魔芋软腐病致病细菌也有较强的拮抗作用,即筛选出的6株拮抗放线菌同时对2株致病真菌及魔芋软腐细菌均具有较强的抗菌活性。

表 7 拮抗放线菌对魔芋软腐病原菌的拮抗活性
3讨论
3.1魔芋土传病害致病性镰刀菌
研究证明,黄瓜[14]、甜瓜[13]、芹菜[15]及辣椒[16]等作物土传病害的发生与根域微生物区系变化密切相关。本研究对刺槐林及农田魔芋田间生态现象的观察发现,在相同生态条件下的同一田块,农艺措施基本相同,魔芋软腐病株与健株同时存在,通过对健康与软腐病株根域土壤微生态系统比较发现,上述生态现象存在的原因也与根际微生物区系不同有关(拟另文报道)。
本研究表明,在魔芋软腐病株根区、根表土壤及根系中存在大量的腐皮镰刀菌和尖孢镰刀菌。腐皮镰刀菌是一类分布广泛的植物病原菌,可侵染木薯等作物[17];尖孢镰刀菌是引起瓜类枯萎病的主要病原菌[18];腐皮镰刀菌和尖孢镰刀菌复合侵染可导致苜蓿根腐病病害发生[19]。腐皮镰刀菌也是魔芋干腐病的病原菌,发病植株叶片退绿,逐渐黄化,萎蔫下垂,严重时植株倒伏死亡[20]。镰刀菌(Fusarium)也是魔芋根腐病病原菌之一,主要为害根部,植株轻度受害时地上部叶片退绿黄化,后期叶柄枯死,地下球茎膨大受到严重影响[20]。尽管目前大部分研究者公认,魔芋软腐病是由胡萝卜软腐欧文氏菌胡萝卜亚种(Erwiniacarotovorassp.cantovora,Ecc.)、菊欧文氏菌(E.chrysanthemi,Ech.)、胡萝卜软腐欧文氏菌黑胫亚种(E.carotovorassp.atroseptica,Eca.)、果胶杆菌属(Pectobacterium)和肠杆菌(Enterobacterspp.)等[21]细菌引起的土传病害,但细菌侵染过程中致病性真菌的作用也不容忽视。
本研究发现,同一生态条件下软腐病株、健株根域优势真菌存在显著差异,其中值得特别注意的重要差异是软腐病株根域致病性真菌数量远高于健株。魔芋软腐病株根域腐皮镰刀菌和尖孢镰刀菌的大量存在就证明了魔芋软腐病发生是软腐病菌与腐皮镰刀菌及尖孢镰刀菌复合侵染的结果。
李艳梅等[22]也发现,植物病害的发生往往是多种病原菌复合侵染的结果,发病植物根际土壤中其他致病菌亦会参与并加剧病害发生。吴祝平[23]研究表明,魔芋病害是以一个病害为主,多个病害共同发生构成的“复合感染”。因此,在对魔芋软腐病的防治过程中,应该探索全方位兼顾病原细菌和致病性真菌的防治策略,以达到标本兼治的效果。
微生物产生的毒素作为化感物质能导致寄主植物萎蔫、组织坏死[24]。镰刀菌毒素是镰刀菌在生长过程中产生的多种有毒代谢产物,能造成植物萎蔫、根腐及穗腐等腐烂病,导致作物减产甚至绝收[25]。研究表明,植物的幼嫩组织如种子萌发期幼苗胚根、胚轴对毒素的胁迫极为敏感[26],培养初期的尖孢镰刀菌粗毒素滤液对黄瓜种子萌发及胚根生长具有明显的抑制作用;胚根生长的抑制率达30.0%~45.0%[27]。本研究发现,2株镰刀菌产生的毒素对甜瓜种子萌发及幼苗胚根、胚轴生长也具有明显的抑制作用。腐皮镰刀菌和尖孢镰刀菌发酵粗滤液对离体魔芋球茎和胡萝卜组织均有侵染和致病性。该结果表明,2株致病镰刀菌也可能通过有毒代谢产物参与魔芋软腐病的致病过程。
3.2拮抗放线菌筛选
目前,国内外主要通过栽培措施[28]、化学药剂[29]、生防细菌[30-33]和生防真菌[34]等防治魔芋软腐病,而有关放线菌生防的研究报道较少,仅见叶晶龙[21]筛选出11株对魔芋软腐病病原菌有抑菌能力的放线菌菌株的报道。此外,现有的研究基本以单一的软腐病菌为靶标菌来筛选生防菌,筛选得到的生防菌抗菌谱未覆盖致病真菌,限制了生防菌抗菌效果的发挥。因此,筛选对软腐病菌及致病性真菌同时有抑制作用的广谱拮抗性放线菌对提高魔芋软腐病微生物防治效果有重要意义。
本研究以魔芋软腐病株根域大量存在的2株致病性镰刀菌为靶标菌,从供试662株放线菌中筛选出11株对软腐病株根区、根表土壤及根系大量存在的致病性镰刀菌有较强拮抗作用的放线菌。抗软腐病细菌活性测定结果表明,所选拮抗菌中有6株同时对软腐细菌具有较强的抗菌活性。该结果为魔芋软腐病土传病害生物防治及微生态调整提供了活性较强的广谱拮抗菌资源,其中的放线菌娄彻氏链霉菌(S.rochei,D74)、濑里予链霉菌(S.senoensis,420)、黄三素链霉菌(S.flavotricini,C27)、肉质链霉菌(S.carnosus,Act11)、密旋链霉菌(S.pactum,Act 12)已用于魔芋盆栽和大田试验,表现出良好的防病促生作用(拟另文发表)。
由于魔芋软腐病采用传统的化学药剂难以有效控制,探索新的防治途径是目前亟待解决的问题。放线菌是抗生素的主要产生菌[35],其中的链霉菌孢子量大,孢子存活能力强,易于工业化生产及应用。接种拮抗性放线菌可减少魔芋根域致病菌数量,有望从源头上阻止或减轻魔芋软腐病等土传病害的发生。因此,本研究的拮抗菌筛选结果对魔芋软腐病的生物防治有重要意义。
[参考文献]
[1]Vasques C A,Rossetto S,Halmenschlager G,et al.Evaluation of the pharmac-therapeutic efficacy ofGarciniacambogiaplusAmorphalluskonjacfor the treatment of obesity [J].Phytotherapy Research,2008,22:1135-1140.
[2]Wu J P,Ding Z L,Jiao Z B,et al.Identification of antagonistic bacteria forAmorphoralluskonjacsoft rot disease and optimization of its fermentation condition [J].African Journal of Microbiology Research,2013,7(41):4870-4876.
[3]何斐,段佳丽,罗宝芳,等.岚皋魔芋软腐病病原细菌生物多样性研究 [J].西北农林科技大学学报: 自然科学版,2013,41(7):1-8.
He F,Duan J L,Luo B F,et al.Pathogenic bacteria biodiversity ofAmorphophallusinfected with soft rot disease in Langao,Shaanxi [J].Journal of Northwest A&F University:Natural Science Edition,2013,41(7):1-8.(in Chinese)
[4]程丽娟,薛泉宏,来航线.微生物学实验技术 [M].北京:科学出版社,2012.
Cheng L J,Xue Q H,Lai H X.Experimental techniques of microbiology [M].Beijing:Science Press,2012.(in Chinese)
[5]周永强,薛泉宏,杨斌,等.生防放线菌对西瓜根域微生态的调整效应 [J].西北农林科技大学学报:自然科学版,2008,36(4):143-150.
Zhou Y Q,Xue Q H,Yang B,et al.Adjusted effect of inoculating with biocontrol actinomyces on microbial flora of watermelon rooting zone [J].Journal of Northwest A&F University:Natural Science Edition,2008,36(4):143-150.(in Chinese)
[6]孙广宇,张雅梅,张荣.突脐孢属Brn1基因核苷酸序列比较及系统发育研究 [J].菌物学报,2004,23(4):480-486.
Sun G Y,Zhang Y M,Zhang R.Sequence comparison and phylogenetic analysis ofBrn1 genes fromExserohilumspecies [J].Mycosystema,2004,23(4):480-486.(in Chinese)
[7]李晓红.魔芋软腐病菌致病性测定及遗传多样性分析 [D].湖北武汉:华中农业大学,2009.
Li X H.Studies on the pathogenicity and genetic diversity in Konnyku’s soft rot bacteria [D].Wuhan,Hubei:Huazhong Agricultural University,2009.(in Chinese)
[8]方中达.植病研究方法 [M].北京:中国农业出版社,1998:137-140.
Fang Z D.Plant disease research method [M].Beijing:China Agriculture Publishing,1998:137-140.(in Chinese)
[9]赵娟,薛泉宏,杜军志,等.两株镰孢菌的鉴定及其粗毒素对甜瓜幼苗的化感作用 [J].应用生态学报,2013,24(1):142-148.
Zhao J,Xue Q H,Du J Z,et al.Identification of twoFusariumisolates and their crude toxin allelopathic effect onCucumismeloseedlings [J].Chinese Journal of Applied Ecology,2013,24(1):142-148.(in Chinese)
[10]王延琴,杨伟华,许红霞,等.水分胁迫对棉花种子萌发的影响 [J].棉花学报,2009,21(1):73-76.
Wang Y Q,Yang W H, Xu H X,et al.Effect of water stress on germination of cotton seeds [J].Cotton Science,2009,21(1):73-76.(in Chinese)
[11]Sturz A V,Christie B R,Nowak J.Bacterial endophytes:Potential role in developing sustainable systems of crop production [J].Critical Reviews in Plant Sciences,2000,19(1):1-30.
[12]陈杰,郭天文,谭雪莲,等.马铃薯连作土壤拮抗放线菌研究 [J].西北农业学报,2013,22(11):168-177.
Chen J,Guo T W,Tan X L,et al.Antagonistic actinomycetes in continuous cropping potato soil [J].Acta Agriculturae Boreali-Occidentalis Sinica,2013,22(11):168-177.(in Chinese)
[13]赵娟.连作甜瓜蔓根真菌病害发生与放线菌生物防治研究 [D].陕西杨凌:西北农林科技大学,2012.
Zhao J.Occurrence of fungal disease in tendril and root of continuous melon plants and its management by biocontrol actinomycetes [D].Yangling,Shaanxi:Northwest A&F University,2012.(in Chinese)
[14]段春梅,薛泉宏,呼世斌,等.连作黄瓜枯萎病株、健株根域土壤微生物生态研究 [J].西北农林科技大学学报:自然科学版,2010,38(4):143-150.
Duan C M,Xue Q H,Hu S B,et al.Microbial ecology ofFusariumwiltinfected and healthy cucumber plant in root zone of continuous cropping soil [J].Journal of Northwest A&F University:Natural Science Edition,2010,38(4):143-150.(in Chinese)
[15]王玲娜,薛泉宏,唐明,等.内蒙古芹菜根腐病病株和健株根域土壤的微生物生态研究 [J].西北农林科技大学学报:自然科学版,2010,38(8):167-172,181.
Wang L N,Xue Q H,Tang M,et al.Microbial ecological study about the root-zone soil of the healthy and disease celery plant in Inner Mongolia [J].Journal of Northwest A&F University:Natural Science Edition,2010,38(8):167-172,181.(in Chinese)
[16]蔡艳,薛泉宏,陈占全,等.青海高原东部土壤辣椒疫霉生防菌的初步筛选 [J].西北农业学报,2007,16(2):241-244.
Cai Y,Xue Q H,Chen Z Q,et al.Preliminary selecting of soil antimicrobials againstPhytophthoracapsiciin the eastern part of Qinghai Plateau [J].Acta Agricultural Boreali-Occidentalis Sinica,2007,16(2):241-244.(in Chinese)
[17]Barros J A,Medeiros E V,Notaro K A,et al.Different cover promote sandy soil suppressiveness to root rot disease of cassava caused byFusariumsolani[J].African Journal of Microbiology Research,2014,8(10):967-973.
[18]张淑梅,赵晓宇,张先成,等.3种瓜类枯萎病菌Fusariumoxysporum的分子检测 [J].植物病理学报,2010,40(6):636-641.
Zhang S M,Zhao X Y,Zhang X C,et al.Molecular detection ofFusariumoxysporumin cucumber,watermelon and melon [J].Acta Phytopathologica Sinica,2010,40(6):636-641.(in Chinese)
[19]王多成,孟有儒,李文明,等.苜蓿根腐病病原菌的分离及鉴定 [J].草叶科学,2005,22(10):78-81.
Wang D C,Meng Y R,Li W M,et al.Isolation and identification of the pathogens causing root rot disease ofMedicagosativa[J].Pratacultural Science,2005,22(10):78-81.(in Chinese)
[20]费甫华,张化平,盛正逵,等.三峡地区魔芋病害种类及为害调查 [J].湖北植保,2001,1(1):22-23.
Fei F H,Zhang H P,Sheng Z K,et al.Disease species and damage survey ofAmorphophalluskonjacin the three gorges region [J].Hubei Plant Protection,2001,1(1):22-23.(in Chinese)
[21]叶晶龙.魔芋软腐病拮抗放线菌的分离、鉴定及其应用的初步研究 [D].湖北宜昌:三峡大学,2012.
Ye J L.Isolation and identification of actinomyces antagonistic to soft rot ofAmorphophalluskonjacand initial study on its application [D].Yichang,Hubei:China Three Gorges University,2012.(in Chinese)
[22]李艳梅,李小六,陈超,等.大花蕙兰根腐病病原菌的分离与鉴定 [J].河南农业大学学报,2007,41(1):85-89.
Li Y M,Li X L,Chen C,et al.Isolation and identification of the pathogens causing root rot disease ofCymbidiumhybrida[J].Journal of Henan Agricultural University,2007,41(1):85-89.(in Chinese)
[23]吴祝平.湖北省魔芋病害调查及主要病害防治技术研究 [D].湖北武汉:华中农业大学,2007.
Wu Z P.Study on survey ofAmorphophallusrivieridiseases and main diseases control technology in Hubei province [D].Wuhan,Hubei:Huazhong Agricultural University,2007.(in Chinese)
[24]韩珊,朱天辉,李芳莲.植物病原真菌毒素作用机理研究进展 [J].四川林业科技,2008,29(6):26-30.
Han S,Zhu T H,Li F L.Advances in researches on mechanism of plant pathogenic mycotoxins [J].Journal of Sichuan Forestry Science and Technology,2008,29(6):26-30.(in Chinese)
[25]彭杰,吴晓鹏,黄惠琴,等.镰刀菌毒素研究进展 [J].中国农学通报,2009,25(2):25-27.
Peng J,Wu X P,Huang H Q,et al.Research development ofFusariumtoxins[J].Chinese Agricultural Science Bulletin,2009,25(2):25-27.(in Chinese)
[26]田雪亮,刘鸣韬,杨家荣.黄瓜枯萎菌粗毒素对不同抗性黄瓜种子萌发及幼苗胁迫作用研究 [J].中国生态农业学报,2008,16(6):1495-1498.
Tian X L,Liu M T,Yang J R.Seed germination and growth of various resistant cucumber seedlings underFusariumoxysporumcrude toxin stress [J].Chinese Journal of Eco-Agriculture,2008,16(6):1495-1498.(in Chinese)
[27]车建美,刘波,林营志,等.黄瓜枯萎病原菌的粗毒素滤液对黄瓜种子萌发的影响 [J].厦门大学学报:自然科学版,2004,43(增刊):91-93.
Che J M,Liu B,Lin Y Z,et al.Toxic effects ofFusariumoxysporumextracts on the germination of cucumber seed [J].Journal of Xiamen University: Natural Science Edition,2004,43(Sup):91-93.(in Chinese)
[28]彭磊,卢俊,邓春英,等.魔芋软腐病病原传播途径及无公害防治方法 [J].中国生物防治,2006,22(S1):201-202.
Peng L,Lu J,Deng C Y,et al.The propagation path of pathogens of Konjac soft rot and the prevention ways in nuisance free [J].Chinese Journal of Biological Control,2006,22(S1):201-202.(in Chinese)
[29]张鑫.魔芋软腐病防治综述 [J].现代农业科技,2011(8):174-175.
Zhang X.Review on control ofAmorphophalluskonjacsoft rot [J].Modern Agricultural Sciences and Technology,2011(8):174-175.(in Chinese)
[30]马琼.魔芋软腐病拮抗菌的分离及抗性研究 [J].湖北民族学院学报:自然科学版,2007,25(4):455-457.
Ma Q.Studies on separation and antagonism of antagonizing bacteria againstAmorphophallusrivieridurieu soft rot [J].Journal of Hubei Institute for Nationalities:Natural Science Edition,2007,25(4):455-457.(in Chinese)
[31]吴金平.魔芋软腐病病原菌及其拮抗菌的研究 [D].武汉:武汉大学,2010.
Wu J P.Pathogens and antagonistic bacteria of soft rot disease on konjac [D].Wuhan:Wuhan University,2010.(in Chinese)
[32]吴亚鹏,姬广海,陈云兰,等.生防细菌13-1对魔芋软腐病的控制及机理研究 [J].中国生物防治,2010,26(2):193-199.
Wu Y P,Ji G H,Chen Y L,et al.Biocontrol effect and mechanisms ofLysobacterantibioticus13-1 against soft rot pathogen ofAmorphophalluskonjac[J].Chinese Journal of Biological Control,2010,26(2):193-199.(in Chinese)
[33]周盈,陈琳,柴鑫莉,等.魔芋内生拮抗细菌的分离及其抗菌物质特性研究 [J].微生物学报,2007,47(6):1076-1079.
Zhou Y,Chen L,Chai X L,et al.Isolation of endophytic antagonistic bacterium fromAmorphophalluskonjacand research on its antibacterial metabolite [J].Acta Microbiologica Sinica,2007,47(6):1076-1079.(in Chinese)
[34]Schmeda-Hirschmann G,Hormazabal E,Rodriguze J A,et al.Cycloaspeptide A and pseurotin A from the endophytic fungusPenicilliumjanczewskii[J].Z Naturforsch C,2008,63(5/6):383-388.
[35]夏广欣.土壤放线菌的筛选、鉴定及其发酵产物的活性研究 [D].哈尔滨:东北农业大学,2012.
Xia G X.Screening and identification of actinomycetes from soil and analysis on fermentation products [D].Harbin:Dongbei Agriculture University,2012.(in Chinese)
Identification and allelopathic effect of dominant fungi in root-zone ofAmorphophalluskonjacand screening of the bio-control actinomycetes
HE Fei1a,ZHANG Zhong-liang1b,CUI Ming2,XUE Quan-hong1c
(1 aCollegeofLifeScience,bCollegeofForestry,cCollegeofNaturalResourcesandEnvironment,NorthwestA&FUniversity,Yangling,Shaanxi712100,China;2QinbaMoyuResearchandDevelopmentCenter,Ankang,Shaanxi725000,China)
Abstract:【Objective】 Dominant fungi F3 and F8 were obtained from rhizosphere soil,rhizoplane soil,and root of soft rot-infected Amorphophallus konjac plants and their pathogenicity and allelopathic activities were tested.Efficient and broad-spectrum biocontrol actinomycetes with conspicuous antagonistic effect on dominant fungi and pathogenic bacteria were also screened.【Method】 Strains F3 and F8 isolated from diseased and healthy A.konjac plants were identified according to colony morphology and rDNA-ITS sequence analysis.Infection test in vitro was used to determine the pathogenicity on A.konjac and carrot tissues.Melon seed germination experiments were conducted to investigate the allelopathic activity.Antagonistic bio-control actinomycetes against dominant fungi and pathogenic bacteria were screened by agar block and fermentation filtrate.【Result】 ① A large number of F3 and F8 existed in rhizosphere soil,rhizoplane soil and root of soft rot-infected A.konjac plants. Isolates F3 and F8 were identified as Fusarium solani and Fusarium oxysporum.Their crude filtrates of fermentation were pathogenic to A.konjac corms and carrot tissues.Their crude toxin solutions also had inhibition effects on seed germination and growth of melon seedlings.②Six bio-cotrol actinomycetes were screened with strong antagonistic activity against dominant Fusarium and soft rot pathogenic bacteria of A.konjac.【Conclusion】 Dominant fungi Fusarium solani and Fusarium oxysporum found abundantly in rhizosphere soil,rhizoplane soil and root of diseased A.konjac had pathogenic and allelopathic activities.Six antagonistic bio-control actinomycetes were screened against dominant Fusarium and soft rot pathogenic bacteria of A.konjac.
Key words:Amorphophallus konjac;soft rot disease;Fusarium solani;Fusarium oxysporum;allelopathic effect;composite infection
DOI:网络出版时间:2016-03-1408:4510.13207/j.cnki.jnwafu.2016.04.022
[收稿日期]2014-09-02
[基金项目]国家林业局重点科技推广项目(魔芋产业化配套技术2010-38);财政部农业科技体系建设项目(XTG2013-36);陕西省科学技术研究发展计划项目(2013K02-24)
[作者简介]何斐(1988-),女,陕西南郑人,硕士,主要从事微生物资源利用研究。E-mail:hefei6000@163.com[通信作者]薛泉宏(1957-),男,陕西白水人,教授,博士生导师,主要从事微生物资源与应用研究。
[中图分类号]S432;Q939.95
[文献标志码]A
[文章编号]1671-9387(2016)04-0157-11
网络出版地址:http://www.cnki.net/kcms/detail/61.1390.S.20160314.0845.044.html
E-mail:xuequanhong@163.com

