不同矮化中间砧对苹果苗光合特性的影响
罗 静,易盼盼,王 飞,韩明玉,吴维芳,王荣花
(1 高平市林业局,山西 高平 048400;2 西北农林科技大学 园艺学院,陕西 杨凌 712100)
不同矮化中间砧对苹果苗光合特性的影响
罗静1,易盼盼2,王飞2,韩明玉2,吴维芳2,王荣花2
(1 高平市林业局,山西 高平 048400;2 西北农林科技大学 园艺学院,陕西 杨凌 712100)
[摘要]【目的】 对2种矮化中间砧盆栽嫁接苹果苗的光合指标和叶绿素荧光参数变化进行研究,揭示苹果中间砧对嫁接植株光合机理的影响。【方法】 以八棱海棠为基砧,M9和M26为矮化中间砧,2年生“长富2号”为嫁接材料,设八棱海棠同龄砧嫁接“长富2号”为对照,分析M9和M26矮化中间砧对嫁接苗比叶重、叶绿素和类胡萝卜素含量、光合指标(净光合速率、胞间CO2浓度、气孔导度、蒸腾速率)及日变化、叶绿素荧光参数和其日变化的影响。【结果】 M9和M26矮化中间砧嫁接苗的净光合速率显著高于对照嫁接苗,而气孔导度、胞间CO2浓度和蒸腾速率较低。M9和M26矮化中间砧嫁接苗的Fm、Fv/Fm和 Fv/Fo显著低于对照嫁接苗,但qN、ETR、NPQ却高于对照嫁接苗。经过中午的强光和高温后,M9和M26矮化中间砧嫁接苗的Fo显著下降,NPQ和ETR明显升高,而对照嫁接苗的Fo显著上升,NPQ和ETR升高不明显,Fo的升高表明对照嫁接苗的PSⅡ反应中心由于强光破坏而明显失活。【结论】 矮化中间砧影响下的苹果苗防御强光破坏的机制与对照嫁接苗不同,矮化苗的光能调节能力更强,其因具有较高的净光合速率而早产。
[关键词]苹果生理;矮化中间砧;光合指标;荧光参数
运用矮化砧木实现苹果树的矮化密植为苹果树栽培的重要发展方向,矮化砧木在实现植株矮化的同时,还可影响植株的结果期、产量和品质,而这些都与植物的光合作用密切相关。叶绿素荧光动力学技术为测定植物叶片光合指标的快速且准确的探针[1],在果树逆境生理、光合机理、抗性品种的选择等研究中得到了广泛应用[2-3];但尚未见用该技术对不同矮化中间砧嫁接盆栽苹果苗的荧光动力学参数进行研究的报道。因此,本研究利用叶绿素荧光技术对苹果不同矮化中间砧(M9、M26)嫁接树的主要荧光参数及其日变化进行了测定,探讨矮化中间砧嫁接植株的光合特性和机理,以期为进一步揭示矮化中间砧提高嫁接苗的光合能力机理提供理论依据。
1材料与方法
1.1试验材料及处理
以2年生“长富2号”为嫁接材料,八棱海棠为基砧,分别以M9和M26为矮化中间砧嫁接“长富2号”,设八棱海棠同龄砧嫁接“长富2号”为对照,共3种处理。试验采用盆栽 (营养钵50 cm×50 cm)进行,盆中营养土按基质与壤土质量比3∶1混合而成。每种处理10株,重复3次,生长季常规管理。试验地在陕西省杨凌示范区现代农业示范园国家苹果产业技术体系杨凌试验示范苗圃(东经 108°04′,北纬 34°16′)内。
1.2测定项目及方法
1.2.1比叶重的测定于2010年与2011年的8月,选取每处理植株6株,每株取10片叶(选树体向阳侧生长一致的5个新梢的第6或7片成熟叶),使用叶片打孔器(d=7 mm)于同一位置打孔取样,然后将叶片放在天平上称鲜质量,计算叶面积(cm2)=π(d/2×10-1)2。比叶重=叶鲜质量(mg)/叶面积(cm2)。
1.2.2叶绿素含量的测定2012-08,参照高俊凤[4]的方法,每处理分别选取5株植株,每株取6片成熟叶,剪碎后称取0.02 g,放入5 mL体积分数80%丙酮提取液中,以体积分数80%丙酮提取液为对照,用紫外分光光度计在波长665,649,470 nm下测定吸光度,计算叶绿素和类胡萝卜素含量。
1.2.3光合指标的测定2012-08,晴天用LI-6400(XT)便携式光合仪进行光合指标的测定。不同处理随机选取5株,每株树取树冠外围、同一高度、同一方向、发育健壮的新梢的第6或7成熟叶1片,测定时间为08:00-16:00,每隔2 h测定1次各处理叶片的净光合速率(Pn)、胞间CO2浓度(Ci)、气孔导度(Gs)、蒸腾速率(Tr)。采取随机测定的方法,以消除时间误差。水分利用效率WUE=净光合速率/蒸腾速率×100%。
1.2.4叶绿素荧光参数的测定2012-08,选取生长势一致的植株为试材,单盆小区,每处理 6 次重复,每株选高度和方位一致的健壮营养枝中部功能叶,挂牌标记,于晴天使用 PAM-2500(Walz,Germany)便携式叶绿素荧光仪进行荧光参数的测定,测定时间为08:00-16:00,每隔2 h测定1次。测定前叶片暗适应30 min。测定的叶绿素荧光参数包括:初始荧光(Fo)、可变荧光(Fv)、最大荧光(Fm)、PSⅡ最大光化学效率(Fv/Fm)、PSⅡ潜在活性(Fv/Fo)、非光化学淬灭系数(qN)、光化学淬灭系数(qP)、叶绿素荧光非光化学淬灭(NPQ)和表观光合电子传递速率(ETR), 其中Fv=Fm-Fo。
1.3数据统计分析
所有数据均采用SPSS 16.0软件进行统计和差异性分析;采用Excel软件绘图。
2结果与分析
2.1不同砧木组合对苹果苗比叶重、叶绿素和类胡萝卜素含量的影响
由表1可知,对照嫁接苗的比叶重显著小于M9和M26矮化中间砧嫁接苗,M9和M26矮化中间砧嫁接苗比叶重之间差异不显著。对于叶绿素含量,M9和M26矮化中间砧嫁接苗的叶绿素a(Chl a)、叶绿素a+b含量(Chl a+b)、叶绿素a/b(Chl a/b)值均显著大于对照嫁接苗;而3种砧木组合的叶绿素b(Chl b)含量无显著差异。类胡萝卜素在植物体内主要起光保护作用,3种砧木组合的类胡萝卜素含量差异均显著,对照嫁接苗的类胡萝卜素含量显著低于2种矮化中间砧嫁接苗,M26矮化中间砧嫁接苗类胡萝卜素含量显著高于M9矮化中间砧嫁接苗。

表 1 不同砧木组合对苹果苗比叶重、叶绿素和类胡萝卜素含量的影响
注:同列数据后标不同小写字母表示各处理间差异显著。下表同。
Note:Different lowercase letters mean significant difference between groups.The same below.
2.2不同砧木组合对苹果苗光合指标的影响
在一定的光照强度下,植物的净光合速率可直接反映其光合积累有机物的能力。如表2所示,M9和M26矮化中间砧嫁接苗的净光合速率显著高于对照嫁接苗,而其气孔导度、胞间CO2浓度、蒸腾速率却显著低于对照嫁接苗,矮化中间砧嫁接苗蒸腾速率降低是由于其气孔导度变小,从而使气孔开张度减小而导致的;而胞间CO2浓度降低则说明M9和M26矮化中间砧嫁接苗具有较高的CO2利用率。M9和M26矮化中间砧嫁接苗具有较高的净光合速率和较低的蒸腾速率使其具有更高的水分利用效率。

表 2 不同砧木组合对苹果苗光合指标的影响
2.3不同砧木组合对苹果苗光合日变化的影响
2.3.1净光合速率与胞间CO2浓度的日变化图1-A显示,生长季晴天,3种苹果嫁接苗的净光合速率日变化趋势相似,呈现明显的双峰曲线,出现光合“午休”现象。由图1-A可看出,3种砧木组合嫁接苗的净光合速率差异显著,M9和M26矮化中间砧嫁接苗的净光合速率显著高于对照嫁接苗,表现出较高的有机物积累能力。

图 1 不同砧木组合对苹果苗净光合速率(Pn)和胞间CO2浓度(Ci)日变化的影响
CO2是光合作用的主要原料,胞间CO2浓度直接影响光合速率。由图1-B可看出,3种苹果嫁接苗胞间CO2浓度的日变化规律基本一致,同时,胞间CO2浓度与净光合速率呈负相关。08:00-10:00,随着净光合速率的迅速升高,胞间CO2浓度持续下降;10:00-12:00,随着光合“午休”现象的出现,胞间CO2浓度逐渐升高,至中午12:00达最大值,之后随着光合第2峰值的出现,胞间CO2浓度逐渐下降至出现第2低谷,之后随着净光合速率的下降而逐渐恢复。
2.3.2气孔导度与蒸腾速率的日变化气孔导度反映了植物气孔传导水和CO2的能力。植物通过改变气孔的开张度等方式来控制植物与外界水和CO2的交换,从而调节光合速率和蒸腾速率。本研究中,3种苹果嫁接苗的气孔导度和蒸腾速率日变化趋势相同(图2)。由图2可看出,3种苹果嫁接苗气孔导度与蒸腾速率呈正相关,上午随着气孔导度的增大,蒸腾速率逐渐升高,但M9和M26矮化中间砧嫁接苗的气孔导度、蒸腾速率显著低于对照嫁接苗,可见2种矮化中间砧嫁接苗是通过改变气孔开张度来降低蒸腾速率的,最终提高了矮化苗的水分利用效率。
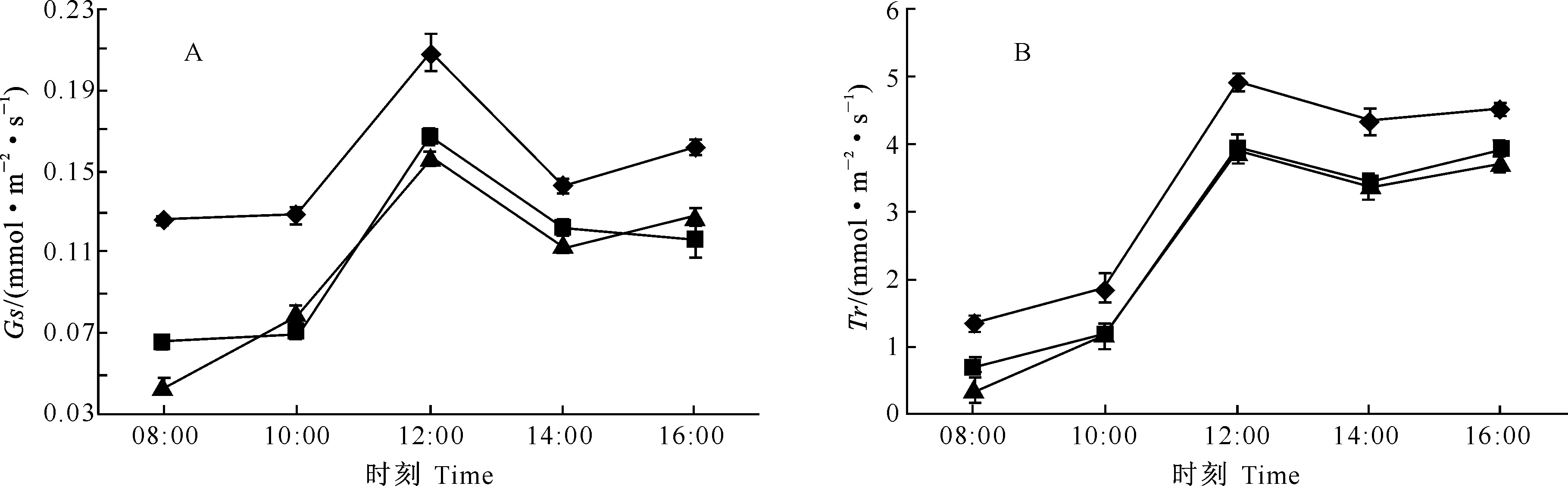
图 2 不同砧木组合对苹果苗气孔导度(Gs)和蒸腾速率(Tr)日变化的影响
2.4不同砧木组合对苹果苗叶绿素荧光参数的影响
表3显示,3种苹果嫁接苗的Fo、Fv、Fm表现出较大的差异,对照嫁接苗的Fo显著低于M9和M26矮化中间砧嫁接苗,这与对照嫁接苗较低的叶绿素总含量有关。然而,对照嫁接苗的Fv、Fm值却显著高于M9和M26矮化中间砧嫁接苗;同时,对照嫁接苗的Fv/Fm、Fv/Fo显著高于M9和M26矮化中间砧嫁接苗,这说明M9和M26矮化中间砧嫁接苗的PSⅡ原初光能转化效率及PSⅡ潜在活性较低。
由表3可见,M9和M26矮化中间砧嫁接苗的NPQ、qP和ETR显著高于对照嫁接苗,这可能是导致2种矮化中间砧嫁接苗具有较高光合速率及产量的原因。M9和M26矮化中间砧嫁接苗的qN显著高于对照嫁接苗,qN的高低能反映热耗散能力的大小,而矮化中间砧嫁接苗的qN较高,说明其热耗散能力较强,可以在不利条件下将吸收的多余光能以热能的形式释放,避免强光对植株光系统的伤害,有效调节对光能的吸收和利用。

表 3 不同砧木组合苹果苗叶绿素荧光动力学参数的比较
2.5不同砧木组合对苹果苗叶绿素荧光参数日变化的影响
光合作用包括光反应和暗反应两个过程,叶绿素荧光动力学参数的变化反映了植物对外界光变化的调节能力,它可以直观反映原初反应中光系统Ⅱ(PSⅡ)反应中心在经过高温、强光后的自我调节能力。
2.5.1初始荧光(Fo)和最大荧光(Fm)的日变化初始荧光(Fo)也称固定荧光,是PSⅡ反应中心处于完全开放时的荧光产量[5],是一个物理参数。Fo的大小与叶绿素含量有关,而Fo的变化能够反映光合机构中PSⅡ反应中心的受害程度,Fo升高表明PSⅡ反应中心受到强光破坏,不能有效消耗过剩光能。图3-A显示,经过中午的强光和高温后,在下午14:00时3种苹果嫁接苗的Fo差异显著,M9和M26矮化中间砧嫁接苗的Fo显著降低,对照嫁接苗的Fo却显著升高,而到16:00时,3种苹果嫁接苗的Fo又均恢复到早上水平。这表明对照嫁接苗的PSⅡ反应中心受到强光破坏而短暂性失活,而M9和M26矮化中间砧嫁接苗的热能耗散活动良好,避免了过剩光能对反应中心的破坏。
3种苹果嫁接苗的Fm日变化趋势一致(图3-B)。早晨08:00时,3种苹果嫁接苗的Fm较高,随着日间光照强度的增大,Fm逐渐降低,最小值出现在14:00时,之后随着光强的减弱而升高,且对照嫁接苗的Fm显著高于M9和M26矮化中间砧嫁接苗。
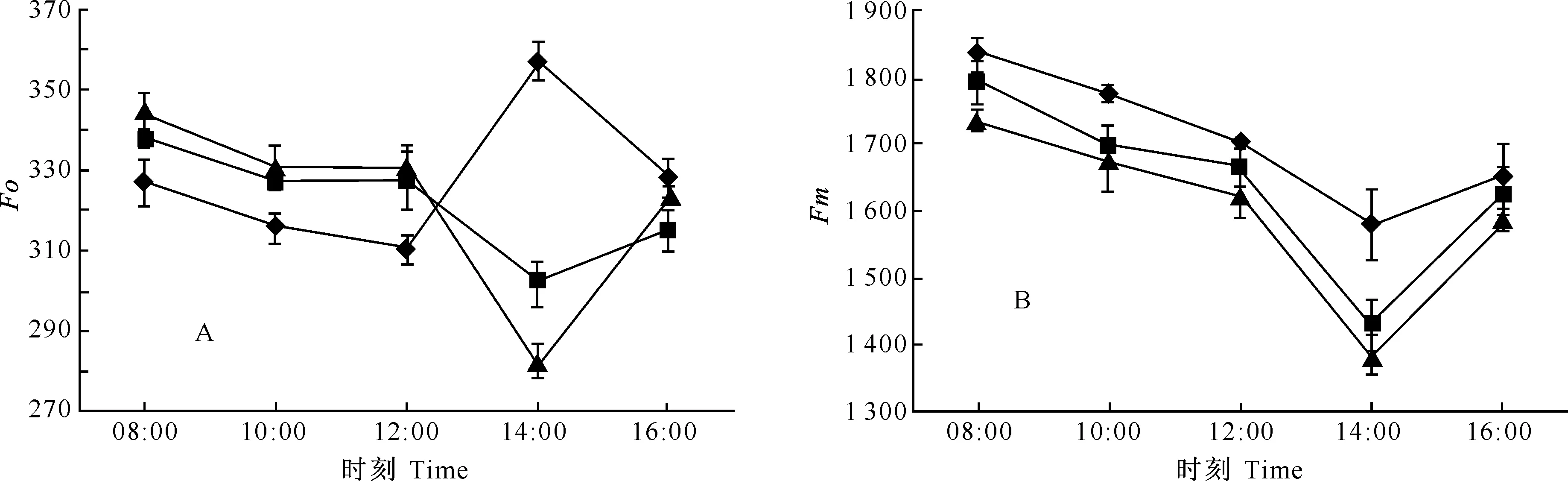
图 3 不同砧木组合对苹果苗Fo和Fm日变化的影响
2.5.2PSⅡ最大光化学效率(Fv/Fm)和PSⅡ潜在活性(Fv/Fo)的日变化由图4可见,3种苹果嫁接苗的Fv/Fm和Fv/Fo日变化趋势相似,都出现了午间降低的现象。早上08:00时,Fv/Fm和Fv/Fo较高,之后随着日间光照强度的增大和温度的升高而逐渐下降,下午14:00时达到最低点,表明此时植株出现光抑制,下午随着光照强度的减弱和温度的降低,Fv/Fm和Fv/Fo又上升,表明此时植株光抑制减弱。上午08:00-12:00对照嫁接苗Fv/Fm和Fv/Fo显著高于M9和M26矮化中间砧嫁接苗(图4),但午间急剧下降,最低点明显低于M9和M26矮化中间砧嫁接苗,可见此时对照嫁接苗叶片受到的光抑制较为严重。

图 4 不同砧木组合对苹果苗Fv/Fm、Fv/Fo日变化的影响
2.5.3叶绿素荧光非光化学淬灭(NPQ)的日变化图5-A显示,3种苹果嫁接苗的NPQ日变化趋势相同,上午随着日间光照强度增大和温度的升高而上升,中午12:00达到最高值,其中10:00-12:00NPQ升高较快,之后随着光强的减弱而下降。M9和M26矮化中间砧嫁接苗的NPQ显著高于对照嫁接苗,表明M9和M26矮化中间砧嫁接苗的热耗散能力强于对照,随着光照强度和温度的升高,中间砧嫁接苗植株的热耗散增强,这是植物防止反应中心遭受强光破坏的重要调节机制之一。
2.5.4表观光合电子传递速率(ETR)的日变化由图5-B可见,3种苹果嫁接苗的ETR日变化趋势基本一致,08:00-12:00,随着光照强度的增大ETR逐渐上升,并于12:00达到最高峰,之后随着光照强度的减弱ETR下降,这与NPQ的日变化规律类似。由图5-B可看出,一天大部分时间中,M9和M26矮化中间砧嫁接苗的ETR显著高于对照嫁接苗,这是矮化嫁接苗具有较高光合速率的原因。
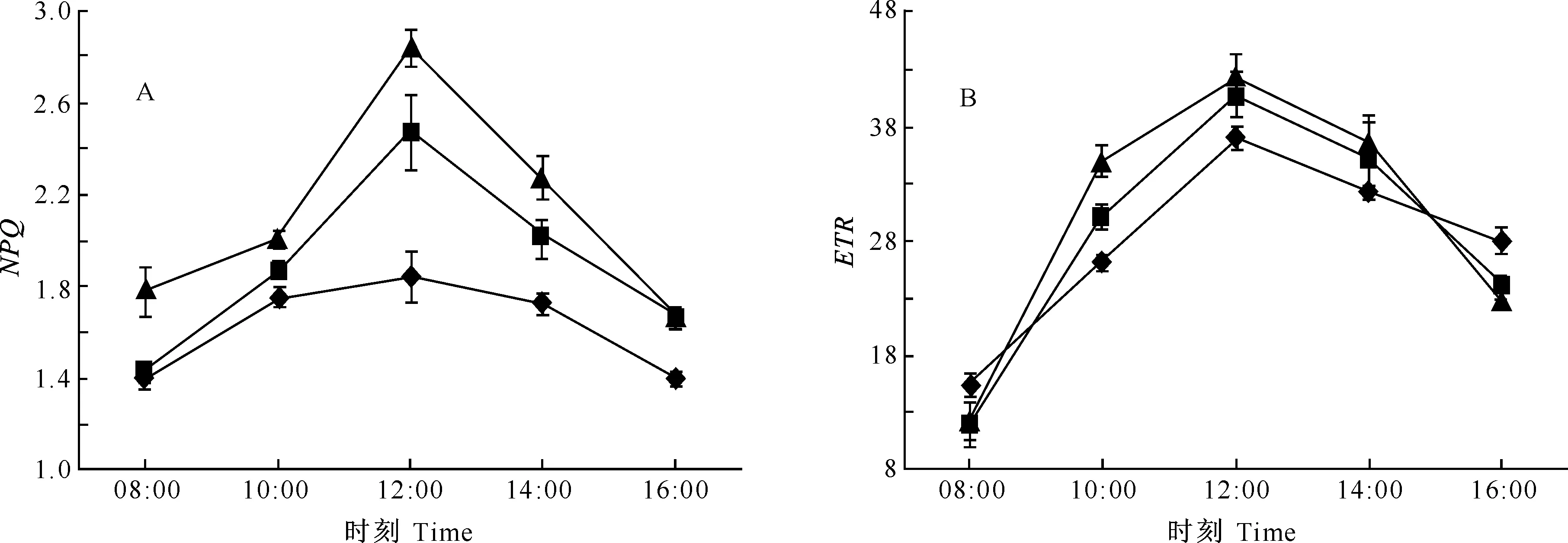
图 5 不同砧木组合对苹果苗NPQ和ETR日变化的影响
3讨论与结论
3.1不同砧木组合对苹果嫁接苗光合指标的影响
光合作用是植株生长发育的基础,果树光合强弱会受到不同嫁接砧木的影响[6]。本研究发现,晴天同一光照强度下,M9和M26矮化中间砧嫁接苗的Pn显著高于对照嫁接苗,这与王中英等[7]和张建光等[8]的研究结果一致。此外,一般认为,叶绿素含量越高,比叶重越大,果树的净光合速率就越高,本研究同样发现,M9和M26矮化中间砧嫁接苗的叶绿素a和叶绿素总含量及比叶重显著高于对照嫁接苗。除Pn之外,M9和M26矮化中间砧嫁接苗蒸腾速率(Tr)较低,从而提高了嫁接苗的水分利用效率。3种嫁接苗的Pn日变化趋势均为双峰曲线,出现光合“午休”现象,这与郑文君[9]和孙霞等[10]的研究结果相同。然而Ci日变化与Pn日变化呈负相关,这是由于光合暗反应中碳同化随光强升高而增加的速度大于Gs的增加速度,从而导致Pn增加而Ci降低的现象,这与梁红柱等[11]在砂仁上的研究结论类似。Gs与Tr呈正相关性,说明M9和M26矮化中间砧嫁接苗蒸腾速率的降低是由气孔因素造成的。
3.2不同砧木组合对苹果嫁接苗叶绿素荧光参数的影响
当植物接受的光能超过光合作用所需要的光能时就会产生过剩光能,过剩光能会对植物的光合反应机构造成损害,使光合功能下降,C3植物在经历中午强光和高温后会出现“光抑制”[12]。叶绿素荧光参数Fm和Fv/Fm降低可以作为反映光抑制的指标[13]。本研究发现,上午随着光照强度和温度的增加,3种苹果嫁接苗的Fm、Fv/Fm变化幅度均不大,然而午后这2个参数却显著下降,表明此时光抑制最强,下午Fm、Fv/Fm有所恢复,说明此时光抑制减弱,这与前人在其他植物上的研究结果[14-16]一致。本研究中,M9和M26矮化中间砧嫁接苗的Fm、Fv/Fm及Fv/Fo值12:00前显著低于对照嫁接苗。唐礼俊等[17]在研究华山松叶绿素荧光参数与树高的关系时发现,Fv/Fo和Fv/Fm值与华山松的树高生长呈正相关。林世青等[18]也认为较高的生长速率与较高的PSⅡ光能转化效率及PSⅡ的潜在活性有关。由此可认为,M9和M26矮化中间砧嫁接苗的生长势较弱可能与Fv/Fo和Fv/Fm数值较低有关,但需要进行深入的研究。
荧光淬灭包括非光化学淬灭(热耗散)和光化学淬灭。当植物受到光抑制时,初始荧光(Fo)降低伴随热耗散(NPQ) 的增加,而类胡萝卜素在光保护热耗散调节机制中作用显著,主要体现在叶黄素的循环[19]上。本研究中,M9和M26矮化中间砧嫁接苗的Fo在中午过后显著降低,NPQ显著增加;而对照嫁接苗Fo却异常升高,NPQ增加不明显,说明这2种矮化中间砧嫁接苗由于含有较多的类胡萝卜素从而增加了热耗散,最终避免了PSⅡ反应中心受强光和高温的破坏。许多研究者也发现,矮化砧木确实可以将吸收的多余光能以热能的形式释放,避免强光对光系统的损伤,保证在不利的外界环境条件下光能的正常吸收和利用[20-22],这与本研究结论一致。本研究还发现,中午强光高温造成了光抑制,但此时ETR并未减小反而增大,说明光抑制不是造成净光合速率下降的原因,而ETR升高正好表明植物通过加强光化学反应,更多的利用光能来保护光合机构免受强光和高温的破坏。M9和M26矮化中间砧嫁接苗的ETR、NPQ显著高于对照嫁接苗,表明矮化中间砧嫁接苗具有较强的光能调节机制,同时ETR升高可能是导致矮化嫁接苗净光合速率较高的主因,最终促成矮化嫁接苗早果早产。
综上所述,与乔化苗相比,矮化中间砧影响下的植株具有更好的应对强光和高温的防御机制,矮化苗通过增加类胡萝卜素含量,提高了热耗散(NPQ)能力,通过升高表观光合电子传递速率(ETR)来加强光化学反应从而消耗更多光能,并可避免PSⅡ反应中心受强光和高温的破坏,最终有效利用和吸收光能,以维持叶片光能平衡;同时ETR的增加还提高了净光合速率,使植株高产、早产。
[参考文献]
[1]赵丽英,邓希平,山仑.不同水分处理下冬小麦旗叶叶绿素荧光参数的变化研究 [J].中国生态农业学报,2007,15(1):63-66.
Zhao L Y,Deng X P,Shan L.Effects of altered water condition on some chlorophyll fluorescence parameters of flag leaves of winter wheat [J].Chinese Journal of Eco-Agriculture,2007,15(1):63-66.(in Chinese)
[2]范苓,段伟,程杰山,等.水杨酸对高温胁迫下及恢复期间葡萄幼苗叶片光合机构PSⅡ的影响 [J].果树学报,2009,26(5):623-627.
Fan L,Duan W,Cheng J S,et al.Effects of salicylic acid on photosynthetic apparatus PS Ⅱin leaves of young grape plants under heat stress and during the recovery period from stress [J].Journal of Fruit Science,2009,26(5):623-627.(in Chinese)
[3]韩春丽,孙中海,王艳,等.不同光强对纽荷尔脐橙叶片PSⅡ功能和光能分配的影响 [J].果树学报,2008,25(1):40-44.
Han C L,Sun Z H,Wang Y,et al.Effects of different light intensity on the PSⅡ functions and absorbed light allocation in Newhall navel orange leaves [J].Journal of Fruit Science,2008,25(1):40-44.(in Chinese)
[4]高俊凤.植物生理学实验技术 [M].北京:高等教育出版社,2006:74-77.
Gao J F.The experimental technology of plant physiology [M].Beijing:Higher Education Press,2006:74-77.(in Chinese)
[5]徐德聪,吕芳德,潘晓杰.叶绿素荧光分析技术在果树研究中的应用 [J].经济林研究,2003,21(3):88-91.
Xu D C,Lü F D,Pan X J.Application of chlorophyll fluorescence analysis technique to research of fruit trees [J].Economic Forest Researches,2003,21(3):88-91.(in Chinese)
[6]Goncalves B,Moutinho-perira J,Santos A,et al.Scion-rootstock interaction affects the physiology and fruit quality of sweet cherry tree [J].Tree Physiology,2005,26(1):93-104.
[7]王中英,解思敏,杨佩芳.矮砧苹果树光合速率变化研究 [J].华北农学报,1990,5(3):89-93.
Wang Z Y,Xie S M,Yang P F.A study on the changes of the photosynthetic rate of apple trees in dwarfing rootstocks [J].Acta Agriculturae Boreali-Sinica,1990,5(3):89-93.(in Chinese)
[8]张建光,刘玉芳,施瑞德.不同砧木上苹果品种光合特性比较研究 [J].河北农业大学学报,2004,27(5):31-33,40.
Zhang J G,Liu Y F,Shi R D.Comparative study on photosynthetic performance of several apple cultivars on different rootstocks [J].Journal of Agricultural University of Hebei,2004,27(5):31-33,40.(in Chinese)
[9]郑文君. 渭北苹果光合特性的研究 [D].陕西杨凌:西北农林科技大学,2007.
Zheng W J.The study of photosynthesis characters of apples from the Weibei [D].Yangling,Shaanxi:Northwest Agriculture and Forestry University,2007.(in Chinese )
[10]孙霞,柴仲平,蒋平安.‘红富士’苹果光合特性日变化特征研究 [J].北方果树,2010(5):4-6.
Sun X,Chai Z P,Jiang P A.Study on the diurnal variation of photosynthetic characteristics on ‘Red Fuji’ apples [J].Northern Fruits,2010(5):4-6.(in Chinese)
[11]梁红柱,窦德泉,冯玉龙. 热带雨林下砂仁叶片光合作用和叶绿素荧光参数在雾凉季和雨季的日变化 [J].生态学报,2004,24(7):1421-1429.
Liang H Z,Dou D Q,Feng Y L.Diurnal changes in photosynthesis and chlorophyll fluorescence parameters ofAmomumvillosumlourgrown under tropical rainforest in rainy,and foggy and cool seasons at Xishuangbanna [J].Acta Ecologica Sinica,2004,24(7):1421-1429.(in Chinese)
[12]郭连旺,许大全,沈允钢.棉花叶片光合作用的光抑制和光呼吸的关系 [J].科学通报,1995,40(20):1885-1888.
Guo L W,Xu D Q,Shen Y G.The relationship between photoinhibition and light respiration photosynthesis of cotton leaves [J].Chinese Science Bulletin,1995,40(20):1885-1888.(in Chinese)
[13]赵会杰,邹琦,于振文.叶绿素荧光分析技术及其在植物光合机理研究中的应用 [J].河南农业大学学报,2000,24(7):248-251.
Zhao H J,Zou Q,Yu Z W.Chlorophyll fluoresence analysis technique and its application to photosynthesis of plant [J].Journal of Henan Agricultural University,2000,24(7):248-251.(in Chinese)
[14]王振磊,陈海江,林敏娟,等.黄金梨和鸭梨叶片光合作用的光抑制及其恢复的比较研究 [J].园艺学报,2009,36(9):1261-1268.
Wang Z L,Chen H J,Lin M J,et al.Photoinhibition and recovery of photosynthesis in pear leaves [J].Acta Horticulturae Sinica,2009,36(9):1261-1268.(in Chinese)
[15]Chowdhury S R,Kumar A,Sahoo N.Diurnal changes in chlorophyll fluorescence and light utilization inColocasiaesculentaleaves grown in marshy waterlogged area [J].Biologia Plantarum,2009,53(1):167-170.
[16]郭延平,张良诚,洪双松,等.温州蜜柑叶片光合作用的光抑制 [J].园艺学报,1999,26(5):281-286.
Guo Y P,Zhang L C,Hong S S,et al.Photoinhibition of photosynthesis in Satsuma Mandarin (CitrusunshiuMarc.) leaves [J].Acta Horticulturae Sinica,1999,26(5):281-286.(in Chinese)
[17]唐礼俊,李渤生,匡廷云,等.华山松叶绿素荧光诱导动力学参数的地理变异及其与树高生长的关系 [J].植物生态学报,1997,21(5):474-479.
Tang L J,Li B S,Kuang T Y,et al.Geographical variation in the parameters of chlorophyll fluorescence induction kinetics ofPinusarmandiand its relations with the growth of tree height [J].Acta Phytoecologica Sinica,1997,21(5):474-479.(in Chinese)
[18]林世青,许春辉,张其德,等. 叶绿素荧光动力学在植物抗性生理学、生态学和农业现代化中的应用 [J].植物学通讯,1992,9(1):1-16.
Lin S Q,Xu C H,Zhang Q D,et al.Some application of chlorophyll fluorescence kinetics to plant stress physiologyphy to ecology and agricultural modernization [J].Chinese Bulletin of Botany,1992,9(1):1-16.(in Chinese)
[19]Lin R C,Xu C C,Li L B,et al.Xanthophyll cycle and its molecular mechanism in photoprotection [J].Acta Botanica Sinica,2002,44(4):379-383.
[20]史宝胜,徐继忠,马宝.SH系砧木光合作用特性的研究 [J].河北农业大学学报,2001,24(4):54-57.
Shi B S,Xu J Z,Ma B.The study on photosynthetic character to SH stocks [J].Journal of Agricultural University of Hebei,2001,24(4):54-57.(in Chinese)
[21]Thomas D S,Turner D W.Banana (Musasp.) leaf gas exchange and chlorophyll fluorescence in response to soil drought,shading and lamina folding [J].Scientia Horticulturae,2001,90(1/2):93-108.
[22]徐伟红,郭卫华,徐飞,等.三种枣树叶绿素荧光参数的日变化 [J].山东农业科学,2007(2):29-32.
Xu W H,Guo W H,Xu F,et al.Diurnal changes of chlorophyll fluorescence parameters of three types ofZizyphusjujubaMill [J].Shandong Agricultural Sciences,2007(2):29-32.(in Chinese)
Effects of different dwarfing interstocks on photosynthetic characteristics of grafted apple trees
LUO Jing1,YI Pan-pan2,WANG Fei2,HAN Ming-yu2,WU Wei-fang2,WANG Rong-hua2
(1Gaoping’sForestryBureau,Gaoping,Shanxi048400,China;2CollegeofHorticulture,NorthwestA&FUniversity,Yangling,Shaanxi712100,China)
Abstract:【Objective】 The photosynthetic indexes and chlorophyll fluorescence parameters of grafted apple trees with two dwarfing interstocks were investigated to reveal the photosynthetic mechanism of apple trees grafted on dwarfing interstocks.【Method】 Using M.micromalus as rootstock and biennials Nagafu No.2 as grafting material,the effects of M9 and M26 as dwarfing interstocks on leaf quality,contents of chlorophyll and carotenoid,photosynthetic indexes (net photosynthetic rate,intercellular CO2 concentration,transpiration rate,and stomatal conductance) and their diurnal variations,as well as chlorophyll fluorescence parameters and their diurnal variations were compared to biennials Nagafu No.2 grafted onto M.micromalus as control.【Result】 Photosynthetic rates of apple trees grafted on M9 and M26 were significantly higher than that of the control while stomata conductance,intercellular CO2 concentrations and transpiration rates were lower.The Fm,Fv/Fm and Fv/Fo of apple trees grafted on M9 and M26 were significantly lower than the control,while qN,ETR and NPQ were higher.After the strong light and high temperature at noon,Fo of apple trees grafted on M9 and M26 declined significantly,while NPQ and ETR rose obviously.In contrast,Fo of control group rose significantly,while NPQ and ETR rose insignificantly.The increase of Fo indicated that PSⅡ reaction center of control group deactivated due to the damage of strong sunlight.【Conclusion】 The photosynthetic mechanism of trees grafted on M9 and M26 dwarfing interstocks in defensing strong sunlight damage was different from grafted trees in control group.Trees grafted on dwarfing interstocks had stronger light regulation,higher net photosynthetic rate and earlier harvest time.
Key words:apple physiology;dwarfing interstock;photosynthesis;fluorescence parameters
DOI:网络出版时间:2016-03-1408:4510.13207/j.cnki.jnwafu.2016.04.024
[收稿日期]2014-06-20
[基金项目]陕西省科技统筹创新工程重大专项“苹果园提质增效关键技术研究与示范”(2011KTZB02-02)
[作者简介]罗静(1987-),女,山西大同人,硕士,主要从事园林植物生理生态研究。
[通信作者]王飞(1954-),女,河南孟津人,教授,博士生导师,主要从事园艺植物种质资源评价与利用研究。
[中图分类号]S661.1
[文献标志码]A
[文章编号]1671-9387(2016)04-0177-08
网络出版地址:http://www.cnki.net/kcms/detail/61.1390.S.20160314.0845.048.html

