损伤性肾匀浆体外诱导大鼠骨髓间充质干细胞转分化效果及可能机制的研究*
陈昌金,杨雪梅,吕春燕,赵梓亦,袁 惠,辜海英,高 泓,陈奕名,陈 明
(1.成都中医药大学附属医院中心实验室,成都 610072;2.成都中医药大学附属医院肾病内科,成都 610072;3.四川省成都市第五人民医院病理科 611130,4.四川省成都市树德中学光华校区 610091)
损伤性肾匀浆体外诱导大鼠骨髓间充质干细胞转分化效果及可能机制的研究*
陈昌金1,杨雪梅2,吕春燕3,赵梓亦1,袁惠1,辜海英1,高泓1,陈奕名4,陈明2
(1.成都中医药大学附属医院中心实验室,成都 610072;2.成都中医药大学附属医院肾病内科,成都 610072;3.四川省成都市第五人民医院病理科611130,4.四川省成都市树德中学光华校区610091)
[摘要]目的利用损伤性肾匀浆体外模拟急性肾损伤的微环境,探讨骨髓间充质干细胞(BMSC)诱导转分化及其可能机制。方法将体外培养的BMSC用10%大鼠缺血再灌注损伤肾匀浆上清液进行培养。7 d后从形态学改变、18型角蛋白(CK-18)、肝细胞生长因子(HGF)、骨形态发生蛋白-7( BMP-7)的相应表达水平。结果损伤肾匀浆诱导7 d后,骨髓间充质干细胞形态发生明显变化,并检测到CK-18阳性表达;同时被诱导的HGF和BMP-7表达水平明显升高。结论损伤肾匀浆可诱导BMSC部分向肾小管上皮样细胞转分化,其可能机制是BMSC可能以旁分泌的形式产生了HGF和BMP-7等“肾脏保护因子”。
[关键词]间质干细胞;上皮细胞;肾小管;骨髓间充质干细胞;急性肾损伤;转分化
骨髓间充质干细胞(bone marrow mesenchymal stem cell,BMSC)存在于骨髓基质中,来源于中胚层间充质,是骨髓中的一类非造血干细胞,具有横向分化(即可塑性)和多向分化的潜能。近年研究发现BMSC的分化潜能不仅局限于间充质系,在特定条件下BMSC还能够分化为肝脏细胞[1-2]、内皮细胞[3]、神经细胞[4]等。BMSC用于肾脏方面的研究开始的时间比较晚,但干细胞移植在急性肾损伤的修复方面已经取得一定的成绩。转分化是干细胞的两大基本特征之一。它是指干细胞能从一种细胞类型变成另一种完全不同的细胞类型。其主要机制是在一定条件影响下,相关基因出现了差异性,选择性的表达。目前认为干细胞发挥作用的可能机制有:(1)转分化;(2)细胞输入;(3)自分泌(autocrine);(4)旁分泌(paracrine);(5)最新的假设还包括促血管再生、抑制凋亡、抗炎、更好定位及归巢(homing efficiency),以及固有细胞的转分化和增生[5-7]。其中,旁分泌目前被认为更为重要[8-9]。那么,旁分泌产生的细胞因子和干细胞的转分化又有什么关系呢?本实验拟通过大鼠缺血再灌注损伤肾脏匀浆模拟肾损伤的微环境,体外诱导BMSC的转分化,同时检测旁分泌产生的相关细胞因子肝细胞生长因子(HGF)和骨形态发生蛋白7(BMP-7),来进一步探讨二者的可能关系。
1材料与方法
1.1材料
1.1.1实验动物4周龄雄性SD大鼠,体质量120~150 g,另外取8周龄SD雄性大鼠2只(制作肾脏匀浆用),均由华西医学实验动物中心饲养提供。
1.1.2仪器与试剂倒置显微镜(Olympus公司);电泳仪、凝胶成像系统;实时荧光PCR仪;垂直板电泳装置;PCR仪(Bio-Rad);流式细胞分析仪(Thermo);DMEM /F-12(1∶1,Hyclone公司);胰蛋白酶(Hyclone公司);异硫氰酸荧光素(FITC)标记的兔抗大鼠SH2抗体(BD公司);FITC标记的小鼠抗大鼠SH3抗体(Millcell公司);重组人细胞角蛋白18(CK-18,Sigma 公司);HGF和BMP-7引物(华大生物公司)。
1.2方法
1.2.1BMSC的分离与纯化将4只雄性大鼠断颈处死,75%乙醇中浸泡10 min左右。于超净台中无菌条件下取大鼠股骨、胫骨,除去骨表面附着的组织,并用 磷酸盐缓冲液(PBS)将血迹冲洗干净。去除干骺端钻孔,吸取 2 mL低糖DMEM(L-DMEM)培养液从一端冲洗骨髓腔将骨髓细胞吹到培养皿内,用密度为1.077 g/L的淋巴细胞分离液分离,得到单核细胞层,加入含10%胎牛血清的DMEM/F-12培养液制成单细胞悬液,计数后按1×106个/mL有核细胞的密度接种于细胞培养皿中,放入培养箱在 37 ℃、5%CO2、饱和湿度条件下常规培养。于接种后24 h首次全量换液,此后每隔 3 天全量换液。原代细胞约7 d时细胞可到 80%~90%融合,0.25%胰蛋白酶消化后按1∶2传代。
1.2.2BMSC鉴定大鼠骨髓间充质干细胞(BMSC)的免疫表型鉴定 收集培养第3代的骨髓间充质干细胞,分成3组,每组浓度均制成2×106个/mL,分别加入FITC标记的兔抗大鼠SH2单克隆抗体、小鼠抗大鼠SH3单克隆抗体和加入同型对照IgG孵育。4 ℃避光保存1 h后,1×PBS清洗3次,用流式细胞仪检测细胞表面抗原SH2、SH3的表达,鉴定骨髓间充质干细胞的免疫表型。
1.2.3BMSC体外诱导分化
1.2.3.1肾匀浆制备取正常SD雄性大鼠2只,麻醉后常规消毒,腹部正中切开,无损伤动脈夹夹闭双肾肾蒂,缺血60 min后松开动脉夹,再灌注60 min,得损伤肾。清除脂肪层及筋膜,用无菌眼科剪剪碎,以1×PBS作为匀浆介质,在玻璃匀浆器中无菌操作,得10%肾匀浆(匀浆过程在冰上操作)。将所得肾匀浆3 000 r/min 离心20 min后取上清液,经0.22 μm滤网过滤除菌后4 ℃备用。
1.2.3.2体外诱导骨髓间充质干细胞(MSC)分化取第3代纯化的且经流式仪鉴定后的骨髓间充质干细胞,按5×105个/mL接种于预先放置盖玻片的6孔培养板中培养。将细胞分为两组,分别进行后续的分析。两组细胞分别标为(1)未诱导组:DMEM/F12培养液,10%胎牛血清;(2)诱导组:DMEM/F12培养液,10%胎牛血清,10%大鼠缺血再灌注损伤肾脏组织匀浆上清液;此外,将未做表型鉴定的原代培养细胞,以同样的细胞浓度作为空白对照组,该组只加入DMEM/F12培养液,10%胎牛血清。
1.2.4诱导细胞鉴定
1.2.4.1细胞形态学鉴定诱导第 0、3、5、7 d,倒置显微镜下观察诱导组细胞大体形态变化。
1.2.4.2Western Blot检测诱导7 d后细胞CK-18的表达用1×PBS分别将诱导第7天的诱导组及未诱导组细胞冲洗3遍,每孔中加细胞裂解液1 mL使细胞充分裂解,提取细胞总蛋白,并检测样品蛋白含量。将检测完后的蛋白制作成两组样品进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)电泳,电泳结束后即转膜。转膜后将所转膜取出,将膜用1×PBS浸湿后,移至含有封闭液的平皿中,室温下脱色摇床上摇动封闭30 min。将抗CK-18蛋白一抗用PBS-T(含1×PBS,0.1% Tween)稀释至适当浓度,室温下孵育1 h后,用PBS-T在室温下脱色摇床上洗3次,每次20 mL,10 min。同上方法准备二抗稀释液并与膜接触,室温下孵育1后,用TBST在室温下脱色摇床上洗3次,每次10 min后,显色,拍照。ACTB为内参,利用ScnImage软件测定各目的条带的净灰度值与内参照ACTB条带值相比较。
1.2.4.3实时定量PCR(qPCR)检测诱导细胞内HGF、BMP-7 mRNA的表达分别提取未诱导组及诱导7 d的诱导组细胞的总RNA,电泳跑胶对总RNA完整性进行鉴定。将提取的细胞总RNA作为模板,各取1 μg用于逆转录,按SsoFast EvaGreen supermix试剂盒方法得到cDNA,得到两组各20 μL逆转录产物。将上述cDNA按1∶5稀释,稀释后按AgPath-IDTMOne-Step RT-PCR Reagents说明书进行,以ACTB mRNA作为内参基因,共分6组。完成后将样本插入qPCR仪,1 h后查看结果,与内参ACTB mRNA值相比,得到各指标比较值。各引物序列如表1。

表1 各基因引物序列
1.2.4.4Western blot半定量检测细胞内和培养基上清液中HGF和BMP-7的蛋白表达水平细胞接种于六孔板,5% CO2培养箱中培养24 h后,用4 ℃预冷的PBS清洗处于对数生长期的细胞,弃掉上清液后(或保留上清液直接上样电泳),每个6孔板的单孔加入50 μL RIPA[含1%花絮物质苯甲基磺酰氟(PMSF)],冰置30 min充分反应并将细胞收集到离心管中,于4 ℃、12 000 g离心15 min,将上清液转移到新离心管中待用,方法如前所述。
2结果
2.1BMSC体外分离、纯化将经1.077 g/L淋巴细胞分离液分离后所得原代单个核细胞贴壁培养,约24 h可基本贴壁,3 d细胞生长良好,约7 d细胞融合约80%~90%,消化传代后3 d细胞生长基本可达80%~90%融合。取第3代大鼠MSC,利用流式细胞仪检测SH2阳性率94.5%,SH3阳性率95.8%,见图1。第3代细胞,倒置显微镜下可见细胞呈长梭形、涡旋状有序排列,见图2。

图1 流式细胞仪鉴定BMSC SH2(A)、SH3(B)表达
A:原代细胞第3天;B:原代细胞第7天;C:第1代细胞第3天;D:第2代细胞第3天;E:第3代细胞第3天。
图2BMSC原代细胞第3、7天及传代后3 d形态
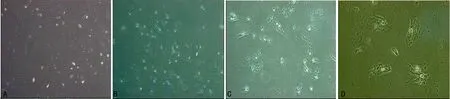
A:未诱导BMSC细胞;B:诱导后细胞(×10);C:诱导后细胞(×20);D:诱导后细胞(×40)。
图3诱导第7天BMSC倒置显微镜下形态

图4 Western Blot检测CK-18的表达
2.2BMSC诱导7 d后形态学观察诱导第7天,未诱导组细胞呈明显长梭形(图3 A);诱导组细胞数减少,部分形态变为短梭形、圆形或不规则形(图3 B~D)。
2.3Western Blot检测诱导7 d后细胞18型角蛋白的表达Western Blot检测诱导7 d细胞CK-18表达阳性,净灰度值明显高于未诱导组,见图4。
2.4HGF、BMP-7的mRNA和相应蛋白质表达的检测本研究比较了未诱导组和诱导7 d的诱导组细胞中HGF、BMP-7的mRNA含量。图5A结果表明,诱导后细胞中的目的基因HGF和BMP-7的转录水平明显升高。图5B的半定量Western blot结果显示,诱导后不但细胞中HGF和BMP-7的mRNA水平升高,蛋白水平也相应升高。本研究比较了分泌到培养基中的HGF与BMP-7蛋白含量。图5C显示,虽然诱导分化后白细胞介素-6表达可能减弱,但却能看到明显的HGF和BMP-7的含量增加。

A:RT-qPCR检测mRNA水平;B:细胞内相应蛋白的检测;C:细胞外相应蛋白的检测。
图5BMP-7和HGF的表达情况检测
3讨论
干细胞治疗急性肾损伤,目前的焦点主要集中在干细胞的来源和作用机制上。修复损伤肾的干细胞包括肾脏外源性干细胞和肾脏内源性干细胞。内源性肾干细胞是指各种肾祖细胞(progenitor of kidney),其来源有两种学说:(1)原位干细胞学说(stem cell in situ theory) 指部分干细胞在肾发育阶段,就提前进入肾脏,潜伏于肾脏组织中,处于静止状态,肾乳头是其聚集区[10],能表达特有的Nanog基因[11];(2)骨髓干细胞学说(stem cell in bone marrow theory)肾脏祖细胞存在于骨髓中,当肾脏受损时,从骨髓中迁移出来,随血循环归巢到受损的肾脏。目前认为存在于肾脏组织中的固有干细胞才是修复肾损伤组织的主要来源干细胞[12]。
本研究使用损伤性肾匀浆,在体外模拟出肾损伤的微环境,这种肾匀浆实际上含有一些有毒的细胞代谢产物及炎性细胞因子等,也包含有肾组织细胞产生的肾脏保护因子如HGF等。在这些综合因素的作用下,使BMSC在体外产生了转分化,一部分BMSC分化成了CK-18表达阳性,细胞形态类似于肾小管上皮细胞的“肾小管样上皮细胞”。转分化后的BMSC,虽然具有肾小管上皮细胞的形态和特有的CK-18表达,但是发现其生长状况并不理想,容易出现死亡。这些发现与文献报道的相一致。例如Poulsom等[13]报道,大约有3%~22%的BMSC能转变成肾小管上皮细胞,Costanza等[14]报道转分化的干细胞容易发生凋亡,可能是某些旁分泌因子产生了作用,并推测是干细胞治疗肾损伤效果并不理想的可能原因。干细胞通过旁分泌产生的保护性肾脏因子,被认为是干细胞主要的治疗机制之一。为了排除来自肾匀浆中的保护性肾脏因子对诱导转发化的干扰,本研究测定了干细胞内HGF 和BMP-7的mRNA水平定量表达,结果显示诱导组干细胞的HGF和BMP-7表达水平显著高于未诱导组,说明在该诱导分化过程中,BMSC的HGF和BMP-7的表达上调。随后的Western Blot 半定量检测发现:在细胞内及细胞外均出现相应的HGF和BMP-7表达产物增加,尤其细胞外液中的表达产物增加,是否可以推测就是干细胞旁分泌产生的结果?此外,这种以旁分泌产生的细胞因子,除了促进肾脏细胞本身修复外,是否也是促使或干预干细胞向不同细胞分化的可能因素呢?这些问题有待作进一步的探索。认识到旁分泌产生的细胞因子对肾损伤的修复作用后,可以应用基因工程技术干预细胞因子的表达,使间充质干细胞在移植治疗中发挥更重要的用[15]。
参考文献
[1]Fürst G,Schulte Am Esch J,Poll LW,et al.Portal vein embolization and autologous CD133+ bone marrow stem cells for liver regeneration:initial experience[J].Radiology,2007,243(1):171-179.
[2]朱海鹏,高志良,彭亮,等.急性肝衰竭大鼠肝匀浆蛋白诱导骨髓间充质干细胞向肝细胞的分化[J].中国现代医学杂志,2011,21(11):1324-1330,1334.
[3]张婷,周云,张亚,等.体外诱导骨髓间充质干细胞向肾小管上皮细胞的分化[J].中国组织工程研究与临床康复,2007,11(3):478-481,603.
[4]Zeng Z,Yuan X,Liu G,et al.Manipulation of proliferation and differentiation of human bone marrow-derived neural stem cells in vitro and in vivo[J].J Neurosci Res,2007,85(2):310-320.[5]Plotnikov EY,Khryapenkova TG,Vasileva AK,et al.Cell-to-cell cross-talk between mesenchymal stem cells and cardiomyocytes in co-culture[J].J Cell Mol Med,2008,12(5A):1622-1631.
[6]Asanuma H,Meldrum DR,Meldrum KK.Therapeutic applications of mesenchymal stem cells to repair kidney injury[J].J Urology,2010,184(1):26-33.
[7]Shabbir A,Zisa D,Suzuki G.Heart failure therapy mediated by the trophic activities of bone marrow mesenchymal stem cells:a noninvasive therapeutic regimen[J].Am J Physiology,2009,296(6):H1888-1897.
[8]Hishikawa K,Fujita T.Stem cells and kidney disease[J].Hypertens Res,2006,29(10):745-749.
[9]吕春燕,陈高莉,杨玲,等.大鼠脂肪干细胞分离培养及细胞表型的研究[J].海南医学,2014,25(9):1256-1259.
[10]Oliver JA,Maarouf O,Cheema FH,et al.The renal papilla is a niche for adult kidney stem cells[J].J Clin Invest,2004,114(6):795-804.
[11]Yan QJ,Chen XM,Zhang YM,et al.NANOG changes in mouse kidney with age[J].Rejuvenation Res,2005,8(4):248-253.
[12]Humphreys BD,Valerius MT,Kobayashi A,et al.Intrinsic epithelial cells repair the kidney after injury[J].Cell Stem Cell,2008,2(3):284-291.
[13]Poulsom R,Forbes S,Hodivala-Dike K,et al.Bone marrow contributes to renal parenchymal turnover and regeneration[J].J Pathol,2001,195(2):229-235.
[14]Costanza S,Elisa R,Elena L,et al.Stem-cell approaches for kidney repair:choosing the right cells[J].Mol Med,2008,14(7):177-185.
[15]陈昌金,袁惠,辜海英,等.多效生长因子基因转染小鼠脂肪来源干细胞的实验研究[J].中国修复重建外科杂志,2013,27(8):897-901.
Transdifferentiation of rat bone marrow mesenchymal stem cell induced by injured kidney homogenate in vitro and the mechanism study*
ChenChangjin1,YangXuemei2,LvChunyan3,ZhaoZiyi1,YuanHui1,GuHaiying1,GaoHong1,ChenYiming4,ChenMing2
(1.CentralLaboratory,TeachingHospitalofChengduUniversityofT.C.M,Chengdu,Sichuan610072,China;2.DepartmentofNephropathy,TeachingHospitalofChengduUniversityofT.C.M,Chengdu,Sichuan610072,China;3.DepartmentofPathology,ChengduFifthPeople′sHospital,Chengdu,Sichuan611130,China;4.GuanghuaDistrictofChengduShudeMiddleSchool,Chengdu,Sichuan610091,China)
[Abstract]ObjectiveTo explore the effect of transdifferentiation of bone marrow- derived mesenchymal stem cells(BMSCs) and the possible mechanism,the micro-environment of acute kidney injury in vitro was simulated with injured kidney homogenate.MethodsBMSCs,isolated from rat bone marrow,were cultured with the presence of 10% injured kidney homogenates.After seven days′ culturing,the morphological changes were observed under microscope.The expression of CK-18,hepatocyte growth factor(HGF) and bone morphogenetic proteins-7(BMP-7) were tested by qPCR and Western blot respectively.ResultsThe morphological observation showed that the BMSCs of induced group had been changed obviously after 7 days incubation.The expression of CK-18 induced group were significantly upregulated.The protein levels of HGF and BMP-7 both in cell culture medium and in induced cell were increased sharply.ConclusionBMSCs could be transdifferentiated partly into renal tubular-like epithelial cells after incubation.It figures out the possible mechanism that BMSCs may produce “kidney protection factors” such as HGF and BMP-7 by their paracrine.
[Key words]mesenchymal stem cells;epithelial cells;kidney tubules;bone marrow mesenchymal stem cells;acute kidney injury;transdifferentiation
doi:·论著·10.3969/j.issn.1671-8348.2016.03.004
*基金项目:成都市科技局项目(313-106);成都中医药大学附属医院项目(Y2009003)。
作者简介:陈昌金(1965-),助理研究员,博士,主要从事肿瘤,干细胞等相关领域的细胞及分子生物学研究。
[中图分类号]R363
[文献标识码]A
[文章编号]1671-8348(2016)01-0299-04
(收稿日期:2015-08-08修回日期:2015-10-16)

