Orexin-A对肥胖抵抗大鼠和高脂饮食诱导肥胖大鼠摄食和自由活动的影响*
彭晓燕, 张海鑫, 郭菲菲, 孙向荣, 公衍玲, 徐 珞△
(1青岛大学医学院病理生理教研室,山东 青岛266021; 2吉林大学第二医院,吉林 长春 130021;3青岛科技大学化工学院,山东 青岛266021)
Orexin-A对肥胖抵抗大鼠和高脂饮食诱导肥胖大鼠摄食和自由活动的影响*
彭晓燕1,张海鑫2,郭菲菲1,孙向荣1,公衍玲3,徐珞1△
(1青岛大学医学院病理生理教研室,山东 青岛266021;2吉林大学第二医院,吉林 长春 130021;3青岛科技大学化工学院,山东 青岛266021)
[摘要]目的: 探讨肥胖抵抗(OR)大鼠、高脂饮食诱导肥胖(DIO)大鼠及正常SD大鼠的摄食量和自由活动量的差异及食欲肽(orexin-A)在其中的作用。方法: 分别于OR、DIO和SD大鼠下丘脑头端外侧区(rLHa)埋置套管,经套管注射不同剂量(0、31.25、62.5、125和250 pmol)的orexin-A,观察大鼠2 h内摄食量和自由活动情况;采用real-time PCR检测下丘脑和rLHa prepro-orexin、orexin-A受体(OX1R)和 orexin-B受体(OX2R)的 mRNA表达;采用放射免疫分析法检测下丘脑和rLHa OX1R和OX2R的蛋白含量。结果: rLHa微量注射orexin-A可显著增加OR、DIO和SD大鼠的摄食量(P<0.05);rLHa微量注射orexin-A后,OR和SD大鼠的自由活动量比DIO大鼠显著增高(P<0.05)。OR大鼠rLHA OX1R和OX2R的mRNA及蛋白表达均明显高于DIO和SD大鼠(P<0.05)。结论: 下丘脑orexin-A参与肥胖和正常大鼠能量代谢调控,其中对OR大鼠的调控效应最佳。
[关键词]肥胖抵抗大鼠; 饮食诱导肥胖大鼠; 摄食; 自由活动量; 食欲肽A
食欲肽A(orexin-A,OXA)是一种参与摄食和觉醒功能的神经肽,主要表达于下丘脑外侧区、背外侧部及穹窿周区[1-3]。Orexin神经元呈辐射状分布在大脑的各个区域,并通过不同机制调控觉醒和摄食行为[2, 4]。Orexin神经元可投射至黑质中支配纹状体的多巴胺能神经元,后者是调节自由活动的关键。有文献报道,orexin缺乏时大鼠的自由活动量和摄食量同时减少,但体重明显增加,表明大鼠自由活动量的变化对体重的影响大于能量摄入[2-3]。雄性SD大鼠长期喂饲高能量饮食后,可表现出不同的体重增加模式,大约50%大鼠体重显著增长,称之为饮食诱导肥胖(diet-induced obese,DIO)大鼠;而另一半体重保持不变的为肥胖抵抗(obesity-resistant,OR)大鼠。OR大鼠虽然摄食量增加,但其体重可维持相对状态,可能与其活动量明显增多有关[5]。目前对调控DIO和OR大鼠自由活动量的中枢机制仍不清楚。本研究拟采用下丘脑头端外侧区(rostral lateral hypothalamic area,rLHa)微量注射OXA的方法,观察大鼠的摄食量和自由运动量改变及机制。
材料和方法
1实验动物
成年雄性SD大鼠,体质量220~250 g,月龄2~4个月,由青岛市药物检验所提供。置于室温(25±2) ℃,12 h昼夜循环光照条件下饲养。自由摄食、饮水。所有动物实验均符合“青岛大学实验动物保护和使用管理方法”。
2实验仪器及试剂
大鼠脑立体定位仪(Scientifica);ANY-maze视频分析系统(Stoelting);orexin-A(Sigma)。
3实验方法
3.1DIO大鼠和OR大鼠模型的建立[6]选取成年雄性SD大鼠312只,其中214只给予高能量饮食(配方为80%基础饲料,10%蛋黄粉,10%猪油)喂养8周,其余98只大鼠给予正常动物饲料喂养8周,造模期间所有大鼠均自由饮水。实验结束后,大鼠麻醉下腹主动脉取血,检测体重、血脂、血清瘦素和胰岛素水平,以体重比正常组大鼠增加15%且Lee′s指数比正常组增加1.5%作为肥胖大鼠建模指标,共99只OR大鼠和103只DIO大鼠制备成功。
3.2rLHa埋置套管大鼠在戊巴比妥钠(50 ng/kg)麻醉下行外科手术。参照Paxinos和Watson脑图谱,将大鼠置于脑立体定位仪,在rLHa植入一同芯套管(定位:前囟后2.2 mm,旁开1.9 mm,深7.3 mm),并固定于颅骨表面。术后7 d进行实验。
3.3大鼠自由活动量检测采用Any-maze视频分析系统监测并记录大鼠自由活动。将大鼠置于1 m×1 m×1.5 m自由活动测量箱内,箱内安装可记录大鼠自由活动情况的视频摄像机。实验结束后将图像传入计算机并自动分析,统计大鼠在箱内0~2 h的活动距离。
3.4Real-time PCR实验DIO、OR和SD大鼠各10只,随机分为2组,大鼠断头取脑,参照Paxinos-Watson大鼠脑图谱分离下丘脑(5只)或rLHa(5只),迅速加入1 mL冰冻TRIzol匀浆。用Trizol reagent方法提取总RNA,NanoORop紫外线分光光度计测定总mRNA浓度和纯度。
取1 μL总RNA,以Oligo (dT)为引物,按试剂盒说明书行逆转录反应,以生成的ss-cDNA为模板,然后加入TaqDNA聚合酶以及prepro-orexin、orexin-A受体(orexin-A receptor,OX1R)和orexin-B受体(orexin-B receptor,OX2R)特异性引物,β-actin作为内参照。扩增反应用SYBR GreenⅠ定量PCR试剂盒和5700型定量PCR仪完成。扩增条件:95 ℃ 1 min;95 ℃ 30 s;60 ℃(preproorexin)或59 ℃(OX1R/OX2R)20 s;72 ℃ 15 s;40个循环。随后观察该PCR产物的熔解曲线[94 ℃ 0 s,84 ℃(OX1R)、82 ℃(OX2R)或79 ℃(prepro-orexin)15 s,94 ℃ 0 s;温度变化速度为0.1 ℃/s],并由电脑自动分析系统进行定量分析。Real-time PCR引物由上海生工合成,引物序列见表1。
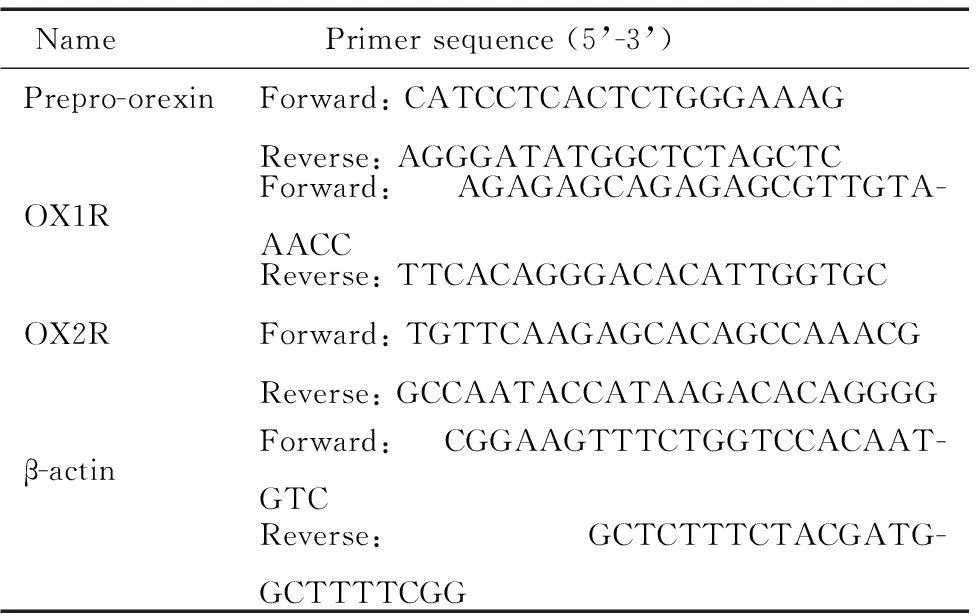
表1 引物序列
3.5放射免疫法检测OX1R 和OX2R DIO、OR和SD大鼠各18只进行放射免疫测定。放射免疫试剂盒由Phoenix提供,大鼠脑区内OX1R 和OX2R的提取和放免检测严格按说明书进行操作。首先配制OX1R 或OX2R标准液(将OX1R 或OX2R标准品用PBS缓冲液稀释成每100 μL分别含2.5、5、10、20、40、80、160、320、640和1 280 pg);OX1R 或OX2R抗血清用PBS稀释至1∶8 000(OX1R 或OX2R纯品和抗OX1R 或OX2R兔血清均为Sigma产品)。动物实验完毕,迅速断头取脑,将脑置于煮沸的生理盐水中煮5 min;吸干、分离下丘脑(9只)或下丘脑背外侧核(9只)、称质量,加1 mol/L盐酸1.0 mL制成匀浆,室温下静置100 min。然后加1 mol/L氢氧化钠1 mL中和,4 000 r/min离心20 min,取上清液测定。测定程序:各管加[125I]-OX1R 或[125I]-OX2R 100 μL,抗OX1R 或OX2R血清100 μL。样品管加100~200 μL,标准管加OX1R 或OX2R 100 μL,最后以磷酸缓冲液补足总反应体积为500 μL;4 ℃冰箱内孵育24 h;各管加1∶3羊抗兔血清100 μL,继续孵育24 h,4 000 r/min离心20 min,弃上清液。测沉淀物的CPM,根据同批测定管的OX1R 或OX2R竞争抑制曲线,求取每mg组织中OX1R或OX2R的含量。
3.6Orexin-A对大鼠摄食量和自由活动量的影响将DIO、OR和SD大鼠分别随机分为2组(每组7只),实验组大鼠rLHa分别微量注射0.5 μL orexin-A(31、25、62.5、125和250 pmol);对照组大鼠下丘脑背外侧核注射0.5 μL生理盐水,给药后1 h和2 h测定大鼠摄食量。
大鼠自由活动量检测前,先将大鼠在测量箱内适应140 min。DIO、OR和SD大鼠随机分为2组(每组7只),实验组大鼠rLHa微量注射0.5 μL orexin-A(31.25、62.5、125和250 pmol);对照组大鼠下丘脑背外侧核注射0.5 μL NS,注射后1 h和2 h监测大鼠自由活动。
4统计学处理
用SPSS 18.0和Prism 5.0统计学软件进行数据处理。数据以均数±标准差(mean±SD)表示,两个独立样本组间均数比较采用t检验,多组间均数差异采用单因素方差分析(one-way ANOVA),方差分析后各组均数间两两比较采用q检验(SNK法)。以P<0.05为差异有统计学意义。
结果
1rLHa注射OXA对大鼠摄食量的影响
DIO、OR或SD大鼠rLHa分别微量注射NS以及31.25、62.5、125和250 pmol OXA,观察大鼠0~2 h摄食量,结果见表2。
分析0~1 h摄食量可见OR大鼠的摄食量明显多于DIO大鼠和SD大鼠(P<0.05);DIO大鼠的摄食量与SD大鼠差异无统计学意义。与NS组相比,rLHa注射高剂量(62.5、125和250 pmol)OXA可显著促进各组大鼠的摄食量(P<0.05);但高剂量组之间大鼠摄食量的差异无统计学意义,且注射相同高剂量OXA(62.5、125或250 pmol)时,OR大鼠的摄食量明显大于DIO大鼠和SD大鼠(P<0.05)。
分析1~2 h的摄食量可见,与NS组相比,rLHa注射不同剂量OXA (31.25、62.5、125和250 pmol), DIO、OR和SD大鼠摄食量的差异无统计学意义。rLHa注射相同剂量OXA时,OR大鼠和DIO大鼠的摄食量之间的差异无统计学意义,但OR大鼠的摄食量显著大于SD大鼠(P<0.05);DIO大鼠的摄食量显著大于SD大鼠(P<0.05)。结合0~1 h数据可推测,OXA对摄食量的作用在0~1 h内逐渐达到峰值,在1~2 h逐渐下降。
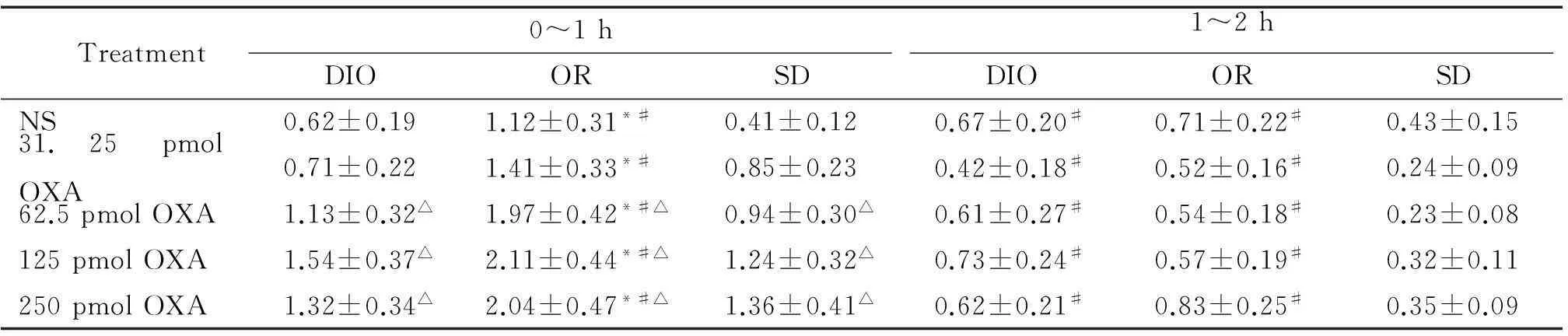
表2 rLHa注射OXA对DIO、OR和SD大鼠摄食量的影响
*P<0.05vsDIO rats with the same treatment;#P<<0.05vsSD rats with the same treatment;△P<0.05vsNS.
2rLHa注射OXA对大鼠自由活动量的影响
DIO、OR和SD大鼠经rLHa分别注射NS以及31.25、62.5、125和250 pmol OXA,观察大鼠0~2 h活动量,结果见图1。
分析0~1 h的自由活动量可见OR大鼠的活动量明显多于DIO大鼠和SD大鼠(P<0.05)。与对照组相比,rLHa注射高剂量(62.5、125和250 pmol)OXA可显著促进各组大鼠的活动量(P<0.05);但高剂量组之间大鼠活动量的差异无统计学意义,且注射相同高剂量OXA(62.5、125或250 pmol)时,OR大鼠的活动量明显大于DIO大鼠和SD大鼠(P<0.05)。
分析1~2 h的自由活动量可见,与对照组相比,rLHa注射不同剂量OXA (31.25、62.5、125和250 pmol), DIO、OR和SD大鼠活动量的差异无统计学意义。rLHa注射相同剂量OXA时,DIO大鼠和SD大鼠的活动量并无显著差异,但OR大鼠活动量大于DIO大鼠和SD大鼠(P<0.05)。结合0~1 h数据可推测,OXA对自由活动量的影响在0~1 h内逐渐达到峰值,在1~2 h逐渐下降。

Figure 1. The effect of OXA injection in rLHa on spontaneous physical activity of DIO, OR and SD rats. Mean±SD.n=7.*P<0.05vsDIO rats with the same treatment;#P<0.05vsSD rats with the same treatment;△P<0.05vsNS.
图1rLHa注射OXA对DIO、OR和SD大鼠自由活动量的影响
3下丘脑和rLHa prepro-orexin、OX1R和OX2R 的mRNA表达
OR大鼠rLHa OX1R和OX2R的mRNA表达均显著高于DIO大鼠和OR大鼠(P<0.05);但3种大鼠rLHa的prepro-orexin以及下丘脑prepro-orexin、OX1R和OX2R的 mRNA表达均无显著差异,见表3。

表3 下丘脑和rLHa prepro-orexin、OX1R和OX2R mRNA的表达
*P<0.05vsSD rats;#P<0.05vsDIO rats.
4下丘脑和rLHa OX1R和OX2R蛋白表达的改变
放射免疫分析结果显示,OR大鼠rLHa的 OX1R和OX2R含量均显著高于DIO大鼠和SD大鼠(P<0.05);DIO大鼠rLHa 的OX1R和OX2R明显高于SD大鼠(P<0.05),但DIO、OR和SD大鼠的整个下丘脑内OX1R和OX2R的表达均无显著差异,见表4。
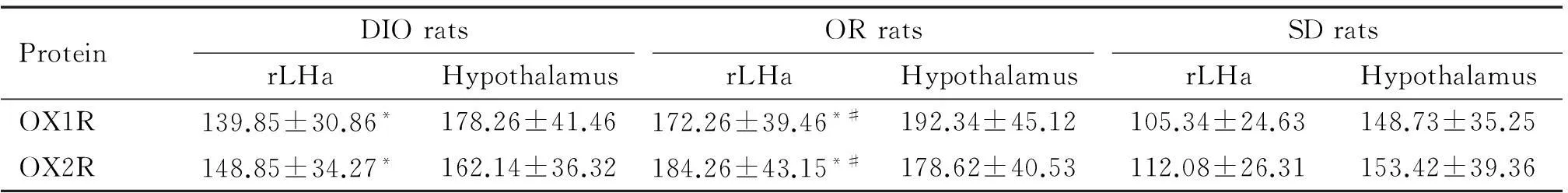
表4 下丘脑和rLHa OX1R和OX2R蛋白的含量
*P<0.05vsSD rats;#P<0.05vsDIO rats.
讨论
为探讨DIO及OR大鼠摄食行为和自由活动的差异,我们选择正常SD大鼠作为参照。本实验大鼠于rLHa注射OXA引起的摄食行为与之前学者们[3, 7-8]的研究结果基本一致,都证实了在中枢OXA促进大鼠的自由活动[7, 9-10]和能量消耗[11-12]。此外,本研究发现,OXA诱导大鼠摄食量的增加主要体现于0~1 h摄食量的增加;而OXA诱导的自由活动量增加主要体现在0~2 h阶段,即由OXA诱发的单位时间段内的摄食量及自由活动量变化不同,可能是摄食和自由活动的调节通过2种不同的作用通路。此外,OR大鼠rLHa OX1R 和OX2R的 mRNA含量明显高于DIO大鼠,推测rLHa注射相同剂量OXA后OR大鼠活动量大于DIO和SD大鼠的原因可能是OXA通过rLHa的OX1R和OX2R信号因子发挥作用。
本研究实验数据显示,与DIO和SD大鼠相比,OR大鼠具有较大的基础自由活动量,且注射相同剂量OXA,OR大鼠有着更高的摄食量和自由活动量。但OR大鼠对OXA反应敏感的作用机制现还不清楚,可能是OR大鼠下丘脑OXA受体表达量较高,为了验证这个假设,我们检测了OR及DIO大鼠下丘脑OX1R 和OX2R的mRNA表达水平。结果发现,OR大鼠rLHa内OX1R 和OX2R 的mRNA表达均比DIO大鼠显著增多,提示OXRs的增加和OXA引起摄食量和自由活动量的增加是同步进行的,OX1R和OX2R这2种受体亚型均有可能参与摄食及自由活动的调节过程。此外我们还测定了整个下丘脑的prepro-orexin和OXRs的mRNA表达水平,以判断orexins在DIO和OR大鼠的表达是否相同。结果显示DIO和OR大鼠下丘脑prepro-orexin和OXRs的mRNA表达水平差异无统计学意义,我们推测下丘脑内有多种食欲肽,虽各种食欲肽的mRNA表达有显著差异,但总体水平相当。
此外,放射免疫研究显示OR大鼠rLHa 的OX1R和OX2R含量明显高于DIO和SD大鼠,而整个下丘脑区域的OX1R或OX2R含量无显著差异,与rLHa区OXRs的mRNA和蛋白表达结果一致。本研究发现OR和DIO大鼠之间自由活动量的差异可能是导致其体重变化的重要因素之一[7]。有文献报道,DIO和OR大鼠对OXA诱导摄食和能量代谢效应的差异可能与中枢单胺类神经递质[13]、瘦素[14-15]以及胰岛素[16]功能活动有关,但具体机制不清。
[参考文献]
[1]Kukkonen JP, Leonard CS. Orexin/hypocretin receptor signalling cascades[J]. Br J Pharmacol, 2014, 171(2):314-331.
[2]Gao XB, Horvath T. Function and dysfunction of hypocretin/orexin: an energetics point of view[J]. Ann Rev Neurosci, 2014, 37:101-116.
[3]Sakurai T, Amemiya A, Ishii M, et al. Orexins and orexin receptors: a family of hypothalamic neuropeptides and G protein-coupled receptors that regulate feeding behavior[J]. Cell, 1998, 92(4):573-585.
[4]Hoyer D, Jacobson LH. Orexin in sleep, addiction and more: is the perfect insomnia ORug at hand? [J]. Neuropeptides, 2013, 47(6):477-488.
[5]Zink AN, Perez-Leighton CE, Kotz CM. The orexin neuropeptide system: physical activity and hypothalamic function throughout the aging process[J]. Front Syst Neurosci, 2014, 8:211.
[6]徐姝迪,郑玉建,丁红,等. 高脂饲料诱导肥胖大鼠模型的方法研究[J]. 现代预防医学, 2012, 39(2):294-295.
[7]Perez-Leighton CE, Billington CJ, Kotz CM. Orexin modulation of adipose tissue[J]. Biochim Biophys Acta, 2014, 1842(3):440-445.
[8]Sakurai T. Roles of orexins in the regulation of body weight homeostasis[J]. Obesity Res Clin Pract, 2014, 8(5):e414-e420.
[9]Zhang XY, Yu L, Zhuang QX, et al. Central functions of the orexinergic system[J]. Neurosci Bull, 2013, 29(3):355-365.
[10]Mieda M, Sakurai T. Overview of orexin/hypocretin system[J]. Prog Brain Res, 2012, 198:5-14.
[11]Baimel C, Bartlett SE, Chiou LC, et al. Orexin/hypocretin role in reward: implications for opioid and other addictions[J]. Br J Pharmacol, 2015, 172(2): 334-348.
[12]Tsuneki H, Sasaoka T. Hypothalamic orexin system regulates energy and glucose metabolism[J]. Nihon Yakurigaku Zasshi, 2013, 142(6):316-317.
[13]Hassanain M, Levin BE. Dysregulation of hypothalamic serotonin turnover in diet-induced obese rats[J]. Brain Res, 2002, 929(2):175-180.
[14]How JM, Pumpa TJ, Sartor DM. The circulatory and renal sympathoinhibitory effects of gastric leptin are altered by a high fat diet and obesity[J]. Auton Neurosci, 2013, 177(2):95-100.
[15]Scarpace PJ, Zhang Y. Leptin resistance: a prediposing factor for diet-induced obesity[J]. Am J Physiol Regul Integr Comp Physiol, 2009, 296(3):R493-R500.
[16]Olea E, Agapito MT, Gallego-Martin T, et al. Intermittent hypoxia and diet-induced obesity: effects on oxidative status, sympathetic tone, plasma glucose and insulin levels, and arterial pressure[J]. J Appl Physiol, 2014, 117(7): 706-719.
(责任编辑: 陈妙玲, 罗森)
Effects of orexin-A on food intake and spontaneous physical activity in obesity-resistant rats and high-fat diet-induced obese rats
PENG Xiao-yan1, ZHANG Hai-xin2, GUO Fei-fei1, SUN Xiang-rong1, GONG Yan-ling3, XU Luo1
(1DepartmentofPhysiology,QingdaoUniversityMedicalCollege,Qingdao266021,China;2TheSecondHospitalofJilinUniversity,Changchun130021,China;3CollegeofChemicalEngineering,TsingtaoUniversityofScience&Technology,Qingdao266021,China.E-mail:xu.luo@163.com)
[ABSTRACT]AIM: To investigate the differences of food intake and spontaneous physical activity (SPA) among obesity-resistant (OR) rats, diet-induced obese (DIO) rats and normal Sprague-Dawley (SD) rats and the role of orexin-A in these processes. METHODS: The rostral lateral hypothalamic area (rLHa) catheter was implanted into the OIO, OR, and SD rats. Orexin A at doses of 0, 31.25, 62.5, 125 and 250 pmol was injected through the catheter. The SPA and food intake were measured and recorded for 2 h after injection. The mRNA expression of prepro-orexin, orexin-A receptor (OX1R) and orexin-B receptor (OX2R) in the rLHa and hypothalamus of OR, DIO and SD rats was detected by real-time PCR. The protein expression of OX1R and OX2R in the hypothalamus and rLHa of the rats was measured by radioimmunoassay. RESULTS: A small-dose injection of orexin-A into rLHa significantly increased the food intake in all the rats. Orexin A-induced SPA had significant differences, showing that the OR and SD rats had the higher motion than the DIO rats. The mRNA and protein levels of OX1R and OX2R in the rLHa of OR rats were significantly higher than those in DIO and SD rats. CONCLUSION: Hypothalamic orexin-A participates in the regulation of energy metabolism in obese and normal rats, in which the regulatory effect on OR rats is the best.
[KEY WORDS]Obesity-resistant rats; Diet-induced obese rats; Food intake; Spontaneous physical activity; Orexin-A
[文章编号]1000- 4718(2016)01- 0046- 05
[收稿日期]2015- 06- 25[修回日期] 2015- 10- 27
*[基金项目]国家自然科学基金资助项目(No. 81270460;No. 81470815;No. 81500414);山东省优秀中青年科学家科研奖励基金资助项目(No. BS2014YY009);青岛市公共领域科技支撑计划(No.14-2-3-3-nsh)
通讯作者△Tel: 0532-82991713; E-mail: xu.luo@163.com
[中图分类号]R363
[文献标志码]A
doi:10.3969/j.issn.1000- 4718.2016.01.008

