外源H2S对干旱胁迫下水稻种子萌发过程淀粉酶活性的影响
刘晶 张鹤婷 殷悦 陈惠萍
摘 要 为了探索H2S对干旱胁迫下萌发水稻种子中淀粉酶活性的影响,本研究以‘粤优589水稻(Oryza sativa L.)杂交种子为实验材料,以20%PEG模拟干旱,0.75 mmol/L硫氢化钠(NaHS)作为外源H2S供体,采用DNS比色法、碘染等方法探究水稻种子萌发过程中淀粉酶活性变化、种子吸胀速率、胚乳乳化等现象。结果表明:在干旱胁迫条件下,外源H2S供体NaHS处理使水稻种子吸水速度加快1.5 h;在胚乳乳化过程中,NaHS处理的淀粉分泌斑块较PEG处理大,碘染后液化现象明显优于PEG处理;与PEG相比,NaHS处理的淀粉酶活性呈现显著增强趋势,且第4天增高幅度最大,总淀粉酶活性提高67.14%,α-淀粉酶活性提高35.31%,β-淀粉酶活性提高71.79%,且在水稻种子萌发初期,β-淀粉酶的贡献大于α-淀粉酶;H2S的抑制剂羟胺(NH2OH)则逆转了外源H2S供体NaHS对水稻种子萌发的作用效应。证实外源H2S有效地缓解干旱胁迫对水稻种子萌发的抑制作用,提高淀粉酶活性,加快种子吸胀速率、胚乳乳化速度,显著地促进水稻种子的萌发。
关键词 干旱胁迫;H2S;淀粉酶活性;胚乳乳化;吸胀作用
中图分类号 S511 文献标识码 A
干旱是农作物减产的主要原因之一,据统计,因干旱所造成的产量损失居于各种胁迫之首[1]。根据水分缺失的程度,对于作物的影响也不同。适度轻微的干旱胁迫可以提高作物的淀粉积累速度,改善籽粒的充实状况[2]。但较为严重的干旱胁迫,即使前期的供水充足,孕穗、抽穗与灌浆等过程的水分缺失也会造成灌浆时间明显缩短,造成早衰现象,从而影响作物的品质与产量[3]。
水稻(Oryza sativa L.)属禾本科植物,胚乳是贮藏碳水化合物的主要场所,淀粉作为主要的贮藏物质需要在淀粉酶的作用下进行降解,然后以蔗糖的形式运输到生长中的胚芽和胚根中, 为种子的呼吸作用提供基质,为胚根、胚芽生长和器官建造提供物质基础和能量来源。因此,淀粉酶在水稻种子萌发过程中有着不可或缺的作用。同时,关于水稻等作物干旱胁迫应答机制的研究较多,如干旱胁迫下水稻膜透性的变化研究[4]、水稻形态指标上的影响[5]、叶片光合特性及糖代谢变化等[6],对于萌发过程中的淀粉酶研究较少。
H2S是一种无色、易燃并具有臭鸡蛋气味的气体,在动物体中已发现内源性的H2S通过参与ATP敏感的K+通道(KATP)途径[7]、cAMP途径作用于神经系统[8],以及作用于细胞的电压门控和TTX-敏感性钠离子通道[9]等途径进行信号传导,是动物体中较为重要的信号调节物质。植物中的H2S可以诱导不定根的形成[10],促进种子的萌发并缓解非氧化损伤[11-15],还参与保卫细胞的信号传导,调节气孔的运动[16-17]等,此外,还对植物体的光合作用机制产生影响[18]。有研究表明H2S可以减轻干旱胁迫对植物的影响。吴单华等报导NaHS浸种可提高小麦种子在干旱胁迫下的发芽率及幼苗的存活率,提高幼苗的内源脯氨酸和可溶性糖的积累,缓解干旱胁迫对膜脂的过氧化作用,进而提高小麦幼苗对干旱胁迫的综合抵抗能力[19]。Zhang等报导:在干旱条件下,用NaHS溶液浇灌大豆幼苗,可以增加叶片中的叶绿素含量,提高SOD、CAT等抗氧化酶活性,延长幼苗的存活时间,增加地上和地下部的生物量,延迟自由基的累积,减缓其遭受干旱胁迫的程度[20]。H2S作为外源性的信号调节物质,所需的浓度不高,不会对作物产生较大的毒性[21],而又能够有效的提高作物的抗旱性。可以作为一种新的农业调节手段,提高对于水资源的利用,并且有助于培育出抗旱性较高的品种。因此,本研究用碘染法、DNS比色法、表观分析等手段探讨外源H2S气体对模拟干旱胁迫条件下萌发水稻种子中的淀粉酶活性变化的影响,以期为提高水稻抗旱性提供理论参考。
1 材料与方法
1.1 材料
实验材料为2015年的‘粤优589杂交种水稻(Oryza sativa L.),購自海口种子站。先用0.1%高锰酸钾消毒15 min,再用蒸馏水冲洗,分别用不同的处理液浸种12 h后移入培养皿。以蒸馏水培养作为对照组CK,其余各组处理加入10 mL 20%聚乙二醇(PEG-6000)并放入光照培养箱继续培养,培养条件为光强400 μmol/(m2·s),光照时间16 h,昼夜温度为25/18 ℃。培养48 h后开始观察。
1.2 方法
1.2.1 实验处理 实验处理为:(1)CK:水(对照处理); (2)PEG: 20%PEG-6000; (3)PEG+NaHS:20%PEG-6000+0.75 mmol/L NaHS;(4)PEG+NH2OH:20%PEG-6000+0.50 mmol/L NH2OH;(5)PEG+NaHS+NH2OH:20%PEG-6000+0.75 mmol/L NaHS+0.50 mmol/L NH2OH。
1.2.2 测定指标与方法 (1)总淀粉酶及α-淀粉酶活性的测定:参照3,5-二硝基水杨酸比色法[22];(2)种子吸水膨胀的表观测定:在处理液中加入10倍稀释的碘-碘化钾母液,使碘试剂随种子吸水膨胀进入内部,淀粉遇碘变蓝,记录观察蓝色斑点的移动速度,通过对比蓝色斑点面积的大小,确定种子吸水速率的快慢;(3)α-淀粉酶活性的表观测定:为进一步确定各处理种子的α-淀粉酶活性变化,用碘染的方法对培养1~6 d的种子淀粉酶活性进行表观的测定分析,可以通过培养皿中的白色斑点的大小,直观的判断α-淀粉酶活性的大小。将各种处理培养1~6 d的种子进行横切,取带有胚的一半接种在培养基上(100 mL内含H2O、0.25 g煮沸过的可溶性淀粉、2 g琼脂、10 mmol/L pH5.3醋酸缓冲液和0.03 g CaCl2),置于25 ℃恒温箱中培养24 h,然后,用稀释5倍的碘液染色,观察培养基上种子周围的白色斑点大小,通过对比斑点的大小,确定α-淀粉酶活性的高低;(4)胚乳的液化观察:采用培养4 d的不含胚的半粒种子,接种在培养基上(100 mL内含H2O、2 g琼脂、10 mmol/L pH5.3醋酸缓冲液和0.03 g CaCl2),置于25 ℃恒温箱中培育24 h后,观察胚乳液化的现象并做记录;(5)种子纵剖碘染观察:将不同处理培养的1~6 d的种子,进行纵切并用稀释后的碘液进行胚乳的染色,依次进行观察并拍照。
1.3 数据分析
所有的数据均重复测定3次,采用SPSS和Excel软件对测得数据进行统计分析和作图,用LSD极差法小于0.05判断各种结果差异是否显著,小于0.01判断差异是否极显著。
2 结果与分析
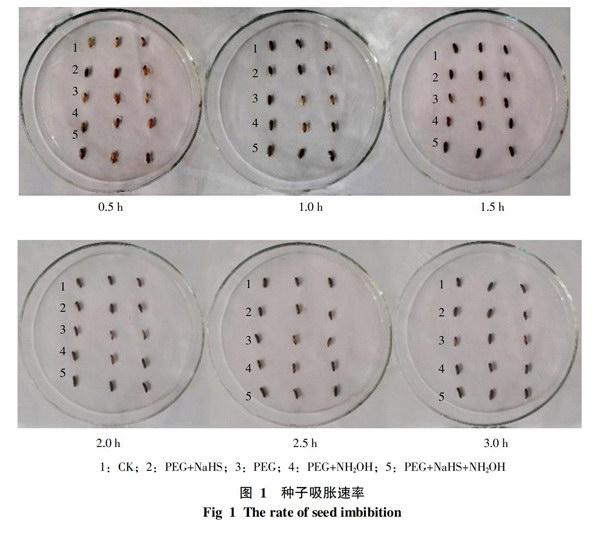
2.1 种子吸水速率对萌发的影响
水稻种子在经过稀释碘液处理后的3 h内,对其进行连续观察。结果如图1所示,在稀释碘液处理后的0.5~3 h,水稻种子胚乳上的蓝色斑点迅速扩大,直至3 h后基本全部变蓝。PEG+NaHS处理的吸水速度明显较快,到1.5 h为止,种子已全部变蓝;而PEG+NH2OH和PEG+NaHS+NH2OH处理在2~2.5 h内变蓝,只有PEG处理吸水速度稍慢,在3 h后才全部变蓝。由不同处理所表现出的吸水速率可以看出,经过NaHS进行处理的种子与其它处于干旱胁迫条件下的处理相比,吸水速率明显提高,基本与CK一致。说明外源H2S对缓解干旱、增加吸涨作用有一定的效果。
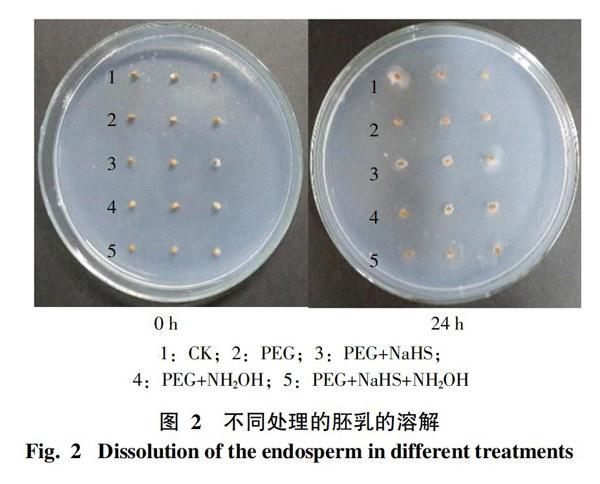
2.2 水稻胚乳的液化及溶解分析
2.2.1 胚乳液化的表观现象 为进一步验证不同处理中胚乳乳化的速率与种子的萌发形态是否一致,在此设置了胚乳乳化观察实验。将不含胚的半粒种子接种于培养基中,经过24 h后,种子周围会出现明显的淀粉分泌斑块,而斑块的大小可代表处理中胚乳液化或溶解的速度快慢。所得结果如图2所示,经过24 h后,种子周围分泌斑块的形成,从整体上看,CK的分泌斑块相对明显;在含有PEG处理的种子中,PEG+NaHS处理的分泌斑块较大,单独PEG处理的斑块最小,其它处理的分泌斑块大小比较相近。说明干旱条件下各处理中,PEG+NaHS处理的胚乳液化、溶解程度较高。
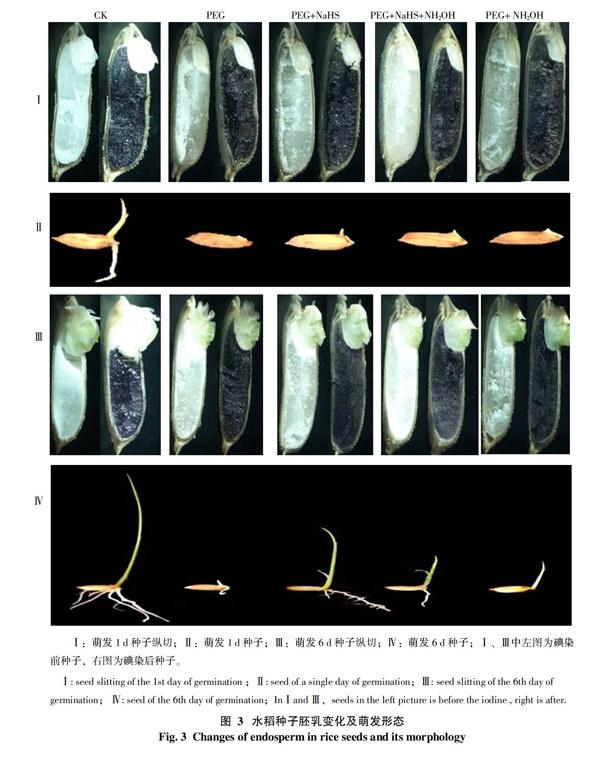
2.2.2 水稻种子纵切及胚乳乳化分析 为了更加直观的了解种子萌发时胚乳的乳化现象,将水稻种子纵切的碘染前、后与种子萌发形态进行直观的对比,如图3所示。分别取5个处理1 d和6 d的种子进行对比,发现胚乳从胚与其连接部分开始逐渐乳化,说明水稻种子的胚乳随时间的增长,出现逐渐液化、溶解的现象。
在图3-Ⅰ、Ⅲ中,各处理种子碘染前,1 d中的白色淀粉粒在胚乳内分布较多,在6 d 时相对减少,说明随时间的增长,胚乳中的淀粉也在不断被水解。将种子进行碘染后,可观察到被染色的胚乳面积逐渐向下移动,其中,CK最为明显,而在含有PEG的各处理中,PEG+NaHS处理的胚乳乳化及淀粉粒减少现象更为明显。可以看出PEG+NaHS处理的胚乳乳化及淀粉水解速度高于其它处于干旱处理的,因此,其萌发速率相应得到了增加(图3-Ⅳ)。
将3-Ⅱ和Ⅳ中种子形态进行比较,第1天中除CK的已萌发出根和芽外,处于干旱胁迫下的处理基本露白,其中,PEG+NaHS 处理已开始胚芽的萌发,长势稍好;而6 d中各处理都出现了胚根和胚芽的形态发生,其中,CK的长势最好,其次是PEG+NaHS处理明显比其它含有PEG的处理具有较显著的生长优势。说明在干旱胁迫下,加入NaHS可在一定程度上促进种子根和芽的萌发,而加入了NaHS抑制剂的处理则效果不明显。
2.3 H2S对干旱条件下萌发水稻种子总淀粉酶活性的影响
如图4所示,萌发过程中的淀粉酶活性变化呈现上升的趋势。随着处理时间的延长,各处理的差异逐渐明显。PEG+NaHS处理在第1~2天的总淀粉酶活性与其它含PEG的处理无明显差异,第2天后则显著提升,明显高于其它的处理,在第4天NaHS比PEG淀粉酶提高了67.14%。说明NaHS对于干旱胁迫起到了一定的缓解作用,使酶活性后期有显著的提高。而PEG+NH2OH和PEG+NaHS+NH2OH处理与单独的PEG处理结果都比较相近,没有显著性差异,说明H2S抑制剂NH2OH逆转了NaHS提高干旱下酶活性的效应。
通过比较发现,在处理的第1天,正常处理种子的总淀粉酶活性最高,比最低的PEG+NaHS+NH2OH处理高49.74%,PEG+NH2OH处理处于中间水平;PEG+NaHS处理与PEG单独处理种子的总淀粉酶活性基本相同。从平均增长幅度来看,最高的CK增长271.99%,除PEG处理外,其余3组的平均增长幅度较为接近。由此可知,PEG抑制水稻种子萌发时总淀粉酶活性的现象较为明显,加入NaHS可在一定程度上增加总淀粉酶活性。
2.4 H2S对干旱条件下水稻种子萌发过程α-淀粉酶活性的影响
2.4.1 水稻种子萌发过程α-淀粉酶活性变化 由图5可知,α-淀粉酶的活性随种子萌发时间的增长而升高,CK处理的α-淀粉酶活性最高。在1~3 d,其它处理的活性未有明显的差异,增长趋势相近,干旱胁迫的4个处理的α-淀粉酶活性均明显低于CK,但从第3天后,活性增长的幅度有了明显差异,PEG+NaHS处理的种子α-淀粉酶活性大幅度提升,明显高于其它三个处理,最高时高达45.73%。因为NH2OH对NaHS具有抑制作用,PEG+NaHS+NH2OH处理表现出的活性增长速度与PEG+NH2OH的处理相似。而NH2OH与PEG本身并不产生反应,PEG+NaHS+NH2OH表现出的活性增长与单独PEG处理和PEG+NaHS+NH2OH处理相似。从平均增长率来看,PEG+NaHS处理的平均增长速率较快,为3.83,CK为3.28,与PEG处理的平均增长速率相近,另外两个处理的增长较缓慢一些,约2.5。
水稻种子的α-淀粉酶活性在发芽天数间具有极显著差异(p<0.01),在处理间具有显著差异(p<0.05)。为进一步了解处理组间的差异,对不同的处理进行两两比较。结果表明:CK与其它4个处理间均呈现极显著差异;对干旱胁迫的4个处理进行比较,除PEG处理与PEG+NH2OH处理相比不显著外,其它3个处理比较表现差异显著。通过上述结果可知,NaHS能缓解干旱胁迫下水稻萌发时α-淀粉酶活性的下降,使PEG+NaHS處理的酶活性维持在较高的水平,且显著高于其它3个处理。
2.4.2 水稻种子萌发时α-淀粉酶活性的表观测定分析 结果见图6,从1~6 d,培养基中的白斑渐渐扩大,将同一时间的各个处理进行对比,发现CK的白斑最大(6 d时可达到半径0.5~0.6 cm);在1~3 d,含PEG的4个处理的白斑大小差异不明显,但在3 d后,以PEG+NaHS处理的白斑半径最大(6 d达到0.5 cm左右);而PEG、PEG+NH2OH和PEG+NaHS+NH2OH三个处理的差异并不明显,白斑半径均小于0.5 cm。表明含有PEG处理的种子α-淀粉酶活性受到抑制,白色斑点较小,而加入NaHS后白斑有了明显的扩大,α-淀粉酶活性显著提高。由此可见,1~6 d培养的各处理种子萌发的形态及α-淀粉酶活性变化基本保持一致。
上述结果表明:与其它处理相比,CK的酶活性的平均增长速率较高。经过PEG处理的酶活性和增长速率明显降低,但通过加入H2S供体NaHS则有效缓解了干旱胁迫,使酶活性及增长速率在3~4 d后明显得到提高,为进一步确定NaHS的作用,在处理中同时加入NH2OH,使其抑制NaHS的干旱缓解作用并进行检验,所得结果与单独PEG处理和PEG+NH2OH处理的效果相近。通过以上比较发现,NaHS对于α-淀粉酶活性的平均增长速率及种子最初所含的淀粉酶活性均产生影响,从而使总淀粉酶活性发生变化,验证了NaHS对α-淀粉酶的作用。
2.5 H2S对干旱条件下水稻种子萌发过程β-淀粉酶活性的影响
由图7可知,各处理随着时间的延长,活性逐渐提高。在1~2 d,各处理的酶活性无显著差异,2 d后,PEG+NaHS处理的酶活性显著提升,与其它处理间存在显著差异。在2~4 d,PEG+NaHS处理的酶活性提升最快,高达117.2%,而PEG、PEG+NH2OH和PEG+NaHS+NH2OH处理的酶活性差异不明显;4~6 d进入平缓期;6 d后,各处理的β-淀粉酶活性达到1 d的约4倍左右。
对β-淀粉酶活性的平均增长率以及种子最初所含的酶活性进行比较,以CK为例,发现最低的第1天种子所含有的β-淀粉酶活性已经比α-淀粉酶活性大62.22个酶活,平均增长速率也高37.46。进行处理间比较,CK、PEG+NaHS、PEG、PEG+NH2OH和PEG+NaHS+NH2OH处理的β-淀粉酶活性平均增长速率分别40.74、31.80、22.40、28.46和29.16。可以看出NaHS处理表现出酶活性有较明显的提高。
综上所述,β-淀粉酶活性变化趋势与总淀粉酶活性变化基本一致,β-淀粉酶活性随萌发时间的延长而逐渐增加。对含PEG的4个处理进行比较,PEG+NaHS处理的β-淀粉酶活性增长速率快,与其它处理相比,均表现出极显著差异。
对β-淀粉酶活性进行的各项分析结果表明:处于干旱条件下水稻种子的β-淀粉酶活性、平均增长速率等有大幅度降低,而加入外源H2S后,起到一定缓解作用。在2~4 d,活性及平均增长率明显上升,因此,此时PEG+NaHS处理的β-淀粉酶活性均为平均水平以上,种子中最初所含的酶活性也有所增加。综上各项分析,NaHS对于β-淀粉酶活性也有显著的影响,通过β-淀粉酶及α-淀粉酶活性的共同作用对总淀粉酶活性产生影响。
3 讨论与结论
吸胀作用对于禾本科植物萌发阶段尤为重要,会影响种子的萌发速度与质量。在干旱胁迫下,水稻种子萌发过程中吸水受到抑制,这样不可避免地影响到种子中与碳氮代谢相关酶的活性及其代谢产物,从而影响种子萌发[23]。在本实验中,通过表观测定中蓝色斑点的扩散速度或面积大小,判断种子的吸胀作用的快慢,蓝色斑点面积越大或越早出现表明种子的吸胀作用越好,干旱胁迫下的处理比正常CK处理的扩散速度慢,而NaHS的处理比其他干旱处理的速率高,说明外源H2S处理可以减轻干旱胁迫对种子吸水的抑制作用。水稻种子开始发芽后,胚乳细胞的细胞壁被溶解,使胚乳细胞分离,然后在一系列酶的作用下,胚乳中所含的淀粉、纤维素等物质被逐渐分解,使整个胚乳结构变得疏松,进而导致胚乳液化、溶解[24]。本研究结果表明,对照的胚乳液化程度最高,干旱胁迫中以NaHS最高。说明萌发水稻种子在受到干旱胁迫后,胚乳的乳化及溶解过程减慢,种子萌发吸水速率降低,从而表现为水稻种子萌发时形态上的差异。NaHS处理明显提高了干旱胁迫下种子的吸水速率以及胚乳乳化程度,在一定程度上促进种子萌发,缓解干旱效应,促进干旱胁迫下萌发水稻种子的形态建成。
淀粉主要通过水解的方式进行降解,α-淀粉酶与β-淀粉酶都是必不可少的分解淀粉的酶类。本研究表明,与CK相比,处于干旱胁迫条件下的种子,α-淀粉酶和β-淀粉酶活性显著降低,很大程度上抑制了水稻种子萌发。孙果忠等[25]研究发现种子正常萌发时,胚内的淀粉酶活性会不断增强,若施以水分胁迫,这种增长就会受到抑制,与本研究的结果也相一致。β-淀粉酶活性的变化趋势与α-淀粉酶及总淀粉酶的相一致,且β-淀粉酶活性的平均增长速率明显高于α-淀粉酶活性;不同处理种子中β-淀粉酶活性前期变化幅度较大,而后期趋于稳定,推测是种子中所含的束缚态β-淀粉酶不断释放的结果[26]。有报道称小麦种子中的β-淀粉酶在浸种完成后就有存在[24],而α-淀粉酶是在发芽后重新开始合成的;开始发芽后,α-淀粉酶会迅速合成,并在第4天左右的时候合成速度变慢。所以,种子中所含的β-淀粉酶活性也明显高于α-淀粉酶活性。该变化与阎娥[27]的结论一致。
对各处理种子进行酶活性方差分析,得知在β-淀粉酶活性测定中,PEG+NaHS处理与其它含PEG的3个处理比较,其酶活性极显著提高(p<0.01),而其它3个处理间无显著差异。在α-淀粉酶活性测定当中,除单独PEG处理与PEG+NH2OH处理间差异不显著外,其它处理间均为显著差异(p<0.05)。说明H2S对α、β-淀粉酶活性调节的程度不同,H2S对β-淀粉酶活性的调节作用更为明显,但在萌发前期不同时间内具体作用于哪种酶的效果更明显,其结果尚不明确,待进一步研究证实。本文所得结论与宋俊洲等[24]在大麦萌发过程中,对于α-淀粉酶活性的影響最为显著的结论不同,猜测是因为材料不同的缘故,但与张华[28]的小麦的结论一致。
本实验最终表明,外源H2S可以加快干旱胁迫下萌发水稻种子的吸水速率和胚乳乳化速率,提高淀粉酶活性,减缓干旱对水稻萌发的抑制,显著促进种子的萌发。但是,对于种子萌发前期,外源H2S对于哪种淀粉酶作用更显著的问题,还尚无定论,其具体差异还需进行更深入的探讨。
参考文献
[1] Riadh K, Wided M, Hans-Werner K, et al. Responses of halophytes to environmental stresses with special emphasis
to salinity[J]. Adv Bot. Res, 2010, 53: 117-145.
[2] 王 维, 蔡一霞, 杨建昌,等. 结实期土壤水分亏缺影响水稻籽粒灌浆的生理原因[J]. 植物生态学报, 2011, 35(2): 195-202.
[3] 张秋英, 李发东, 高克昌,等. 水分胁迫对冬小麦光合特性及产量的影响[J]. 西北植物学报, 2005, 25(6): 1 184-1 190.
[4] 姜孝成, 周广洽, 陈良碧, 等. 开花灌浆期干旱胁迫对水、 陆稻细胞膜透性和产量性状的影响[J]. 中国水稻科学, 1998(S1): 34-38.
[5] 孙 娜, 封 雷, 王 涛,等. 干旱胁迫对水稻形态及光合特性的影响[J]. 安徽农业科学, 2009(16): 7 370-7 371, 7 374.
[6] 王泽港, 梁建生, 曹显祖,等. 半根干旱胁迫处理对水稻叶片光合特性和糖代谢的影响[J]. 江苏农业研究, 1999, 20(3): 21-26, 58.
[7] Zhao W, Zhang J, Lu Y, et al. The vasorelaxant effect of H2S as an endogenous gasous KATP channel opener[J]. J EBO, 2001, 20: 6 008-6 016.
[8] Eto K, Ogasawara M, Umemura K, et al. Hydrogen sulfide is produced in response to neuronal excitation[J]. Journal of Neuroscience, 2002, 22(9): 3 386-3 391.
[9] Warenycia M W, Steele J A, Karpinski E, et al. Hydrogen sulfide in combination with taurine or cysteic acid reversibly abolishes sodium currents in neuroblastoma cells[J]. Neurotoxicology, 1989, 10: 191-199.
[10] 林玉婷. HO-1/CO信号系统参与H2S、 β-CD-hemin和H2诱导的黄瓜不定根发生[D]. 南京: 南京农业大学, 2012.
[11] 焦 浩. 硫化氢调控胁迫条件下植物种子萌发及幼苗生长的信号机制[D]. 合肥: 合肥工业大学, 2010.
[12] 窦 伟. 硫化氢对盐和铝胁迫下小麦种子萌发及氧化损伤的缓解效应[D]. 合肥: 合肥工业大学, 2010.
[13] 于立旭. 硫化氢对盐和镉胁迫下黄瓜种子萌发及氧化损伤的缓解效应[D]. 泰安: 山东农业大学, 2012.
[14] 郭希凯. 二氧化硫调节铝和干旱胁迫下小麦种子萌发的信号机理研究[D]. 合肥:合肥工业大学, 2012.
[15] 鲍 敬,丁同楼, 贾文娟, 等. 外源H2S对盐胁迫下小麦种子萌发的影响[J]. 现代农业科技, 2011(20):40-42.
[16] 侯智慧, 刘 菁, 侯丽霞, 等. H2S可能作为H2O2的下游信号介导茉莉酸诱导的蚕豆气孔关闭[J]. 植物学报, 2011, 46(4): 396-406.
[17]王兰香,侯智慧,侯丽霞,等. H2O2介导的H2S产生参与干旱诱导的拟南芥气孔关闭[J]. 植物学报, 2012, 47(3): 217-225.
[18] 段冰冰,陸 巍. 强光下硫化氢通过促进光系统Ⅱ的活性来缓解水稻的光抑制[J]. 植物生理学报, 2014, 50(7): 1 019-1 026.
[19] 吴单华, 李应林, 夏 眴, 等. 硫化氢供体硫氢化钠处理提高小麦对高温和干旱胁迫的综合抵抗能力[J]. 云南师范大学学报(自然科学版), 2013, 33(6): 29-35.
[20] Zhang H, Jiao H., Jiang C X. Hydrogen sulfide protects soybean seedlings against drought-induced oxidative stress[J]. Acta Physiologiac Plantarum, 2010, 32: 849-857.
[21] 胡树立. H2S延缓采后草莓衰老及调控植物切花保鲜的信号机制[D]. 合肥: 合肥工业大学, 2012.
[22] 刘小丽, 宋保军,侯睿林. 测定α-淀粉酶活性的两种方法的比较研究[J]. 农业科技与信息, 2006(9): 36-38.
[23] 郁飞燕, 张联合, 李艳艳,等. 干旱胁迫对水稻种子萌发的影响[J]. 山东农业科学, 2011(8): 36-39.
[24] 宋俊洲. 大麦发芽过程中酶和淀粉特性的研究[D]. 大连: 大连工业大学, 2010.
[25] 孙果忠, 张秀英, 肖世和.活性氧对ABA和水分胁迫抑制的小麦萌发胚内α-淀粉酶表达的影响[J]. 麦类作物学报, 2005, 25(4): 50-53.
[26] 张新忠. 大麦发芽过程中淀粉酶活性变化及其与麦芽品质关系研究[D]. 扬州: 扬州大学, 2010.
[27] 阎 娥,乔有明. 两燕麦品种种子萌发中淀粉酶活性变化的研究[J]. 草业科学, 2006, 23(9): 96-98.
[28] 张 华. 外源一氧化氮促进小麦种子萌发及其信号作用机制研究[D]. 南京: 南京农业大学, 2005.

