微小RNA与胃癌关系的研究进展
毛玉娣,丁西平,王 华
(1.安徽医科大学附属省立医院消化内科,老年病科, 安徽 合肥 230001;2. 安徽医科大学第一附属医院肿瘤内科,药学院,安徽 合肥 230032)
微小RNA与胃癌关系的研究进展
毛玉娣1,丁西平1,王华2
(1.安徽医科大学附属省立医院消化内科,老年病科, 安徽 合肥230001;2. 安徽医科大学第一附属医院肿瘤内科,药学院,安徽 合肥230032)
摘要:胃癌始终具有高发病率及死亡率,其发病机制复杂、多元化,涉及众多遗传学和表观遗传学的改变。近年来,越来越多的证据表明,微小RNA(microRNA,miRNA)可以影响细胞的增殖、分化、凋亡,参与到包括胃癌在内的多种肿瘤病理过程中。miRNA不仅与胃癌的发生、发展、浸润、转移有关,而且与胃癌细胞抗药性存在密切联系;此外,miRNA极有可能成为胃癌标志物,提供新的治疗目标和治疗手段。该文主要介绍miRNA结构和生物学功能,以及其在胃癌中发挥的作用。
关键词:微小RNA;非编码RNA;胃癌;抗肿瘤;肿瘤标志物;胃癌治疗靶点;基因调控
胃癌是常见的恶性程度较高的肿瘤之一,我国学者最新的统计数据显示:胃癌在我国男性最常见恶性肿瘤中排第2位,女性中排第3位,且具有相当高的死亡率[1],据统计胃癌的5年生存率仅有24%~25%[2]。胃癌的病理机制复杂,为了提高胃癌早期诊断率和寻找新的治疗手段,深入研究胃癌发病的分子机制是非常必要的。近年来,越来越多的研究开始关注微小RNA(microRNA, miRNA)与胃癌的关系,目前认为, miRNA可以通过调节细胞增殖、分化、凋亡和侵袭,参与到肿瘤的发生、发展和转移的过程中。尤为重要的是,有研究表明miRNA可以在血液中稳定存在[3],这样便可应用非侵入性技术对其进行动态监测,使其作为生物标志物和肿瘤治疗的生物靶分子成为了可能。因此,深入研究并阐明miRNA在胃癌中的作用机制,将为胃癌的诊断、治疗及预后的评估提供新的方向。
1miRNA的定义及功能特点
研究发现,75%的人类基因组被转录成RNA,但是仅有不到1.2%的RNA被翻译成蛋白质[4]。那些由基因转录但并不编码蛋白质的RNA称之为非编码RNA(non-coding RNA, ncRNA),根据大小主要可以分为两类:① 小RNA, 长度一般小于200 nt,包括miRNA,内源性短干扰RNA等;② 长链非编码RNA(long non-coding RNA,lncRNA),是转录长度超过200 nt的RNA分子[5]。其中miRNA是一类内生性非编码的小分子单链RNA,多由单链RNA的前体经过加工后生成,长度一般在19~24 nt。目前,人类基因组中大约已有2 000个miRNA被记录,它们主要通过调节转录因子在转录及转录后水平调节基因的表达,例如miRNA可以直接结合mRNA的3′端非编码区(3′-UTR)、mRNA的编码区或者5′-UTR来调节靶mRNA分子的表达或导致其降解[6]。基于miRNA影响细胞发育、分化、增殖和凋亡,参与多种疾病及肿瘤的生物学过程中[7-8],因此,探索miRNA调控基因表达及相应的信号通路,将为治疗肿瘤提供药物新靶点。
2miRNA在胃癌中的作用
2.1miRNA在胃癌组织中异常表达
miRNA与肿瘤关系的研究不断深入,现已明确某些异常表达的miRNA可通过调控癌基因或抑癌基因影响肿瘤的发生发展。一些报道也通过基因芯片及高通量测序手段检测胃癌组织中miRNA具有差异性表达,对miRNA与胃癌关系的研究奠定不可缺少的基础。如Shen等[9]通过基因芯片筛选出miR-1、miR-133a、miR-133b、miR-203、miR-205、mi490-3p在胃癌组织中明显下调。Tong等[10]通过高通量测序方法检测胃癌组织中异常表达的miRNA,同时说明miR-139通过作用靶基因CXCR4,miR-1、miR-34a和miR-504作用FOXP1基因的表达影响细胞的增殖;miR-221、miR-222、miR-160b、miR-93和miR-25作用于p57、p21、p27基因的表达影响细胞周期;而miR-21则通过作用RECK基因的表达影响胃癌细胞的侵袭和迁移。近年来关于肿瘤干细胞(CSCs)的关注度较高,曾有学者提出胃癌的复发和转移与此有关。 Zhang等[11]的研究就关注了此点,他们选用了胃腺癌细胞系MKN-45的侧群细胞(side population cells,SP cells,是许多正常组织、肿瘤组织和肿瘤细胞系的侧群细胞,拥有与CSCs相似的表型),然后用基因芯片分析SP细胞中miRNA的表达情况,找出异常表达的关键miRNA,再经过生物信息学预测其对应的靶基因,结果显示,68个异常表达的miRNA,如上调的has-miR-130a、has-miR-324-5p、has-miR-34a,下调的如has-miR-3175、has-miR-203等。其中miR-3157是新发现的标志物,目前的研究较少,需要实验进一步验证其在维持肿瘤多能性方面的作用。此外,miRNA在胃癌细胞耐药株中也存在差异性表达,一项报道选取了90名健康志愿者及30名胃癌化疗患者,用基因芯片分别检测正常胃组织、治疗前及治疗后胃癌样本中miRNA的表达,发现30个miRNA与胃癌细胞耐药性负相关,28个miRNA与胃癌细胞耐药性正相关,其中突出上调的有let-7g、miR-342、miR-16、miR-181、miR-1、miR-34[12]。如果可以将这58个miRNA进行联合检测,便可以判断耐药高风险人群,更重要的是了解这些基因的靶向调控机制,将为治疗胃癌耐药提供重要的帮助。
2.2miRNA调节胃癌细胞的增殖与凋亡
miRNA通过调节转录及转录后加工参与到表观遗传学中,使某些相关基因表达水平改变,进而参与到疾病或肿瘤的生物学过程中。在胃癌相关的病理过程中,miRNA可通过调节某些基因的表达和不同的细胞信号传导途径调节胃癌细胞的增殖、凋亡,其中较常见的是改变细胞周期蛋白依赖性蛋白激酶(cyclin-dependent protein kinases,CDK)的表达。例如miR-29a家族已被证明参与到多种肿瘤进展中,其中也包括胃癌[13-14];与正常胃组织比较,其家族成员miR-29a-3p在胃癌组织中明显下调,同时体外功能性实验显示:miR-29a-3p过表达,可抑制细胞周期蛋白依赖性激酶CDK2/CDK4/CDK6,阻止细胞增殖[14]。此外,以CDK6作为靶分子的miR129也是此通路中的一个重要成员,其在胃肠道多种肿瘤中发挥着重要的作用,在胃癌组织及细胞中,由于miR129的启动子被甲基化而表达下调,并与胃癌的临床病理特征密切相关,若增加miRNA的表达,胃癌细胞的增殖受到明显的影响;同时他们也发现其家族成员miR-129-2-3p和miR-129-5p可以上调SOX4基因(可以调节与肿瘤有关的多种信号传导途径的转录因子)的表达[15]。此前也有研究同样发现低表达的miR129-2可以上调SOX4基因,若使miR-129-2过表达下调SOX4,可以促进胃癌细胞的凋亡[16]。Shen等[9]的研究发现miR-490-3p在胃炎、肠上皮化生、由幽门螺旋杆菌感染和甲基亚硝酸脲所致的胃癌组织中表达下降,将稳定表达miR-490-3p的胃癌细胞种植到裸鼠体内,可以抑制肿瘤的大小和重量;同时他们发现胃癌组织中miR-490-3p低表达是由于其启动子被甲基化所致,而发挥抑癌作用的直接靶分子是肌动蛋白依赖染色质调控因子1(SMARCD1),当miR-490-3p表达沉默时,SMARCD1的表达上升,将会增加细胞克隆集落的形成、促进增殖和致癌作用,反之则亦然;并且发现SMARCD1过度表达与胃癌患者的低生存率相关。既往研究表明,miR-34家族成员miR-34a表达在胃癌细胞和组织表达下调,发挥抑癌作用[17]。Li等[18]在研究胃癌组织及胃癌细胞系中发现miR-449a表达下调,miR-449a位于第5号染色体,在CDC20B第2个内含子高度保守的区域内,属于miRNA34家族,并且通过体外实验说明,如果恢复miR-449a的表达将会阻止胃癌细胞的增殖及克隆集落的形成,转入miR-449a的胃癌细胞将会停留在G0/G1期,此外,应用顺铂进行抗癌治疗时加入miR-449a将会提高疗效,同时他们确定了E2F3(是涉及肿瘤细胞增殖和转移的主要转录因子)是miR-449a作用的靶分子。此外,还有一些miRNA也可通过调节其他经典的细胞信号通路及基因影响胃癌的发生,如miR-181a过表达可以影响肿瘤抑制基因KLF6的表达发挥抗凋亡作用[19],miR-133b体内外实验表明其过度表达将直接抑制Gli1蛋白的表达,影响细胞核内信号通路阻止细胞的增殖[20],miR-218可直接作用靶分子ECOP激活NF-κB信号通路,阻止细胞增殖,促进凋亡[21]。尽管以上结果阐述了miRNA与胃癌细胞增殖和凋亡等方面的关系,但是部分结果仍需进一步验证,以明确胃癌发生的分子机制及作用的信号通路,才能为临床上新药研发提供新的作用靶点。
2.3miRNA调节胃癌细胞的侵袭与转移
miRNA不仅与胃癌的发生有关,而且与胃癌的进展、侵袭及转移密切相关。例如miR-1是一种内生性短链非编码RNA,可以影响转录后水平调节基因的表达,与正常胃黏膜上皮细胞相比其在胃癌细胞及组织中低表达,阻止胃癌细胞的转移,具有一定的肿瘤抑制作用,其作用机制主要是调节原癌基因MET,使其表达下调[12,22]。MET可以编码细胞表面受体酪氨酸激酶,后者在多种人类癌症中升高,目前,MET已被用来作为癌症治疗和改善化疗敏感性的目标,所以在胃癌中miR-1/MET途径将极有可能成为一个潜在的治疗靶点。此外,miR-144也可以通过结合MET mRNA 3′UTR使MET基因表达沉默,减弱胃癌细胞的迁移及侵袭能力;但是在胃癌伴高度转移的组织中,miR-144的表达明显下降,直接对抑癌功能产生影响[23]。所以miR-144联合化疗药物或许将为中晚期胃癌患者提供了一个强有力阻止肿瘤转移的方法。miR-217已经被证明出现在不同的肿瘤类型中,生物信息学的分析显示,在胃癌中miR-217低表达,其作用的靶基因是EZH2(EZH2是一种甲基转移酶和PRC2的中心催化单元,在细胞的增殖、迁移、浸润、干细胞的分化、肿瘤形成中发挥重要的作用),敲除SGC7901胃癌细胞中的miR-217,会明显增加细胞的浸润侵袭力[24]。Huang等[25]的研究表明,与肿瘤分期及浸润深度明显相关的miR-338-3p在胃癌组织中下调,且影响参与上皮-间质转化(epithelial-mesenchymal transition,EMT)过程蛋白的表达;体外实验显示,敲除miR-338-3p会使胃癌细胞间叶变,并证明其主要的机制直接作用锌指E盒结合蛋白2(ZEB2)和结肠癌转移相关因子1(MACC1),抑制蛋氨酸蛋白激酶信号通路(Met/Akt),进而抑制EMT,如果细胞内再次导入ZEB2和MACC1,将会逆转EMT。此外,miR-200c也可抑制EMT,影响肿瘤的发生与进展[26],这是否可以成为治疗胃癌及防治癌前病变恶变的靶点之一,值得期待。关于miRNA在肿瘤中的作用也出现了一些有争议的结果,如miR-203在鳞状细胞癌中表达显著降低,调节CD44的表达和钙粘蛋白E的表达是细胞发生间质改变,并且与肿瘤细胞低分化、晚期临床阶段、转移、5年生存率相关[27]。但是,Stánitz等[28]先前的研究中出现相反的结果,显示在有嗜酒的胃腺癌患者中miR-203过度表达,所以对miR-203是否抑制肿瘤,需要进一步研究。
2.4miRNA影响胃癌的诊断与预后
现有研究表明,miRNA不仅影响肿瘤的发生发展,而且可以作为潜在的生物标记物与肿瘤患者的诊断、预后及总生存年数相关,并且在其他肿瘤中已有报道[29]。 如上述所提到的miR-217在胃癌组织及细胞系中表达下调,其表达量与胃癌组织的大小(P=0.004)和低分化(P=0.008)密切相关,影响胃癌的病理过程和预后[24]。但是miR-217是否能够作为肿瘤生物标志物需要进一步研究。最新关于miR-34a的报道揭示了其判断胃癌预后的能力,研究选用了137例进行胃大部分切除及淋巴结清扫术后的胃癌患者,结果显示,低表达miR-34a者拥有高的复发率(P=0.008)和低的总生存年数(P<0.001),故其可以用作评价胃癌预后的一项新指标[30]。 Zhang等[31]通过微阵列检测胃癌患者、癌前病变患者、胃癌术后与健康人群血浆样本中发现:miR-19b-3p和miR-16-5p在胃癌患者中表达被抑制,两者下调的程度与胃癌的发展分期有关,但是在胃癌术后两者的表达又逐渐恢复;同时也绘制ROC曲线来判断两者筛选胃癌的能力,miR-16-5p在TNM分期IV期时AUC=0.832,miR-19b-3p在TNM分期Ⅲ期时AUC=0.822,胃癌细胞低分化时两者AUC曲线下面积分别是0.801和0.791,所以将miR-19b-3p(敏感度0.813/特异度0.586)和miR-16-5p(敏感度0.490/特异度0.910)两者进行联合检测,很有可能成为筛选胃癌的生物标志物。最近的一项研究第1次用数据说明了由转录因子及miRNA共同调节基因表达网参与到胃癌的浸润之中[32]。但是仍需要大样本及功能性实验来进一步验证这些数据,为胃癌的诊断和治疗策略做出贡献。Sylvain等[33]采取高通量测序的方法检测胃腺癌及胃窦部非癌组织中将近80%的miRNA并进行描述及分析,最终从结果中筛选出7个具有高显著性差异表达的miRNA,其中把hsa-miR-135b和hsa-miR-29c作为标志物,可以将胃窦部非癌组织从不同的组织学类型的胃癌组织中区分开。这项研究发现为胃癌的筛查提供了新的途径。近年来也有一些综述性报道从不同的角度分析了miRNA作为胃癌生物标志物的意义,例如:Shrestha等[34]和Wang等[35]分别对胃癌组织中的异常表达的miRNA做了系统性的评价,列出14种及6种最常报道的miRNA,并对其与胃癌临床病理特征进行相关性分析,发现这些miRNA可以作为生物标志物用于临床的治疗、诊断及判断预后。其中的miR-21也有研究者对其作为诊断标记物的能力进行了Meta分析,同时绘制了ROC曲线,AUC值为0.91[36]。总而言之,大量的体内外实验证明,miRNA在胃癌的发生发展及预后评估等方面发挥的作用不容忽视(Tab 1)。
3展望
随着科学技术的发展,新一代的基因检测技术为我们进行基因及表观遗传学方面的研究提供了巨大的帮助。胃癌相关的miRNA研究也日益增多,但大部分报道为描述1种或几种miRNA在胃癌中的作用,目前仍需大量的样本实验及相应的miRNA-lncRNA-mRNA交互作用的分析进行验证。基于由慢性浅表性炎-慢性萎缩性炎-肠上皮化生-异型增生-胃癌这一经典的胃癌发生机制和以上的研究结果,今后我们应选择新的突破点,探索miRNA在胃黏膜炎性恶化这一过程中的差异性表达及相关的作用,以便能及时在胃癌前病变阶段有效阻碍胃癌的发生发展,为胃癌的防治提供新的视角。
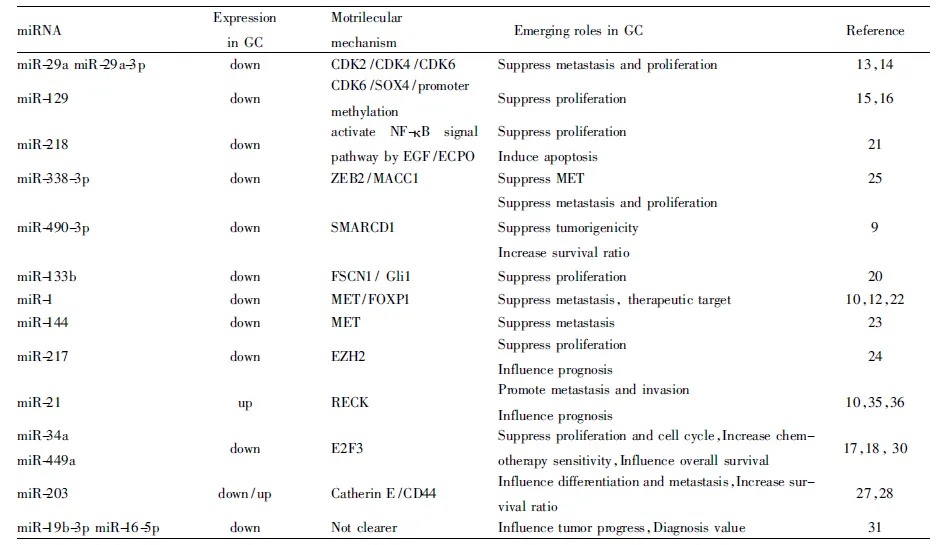
Tab 1 Roles of miRNA in gastric cancer
4总结
这些年,各方面的研究使miRNA积极地摆脱了“基因垃圾”的帽子,其在胃癌发生发展等生物学进程中的作用至关重要,更为胃癌提供新的诊断、治疗、预后评估的靶点。目前,部分miRNA已经开始应用于临床试验中,为临床工作开辟了新的途径。更重要的是,关于胃癌相关miRNA的研究,将会为以后开展胃癌个体化基因治疗奠定必要的基础。
(致谢:本综述基金课题及所涉及的实验在安徽医科大学公共卫生学院分子生物学实验室及安徽医科大学附属省立医院内镜中心实验室完成。)
参考文献:
[1]Chen W,Zheng R,Baade P D, et al. Cancer statistics in China,2015[J].CACancerJClin,2016,66(2):115-32.
[2]Luebeck E G, Curtius K, Jeon J, Hazelton W D. Impact of tumor progression on cancer incidence curves[J].CancerRes,2013,73(1):1086-96.
[3]Yan W,Qian L,Chen J,et al. Comparison of prognostic microRNA biomarkers in blood and tissues for gastric cancer[J].JCancer,2016,7(1): 95-106.
[4]Djebali S, Davis C A, Merkel A, et al. Landscape of transcription in human cells[J].Nature,2012,489(7414): 101-8.
[5]Guttman M, Rinn J L. Modular regulatory principles of large non-coding RNAs[J].Nature,2012,482(7385): 339-46.
[6]Lytle J R, Yario T A, Steitz J A. Target mRNAs are repressed as efficiently by microRNA-binding sites in the 5′ UTR as in the 3′UTR[J].ProcNatlAcadSciUSA,2007,104(23): 9667-72.
[7]刘晓丽,王如峰,胡秀华. MicroRNAs在呼吸系统疾病预防和治疗中的研究进展[J]. 中国药理学通报,2015,31(7):895-9.
[7]Liu X L, Wang R F,Hu X H. Advanced study on microRNAs involved in prevention and treatment of respiratory system diseases[J].ChinPharmacolBull,2015,31(7):895-9.
[8]马婧,凌霜,党延启,等.非编码RNA在血管损伤、重塑和老化中的作用[J]. 中国药理学通报,2016,32(1):14-8.
[8]Ma J, Ling S,Dang Y Q,et al. Role of noncoding RNA in vascular injury,remodeling and aging[J].ChinPharmacolBull,2016,32(1):14-8.
[9]Shen J, Xiao Z, Wu W K,et al. Epigenetic silencing of miR-490-3p reactivates the chromatin remodeler SMARCD1 to promote helicobacter pylori-induced gastric carcinogenesis[J].CancerRes,2015,75(4): 754-65.
[10]Tong F, Cao P, Yin Y, et al. MicroRNAs in gastric cancer: from bench top to bedside[J].DigDisSci, 2014,59(1): 24-3.
[11]Zhang H H, Gu G L, Zhang X Y,et al.Primary analysis and screening of microRNAs in gastric cancer side population cells[J].WorldJGastroenterol,2015,21(12): 3519-26.
[12]Kim C H, Kim H K, Rettig R L, et al. miRNA signature associated with outcome of gastric cancer patients following chemotherapy[J/OL].BMCMedGenet,2011,4:79.
[13]Gong J, Li J, Wang Y, et al. Characterization of microRNA-29 family expression and investigation of their mechanistic roles in gastric cancer[J].Carcinogenesis,2014,35(2): 497-506.
[14]Zhao Z, Wang L, Song W,et al. Reduced miR-29a-3p expression is linked to the cell proliferation and cell migration in gastric cancer[J/OL].WorldJSurgOncol,2015,13:101.
[15]Yu X, Song H, Xia T, et al. Growth inhibitory effects of three miR-129 family members on gastric cancer[J].Gene,2013,532(1): 87-93.
[16]Shen R, Pan S, Qi S, et al. Epigenetic repression of microRNA-129-2 leads to overexpression of SOX4 in gastric cancer[J].BiochemBiophysResCommun,2010,394(4):1047-52.
[17]Cao W, Yang W, Fan R, et al. miR-34a regulates cisplatin-induce gastric cancer cell death by modulating PI3K/AKT/survivin pathway[J].TumourBiol,2014,35(2):1287-95.
[18]Li X P, Li H, Zhang R, et al. MicroRNA-449a Inhibits Proliferation and Induces Apoptosis by Directly Repressing E2F3 in Gastric Cancer[J].CellPhysiolBioche, 2015, 35(5): 2033-42.
[19]Zhang X,Nie Y,Du Y,et al.MicroRNA-181a promotes gastric cancer by negatively regulating tumor suppressor KLF6[J].TumourBiol,2012,33(5):1589-97.
[20]Zhao Y, Huang J, Zhang L, et al. MiR-133b is frequently decreased in gastric cancer and its overexpression reduces the metastatic potential of gastric cancer cells[J/OL].BMCCancer,2014,14:34.
[21]Gao C, Zhang Z, Liu W, et al. Reduced microRNA-218 expression is associated with high nuclear factor kappa B activation in gastric cancer[J].Cancer,2010,116(1): 41-9.
[22]Han C, Zhou Y B, An Q, et al. MicroRNA-1(miR-1) inhibits gastric cancer cell proliferation and migration by targeting MET[J].TumorBiol,2015,36(9): 6715-23.
[23]Liu J, Xue H, Zhang J,et al. MicroRNA-144 inhibits the metastasis of gastric cancer by targeting MET expression[J/OL].JExpClinCancerRes,2015,34:35.
[24]Chen D L, Zhang D S, Lu Y X , et al. MicroRNA-217 inhibits tumor progression and metastasis by downreg- gulating EZH2 and predicts favorable prognosis in gastric cancer[J].Oncotarget, 2015, 6(13): 10868-79.
[25]Huang N, Wu Z Z, Lin L, et al. MiR-338-3p inhibits epithelial-mesenchymal transition in gastric cancer cells by targeting ZEB2 and MACC1/Met/Akt signaling[J].Oncotarget, 2015, 6(17): 15222-34.
[26]Hur K, Toiyama Y, Takahashi M, et al. MicroRNA-200c modulates epithelial to mesenchymal transition(EMT) in human colorectal cancer metastasis[J].Gut,2013,62(9): 1315-26.
[27]Tian L, Li M, Ge J, et al. MiR-203 is downregulated in laryngeal squamous cell carcinoma and can supperss proliferation and induce apoptosis of tumours[J].TumourBiol, 2014, 35(6): 5953-63.
[28]Stánitz E, Juhász K, Tóth C, et al. Evaluation of microRNA expression pattern of gastric adenocarcinoma associated with socioeconomic, environmental and lifestyle factors in northwestern Hungary[J].AnticancerRes,2013,33(8): 3195-200.
[29]Yan W, Xu L, Sun Z, et al. MicroRNA biomarker identification for pediatric acute myeloid leukemia based on a novel bioinformatics model[J].Oncotarget,2015,6(28): 26424-36.
[30]Zhang H, Li S, Yang J, et al. The prognostic value of miR-34a expression in completely resected gastric cancer: tumor recurrence and overall survival[J].IntJClinExpMed,2015, 8(2): 2635-41.
[31]Zhang J, Song Y, Zhang C, et al. MiR-16-5p and MiR-19b-3p as two novel potential biomarkers to indicate progression of gastric cancer[J].Theranostics,2015,5(7): 733-45.
[32]Shi Y, Wang J, Xin Z, et al. Transcription factors and microRNA-Co-regulated genes in gastric cancer invasion inexvivo[J].PLoSOne,2015,10(4): e0122882.
[33]Darnet S, Moreira F C, Hamoy I G,et al. High-throughput sequencing of miRNAs reveals a tissue signature in gastric cancer and suggests novel potential biomarkers[J].BioinformBiolInsights,2015,9(Suppl 1):1-8.
[34]Shrestha S, Hsu S D, Huang W Y, et al. A systematic review of microRNA expression profiling studies in human gastric cancer[J].CancerMed,2014,3(4): 878-88.
[35]Wang J L, Hu Y, Kong X, et al. Candidate microRNA biomarkers in human gastric cancer: a systematic review and validation study[J].PLoSOne,2013,8(9): e73683.
[36]Zhu X, Lv M, Wang H, Guan W. Identification of circulating microRNAs as novel potential biomarkers for gastric cancer detection: a systematic review and meta-analysis[J].DigDisSci,2014,59(5): 911-9.
Research progress on relationship between microRNA and gastric cancer
MAO Yu-di1, DING Xi-ping1,WANG Hua2
(1.DeptofGastroenterology,DeptofGeriatrics,theAffiliatedProvincialHospitalofAnhuiMedicalUniversity,Hefei230001,China;2.DeptofOncology,theFristAffiliatedHospital,SchoolofPharmacy,AnhuiMedicalUniversity,Hefei230032,China)
Abstract:Gastric cancer has a high incidence and accounts for a notable proportion of global cancer mortality. The pathogenesis of gastric cancer is complex involving multiple genetic and epigenetic alterations factors. In recent years, studies have also demonstrated the aberrant regulation of miRNAs in a variety of tumor pathological processes including the gastric cancer through affecting cell proliferation, differentiation and apoptosis. miRNA also plays important roles in gastric cancer growing, invasion, metastasis, and drug resistance of gastric cancers, which might become new biomarkers and potential therapeutic targets in the future. This paper summarizes several important miRNAs involved in gastric cancer and also discusses their function.
Key words:microRNA; non-coding RNA; gastric cancer; antitumor; tumor marker;therapeutic target of gastric cancer; gene regulation
收稿日期:2016-02-02,修回日期:2016-03-10
基金项目:国家自然科学基金资助项目(No 81372577);新世纪优秀人才支持计划(NCET-13-0644);安徽省皖江学者计划资助
作者简介:毛玉娣(1991-),女,硕士生,研究方向:消化道肿瘤,E-mail:myd183@163.com; 丁西平(1964-),男,硕士,主任医师,硕士生导师,研究方向:胃肠黏膜屏障及消化道肿瘤,通讯作者,Tel:0551-62283547,E-mail:dingxipingyx@163.com; 王华(1978-),男,博士,教授,研究方向:抗肿瘤药理,通讯作者,Tel:0551-62923509,E-mail: wanghua@ahmu.edu.cn
doi:10.3969/j.issn.1001-1978.2016.06.004
文献标志码:A
文章编号:1001-1978(2016)06-0756-05
中国图书分类号:R-05;R342.2;R735.2
网络出版时间:2016-5-25 15:39网络出版地址:http://www.cnki.net/kcms/detail/34.1086.R.20160525.1539.008.html

