珍稀药用植物三叶青的高效微繁体系研究
王 静,郭万里,孔亚泽,薛亦豆,许鑫瀚,梁宗锁b
(1.浙江理工大学,a.生命科学学院;b.植物次生代谢调控浙江省重点实验室,杭州 310018;2.杭州三叶青农业科技有限公司,杭州 310018)
珍稀药用植物三叶青的高效微繁体系研究
王静1a,郭万里1,孔亚泽1a,薛亦豆1a,许鑫瀚2,梁宗锁1b
(1.浙江理工大学,a.生命科学学院;b.植物次生代谢调控浙江省重点实验室,杭州 310018;2.杭州三叶青农业科技有限公司,杭州 310018)
摘要:三叶青(Tetrastigma hemsleyanum Diels et Gilg)是我国南方民间常用药,具有清热解毒、消炎、抗肿瘤等功效。社会需求导致其野生资源匮乏,并且人工繁育的研究滞后,严重阻碍了三叶青的规模化种植,加重了供需矛盾,限制了产业链的发展。文章以三叶青带腋芽的茎段为外植体材料,诱导侧枝的发生,通过继代、生根、移栽等过程,建立了三叶青高效微繁体系。结果表明,带腋芽的半木质化茎段(3~8节)作为外植体好于带芽茎尖;最佳腋芽诱导培养基为MS+1.5 mg/L 6BA+0.025 mg/L NAA;最佳侧枝增殖培养基为MS+1.0 mg/L 6BA+0.025 mg/L NAA,生长势下降时加入0.025 mg/L GA ;最佳生根培养基为1/2 MS+1.5 mg/L IBA;移栽成活率可达到90%以上。该体系激素浓度配比低,操作简便,繁殖效率高等特征适合三叶青种苗的规模化和规范化育苗。
关键词:三叶青;茎段;腋芽;侧枝;微繁
0引言
三叶青(TetrastigmahemsleyanumDiels et Gilg),又名三叶崖爬藤、金线吊葫芦、蛇附子等,为葡萄科崖爬藤属多年生藤本植物[1-2]。广泛分布于长江以南各省份,主要有浙江、江西、福建、广西、云南等地区。其生长微环境主要是山坡、林下的灌丛中或山谷溪边林下的岩石缝中,海拔高度一般为300~1300 m[3]。三叶青在我国南方为民间常用药,主要以块根入药,具有清热解毒、活血化瘀等功效,民间主要用于治疗小儿高热惊厥、肺炎、跌打损伤等[2]。近年来,人们发现三叶青在抗氧化[4]、抗肿瘤[5]、提高免疫力[6]及抗病毒等方面也有显著的疗效[7]。由于受到市场欢迎,野生三叶青被无节制的人为采挖,自然资源迅速枯竭。另外,三叶青对生长环境要求苛刻,生长发育缓慢,其扦插繁殖效率较低,从而加剧了三叶青野生资源保护和社会需求之间的矛盾。目前,钟毓倩[8]采用茎尖,钱丽华[9]、Jiang等[10]、史清英[11]、邵骏骅等[12]采用带芽茎段均成功诱导了三叶青的丛生芽,获得试管苗。然而,腋芽丛生增殖方法中使用的激素浓度较高,苗多次继代后长势较弱,需进行壮苗处理,且其愈伤组织容易褐化导致死亡,不适合规模化和规范化育苗。因此,本研究采用微型扦插法,以半木质化的带腋芽茎段为外植体,在总激素降低的前提下,探索最佳的激素配比组合,诱导侧枝的生长,优化继代、生根和移栽等程序,建立了操作简便且增殖率高的高效微繁体系,适用于三叶青种苗的规模化和规范化培育,具有重要的生产价值和实践意义。
1材料与方法
1.1试验材料
2014年6月,三叶青植株取自浙江省杭州市余杭区杭州市三叶青农业科技有限公司种苗基地,种植在浙江理工大学浙江省植物次生代谢调控重点实验室人工气候室中预培养。
1.2试验方法
1.2.1外植体处理
选择三叶青新长出的茎段(茎尖为1~2节,半木质化茎段为3~8节),剪取带腋芽的茎段1.5~2.0 cm,流水冲洗1~2 h,洗洁精清洗5 min,洗净。移至无菌超净台,先用70%乙醇洗30 s,无菌水冲洗,再用0.1%的升汞灭菌8~10 min,期间轻轻震荡,最后用无菌水冲洗4~5次,每次5 min。由此获得无菌材料。
1.2.2培养条件
培养基:以MS或1/2MS为基本培养基[13],附加不同种类、浓度的生长素或细胞分裂素(包括6BA、NAA、IBA等)。初代及继代培养基的蔗糖含量为3%,生根培养基的蔗糖含量为2%,琼脂为0.54%,pH值为5.8~6.0。115℃ 高压蒸汽灭菌15 min。环境条件:光周期为14 h光照,10 h黑暗,光照强度为2000~4000 Lx,温度为(25±2)℃。
1.2.3初代培养
选取嫩枝上带芽茎尖、带腋芽的半木质化茎段进行初培养,将消毒处理后的带芽茎段置于灭菌的牛皮纸上,切去部分生理下端,留下带腋芽的1.0~1.5 cm的茎段,接种到相应的初代培养基上(表1,C1—C16),露出腋芽。每个处理接种30个外植体。培养至45 d时观察并统计生长情况。
1.2.4继代培养
选取长势比较一致的初代无菌苗,将其上端侧枝分离,剪取2.0 cm左右带腋芽且带3~6片叶片的茎段,转到相应继代培养基中(表2,J1—J11)。每个处理接种50个外植体,培养45 d,观察并统计其生长及增殖情况。
1.2.5生根培养
随机选取继代无菌苗,将分枝的茎段分离,选取3.0 cm左右带腋芽的茎段,留有3~6片顶端叶片,插入不同的生根培养基中(1/2MS + 0~4mg/L IBA或NAA)。每个处理接种50个外植体,培养15 d,观察其生根情况。
1.2.6驯化与移栽
驯化:将生根培养基中的无菌苗从组织培养室移至人工气候室,盖子打开,加水至培养基表面1.0 cm左右,光照14 h,驯化3~5 d。
移栽:将蛭石∶草炭土以2∶1比例混合,高压灭菌锅灭菌后铺满育种盘。将驯化之后生长良好的苗取出,轻轻洗去根上的培养基,剪去靠下端的叶片,仅留取顶端叶片即可,移至育种盘中并保湿,置于人工气候室培养。10 d后揭去塑料盖,30 d观察生长情况并统计成活率。
2结果
2.1初代培养
2.1.1外植体的选择
不同外植体材料(带芽茎尖、带腋芽的半木质化茎段)在添加不同浓度6BA的MS培养基中进行初培养,发现茎段的腋芽诱导出的无菌苗都明显较茎尖诱导的长势好(图1)。带腋芽茎段诱导的无菌苗分枝较多,叶片较多,较大,更健壮,且茎尖诱导的无菌苗随着6BA浓度的增加叶片出现严重退化,而茎段诱导的虽叶片变小但少有退化。这可能是因为不同部位的茎段上的腋芽体内的激素水平不同。因此,我们选用半木质化带腋芽的茎段作为外植体进行初代培养。

图1 不同外植体材料在初代培养基中的生长情况注:A、B、C为茎尖分别在1.0、2.0、3.0 mg/L 6BA的MS培养基;D、E、F为茎段分别在1.0、2.0、3.0 mg/L 6BA的MS培养基。
2.1.2不同激素浓度对腋芽诱导的影响
消毒后的腋芽茎段在初代培养基中培养10 d左右,腋芽开始萌动(图2A),30 d左右成长为无菌小苗(图2B),45 d左右生长旺盛(图1D、E、F)。研究发现,在1/2MS基本培养基中,加入少量NAA(0.025 mg/L)对初代苗的生长有显著促进作用,随着6BA浓度增加,平均株高出现先增加后降低的趋势,其中当6BA达到1.5 mg/L时,初代苗平均株高达到最高(4.6±0.84 cm)(图3A);在MS基本培养基中,加入少量NAA(0.025 mg/L)对初代苗株高有一定抑制作用,但对其叶片过小有一定改善作用,其中,6BA浓度增加时,株高逐渐增高并与不含NAA的差距缩短,当达到1.5 mg/L时,与不含NAA的株高并无显著性差异(图3B、表1);在不含NAA激素时,与1/2MS基本培养基相比,MS对株高有明显促进作用,而加入少量NAA后,MS却对株高有一定的抑制作用,不过,随着6BA浓度的增加,其抑制作用逐渐降低(图3C、D)。此外,1/2MS中的无菌苗长势比MS慢,加入少量NAA,愈伤有一定的增大,叶片也有一定的增多增大(表1),因此选用C15(MS+1.5 mg/L 6BA+0.025 mg/L NAA)作为初代苗的最佳诱导培养基。
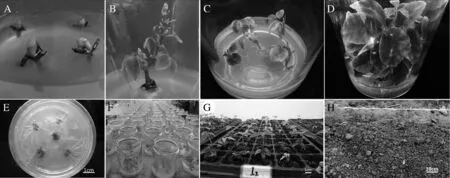
A:带腋芽的茎段;B:诱导的无菌苗;C:继代小苗;D:增殖苗;E:30d生根;F:驯化;G:移栽至温室;H:移栽至大田图2 三叶青微繁体系
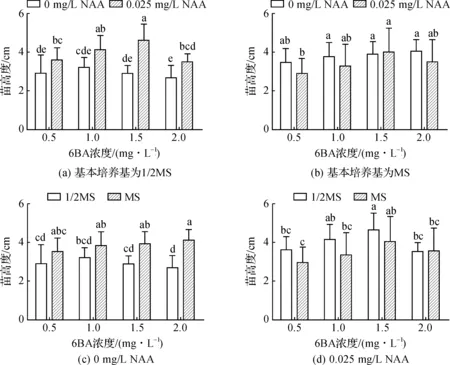
图3 培养基对初代苗高度的影响
编号基本培养基6BA/(mg·L-1)NAA/(mg·L-1)生长情况C11/2MS0.50愈伤较小,叶较多,芽较少,长势较慢C21/2MS1.00愈伤较小,叶较多,芽适中,长势较慢C31/2MS1.50愈伤较小,上端叶较小,芽聚集,长势较慢C41/2MS2.00愈伤较小,叶小、有畸形,芽聚集,长势较慢C51/2MS0.50.025愈伤增大,叶较多、较大,芽较少C61/2MS1.00.025愈伤较大,叶较多、上段叶较大,芽适中C71/2MS1.50.025愈伤较大,叶较多、上段叶较小,芽聚集C81/2MS2.00.025愈伤较大,叶较小,芽聚集较多C9MS0.50愈伤较小,叶较多、较大,芽较少C10MS1.00愈伤较小,叶较多,上段叶较小,芽适中C11MS1.50愈伤较小,上段叶较小,芽较多C12MS2.00愈伤较小,上端叶小、畸形,芽聚集C13MS0.50.025愈伤增大,叶较大,芽较少C14MS1.00.025愈伤增大,叶较多,芽适中C15MS1.50.025愈伤较大,中下段叶较大,芽较多C16MS2.00.025愈伤较大,下段叶较大,芽较多
2.2继代培养
将外植体诱导培养的无菌苗侧枝切分,接种到继代培养基中(图2C、D),培养45 d后以无菌苗生长情况及侧枝的增殖情况为主要参考依据(表2)来筛选最佳增殖培养方案。
当培养基为J1—J5时,随着6BA浓度的增加,继代苗的平均株高逐渐降低,而其平均增殖系数先增加后降低,在6BA浓度为1.25 mg/L时达到最高(5.48 cm),但叶片较小,有部分退化现象。当6BA为1.0~1.5 mg/L时,其增殖系数并无显著性差异。综合考虑株高、增殖系数、愈伤及叶片大小,当6BA浓度为1.0 mg/L时,其长势及增殖情况最佳。
当培养基为J6、J3、J7时,随着GA浓度的增加,继代苗的平均株高逐渐升高,但平均增殖系数逐渐降低,并无显著性差异。当GA为0.025 mg/L时,长势及增殖情况最佳。
当培养基为J8、J3、J9时,随着NAA浓度的增加,继代苗的平均株高逐渐降低,而其增殖系数先增加后降低,愈伤逐渐增大,叶片逐渐变多变大。当NAA为0.025 mg/L时,长势及增殖情况最佳。
当培养基为J10、J11、J3时,随着MS强度的增加,继代苗的平均株高和增殖系数先略降低后升高,叶片逐渐变大。当为全MS时,长势及增殖情况最佳。
综合考虑继代苗的株高、增殖系数、愈伤及叶片大小,选择J3(MS+1.0 mg/L6BA+0.025 mg/LNAA+0.025 mg/LGA)为最佳增殖培养基。
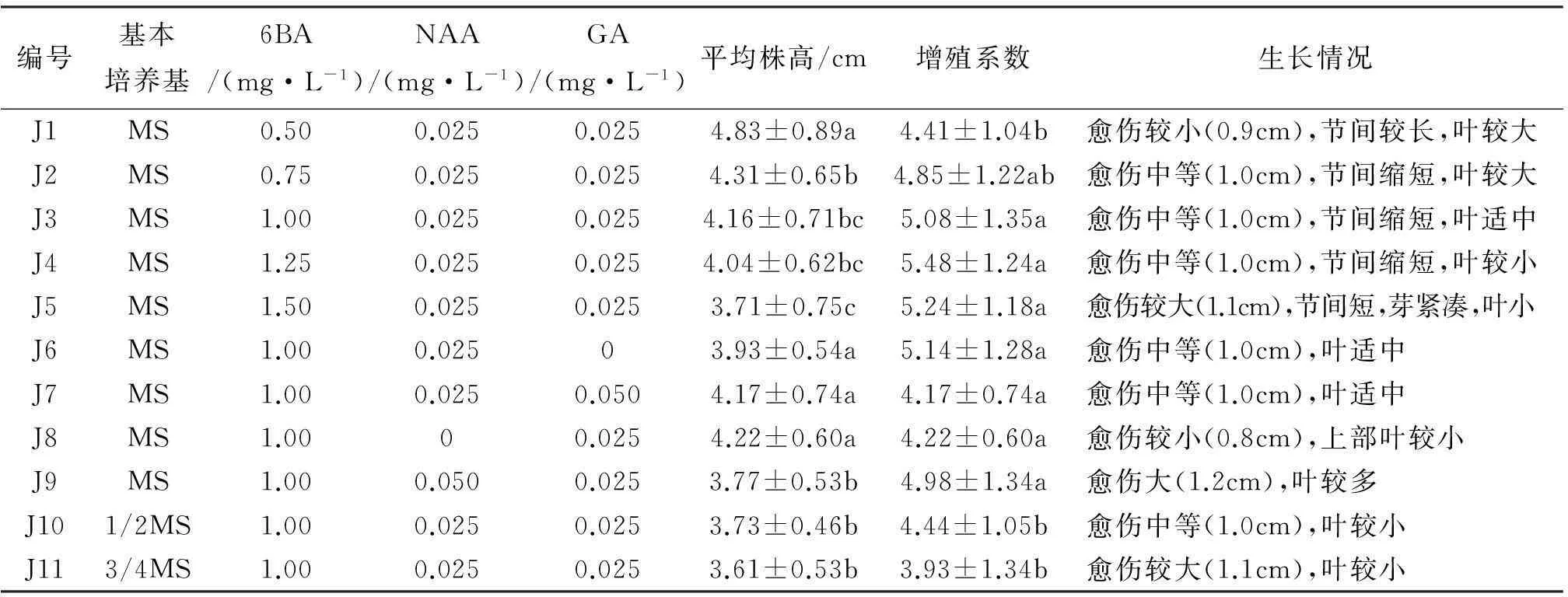
表2 植物激素对三叶青瓶苗的影响
2.3生根情况
在1/2MS基本培养基上加入不同浓度的IBA、NAA,无菌苗的生根情况不同(图2E、图4(a)、(b))。其中,加入IBA或NAA后,其生根率达到100%,但是当NAA浓度超过1.5 mg/L时,其生根率逐渐降低(图4a);随着IBA浓度的增加,其生根数明显增多,达到1.5 mg/L时,其增加并不显著(13.32±5.87根),4.0 mg/L时,生根数达到最多(14.72±5.39根),加入NAA的生根数也是随着浓度的增高而先增加后减少,达到1.0 mg/L时,其生根数达到最高(10.4±4.48根),出于成本与效果的考虑,选择1.5 mg/L IBA为最佳诱导生根浓度(图4(b))。由此看出,IBA的诱导生根效果明显好于NAA,因此选择1/2MS+1.5 mg/L IBA为最佳生根培养基。
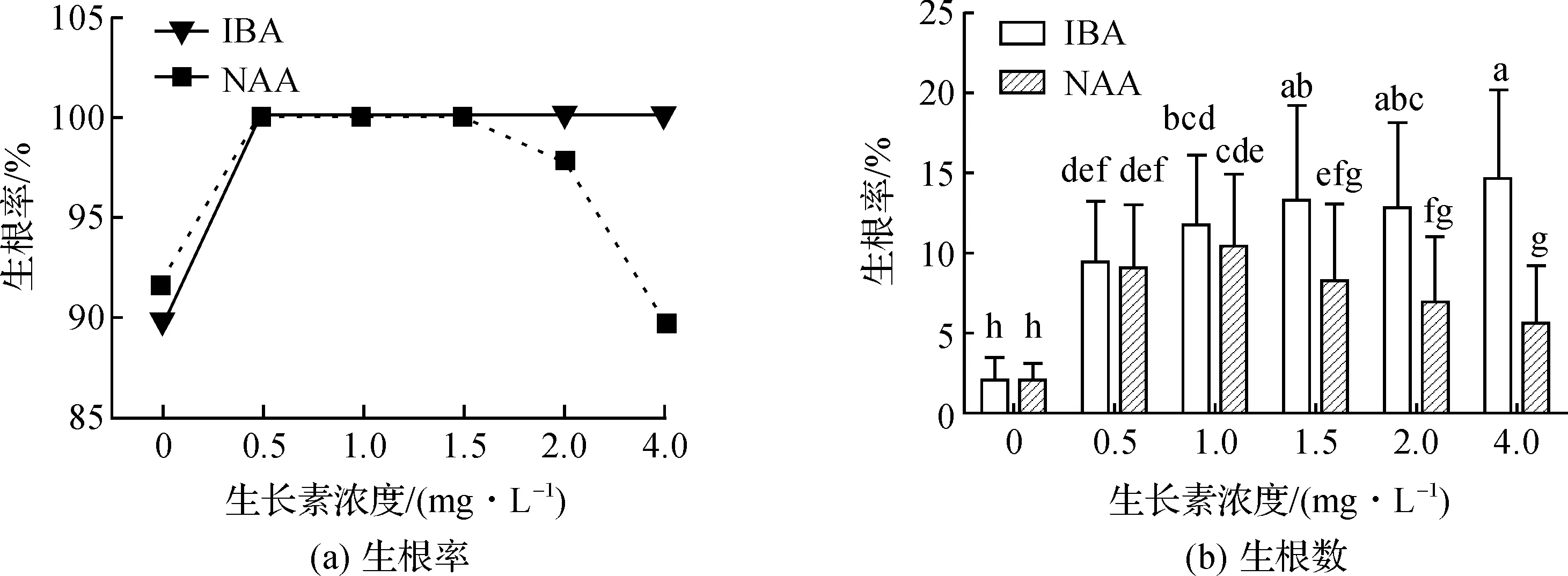
图4 不同生长素浓度对生根的影响
2.4移栽情况
由于继代所用的外植体为侧枝,较为粗壮,通过驯化、移栽,其成活率可达到90%以上(图2G、H)。
3讨论
在无菌苗诱导过程中,外植体的选择至关重要。与外植体先脱分化形成愈伤再分化成幼苗的途径相比,植物以芽繁芽的方式操作简便,且更能稳定地遗传母本的优良性状,不易变异[14-15]。茎尖顶芽具有分生能力强、生长速度快、含病毒少等优点,常被选作多种植物的外植体材料,但是张宗勤[16]研究发现葡萄茎尖顶芽幼嫩,不耐受消毒剂并且容易褐化,从而选择去除顶芽后枝条上端的腋芽作为优良外植体;此外,茎尖材料较少,不宜进行大规模剪切。经过本文研究发现,三叶青上端半木质化茎段上的腋芽与茎尖顶芽相比,诱导出的无菌苗萌芽率高,分枝多,长势好,这可能与体内不同部位激素水平不同有关,尤其与细胞分裂素的浓度有关,如图1随着6BA浓度的增加,愈伤变大、叶退化严重,很可能顶芽中内源6BA浓度较高,添加外源激素时,进一步打破了外植体体内激素平衡,导致顶芽的诱导效果较差。因此,本文采用三叶青半木质化茎段上的腋芽来诱导无菌苗,这与杨威等[17]在乌蔹莓的研究中对外植体的选择一致。
在三叶青无菌培养过程中发现,基本培养基及植物激素(6BA、NAA、GA、IBA)对腋芽诱导、增殖及无菌苗生长、生根情况均有显著影响。结果显示,MS基本培养基比1/2MS诱导的无菌苗长势较快,增殖率较高,适用于诱导及增殖培养,但1/2MS更适合诱导三叶青生根,用于生根培养。在植物中细胞分裂素主要促进细胞分裂,改变顶端优势,促进芽的分化等,生长素主要影响茎和节间伸长、顶端优势、生根等[18]。本研究发现一定浓度的6BA(1.0~1.5 mg/L)可促进三叶青腋芽诱导率及增殖率,但随着浓度逐渐增高,其促进作用强度逐渐降低,且外植体伸长生长受到严重抑制;低浓度的NAA(0.025 mg/L)可促进愈伤,叶片增大,减少畸形,并增加腋芽增殖率,但高浓度(0.050 mg/L)却对腋芽增殖率有一定的抑制作用;只要低浓度的GA(0.025 mg/L)便可在短时间内促进茎及节间的伸长,但抑制芽的分化增殖,高浓度的GA(0.050 mg/L)抑制作用尤为明显。Jiang等[10]认为加入GA可增加三叶青丛生芽高度,但选择最适增殖培养基(2.0 mg/L 6BA +0.1 mg/L NAA)时并未加入GA。因此选择在继代多次生长势出现下降时使用少量GA(0.025 mg/L)以提高组培苗高度。IBA与NAA广泛用于生根,本文中IBA与NAA均能刺激根的发生,但高浓度又抑制根的生长,且IBA生根效果优于NAA。
4结论
本研究以三叶青带腋芽的半木质化茎段为外植体,消毒后接于初代培养基(MS+1.5 mg/L 6BA+0.025 mg/L NAA)进行诱导培养,长大后将侧枝分离转入继代培养基(MS+1.0 mg/L 6BA+0.025 mg/L NAA),增殖率为5.08±1.35,继代几次后,组培苗生长势下降时在培养基中加入0.025 mg/L GA,生根时选取健壮的植株转入(1/2 MS+1.5 mg/L IBA)培养基,15 d后进行驯化移栽,移栽成活率可达到90%以上,在大田中长势良好。该体系具有遗传性状稳定,培养操作过程简单,增殖效率高,移栽容易成活等优点,为三叶青种苗规模化、规范化育苗提供可操作的体系。目前,采用该体系已经培育了5万多株种苗,证明该体系用于三叶青的工厂化繁育是有效可行的。
参考文献:
[1] 江苏新医学院.中药大词典:下册[M].上海:上海人民出版社,1977:2123.
[2] 国家中医药管理局(中华本草)编委会.中华本草[M].上海:上海科学技术出版社,1999:296.
[3] 李朝銮.中国植物志:葡萄科[M].北京:北京科学出版社,1998:122.
[4] YE C L, LIU X G. Extraction of Flavonoids fromTetrastigmahemsleyanumDiels et Gilg and Their Antioxidant Activity [J]. Journal of Food Processing and Preservation,2015,39:2197-2205.
[5] XIONG Y, WU X, RAO L.Tetrastigmahemsleyanum(Sanyeqing) root tuber extracts induces apoptosis in human cervical carcinoma HeLa cells [J]. Journal of Ethnopharmacology,2015,165:46-53.
[6] FENG Z, HAO W, LIN X, et al. Antitumor activity of total flavonoids fromTetrastigmahemsleyanumDiels et Gilg is associated with the inhibition of regulatory T cells in mice [J]. OncoTargets and Therapy,2014,7:947-956.
[7] 王静,郭万里,杨东风,等.珍稀药用植物三叶青的研究进展[J].植物学研究,2015,4:39-46.
[8] 钟毓倩.三叶青的组织培养与快速繁殖研究[J].浙江中医杂志,2007,42(6):363.
[9] 钱丽华.药用植物“三叶青”的组培快繁技术研究[J].杭州农业科技,2007,6:22-23.
[10] JIANG W, FU Y, ZHOU X, et al. High-frequency shoot regeneration of nodal explants fromTetrastigmahemsleyanumDiels et Gilg: a valuable medicinal plant [J]. African Journal of Biotechnology,2011,10(57):12177-12181.
[11] 史清英.三叶青茎段外植体组织培养体系的优化及印度梨形孢对其生长的影响[D].杭州:浙江大学,2015:21-30.
[12] 邵骏骅,邵卫平,刘永立.三叶青高效快繁技术体系的建立[J].安徽农业科学,2015,43(35):208-209.
[13] MURASHIGE T, SKOOG F. A revised medium for a rapid growth and bio assays with tobacco tissue cultures[J]. Physiologia Plantarum,1962,15:473-497.
[14] 颜昌敬.植物组织培养手册[M].上海:上海科学技术出版社,1990:9-12.
[15] 孙英坤,代其林,张俊林,等.“易丰”女贞组培快繁技术体系的建立[J].生物技术通报,2015,31(12):1-6.
[16] 张宗勤.葡萄高效再生体系的建立研究[D].杨凌:西北农林科技大学,2004:27-28.
[17] 杨威,于颖,王艳娇,等.乌蔹梅的组织培养及快速繁殖研究[J].湖南农业科学,2010(9):16-18,21.
[18] 崔福君.酿酒葡萄组织培养及再生系统的建立[D].杨凌:西北农林科技大学,2003:40.
(责任编辑: 许惠儿)
Study on High-Efficiency Micropropagation System of Rare Medicinal Plant-TetrastigmaHemsleyanumDiels et Gilg
WANGJing1a,GUOWanli1,KONGYaze1a,XUEYidou1a,XUXinhan2,LIANGZongsuo1b
(1a.College of Life Science; 1b.Key Laboratory of Plant Secondary Metabolism and Regulation of Zhejiang Province, Zhejiang Sci-Tech University, Hangzhou 310018, China;2. Hangzhou San Ye Qing Agricultural Technology Co., Ltd., Hangzhou 310018, China)
Abstract:Tetrastigma hemsleyanum Diels et Gilg (Vitaceae) is a folk common herb in the south of China and it has the effects of heat clearing, detoxification, anti-inflammatory and anticancer. Social needs result in its shortage of wild resources, and the research on artificial breeding falls behind. This severely hindered large-scale plantation of T. hemsleyanum, aggrawated the imbalance between supply and demand and restricted the development of industrial chain. Therefore, we established high-efficiency micropropagation system of T. hemsleyanum by using stem segments of T. hemsleyanum with axillary buds as the explant materials to induce lateral branch as well as proliferation, rooting and transplantation process. The results showed that the semi-lignified stem segments (3-8 segments) with axillary buds were better than stem apex with buds as explants; the optimal culture medium for bud induction was MS+1.5 mg/L 6BA+0.025 mg/LNAA; the optimal culture medium for lateral branch proliferation was MS+1 mg/L6BA+0.025 mg/LNAA, and 0.025 mg/L GA was added when growth trend declineed; the best rooting culture medium was 1/2 MS+1.5 mg/L IBA; survival rate of transplanting could reach 90%. With lower hormone concentration ratio, user-friendly control, and high breeding efficiency, the micropropagation system is totally suitable for large-scale and standardized production of seedlings of T. hemsleyanum.
Key words:Tetrastigma hemsleyanum Diels et Gilg; stem segment; axillary buds; lateral branch; micropropagation
DOI:10.3969/j.issn.1673-3851.2016.07.027
收稿日期:2016-01-19
基金项目:国家自然科学基金项目(81373908);浙江理工大学科研启动项目(14042008-Y)
作者简介:王静(1990-),女,河北石家庄人,硕士研究生,主要从事三叶青快繁与指纹图谱方面研究。 通信作者: 梁宗锁,E-mail:liangzs@ms.iswc.ac.cn
中图分类号:TS195.644
文献标志码:A
文章编号:1673- 3851 (2016) 04- 0636- 07 引用页码: 070704

