诱导剂作用时间对3T3-L1前脂肪细胞系分化的影响
刘新农,刘 秀,李天佳,王占启,倪 冷,刘 暴,刘昌伟
中国医学科学院 北京协和医学院 北京协和医院血管外科,北京 100730
·论著·
诱导剂作用时间对3T3-L1前脂肪细胞系分化的影响
刘新农,刘秀,李天佳,王占启,倪冷,刘暴,刘昌伟
中国医学科学院北京协和医学院北京协和医院血管外科,北京 100730
摘要:目的观察不同诱导剂作用时间对3T3-L1前脂肪细胞系分化的影响。方法参照传统鸡尾酒法,分别在作用时间为2 d(A组,传统法),3 d(B组)、4 d(C组,改良法)条件下诱导分化,采用倒置显微镜观察细胞形态,油红O染色及三酰甘油检测脂肪含量,台盼蓝染色鉴定细胞活力。结果A组3T3-L1 前脂肪细胞转化率在80%以上的样本数(n=12)占该组所有样本数(n=18)的66%,而B、C两组中所有样本(n=18)的3T3-L1 前脂肪细胞转化率均在80%以上。油红O染色定量检测结果显示,C组510nm处的OD值为2.59±0.17,明显高于A组的2.12±0.47 (F=6.62,P=0.0001)和B组的2.20±0.17 (F=5.15,P=0.0001),A、B两组间差异无统计学意义(F=1.14,P=0.74)。C组的三酰甘油含量为(1351.04±119.01)ng/ml,明显高于A组的(1077.88±272.75)ng/ml (F=6.73,P=0.001)和B组的(1089.38±115.39)ng/ml(F=5.78,P=0.001),A、B两组间差异无统计学意义(F=0.27,P=0.64)。台盼蓝染色结果显示,A、B、C 3组细胞的活力分别为(98.3±1.2)%、(98.5±1.8)%、(98.9±2.1)%,3组间差异无统计学意义(F=0.18,P=0.83)。结论改良法3T3-L1前脂肪细胞诱导法能提高脂肪细胞转化率,可作为高效诱导脂肪细胞模型的方法之一。推荐作用时间为3 d的改良法诱导方案。
关键词:3T3-L1;前脂肪细胞系;脂肪细胞模型;转化率
ActaAcadMedSin,2016,38(3):271-274
成熟脂肪细胞是体外研究脂肪代谢及肥胖相关疾病机制的重要细胞模型[1- 3],3T3-L1前脂肪细胞系是最常用来诱导分化为成熟脂肪细胞的细胞系之一[4]。传统的3T3-L1前脂肪细胞诱导法是将一定剂量的3-异丁基- 1-甲基黄嘌呤(3-isobutyl- 1-methylxanthine,IBMX)、地塞米松、胰岛素序贯加入3T3-L1前脂肪细胞培养液中,故称为鸡尾酒法[5]。然而,传统的鸡尾酒法存在分化不稳定、转化率低且不一致的缺点[6]。此外,文献报道传统鸡尾酒法还受3T3-L1细胞代数及细胞培养皿的影响[7- 8]。本研究比较了不同诱导剂作用时间对3T3-L1前脂肪细胞诱导分化成熟脂肪细胞的影响,以期寻找一种高效的成熟脂肪细胞诱导方法。
材料和方法
材料和试剂高糖DMEM培养基、胰酶、新生小牛血清(new calf serum,NCS)、胎牛血清(fetal bovine serum,FBS)购自美国Gibco公司,IBMX、地塞米松、胰岛素、油红O染料购自德国Sigma公司;3T3-L1前脂肪细胞系购自国家实验细胞资源共享平台中国医学科学院基础研究所细胞中心,该研究所用细胞系代数均控制在3~8代之间。
实验分组参照传统鸡尾酒诱导法[9],根据3种诱导剂(IBMX 0.5 mmol/L、胰岛素10 μg/ml、地塞米松1 μmol/L)作用时间不同设置为A组(2 d,n=18,传统组),B、C 组(3、4 d,n均=18,改良组),各组细胞均采用6孔细胞培养板培养(美国Costar/Corning公司)。
诱导剂配置
IBM溶液:11.5 mg IBMX+940 μl 超净水+60 μl 1 mol/L NaOH,4 ℃保存,用时1 ml培养基加10 μl IBMX溶液,终浓度为0.5 mmol/L。
胰岛素溶液:10 mg 胰岛素粉剂+10 ml 0.01 mol/L HCI溶液,4 ℃保存,用时1 ml培养基加10 μl 胰岛素溶液,终浓度为10 μg/ml。
地塞米松溶液:2 mg 地塞米松+50 ml 无水乙醇,4 ℃保存,用时1 ml培养基加10 μl地塞米松溶液,终浓度为1 μmol/L。
3T3-L1前脂肪细胞系诱导分化3T3-L1前脂肪细胞系复苏,用含10%NCS高糖DMEM培养基培养。待细胞长满后传代并以1×105密度传代接种于6孔细胞培养板。在6孔细胞培养板培养细胞约2 d,即细胞呈汇合状态,继续培养使得细胞接触抑制2 d。细胞接触抑制2 d结束时标记为Day 0,加入含有3种诱导剂(IBMX 0.5 mmol/L、胰岛素10 μg/ml、地塞米松1 μmol/L)的10%FBS高糖培养基培养(记为0 d)。根据A、B、C各组细胞诱导剂作用时间分别于2、3、4 d置换含有胰岛素(10 μg/ml)的培养基继续培养2 d,随后每2 d换含10%FBS高糖DMEM培养基即可。上述细胞培养过程中,每6孔细胞培养板每孔加2 ml培养基。
油红O染色鉴定及转化率计算分别于4、6、8、10 d动态观察A、B、C各组细胞形态变化并拍照(蔡司倒置显微镜Axio Observer D1)。于10 d收集各组细胞行油红O染色并定量。具体为:弃去培养液用PBS溶液轻轻洗3遍,4%甲醛溶液固定1 h,用PBS冲洗后加入油红O溶液(1 ml/孔)室温静置30 min,成熟脂肪细胞则被油红O染料染成红色。镜下观察拍照后经计算机扫描图片后行图像分析,各细胞培养孔中成熟脂肪细胞转化率计算方法为:随机选择3个不同视野,计算每一个视野下红色细胞数目占该视野中所有细胞数目的百分比,并取3者平均值为该孔中成熟脂肪细胞转化率。不同组间脂肪细胞转化率之间的比较则采用转化率在80%以上的细胞样本数量与该组所有细胞样本数量之比。随后,去除油红O溶液,并用PBS溶液冲洗3遍,每孔加入600 μl/孔异丙醇溶液,室温静置30 min,将各孔中异丙醇溶液转移至96孔板(200 μl/孔),每个孔样本均设3个复孔,最后用酶标仪读取510nm OD值。
三酰甘油检测在10 d收集各组细胞培养液,2500 ×g离心5 min,收集上清液。采用酶联免疫吸附法(试剂盒购自北京科盈美科技有限公司)检测上清液中三酰甘油含量,操作步骤参照试剂盒说明书。
台盼蓝细胞活力检测在10 d,各组细胞经0.125%胰酶加0.05%EDTA消化,吹打成细胞悬液。50 μl 细胞悬液加等体积0.4%台盼蓝溶液混匀,37 ℃孵育3 min 后显微镜下计数。细胞活率(%)=未染色的细胞数/观察的细胞总数×100%。
统计学处理采用SPSS 17.0统计软件,计数资料采用均数±标准误表示,两组资料之间比较采用Study-t检验,3组资料之间比较采用单因素方差分析,P<0.05为差异有统计学意义。
结果
3T3-L1前脂肪细胞系转化率正常状态下,3T3-L1前脂肪细胞系呈纤维细胞状态,梭形,胞浆内无脂滴;4 d时各组细胞形态均由梭形变成近圆形,体积较前增大,B、C两组细胞见较多脂滴均匀分布在视野细胞中,而A组细胞此时仅见少量脂滴、呈不均匀分布;6 d时各组细胞脂滴进一步增多,但与B、C两组细胞比,A组含脂滴的细胞比例依然较低且不均匀;8 d时原始倍数视野下观察发现,B、C两组细胞脂滴密度明显高于A组细胞;10 d时各组细胞脂滴进一步积累,可见较多脂滴融合,呈现出成熟脂肪细胞的特点。此时,A组3T3-L1 前脂肪细胞转化率在80%以上的样本数(n=12)占该组所有样本数(n=18)的66%,而B、C两组中所有样本(n=18)的3T3-L1 前脂肪细胞转化率均在80%以上,但C组细胞内脂滴与前两组比略偏小(图1)。
油红O染色定量油红O染色定量检测结果显示,C组510nm处的OD值为2.59±0.17,明显高于A组的2.12±0.47 (F=6.62,P=0.0001)和B组的2.20±0.17 (F=5.15,P=0.0001),A、B两组间差异无统计学意义(F=1.14,P=0.74)。
三酰甘油表达量三酰甘油含量检测结果显示,C组的三酰甘油含量为(1351.04±119.01)ng/ml,明显高于A组的(1077.88±272.75)ng/ml (F=6.73,P=0.001)和B组的(1089.38±115.39)ng/ml(F=5.78,P=0.001),A、B两组间差异无统计学意义(F=0.27,P=0.64)。
台盼蓝细胞活力台盼蓝染色结果显示,A、B、C 3组细胞的活力分别为(98.3±1.2)%、(98.5±1.8)%、(98.9±2.1)%,3组间差异无统计学意义(F=0.18,P=0.83)。
讨论
提供分化稳定、数量一致成熟脂肪细胞模型在脂肪细胞相关研究中具有重要意义。本研究对比了3种诱导剂不同作用时间对3T3-L1前脂肪细胞系分化的影响。根据预实验结果,同时为了不牺牲整个诱导分化过程总体时间,选择分析2、3、4 d 3种不同作用时间。结果显示,改良3T3-L1前脂肪细胞系诱导法可明显提高3T3-L1前脂肪细胞系转化效率。油红O染色后图像分析结果发现,传统鸡尾酒法成熟脂肪细胞转化率达80%以上细胞样本数占该组所有细胞样本数的比例仅为66%,与文献报道波动于50%~90%间类似[10]。推测该波动范围可能与诱导剂浓度及所用细胞代数及细胞培养皿不同有关[7-8,11]。本研究中,采用改良3T3-L1前脂肪细胞系诱导法,所有细胞培养孔成熟脂肪细胞转化率均在80%以上,细胞活力检测发现各组细胞活力均在95%以上,可用于后续体外细胞实验。
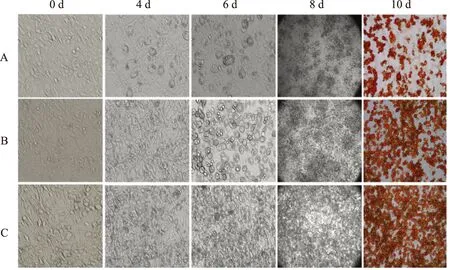
图 13T3-L1前脂肪细胞系分化过程细胞形态变化及油红O染色鉴定(4 d与6 d放大倍数为200倍,0 d与10 d放大倍数为100倍,8 d放大倍数为10倍)
Fig 1Results of cell morphology and Oil red “O” staining during the differentiation of the 3T3-L1 cell lines (Day 4 and 6 were magnified by 200,Day 0 and 10 by 100,and Day 8 by 10)
本研究结果显示,在脂肪含量方面,诱导剂作用4 d的改良3T3-L1前脂肪细胞系诱导法,油红O定量及三酰甘油定量均明显高于诱导剂作用2、3 d组,推测可能与前脂肪细胞转化率高有关。进一步分析发现,诱导剂作用3 d的脂肪含量与作用2 d的脂肪含量无明显差异,推测可能与诱导剂作用3 d转化率高,而同时诱导剂作用2 d尽管成熟脂肪细胞转化率低但脂滴相对较大有关。组内分析结果显示,传统3T3-L1前脂肪细胞系诱导法不同样本脂肪含量差异明显高于改良3T3-L1前脂肪细胞系诱导法。进一步证明改良3T3-L1前脂肪细胞系诱导法可作为一种更有效的提供脂肪细胞模型的方法。Zhu等[12]也采用诱导剂作用3 d 模式进行脂肪细胞诱导分化,但其未对脂肪含量进行定量。
诱导剂浓度是影响诱导分化效率的重要因素[11]。对于IBMX与地塞米松而言,文献中基本采用相对较为一致的药物浓度,分别为0.5 mmol/L和1000 nm/L。胰岛素用量则无统一数值,其用量波动于0~1721 nm/L。本研究中胰岛素用量采取其中间数值,即1000 nm/L。此外,采用改良3T3-L1前脂肪细胞系诱导法6~8 d就可以成功诱导成为成熟脂肪细胞,比文献报道中的时间节省了3~4 d[13]。
综上,本研究结果显示,采用改良3T3-L1前脂肪细胞系诱导法可以提高成熟脂肪细胞转化率,进而为体外脂肪细胞实验有效提供分化较为一致的脂肪细胞模型。推荐诱导剂作用3 d为首选方案。此外,本研究采用6孔细胞培养板,细胞代数控制在3~8代,至于在其他细胞代数及细胞培养皿情况下,改良3T3-L1前脂肪细胞系诱导法是否适用有待进一步研究证实。
参考文献
[1]Yanovski SZ,Yanovski JA. Obesity [J]. N Engl J Med,2002,346(8):591- 602.
[2]McCarthy MI. Genomics,type 2 diabetes,and obesity [J]. N Engl J Med,2010,363(24):2339- 2350.
[4]Poulos SP,Dodson MV,Hausman GJ. Cell line models for differentiation:preadipoctyes and adipocytes [J]. Exp Biol Med (Maywood),2010,235 (10):1185- 1193.
[5]Vishwanath D,Srinivasan H,Patil MS,et al. Novel method to differentiate 3T3 L1 cellsinvitroto produce highly sensitive adipocytes for a GLUT4 mediated glucose uptake using fluorescent glucose analog [J]. J Cell Commun Signal,2013,7(2):129- 140.
[6]Lee SL,Chin TY,Tu SC,et al. Purple sweet potato leaf extract induces apoptosis and reduces inflammatory adipokine expression in 3T3-L1 differentiated adipocytes [J]. Evid Based Complement Alternat Med,2015,doi:10.1155/2015/126 302.[2015- 01- 11].http://www.ncbi.nlm.nih.gov/pmc/articles/PMC4480248/.
[7]Mehra A,Macdonald I,Pillay TS. Variability in 3T3-L1 adipocyte differentiation depending on cell culture dish [J]. Anal Biochem,2007,362(2):281- 283.
[8]Green H,Kehinde O. An established preadipose cell line and its differentiation in culture.II. Factors affecting the adipose conversion [J]. Cell,1975,5(1):19- 27.
[9]Murase Y,Kobayashi J,Nohara A,et al. Raloxifene promotes adipocyte differentiation of 3T3-L1 cells [J]. Eur J Pharmacol,2006,538(1- 3):1- 4.
[10]Zebisch K,Voigt V,Wabitsch M,et al. Protocol for effective differentiation of 3T3-L1 cells to adipocytes [J]. Anal Biochem,2012,425(1):88- 90.
[11]Scott MA,Nguyen VT,Levi B,et al. Current methods of adipogenic differentiation of mesenchymal stem cells [J]. Stem Cells Dev,2011,20(10):1793- 1804.
[12]Zhu HJ,Ding HH,Deng JY,et al. Inhibition of preadipocyte differentiation and adipogenesis by zinc-α2-glycoprotein treatment in 3T3-L1 cells [J]. J Diabetes Investig,2013,4(3):252- 360.
[13]Balachandran A,Guan H,Sellan M,et al. Insulin and dexamethasone dynamically regulate adipocyte 11β-Hydroxysteroid dehydrogenase type 1 [J]. Endocrinology,2008,149(8):4069- 4079.
基金项目:国家自然科学基金(81470585)Supported by the National Natural Sciences Foundation of China(81470585)
通信作者:刘昌伟电话:010- 69152501,电子邮件:liucw@vip.sina.com
中图分类号:R331
文献标志码:A
文章编号:1000- 503X(2016)03- 0271- 04
DOI:10.3881/j.issn.1000- 503X.2016.03.005
Corresponding author:LIU Chang-weiTel:010- 69152501,E-mail:liucw@vip.sina.com
(收稿日期:2015- 08- 12)
Impact of the Action Time of Inducers on Differentiation of 3T3-L1 Cells
LIU Xin-nong,LIU Xiu,LI Tian-jia,WANG Zhan-qi,NI Leng,LIU Bao,LIU Chang-wei
Department of Vascular Surgery,PUMC Hospital,CAMS and PUMC,Beijing 100730,China
ABSTRACT:ObjectiveTo explore the effect of the action time of inducers on the differentiation of 3T3-L1 cells to adipocytes. MethodsAccording to the “Cocktail” method,3T3-L1 cells were divided into three groups according to the action time of inducers,with the action time being 2,3 or 4 days,respectively. Cell morphology was observed using inverted microscope and adipose content were detected by Oil red “O” staining and detection of triglyceride. The cell viability was identified by trypan blue staining method. ResultsThe proportion of samples (n=12) with differentiation rate above 80% in group A was 66% (12/18),while the differentiation rate of all the samples (n=18)in group B and group C were above 80%. For the Oil red “O”,the OD value at 510 nm in group C was 2.59±0.17,which was significantly higher than that in group A (2.12±0.47;F=6.62,P=0.0001)and group B (2.20±0.17;F=5.15,P=0.0001),while no significant difference was found between group A and group B (F=1.14,P=0.74). As for the triglyceride,the value in group C was (1351.04±119.01)ng/ml,which was significantly higher than that in group A[ (1077.88±272.75)ng/ml;F=6.73,P=0.001] and group B [(1089.38±115.39)ng/ml;F=5.78,P=0.001],while no difference was found between group A and group B (F=0.27,P=0.64). The cell viability in group A,B,and C was (98.3±1.2)%,(98.5±1.8)%,and (98.9±2.1)%,respectively,showing no significant difference (F=0.18,P=0.83). ConclusionsThe modified procedure for the differentiation of 3T3-L1 cells to adipocytes can increase the differentiation rate and thus may be applied for establishing adipocyte models. The recommended action time is three days.
Key words:3T3-L1;pre-adipocyte;adipocyte model;differentiation rate

