GABRB2基因启动子区DNA甲基化与精神分裂症及其治疗的关系☆
樊梅 禹顺英
GABRB2基因启动子区DNA甲基化与精神分裂症及其治疗的关系☆
樊梅*禹顺英*
目的 探讨γ-氨基丁酸A型受体β2亚基(gamma-aminobutyric acid type A receptor beta2 subunit,GA⁃BRB2)基因启动子区DNA甲基化水平与精神分裂症及其药物治疗的关系。方法 纳入精神分裂症患者53例和正常对照53名,采用MassARRY EpiTYPER DNA甲基化分析技术检测所有受试者外周血GABRB2基因启动子区DNA甲基化水平。患者组中12例在药物治疗8周后再次检测该基因启动子区DNA甲基化水平。结果 患者组与对照组外周血GABRB2基因启动子区总甲基化和各CpG位点的甲基化水平组间差异无统计学意义(P>0.05)。经性别分层分析,患者组男性CpG_28位点的甲基化水平较对照组男性降低[(0.215±0.084)vs.(0.264± 0.103),P<0.05]。治疗后患者组外周血GABRB2基因启动子区总DNA甲基化水平较治疗前降低[(0.088±0.037)vs.(0.121±0.063),P<0.01],治疗前后各CpG位点甲基化水平差异无统计学意义(P>0.05)。结论 抗精神病药物治疗可降低精神分裂症患者外周血中GABRB2基因启动子区DNA甲基化水平,提示基因启动子区DNA甲基化可能参与抗精神病药物治疗的作用机制。
DNA甲基化精神分裂症 GABRB2基因
【Abstract】Objective Gamma amino butyric acid(GABA)signaling pathway related genes mRNA expression and promoter methylation of GABRB2 gene in peripheral blood were investigated to explore the mechanisms involved in schizophrenia(SZ)and antipsychotics treatment.Methods DNA was isolated from blood samples of 53 SZ patients and 53 gender-and age-matched healthy controls.12 out of 25 SZ patients were followed 8 weeks antipsychotic treatment. The quantitative GABRB2 promoter methylation was analyzed using the high-throughput mass spectrometry on matrix-as⁃sisted laser desorption/ionization time-of-flight(MALDI-TOF)mass array before and after treatment.Results The GA⁃BRB2 promoter methylation pattern of case and control group was not significantly different(P>0.05).However,signifi⁃cant differences of the methylation levels of CpG_28 in the GABRB2 promoter between two groups were found in males[(0.215±0.084)vs.(0.264±0.103),P<0.05].After 8 weeks antipsychotics treatment,a significant decrease of GABRB2 pro⁃moter methylatin was detected in the patients[(0.088±0.037)vs.(0.121±0.063),P<0.01].Conclusion A down regulation of GABRB2 promoter methylation in blood of SZ patients after-treatment supports that GABRB2 promoter methylation in blood may be associated with the mechanisms of antipsychotics treatment in SZ.
【Key words】DNA methylation Schizophrenia GABRB2 gene
γ-氨基丁酸(gamma-aminobutyric acid,GABA)能信号缺陷假说是精神分裂症(schizophrenia,SZ)发病机制的重要假说之一。目前有研究报道SZ患者外周血中存在GABAA受体β2亚基(GABAAre⁃ceptor β2subunit,GABRB2)基因外显子区CpG位点高甲基化[1]。启动子区CpG岛(CpG islands,CGIs)中的 5-甲基胞嘧啶(5-methylcytosine,5-mC)会阻碍转录因子复合体与DNA结合,因而DNA甲基化一般与基因沉默相关联[2]。目前尚未有关于SZ的研究报道GABRB2基因启动子区DNA甲基化异常。本研究拟检测精神分裂症患者外周血GABRB2基因启动子区DNA甲基化水平,探索其与SZ及药物治疗的关系。
1 对象与方法
1.1研究对象 为2012年4月至2013年12月在上海市精神卫生中心就诊的精神分裂症患者。入组标准:①符合《美国精神障碍诊断与统计手册第四版》(Diagnostic and Statistical Manual of Mental Dis⁃orders,Fourth Edition,DSM-Ⅳ)精神分裂症诊断标准;②年龄18~65岁;③未使用过抗精神病药物或至少2周未使用;④阳性和阴性症状量表(positive and negative syndrome scale,PANSS)评分≥70分;⑤法定监护人签署知情同意书。排除标准:①符合DSM-IV轴Ⅰ其他诊断者;②具有明显的自杀或危及自身、他人安全风险者;③患有严重躯体疾病者;④妊娠或哺乳期妇女。共纳入53例患者,年龄18~61岁,平均(31.11±1.47)岁;男性24例,女性29例。
对照组来自上海市精神卫生中心职工及上海交通大学学生。入组标准:①年龄、性别与患者组匹配;②无精神疾病或其他遗传性疾病家族史;③签署知情同意书。排除标准:①患有严重躯体疾病者;②妊娠或哺乳期妇女。共收集53名对照,年龄18~59岁,平均(31.21±1.43)岁;男性24名,女性29名。患者组与对照组的年龄(t=-0.046,P=0.963)和性别(χ2<0.001,P=1.000)差异均无统计学意义。
1.2方法
1.2.1研究方法 SZ患者治疗前检测患者组和对照组GABRB2基因启动子区DNA甲基化水平。然后根据患者病情、既往用药和其他个体情况选择抗精神病药物,进行8周治疗后,采用PANSS量表评估临床疗效,并再次检测GABRB2基因启动子区DNA甲基化水平。入组的53例患者中有28例由于患者或家属个人意愿拒绝参与干预研究,最终25例进入治疗随访。共12例完成8周药物治疗,13例因居住在外地而中途失访,脱落率为52%。完成药物治疗患者中1例服用典型抗精神病药物(五氟利多),其余11例均服用非典型抗精神病药物(利培酮、奥氮平或阿立哌唑)。完成药物治疗的患者中收集到11例完整的PANSS量表评分。
1.2.2 DNA提取 被试抽取外周静脉血3 mL(EDTA抗凝),使用1 mL血液基因组DNA提取试剂盒(上海莱枫生物科技有限公司)提取全基因组DNA。经紫外分光光度仪(NanoDrop 2000)检测DNA纯度及浓度,测光密度(optical density,OD)值在1.8以上为符合后续甲基化检测要求,-80℃保存备用。
1.2.3 GABRB2基因启动子区甲基化检测 使用DNA甲基化试剂盒EZ-96 DNA Methylation Kits (Zymo Research,D5003),按照操作说明书对样本DNA进行亚硫酸氢盐修饰。采用MassARRAY EpiTYPER assay方法检测GABRB2基因启动子区CpG岛甲基化水平。应用EpiDesigner在线软件(http://www.epidesigner.com)设计引物,由上海invi⁃trogen公司合成引物。正向引物序列:5’-aggaaga gagGGGGAGTAGAAAGGTAATGTTGTTT-3’;反向引物序列:5’-cagtaatacgactcactatagggagaaggctCCTC ATTTTACCTACCTTCTAAAAACC-3’。使用基质辅助激光解吸电离飞行时间质谱仪(matrix-assist⁃ed laser desorption/ionization time-of-flight mass ar⁃ray,MALDI-TOF MS)获得质谱图,通过Epityper 1.0软件(Sequenom)获得质谱甲基化水平。共检测GABRB2基因转录起始点上游-1250~-792长459 bp的启动子区24个CpG单位(含44个CpG位点)的甲基化水平。
1.3统计学方法 应用SPSS 13.0进行统计分析。对各CpG位点和总甲基化水平数据进行正态性检验,呈正态分布者组间比较采用独立样本t检验,非正态分布者组间比较采用Mann-Whitney U检验。鉴于不同性别甲基化状态不同[3-4],按性别分层分别比较患者组与对照组间的甲基化水平。患者治疗前后各CpG位点和总甲基化水平比较采用配对t检验或Wilcoxon检验。检验水准α为0.05,双侧检验。
2 结果
2.1治疗前患者组与对照组GABRB2基因启动子区甲基化水平 本研究共检测GABRB2基因转录起始点上游-1250~-792长459 bp的启动子区24个CpG单位(含44个CpG位点)的甲基化水平。由于一些片段分子量过大或过小(>7000 Da或<1500 Da)而不能显示,还有部分甲基化质谱波峰重叠而不能分析,故本研究中CpG_37.38.39.40单位中4个CpG位点未进行分析。患者组和对照组CpG位点的甲基化水平及GABRB2基因启动子区总DNA甲基化水平差异均无统计学意义(均P>0.05)。见表1。
表1患者组和对照组GABRB2基因启动子区总甲基化及23个CpG单位甲基化水平(±s)
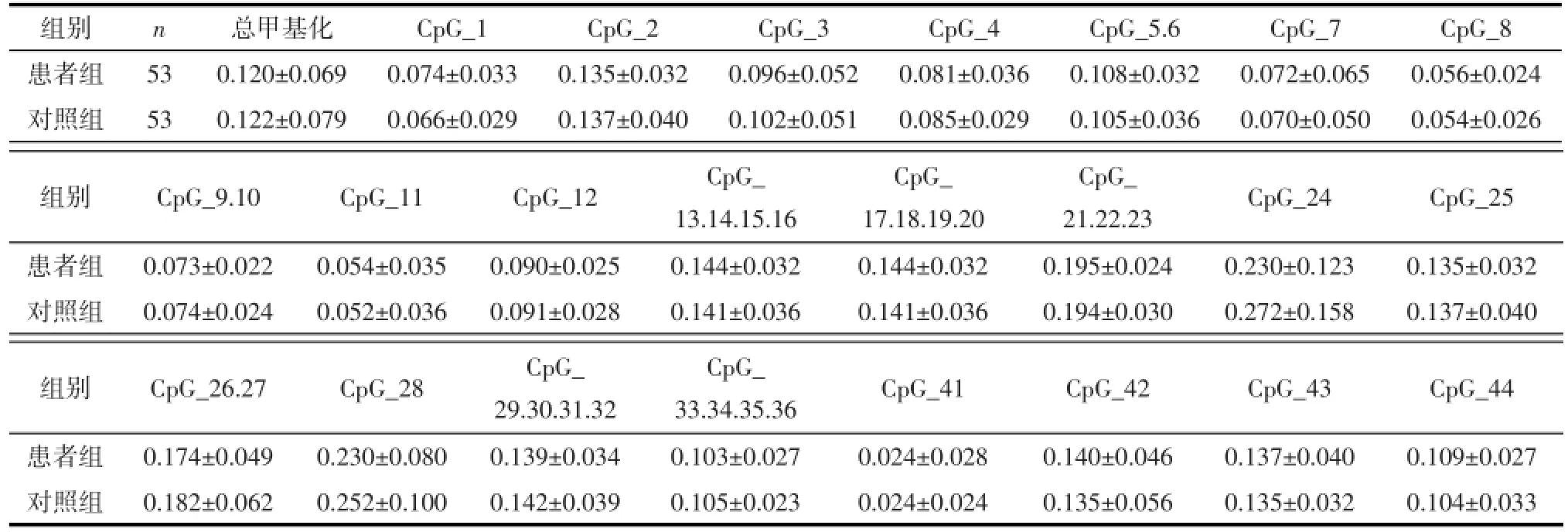
表1患者组和对照组GABRB2基因启动子区总甲基化及23个CpG单位甲基化水平(±s)
组别患者组对照组n 53 53总甲基化0.120±0.069 0.122±0.079 CpG_1 0.074±0.033 0.066±0.029 CpG_2 0.135±0.032 0.137±0.040 CpG_3 0.096±0.052 0.102±0.051 CpG_4 0.081±0.036 0.085±0.029 CpG_5.6 0.108±0.032 0.105±0.036 CpG_7 0.072±0.065 0.070±0.050 CpG_8 0.056±0.024 0.054±0.026组别CpG_9.10CpG_11CpG_12CpG_24CpG_25患者组对照组0.073±0.022 0.074±0.024 0.054±0.035 0.052±0.036 0.090±0.025 0.091±0.028 CpG_ 13.14.15.16 0.144±0.032 0.141±0.036 CpG_ 17.18.19.20 0.144±0.032 0.141±0.036 CpG_ 21.22.23 0.195±0.024 0.194±0.030 0.230±0.123 0.272±0.158 0.135±0.032 0.137±0.040组别患者组对照组CpG_26.27 0.174±0.049 0.182±0.062 CpG_28 0.230±0.080 0.252±0.100 CpG_ 29.30.31.32 0.139±0.034 0.142±0.039 CpG_ 33.34.35.36 0.103±0.027 0.105±0.023 CpG_41 0.024±0.028 0.024±0.024 CpG_42 0.140±0.046 0.135±0.056 CpG_43 0.137±0.040 0.135±0.032 CpG_44 0.109±0.027 0.104±0.033
2.2按性别分层两组间GABRB2基因启动子区甲基化水平 对于男性,患者组CpG_28位点的甲基化水平低于对照组(Z=-2.126,P=0.033),而两组间其他CpG单位及总DNA甲基化水平均无统计学差异(均P>0.05)。对于女性,两组间GABRB2基因启动子区总DNA甲基化及各CpG位点甲基化水平均无统计学差异(均P>0.05)。见表2。
2.3治疗前后患者GABRB2基因启动子区DNA甲基化水平 完成8周药物治疗的12例患者,治疗前PANSS评分平均(89.09±12.37)分,治疗后仅11例患者有完整PANSS量表评分,平均(60.00±13.50)分,减分率平均为(31.14%±3.85%),治疗前后PANSS评分有统计学差异(t=7.158,P<0.001)。相对治疗前,治疗后患者GABRB2基因启动子区总甲基化水平降低(Z=-4.286,P<0.001),治疗前后各CpG位点的甲基化水平均无统计学差异(均P>0.05),见表3。
3 讨论
本研究对SZ患者和对照GABRB2基因转录起始点上游(-1250~-792)启动子区40个CpG位点的甲基化水平进行检测和分析,虽未发现SZ患者与对照间各CpG位点甲基化及总甲基化水平差异有统计学意义,但发现患者治疗后GABRB2基因启动子区总甲基化水平降低(P<0.001),提示GABRB2基因启动子区DNA甲基化可能参与抗精神病药物治疗的作用机制。
近期有多项全基因组DNA甲基化芯片研究报道SZ患者外周血中基因启动子区CpG位点甲基化水平发生改变[2,5]。本研究亦观察到SZ患者GABRB2基因启动子区甲基化水平与对照组间略有差异,但与SATTA等[6]研究结果相似,这些差异均未达到统计学意义。
本研究发现患者与对照外周血GABRB2基因启动子区CpG位点甲基化状态的差异在男性与女性中有不同,男性患者CpG_28位点的甲基化水平低于男性对照,而女性中未发现这种差异。目前多项研究结果显示外周血中DNA甲基化状态存在性别差异,推测这种差异可能与两性之间激素种类和水平不同有关,女性激素可能对DNA甲基化状态具有一定的保护作用以防止其发生异常改变[3-4]。
表2不同性别患者与对照GABRB2基因启动子区总甲基化及23个CpG单位甲基化水平(±s)

表2不同性别患者与对照GABRB2基因启动子区总甲基化及23个CpG单位甲基化水平(±s)
1)与男性对照组比较,经Mann-Whitney U检验,P<0.05
性别男性n女性组别患者组对照组患者组对照组24 24 29 29总甲基化0.117±0.070 0.123±0.079 0.123±0.071 0.122±0.082 CpG_1 0.073±0.038 0.068±0.031 0.075±0.029 0.064±0.028 CpG_2 0.134±0.034 0.138±0.040 0.134±0.031 0.136±0.041 CpG_3 0.098±0.049 0.093±0.056 0.095±0.056 0.109±0.047 CpG_4 0.080±0.029 0.089±0.027 0.082±0.041 0.082±0.030 CpG_5.6 0.106±0.036 0.106±0.036 0.108±0.028 0.105±0.032性别男性女性组别患者组对照组患者组对照组CpG_7 0.080±0.081 0.076±0.063 0.065±0.038 0.064±0.038 CpG_8 0.054±0.024 0.052±0.030 0.056±0.024 0.055±0.024 CpG_9.10 0.067±0.017 0.072±0.023 0.078±0.025 0.076±0.025 CpG_11 0.052±0.035 0.052±0.031 0.055±0.036 0.051±0.040 CpG_12 0.087±0.027 0.087±0.024 0.092±0.024 0.094±0.031 CpG_13.14.15.16 0.139±0.032 0.144±0.028 0.147±0.033 0.138±0.041性别男性女性组别患者组对照组患者组对照组CpG_17.18.19.20 0.139±0.032 0.144±0.028 0.159±0.032 0.136±0.030 CpG_21.22.23 0.195±0.022 0.194±0.031 0.194±0.025 0.193±0.029 CpG_24 0.206±0.129 0.267±0.127 0.249±0.117 0.275±0.180 CpG_25 0.135±0.034 0.138±0.040 0.134±0.031 0.136±0.041 CpG_26.27 0.172±0.061 0.182±0.058 0.176±0.037 0.181±0.066 CpG_28 0.215±0.0841)0.264±0.103 0.243±0.076 0.241±0.098性别男性女性组别患者组对照组患者组对照组CpG_29.30.31.32 0.135±0.032 0.143±0.037 0.141±0.035 0.141±0.042 CpG_33.34.35.36 0.096±0.031 0.108±0.019 0.109±0.022 0.103±0.026 CpG_41 0.023±0.026 0.020±0.023 0.024±0.029 0.028±0.024 CpG_42 0.135±0.034 0.137±0.047 0.143±0.045 0.133±0.063 CpG_43 0.139±0.033 0.138±0.040 0.134±0.031 0.136±0.041 CpG_44 0.107±0.026 0.105±0.031 0.103±0.035 0.110±0.029
既往研究显示SZ患者使用抗精神病药物可以降低基因启动子区的DNA甲基化水平[7],本研究亦得到相似结果,经抗精神病药物治疗后SZ患者GABRB2基因启动子区DNA甲基化水平明显降低。DNA甲基化修饰发生于DNA复制后及转录前,是DNA上CpG二核苷酸中的胞嘧啶在DNA甲基转移酶(DNA methyltransferases,DNMTs)催化下,被选择性地添加甲基形成5-mC。其中DNMT1主要起维持甲基化的作用,而DNMT3a和DNMT3b主要起从头合成甲基化的作用。另一方面,5-mC在10-11易位(ten-eleven translocation,TET)蛋白催化作用下可以转化为5-羟甲基胞嘧啶(5-hydroxy⁃methylcytosine,5-hmC),继而介导去甲基化过程[8]。研究显示精神分裂症患者存在DNA甲基化/去甲基化动态平衡失调[9],在服用抗精神病药物的SZ患者外周血淋巴细胞中存在DNMT1、DNMT3a或TET基因mRNA的表达异常[10],抗精神病药物可以影响GABA通路基因的DNA甲基化水平[7,11]。从而可知,抗精神病药物可能通过影响DNMT1、DN⁃ MT3a、TET基因表达从而引起GABA通路基因甲基化水平的改变,继而调控GABA通路基因的表达,如DNMTs基因高表达及TET1基因低表达可引起GABA通路基因高甲基化,继而抑制GABA通路基因的表达。
然而,亦有研究与本研究结果并不相一致。如近期MELKA等[11]利用大鼠模型研究奥氮平(olanzapine)治疗SZ的作用机制,比较奥氮平治疗前后在大鼠海马、小脑和肝脏组织中GABAA受体基因(GABRE、GABRB1、GABRG1、GABRA6、GA⁃BRD、GABRP)DNA甲基化水平,结果显示差异未达到统计学意义[11],这是目前为数不多的关于抗精神病药物治疗与GABAA受体基因DNA甲基化相关的研究之一。本研究与之结果不一致,可能是因为研究对象不同、实验技术平台不同等。
本研究结果提示外周血中GABRB2基因转录起始点上游(-1250~-792)的启动子区DNA甲基化水平在正常对照及SZ患者中表达水平均较低。但研究的样本量尚较小,在后续验证研究中需要扩大样本量,同时可对该基因启动子区其他序列区域DNA甲基化进行分析,进一步探索该基因启动子区DNA甲基化与精神分裂症及其治疗的关系。如能在动物实验或离体实验,抑或有条件更进一步在正常志愿者中检测用药前后DNA甲基化水平变化情况,结果将更具意义。虽然本研究中SZ患者治疗后GABRB2基因启动子甲基化水平减低未得到所有同类研究的支持,但在一定程度上提示外周血GABRB2基因启动子区甲基化可能与抗精神病药物治疗作用机制相关。
表3患者治疗前后GABRB2基因启动子区总甲基化及23个CpG单位甲基化水平(±s)

表3患者治疗前后GABRB2基因启动子区总甲基化及23个CpG单位甲基化水平(±s)
1)与治疗后比较,经Wilcoxon符号秩和检验,P<0.01
n治疗前治疗后12 12总甲基化0.121±0.0631)0.088±0.037 CpG_1 0.075±0.027 0.068±0.031 CpG_2 0.127±0.028 0.133±0.037 CpG_3 0.108±0.045 0.096±0.059 CpG_4 0.083±0.016 0.085±0.033 CpG_5.6 0.100±0.021 0.113±0.031 CpG_7 0.076±0.040 0.084±0.039 CpG_8 0.052±0.026 0.061±0.016治疗前治疗后CpG_9.10 0.075±0.012 0.070±0.021 CpG_11 0.037±0.026 0.053±0.019 CpG_12 0.073±0.014 0.092±0.022 CpG_ 13.14.15.16 0.120±0.029 0.143±0.030 CpG_ 17.18.19.20 0.120±0.029 0.143±0.030 CpG_ 21.22.23 0.191±0.021 0.182±0.024 CpG_24 0.221±0.142 0.160±0.117 CpG_25 0.127±0.028 0.133±0.037治疗前治疗后CpG_26.27 0.175±0.045 0.171±0.057 CpG_28 0.198±0.054 0.211±0.055 CpG_ 29.30.31.32 0.121±0.033 0.138±0.031 CpG_ 33.34.35.36 0.100±0.016 0.098±0.035 CpG_41 0.024±0.045 0.023±0.023 CpG_42 0.128±0.034 0.138±0.046 CpG_43 0.127±0.028 0.133±0.037 CpG_44 0.102±0.015 0.107±0.015
[1]PUN FW,ZHAO C,LO WS,et al.Imprinting in the schizophre⁃nia candidate gene GABRB2 encoding GABAA receptor β2 sub⁃unit[J].Mol Psychiatry,2011,16(5):557-568.
[2]MAUNAKEA AK,NAGARAJAN RP,BILENKY M,et al.Con⁃servedrole of intragenic DNA methylation in regulating alterna⁃tive promoters[J].Nature,2010,466(7303):253-257.
[3]SHIMABUKURO M,SASAKI T,IMAMURA A,et al.Global hy⁃pomethylation of peripheral leukocyte DNA in male patients with schizophrenia:a potential link between epigenetics and schizophrenia[J].J Psychiatr Res,2007,41(12):1042-1046.
[4]BÖNSH D,WUNSCHEL M,LENZ B,et al.Methylation mat⁃ters?Decreased methylation status of genomic DNA in the blood of schizophrenic twins[J].Psychiatry Res,2012,198(3):533-537.
[5]NISHIOKA M,BUNDO M,KOIKE S,et al.Comprehensive DNA methylation analysis of peripheral blood cells derived from patients with first-episode schizophrenia[J].J Hum Genet,2013,58(2):91-97.
[6]SATTA R,MALOKU E,ZHUBI A,et al.Nicotine decreases DNA methyltransferase 1 expression and glutamic acid decar⁃boxylase 67 promoter methylation in GABAergic interneurons [J].Proc Natl Acad Sci U S A,2008,105(42):16356-16361.
[7]DONG E,NELSON M,GRAYSON DR,et al.Clozapine and sul⁃piride but not haloperidol or olanzapine active brain DNA de⁃methylation[J].Proc Natl Acad Sci U S A,2008,105(36):13614-13619.
[8]LIYANAGE VR,JARMASZ JS,MURUGESHAN N,et al.DNA modifications:function and applications in normal and disease states[J].Biology(Basel),2014,3(4):670-723.
[9]GRAYSON DR,GUIDOTTI A.The dynamics of DNA methyla⁃tion in schizophrenia and related psychiatric disorders[J].Neu⁃ropsychopharmacology,2013,38(1):138-166.
[10]ZHUBI A,VELDIC M,PURI NV,et al.An upregulation of DNA-methyltransferase 1 and 3a expressed in telencephalic GABAergic neurons of schizophrenia patients is also detected in peripheral blood lymphocytes[J].Schizophr Res,2009,111 (1-3):115-122.
[11]MELKA MG,LAUFER BI,MCDONALD P,et al.The effects of olanzapine on genome-wide DNA methylation in the hippocam⁃pus and cerebellum[J].Clin Epigenetics,2014,6(1):1.
(责任编辑:肖雅妮)
Promoter methylation of GABRB2 gene in schizophrenia and antipsychotics treatment.
FAN Mei,YU Shuny⁃ing.Shanghai Mental Health Center,Shanghai Jiao Tong University School of Medicine,600 Wan Ping Nan Road,Shang⁃hai 200030,China.Tel:021-34773299.
R749.3
A
10.3969/j.issn.1002-0152.2016.04.004
☆国家自然科学基金(编号:81071094);十二五科技重大专项“精神药物新药临床评价研究技术平台”(编号:2012ZX09303-003)
*上海交通大学医学院附属精神卫生中心遗传室(上海 200030)
(E-mail:yushuny@yahoo.com)
2015-07-15)

