温度和盐度对华贵栉孔扇贝幼虫存活联合效应研究
李卫东,吕文刚,王辉,王荣霞,黄敏
(1.海南省海洋与渔业科学院,海南 海口 570100;2.厦门大学海洋与地球学院,福建 厦门 361102;3.淮阴师范学院,江苏 淮阴 223300)
温度和盐度对华贵栉孔扇贝幼虫存活联合效应研究
李卫东1,吕文刚2,王辉3,王荣霞1,黄敏1
(1.海南省海洋与渔业科学院,海南海口 570100;2.厦门大学海洋与地球学院,福建厦门361102;3.淮阴师范学院,江苏淮阴223300)
利用中心复合实验设计法研究了温度和盐度两个环境因子对华贵栉孔扇贝幼虫存活的影响。采用响应曲面分析法确立了存活的二次回归方程,同时进行优化处理得到温度、盐度的最佳组合。结果显示在华贵栉孔扇贝幼虫存活中温度与盐度在一定的范围内的互作效应不显著,其中温度效应较为明显。温度对存活率影响的一次项效应和二次项效应均达到显著水平(P<0.0001)。盐度对存活率影响的一次项效应不显著(P>0.05),然而,盐度对存活率影响的二次项效应达到显著水平(P<0.0001)。响应曲面法对华贵栉孔扇贝幼虫存活率不同日龄同时进行优化,其结果显示最佳温度、盐度组合为24.68℃和28.03,此条件下20日龄存活率为48.25%,其满意度函数值达到93.04%。
华贵栉孔扇贝;温度;盐度;生长与存活;相应曲面

华贵栉孔扇贝(Chlamys nobilis)为暖水性贝类,分布于日本的本州、四国、九州、我国的东部和南部沿海以及印尼等西太平洋区域。该贝个体大、生长快、肉质细嫩而味美,具有较高的经济价值和营养价值,是我国重要的养殖贝类。近年来,由于该贝苗种获得较为困难,即使获得苗种但其生长较为缓慢,病死率较高,因此,限制了此贝养殖业的快速发展[1]。
温度和盐度是影响贝类生长最为重要的环境因子,尤其是在胚胎发育和幼虫期其影响效应最为显著。温度和盐度通过影响海洋生物对食物的摄取能力和转化率[2-3]、生物体渗透压的调节[4-7]、生物体能量收支平衡[8-9]和免疫反应[10-11]等诸多方面从而影响个体存活。在环境因子对贝类幼虫存活的影响研究多集中在单因素方面[12-14],其中温度、盐度两个因子单独效应的研究中,贝体耐温性与耐盐性方面有较多的报道[15-18],这些研究多体现了温度或盐度对贝类幼虫生长单独制约效应。对贝类幼虫生长与存活的多因素综合影响效应研究少见报道,而多因素的综合影响效应体现出某种贝类生长时环境因子的协同效应、交互效应,这更能够反映出每种环境因子的重要程度。Doroudi等[19]采用完全因子组合设计研究了4种温度梯度和4种盐度梯度对珠母贝胚胎发育和幼虫生长与存活的综合影响效应。Liang 等[20]采用温度和盐度单一和组合因子设计实验方法,系统地研究了温度、盐度对栉孔扇贝胚胎和幼虫的影响。关于温度和盐度两个环境因子对贝类幼虫存活综合影响效应,除以上研究外,还有少量报道[21-23]。然而,众多研究采用完全或不完全因子组合设计对综合效应加以评估,虽能在一定程度上反映因子的协同作用,但是只能根据实验仅有的几个梯度找到利于生长存活的最佳梯度组合,对梯度外的温度、盐度变化难以进行预测,且实验的工作量大,实施起来较费力。
研究通过中心复合设计,考察在不同温度和盐度下华贵栉孔扇贝幼虫存活情况,研究温度、盐度的协同互作关系,及对幼虫存活的综合影响效应并建立起对应的数学模型找到最佳的温度、盐度组合。研究结果将从理论上更好的指导华贵栉孔扇贝的人工育苗工作。
1 实验材料与方法
1.1实验动物
实验用亲贝取三亚意源养殖有限公司扇贝苗种场,为人工养殖的2龄华贵栉孔扇贝。在实验室条件(温度为24~26℃,盐度为29~31)下暂养一周后用阴干刺激的方法诱导成熟亲贝产卵。在水温(25±1)℃,盐度为(30±1)的条件下进行胚胎及幼虫培育,当培育的幼体壳长达到100~110 μm时,选取健康,活力好的幼体进行实验。
1.2实验设计
采用中心复合实验设计(CCC)方法研究温度、盐度两个因子对华贵栉孔扇贝幼虫存活影响情况。温度、盐度范围的确定是在参考有关研究和预实验的基础上确定的。其中温度范围为18~34℃,盐度20~36。中心复合设计包括中心点4个,因子4个,轴点4个,具体实验设计如表1,整个实验重复一次,中心组合编码值为0,上限编码值为1,下限编码值为-1。
1.3实验操作步骤
1.3.1温度、盐度调控在实验中,温度最高值为34℃,最低值为18℃;盐度最高值为36,最低值为22。盐度是由经处理过后的天然海水、自来水和海水晶调配,由折射盐度计(ATAGO,ATC-S/Mill-E)测定与调控,其调控范围为0~100,精度为0.1%。温度由投入式恒温仪(ZUOFEI,A2)控制(其控温范围为0~50℃),调控使温度处于动态平衡,精度控制在±0.1℃。实验过程中其他的可控条件如溶氧量、pH值、光照等均按该贝正常生长环境设定,其中水中溶氧量控制在大于5 mg/L,pH值在7.9~8.4,光照在1 500 lx以下。
1.3.2幼虫的选取及培育当胚胎发育至直线铰合期时从同一批幼虫群体中选取一定数量幼虫,其幼虫平均壳高在100~110 μm之间,以1 ind/mL左右的幼虫数量放入温度、盐度渐变的水体积为100 L的白色培养箱内培养,各组合密度均匀一致,在12 h内达到实验所需要的温度和盐度条件。饵料以亚心型扁藻[Platymonas subcordiformis(Wille)Hazen]和小球藻为主,水体藻细胞密度保持200~2 000 ind/mL以上,以保证各组摄食充分。为保持盐度,小球藻和扁藻用滤纸过滤浓缩后来投喂。实验水体每天等温度、盐度换水1/5,当幼体生长出现眼点的个体数达到总体数量的30%时,投放附着板(25 cm×30 cm的聚丙乙烯塑料板)每天进行观察并做好记录,实验周期为20 d。
1.3.3存活界定与计算在实验条件达到要求后,在第2天,11 d和20 d时对不同组合的幼虫存活进行统计。在显微镜下观察时死亡幼体整体透明,不能够移动且有裂解的趋势,用吸管将死亡个体吸出,以免死亡幼体影响水质。采用五点取样法取样,每个部位取样2 mL,共取样10 mL计数存活的幼虫数量。存活率为测定时幼虫存活数与实验开始放入幼虫数的比值,其表达式如下所示。
存活率=S1/S0
式中S0和S1分别为实验开始和实验结束时活幼体数量。
1.4数据处理与统计分析
应用SAS8.2统计软件对使用所得数据进行分析。通过方差分析确定回归方程模型及各个实验因素的显著性;采用决定系数(Determination coefficient,R2)、校正系数(Adjust coefficient,Adj_R2)预测系数(Predicted coefficient,Pred_R2)等检验模型的拟合度,同时采用Fisher的F测验来确定其统计显著性。三维的响应曲面图和相应的等高线图用来分析温度、盐度对幼虫存活的影响效应(本文未给出2 d和11 d时回归方程及相应的统计量,但相应的曲面图和等高线图列出,用于比较随着幼虫发育进行,其存活率变化情况,同时给出不同天数时存活数的温度和盐度最优组合值)。
2 结果与分析
2.1回归方程的建立与显著性分析
利用SAS8.2分析系统的实验设计程序对数据进行二次多元回归拟合分别获得了华贵栉孔扇贝的存活率的预测值。对编码自变量处理温度和盐度的二次多项回归方程如下:
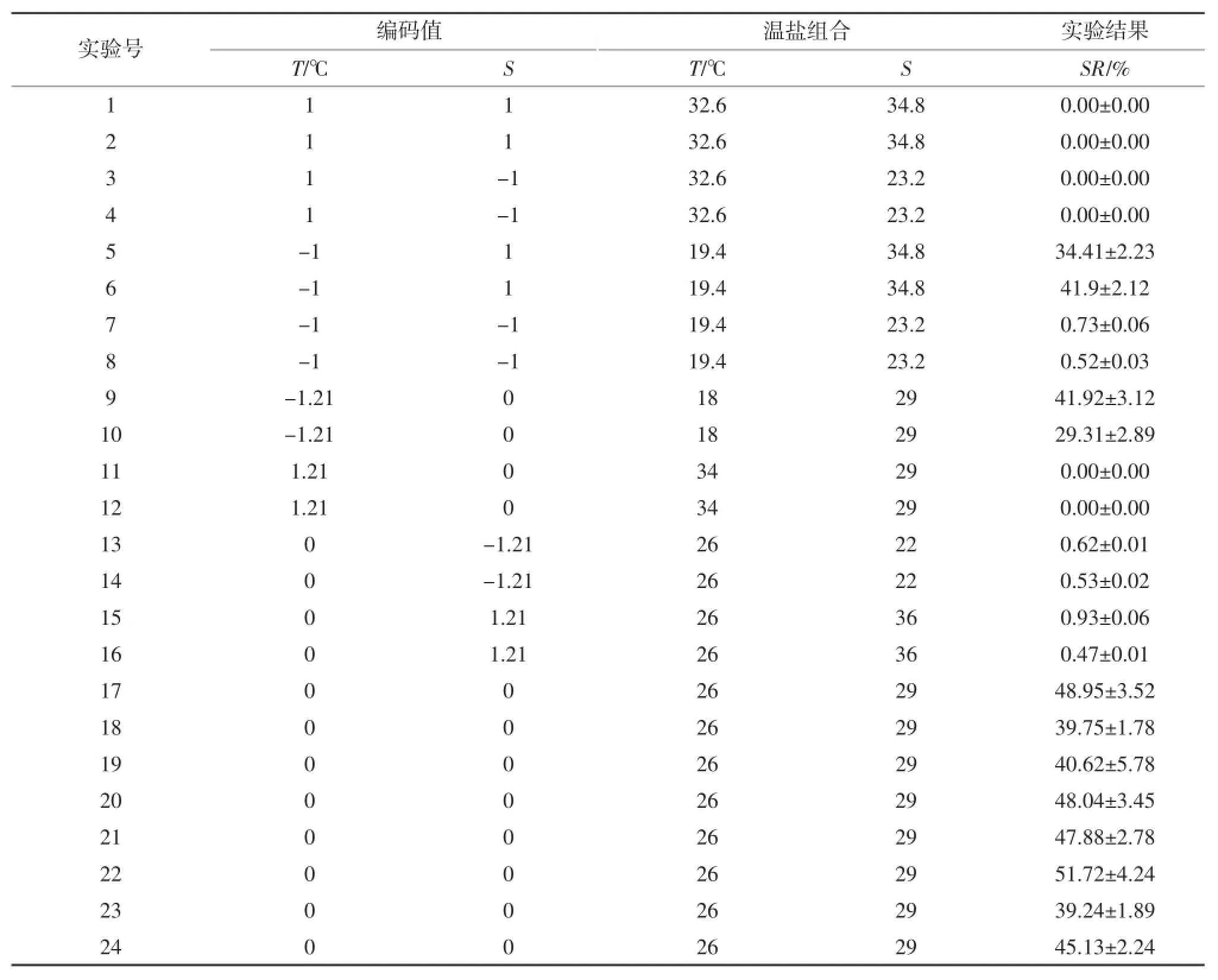
表1 用于响应曲面的中心组合设计及实验结果
SR20=-0.1502.8306+63.9194T+74.6224S-1.7813TS-1.0338T2-1.0720S2+0.1337TS2
对以上回归方程的检验,全部采用F检验法。并由决定系数,校正决定系数,预测系数以及失拟检验来确定回归方程的回归效果和拟合程度。回归方程及方程中的系数显著性检验见表2和表3。
模型方程方差分析表明,本实验所选用的存活率二次多项模型极显著(P<0.0001),通常P<0.001完全可以说明模型方程在99%水平上显著。模型的校正决定系数(Adj_R2=0.9311),预测系数(Pred_R2=0.8911)说明该模型拟合度较好,实验误差小,所以该模型是合适的,可以用此模型分析和预测华贵栉孔扇贝的存活情况。各项回归系数显著性检验表明,温度一次项(P<0.0001)和二次项(P< 0.0001)都为极显著,盐度的一次项未显现显著水平(P=0.2809>0.05),但是盐度的二次项效应极显著(P<0.0001)。温度和盐度的交互项不显著(P= 0.83975>0.05)。失拟检验不显著(P=0.2719>0.05),所以模型拟合度较高。
2.2存活率响应曲面分析与优化
从模型方程的响应曲面图和等高线图(图1—3)的比较中可以看出,等高线由不规则的椭圆形变为较为规则的椭圆形,最后转变为圆形,同时,相应的三维曲面图随着发育天数的增加,有陡峭的山形,逐渐趋于平缓的拱形。这些变化反映出华贵栉孔扇贝不同发育阶段对温度、盐度的适应有一定的变化。在一定的温度范围内(18~26℃),存活率是随温度的升高而升高的,但超出这种范围时,存活率则迅速的下降。在第20天时,等高线图已变成圆形,且从模型方程的系数检验表中可以看出,盐度的对存活的效应已经不显著(P>0.05)。
然而,从优化组合表(表4)发现,温度为24.68℃,盐度为28.03条件下,2 d时幼虫存活率为93.45%,11 d和20 d时分别为70.54%和48.25%。幼虫存活率随着发育的进行呈现下降趋势。

表2 第20天存活率预测模型方程的回归系数,标准差和95%置信区间

表3 第20天存活率模型方程方差分析

表4 最佳存活条件的优化
3 讨论
温度对海洋软体动物贝类存活的影响是多方面的。一般认为,在一定范围内,温度上升会导致生物体内消化酶活力升高,营养物质吸收加快,同时纤毛运动加强,摄食率提高。当超过某一温度,酶活性、纤毛运动反而受到抑制,从而导致贝体生长缓慢,甚至死亡。在本研究中,当盐度处于适宜的范围时(26~29),温度在18~34℃之间变化,观察幼虫运动情况,结果发现低温(18℃)和高温(34℃)的幼虫活动频率较低,说明其鞭毛运动较低,摄食频率下降,生存主要靠消化体内原有的营养物质。有文献报道高温降低贝类机体的免疫能力。He'garet[24]研究温度对美洲牡蛎免疫能力影响时发现,温度的升高将导致呼吸急促,并且血细胞的吞噬能力和聚合能力下降,从而导致贝体的免疫能力丧失。Chen[11]报道在温度急剧变化时,栉孔扇贝有着不同的免疫学反应。当温度28℃时,72 h后贝体的血淋巴有吞噬功能的细胞数量减少,酸性磷酸酶活性降低。而在11℃时无明显的变化。这说明了栉孔扇贝在高温时免疫功能有所降低,贝体有着耐低温的能力。
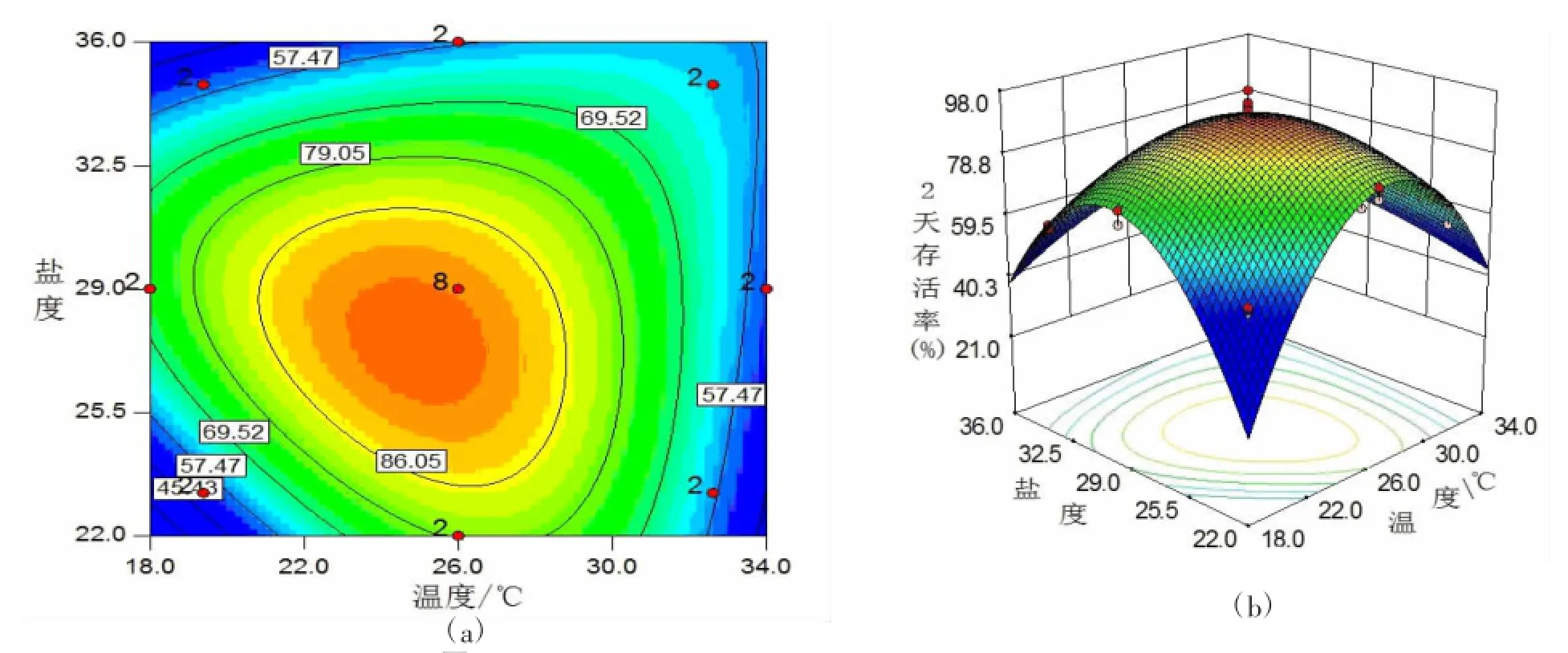
图1 第2天存活率回归方程的等高线(a)和响应曲面(b)

图2 第11天存活率回归方程的等高线(a)和响应曲面(b)

图3 第21天存活率回归方程的等高线(a)和响应曲面(b)
从模型的响应曲面图可以看出,在不适宜的极高极低温度下,幼虫病死率变大,甚至达到100%的病死率。但相比之下,处于极低的温度下,幼虫存活的时间要长于极高温情况,这种情况的出现可能是由于低温时消化酶的活力虽然急剧下降,但由于代谢水平低。幼体贮存的能量足以提供幼体正常生命活动,因而与高温下相比,幼体在一定的温度范围内有较高的存活率,即使在停止生长的温度下,幼体仍能存活;而高温下幼体营养积累不足维持高生长率和高代谢率,能量收支不平衡,最终导致生长停止,幼体死亡。因而在高温下幼虫虽然仍能生长,但存活率低。
可以明显的从图中看出当温度处于适宜的范围(22~26℃)时,盐度的变化对幼体存活的影响情况。当盐度处于26~29时,随着温度和盐度的升高,幼虫存活率也较高。双壳贝类及其他的无脊椎动物的血细胞主要靠吞噬作用来执行其免疫功能,而血细胞对盐度的变化非常的敏感,Fisher[25]报道盐度的降低将导致血细胞循环受阻。Gagnaire等[26]报道盐度的急剧降低将导致太平洋牡蛎血细胞的大量死亡,致使其免疫能力丧失。James等[7]报道贻贝在低盐时免疫功能有所减低。盐度的降低会出现贝体心跳减慢[27,28],呼吸停止[29]电解平衡失调[30]以及能量收支不平衡等不良的生理现象[8,9]。
本研究结果发现,即使是在最佳的温度、盐度条件下(24.68℃,28.03),随着幼体的发育,幼体整个生长周期中存活率呈现下降的趋势。在第2天时,存活率为93.45%,第11天为73.54%,第20天下降到48.25%。出现这种情况可能是由于幼体发育中经历变态期时产生一定的生理变化的结果。因为实验所用的幼体在100~110 μm左右,此时正处于直线铰合期,实验周期为20 d,所以幼体经历变态期。幼虫附着变态受到很多因子的影响,物理因素、化学物质、生物成分都会在不同程度上影响其进程[31,32],如金属阳离子对海产贝类附着均有一定的诱导作用[33]。幼体能够识别环境中某种或某些物质(如微生物黏膜或大型藻类的某种化学成分),被诱导而发生变态,如其生活环境中缺乏这种物质或缺少合适的附着物时,幼体漂浮一段时间,无法完成此过程,最后导致死亡。海产贝类的同种个体的分泌物均能促进其幼虫的附着。同种个体的分泌物在附着变态诱导中也发挥着重要作用[34]。自然海区的生态环境复杂多样,生物在长期的生物竞争中对它们的环境产生了某种适应性,贝类浮游幼体对变态信号的感知和反应正是这种适应性的突出体现。作者认为,在华贵栉孔扇贝浮游到变态期的转变过程中,实验所给定的条件与自然海区有所不同,导致在幼体变态时所需要的条件得不到很好的满足,所以即使在最适的温度、盐度条件下,幼体的存活率也会大幅度的下降。
[1]吕文刚华贵栉孔扇贝早期生活史温盐效应与选择育种及颜色性状遗传规律研究[D].湛江:广东海洋大学,2010.
[2]Navarro J.M.,Leiva G.E.,Martinez G.,et al.Interactive effects of diet and temperature on the scope for growth of the scallop Argopecten purpuratus during reproductive conditioning [J].J Exp Mar Biol Ecol,2000,47(1):67-83.
[3]Loosanoff,V.L.and Davis,H.C.Rearing of bivalve mollusks[C].Advances in Marine Biology,Academic Press,London,1963.1:1-136.
[4]Amal A.Rady.Environmental temperature shift induced adaptive changes of carp(Cyprinus carpio L.)erythrocyte plasma membrane in vivo[J].Comparative Biochemistry and Physiology Part A Physiology,1993,105(3):513-518.
[5]Maria N.Alexis,Elli Papaparaskeva-Papoutsoglou,Sofronios Papoutsoglou Influence of acclimation temperature on the osmotic regulation and survival of rainbow trout(Salmo gairdneri)rapidly transferred from fresh water to sea water[J],Aquaculture,1984,40(4):333-341.
[6]Stuart Khan.Inquiry into a sustainable water supply for Sydney[C].Legislative Council Committee Report Debate,General Purpose Standing Committee.2006(5):1-26
[7]James A.Bussell,Eleanor A.Gidman,David R.Causton,et al.Changes in the immune response and metabolic fingerprint of the mussel,Mytilus edulis(Linnaeus)in response to lowered salinity and physical stress[J].J Exp Mar Biol Ecol,2008,358:78-85.
[8]Bricelj,V.M.,Shumway,S.E.,Physiology:energy acquisition and utilization[C].Shumway,S.E.,Scallops:Biology,E-cology and Aquaculture.Elsevier,1991,305-337.
[9]Gardner,J.P.A.,Thompson,R.J.The effects of coastal andestuarine conditions on the physiology and survivorship of the mussels Mytilus edulis,M.trossulus and their hybrids[J].J. Exp.Mar.Biol.Ecol.2001,265:119-140.
[10]Beatrice Gagnaire,Heloise Frouin,Kevin Moreau,et al. Effects of temperature and salinity on haemocyte activities of the Pacific oyster,Crassostrea gigas(Thunberg) [J].Fish& Shellfish Immunology,2006,20(4):536-547.
[11]Chen Muyan,Hongsheng Yang,Maryse Delaporte,et al. Immune condition of Chlamys farreri in response to acute temperature challenge[J].Aquaculture,2007,271(1-4):479-487.
[12]Ian Laing.Effect of salinity on growth and survival of king scallop spat(Pecten maximus)[J].Aquaculture,2002,205 (1-2):171-181.
[13]Rico-Villa B,Pouvreau S,Robert R.Influence of food density and temperature on ingestion,growth and settlement of Pacific oyster larvae,Crassostrea gigas[J].Aquaculture,2009,287(3-4):395-401.
[14]Gyda Christophersen,divind Strand.Effect of reduced salinity on the great scallop(Pecten maximus)spat at two rearing temperatures[J].Aquaculture,2003,215(1-4):79-92.
[15]Guilherme S.Rupp,G.Jay Parsons.Effects of salinity and temperature on the survival and byssal attachment of the lion's paw scallop Nodipecten nodosus at its southern distribution limits[J].J Exp Mar Biol Ecol,2004,309(2):173-198.
[16]Verween A.,M.Vincx,S.Degraer.The effect of temperature and salinity on the survival of Mytilopsis leucophaeata larvae(Mollusca,Bivalvia):The search for environmental limits[J].J Exp Mar Biol Ecol,2007,348(1-2):111-120.
[17]章启忠,刘志刚,王辉.华贵栉孔扇贝稚贝盐度适应性的研究[J].广东海洋大学学报,2008,27(1):40-43.
[18]刘志刚,刘建勇,杨博.温度与盐度对华贵栉孔扇贝幼贝存活与生长的互作效应研究[J].海洋科学,2011,35(10): 75-80.
[19]Tetelbach S.T.,Rhodes E.W.Combined effects of temperature and salinity on Embryos and larvae of the Northern Bay Scallop Argopecten irradians irradians[J].Marine Biology 1981,63:249-256.
[20]Liang Y.B.,Zhang F.S.Effects of temperature/salinity on development of embryos and larvae of scallop Chlamys farreri [J].Oceanologia et limnologia sinica,2008,39(4):334-339.
[21]José M.Mazón-Suástegui,Karen M.Ruíz-Ruíz,Aurora Parres-Haro,et al.Combined effects of diet and stocking density on growth and biochemical composition of spat of the Cortez oyster Crassostrea corteziensis at the hatchery[J].Aquaculture,2008,284:98-105.
[22]Robert A.R,Shane B B.Larval and spat culture of the Western Australian silver-or goldlip pearl oyster,Pinctada maxima Jameson(Mollusca:Pteriidae)[J].Aquaculture,1994,126(1-2):35-50.
[23]Doroudi M S,Southgate P C,Mayer R J.The combined effects of temperature and salinity on embryos and larvae of the black-lip pearl oyster,Pinctada margaritifera(L.)[J].Aquaculture Research,1999,30:271-277.
[24]Hegaret H.,Wikfors G.H.,Soudant P.,et al.Immunological competence of eastern oysters,Crassostrea virginica,fed different microalgal diets and challenged with a temperature elevation[J].Aquaculture,2004,234:541-560.
[25]Fisher,W.S.Environmental influence on bivalve haemocyte function[J].Am.Fish.Soc.Spec.Publ.1988,18:225-237.
[26]Gagnaire B,Frouin H,Moreau K.Effects of temperature and salinity on haemocyte activities of the Pacific oyster,Crassostrea gigas(Thunberg) [J].Fish&Shellfish Immunology,2006,20(4):536-547.
[27]Bakhmet I.N.,Berger V.J.,Khalaman V.V.The effect of salinity change on the heart rate of Mytilus edulis specimens from different ecological zones[J].J Exp Mar Biol Ecol,2005,318:121-126.
[28]Braby C.E.,Somero G.N.Following the heart:temperature and salinity effects on heart rate in native and invasive species of blue mussels(genus Mytilus) [J].J Exp Biol,2006,209: 2554-2566.
[29]Stickle,W.B.,Sabourin,T.D.Effects of salinity on the respiration and heart rate of the common mussel,Mytilus edulis L.,and the black chiton,Katherina tunicata(Wood)[J].J Exp Mar Biol Ecol,1979,41:257-268.
[30]Natochin,Yu.V.,V.Berger,E.A.Lavrova,O.Kuz'mina,et al.The role of sodium and potassium in cell volume regulation in intertidal mollusks[C]A.V.Zhirmunskij,Physiology and biochemistry of adaptations in marine animals.1981:129-134.
[31]Xiujuan Yu,Weihong He,Ji-Dong Gu,et al.The effect of chemical cues on settlement of pearl oyster Pinctada fucata martensii(Dunker)larvae[J].Aquaculture,2008,277(1-2): 83-91.
[32]Haifang Li,Wei Lin,Guang Zhang,et al.Enhancement of larval settlement and metamorphosis through biological and chemical cues in the abalone Haliotis diversicolor supertexta [J].Aquaculture,2006,258(1-4):416-423.
[33]Pecheruk J.A.Gee C.C.Onset of metamorphic competence in larvae of the gastropod,Crepidula fornicate(L.),judged by a natural and an artificial cue[J].J Exp Mar Biol Ecol,1993,167:59-72.
[34]柯才焕,孙泽伟,周时强,等.华贵栉孔扇贝幼体附着和变态的化学诱导[J].海洋科学,2000,24(12):5-8.
台湾虱目鱼首次“登陆”厦门海沧
记者2015年12月15日从厦门海沧检验检疫局获悉,来自台湾嘉义县的虱目鱼肚已顺利运抵海沧。这是素有“台湾第一鱼”之称的虱目鱼及其产品首次“登陆”海沧口岸。
这批虱目鱼肚共计6.6 t,300箱,价值105万新台币,为预包装产品,经检验检疫合格后可进入大陆市场直接上架销售。
俗称“台湾第一鱼”的虱目鱼,鱼鲜肉细,营养价值高,属海产品中高端鱼类,在台湾养殖面积大、产量高、价格便宜。
福建自贸试验区厦门片区挂牌成立后,厦门海沧检验检疫局落实自贸区政策,为台湾进口水产品打造全程化、高效率物流链条,创造良好的通检环境,吸引了大量的台湾水产从海沧口岸登陆。
据统计,福建自贸区挂牌后,海沧口岸共进口台湾水产品196批次,共计6 908 t,金额达700万美元。
业内人士预测,随着自贸区的发展及口岸通检环境的不断优化,进口台湾水产品数量将会出现大幅上升,海沧将成为台湾水产进口的重要口岸。
(www.bbwfish.com)
Combined effects of temperature and salinity on survival rate of larva in noble scallop,Chlamys nobilis(Reeve)
Li Weidong1,Lv Wengang2,Wang Hui3,Wang Rongxia1,Huang Min1
(1.Tropical Marine Products Fine Breed Center,Hainan Academy of Ocean and Fisheries Sciences,Hainan 570100,China;2.College of Ocean and Earth Sciences,Xiamen University,Xiamen 361102,China;3.School of Life Science,Huaiyin Normal University,Huaiyin 223001,China)
The combined effects of temperature and salinity on the survival rate(SR)of larva in noble scallop,Chlamys nobilis,was evaluated using the central composite orthogonal quadratic design and the response surface methodology.The results showed that the linear effects of temperature on SR were statistically highly significant(P<0.0001);The linear effects of salinity on SR was nonsignificant(P>0.05).the interactions between temperature and salinity on SR were not significant(P>0.05);the quadratic effects of temperature and salinity on SR was highly significant(P<0.01);temperature was more important in influencing survival of larva.By applying the optimization technique,the optimum factor combination,24.68℃/28.03 was found out,at which the optimal SR(48.25%)arrived simultaneously,with the desirability value as high as 93.04%.
Chlamys nobilis,temperature,salinity,survival,RS
Q176
A
1004-2091(2016)01-0001-08
10.3969/j.issn.1004-2091.2016.01.001
国家自然科学基金(31160528);国家海洋公益性行业科研专项(201405020-5);海洋公益专项科研基金(201205021)
李卫东(1978-),博士,副研究员,海洋生物学专业.E-mail:liweidong000@aliyun.com
吕文刚,博士.E-mail:lwg1125@hotmail.com
2015-04-30)

