分散固相萃取净化-高效液相色谱-串联质谱法测定鱼体中地克珠利残留量
邢丽红,孙伟红*,孙晓杰,李兆新,郭江涛(中国水产科学研究院黄海水产研究所,农业部水产品质量安全检测与评价重点实验,农业部水产品质量安全风险评估实验室(青岛),山东 青岛 266071)
分散固相萃取净化-高效液相色谱-串联质谱法测定鱼体中地克珠利残留量
邢丽红,孙伟红*,孙晓杰,李兆新,郭江涛
(中国水产科学研究院黄海水产研究所,农业部水产品质量安全检测与评价重点实验,农业部水产品质量安全风险评估实验室(青岛),山东 青岛 266071)
建立分散固相萃取净化-高效液相色谱-串联质谱法测定鱼体中地克珠利残留量的分析方法。样品经无水硫酸钠脱水,乙腈超声提取并减压浓缩,正己烷去脂,基质分散固相萃取净化,以电喷雾离子源负离子扫描模式进行质谱分析,内标法定量。结果表明,地克珠利在1~100 μg/L范围内线性关系良好,相关系数R2大于0.999。地克珠利添加水平为1.00~50.0 μg/kg时,平均回收率在95.4%~108%之间,批内和批间变异系数均小于15%。地克珠利的检出限为0.50 μg/kg。本方法灵敏、高效、简单、重复性好,能满足鱼体中地克珠利残留量的检测要求。
分散固相萃取;高效液相色谱-串联质谱;鱼;地克珠利
地克珠利是20世纪80年代由比利时杨森制药公司开发研制的非聚醚类化学合成抗球虫药,属三嗪苯乙腈化合物,具有高效、低毒、广谱的特点,常被用于养禽业和养兔业抗球虫病的预防和治疗[1-3]。地克珠利对水生动物孢子虫等有抑制或杀灭作用,在水产养殖中主要用于防治鲤科鱼类粘孢子虫、碘泡虫、尾孢子、四极虫、单极虫等孢子虫病。由于地克珠利具有低毒、广谱、用量小等特点,在使用过程中存在滥用药物、不遵守休药期等情况,因此带来了一系列兽药残留问题,对人体健康存在潜在的危害。
地克珠利的残留标示物是其本身。各国政府和国际组织均制定了动物源性食品中地克珠利的最大残留限量(maximum residue limits,MRLs)[4-6]。我国农业部公告第235号规定地克珠利在绵羊/禽/兔的肌肉、脂肪、肝和肾组织中的MRLs分别为500、1 000、3 000、2 000 μg/kg[7]。由于缺少地克珠利在有鳍鱼类肌肉中残留量的检测方法,因此,目前国内外均没有制定地克珠利在鱼体组织中的MRLs[8]。
地克珠利残留量的检测方法主要有气相色谱-质谱法[9]、高效液相色谱法[8,10-11]、液相色谱-串联质谱法[12-22]及高分辨质谱法[23-24],检测对象以畜禽组织为主,目前鲜见测定鱼体中地克珠利残留量的液相色谱-串联质谱法。现有的样品前处理方法复杂,样品净化步骤操作繁琐,检测效率低下。本研究对样品提取和净化方式进行优化,采用与地克珠利化学结构和性质相似的Diclazuril-methyl作为内标,利用分散固相萃取净化结合高效液相色谱-串联质谱,建立了一种操作快速、简便且高灵敏度的检测鱼体中地克珠利残留量的分析方法。
1 材料与方法
1.1 材料与试剂
地克珠利标准品(CAS:101831-37-2)、Diclazurilmethyl内标标准品(纯度≥98.0%) 美国Sigma公司。
乙腈、甲醇、正己烷(均为色谱纯) 德国Merck公司;无水硫酸钠(分析纯,经650 ℃灼烧4 h,置于干燥器内备用) 国药集团化学试剂有限公司;N-丙基乙二胺(N-propylethylendiamine,PSA)、十八烷基键合硅胶吸附剂(C18)、硅胶(Cleanert Silica)天津博纳艾杰尔科技有限公司;强阴离子交换层析填料(LC-SAX)、石墨化炭黑(ENVI-Carb) 美国Sigma-Aldrich公司;酸性氧化铝(LC-Alumina-A)、弗罗里硅土(Florisil)、中性氧化铝(LC-Alumina-N)、碱性氧化铝(LC-Alumina-B)、强阳离子交换层析填料(LCSCX) 美国Supelco公司;N-乙烯吡咯烷酮-二乙烯基苯聚合物(HLB) 德国CNW公司。
1.2 仪器与设备
TSQ Quantum Access高效液相色谱-串联质谱仪(配电喷雾离子源)、高速离心机(6 000 r/min) 美国Thermo Fisher科技公司;分析天平(感量0.01 g)德国赛多利斯集团;离心机(14 000 r/min) 德国Sigma公司;涡旋混合器 美国Talboys公司;旋转蒸发仪 德国Heidoplh公司;超声波清洗仪 昆山市超声仪器有限公司;Gradient A10 Mill-Q超纯水仪 美国Millipore公司。
1.3 方法
1.3.1 样品处理
称取样品2 g(精确到0.01 g)于50 mL具塞离心管中,准确加入内标标准溶液100 μL,涡旋混合30 s,避光放置10 min。加入无水硫酸钠2 g,涡旋振荡1 min使其分散均匀,再加入乙腈10 mL,涡旋混合1 min,超声提取10 min,6 000 r/min离心5 min,将上清液转移至50 mL梨形瓶中。乙腈10 mL加入到50 mL离心管中重复提取一次,合并提取液,40 ℃减压浓缩至干。准确加入80%甲醇溶液1 mL,涡旋混匀,充分溶解残余物,待净化。
在上述待净化液中,先加入正己烷2 mL,充分涡旋混合1 min,6 000 r/min离心5 min,弃去正己烷层,再加入C18吸附剂50 mg,充分涡旋混合1 min,14 000 r/min离心5 min,取清液过0.22 µm有机相滤膜后,供高效液相色谱-串联质谱仪测定。
1.3.2 标准工作曲线的制作
标准储备液的配制:称取适量地克珠利及其内标标准品,先用1 mL N,N-二甲基甲酰胺将其溶解,再用甲醇稀释并定容,配制成1.0 mg/mL标准储备液,-18 ℃避光保存,有效期6 个月。地克珠利标准使用液:准确移取适量1 mg/mL地克珠利标准储备液,用甲醇稀释,配制成1 μg/mL标准使用液,-18 ℃避光保存。
内标标准使用液的配制:准确移取适量1 mg/mL Diclazuril-methyl内标标准储备液,用甲醇逐级稀释,配制成100 ng/mL内标标准使用液,现配现用。
准确移取适量地克珠利标准使用液,用流动相稀释成质量浓度分别为1、2、5、10、20、50、100 μg/L、内标质量浓度为10 μg/L的标准工作液,供高效液相色谱-串联质谱仪测定。
1.3.3 色谱及质谱条件
1.3.3.1 色谱条件
色谱柱:Waters XTerra C18柱(2.1 mm×150 mm,5 μm);柱温:室温;流速:0.2 mL/min;进样量:10 µL;流动相:A为5 mmol/L醋酸铵溶液,B为甲醇;梯度洗脱程序见表1。
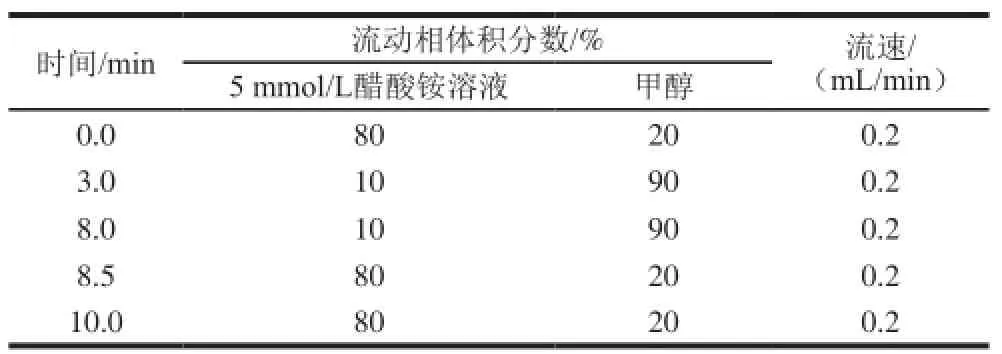
表1 流动相梯度洗脱程序Table 1 Gradient eluti on program of mobilep hase
1.3.3.2 质谱条件
离子化模式:电喷雾离子源(e l e c t r o s p r a y ionization,ESI),负离子模式;喷雾电压:3 500 V;雾化气压力:12 L/min;辅助气流量:2 L/min;离子传输管温度:300 ℃;源内碰撞诱导解离电压:10 V;扫描模式:选择反应监测,选择反应监测母离子、子离子和碰撞能量见表2;Q1半峰宽:0.7 D;Q3半峰宽:0.7 D;碰撞气(氩气)压力:0.2 Pa。
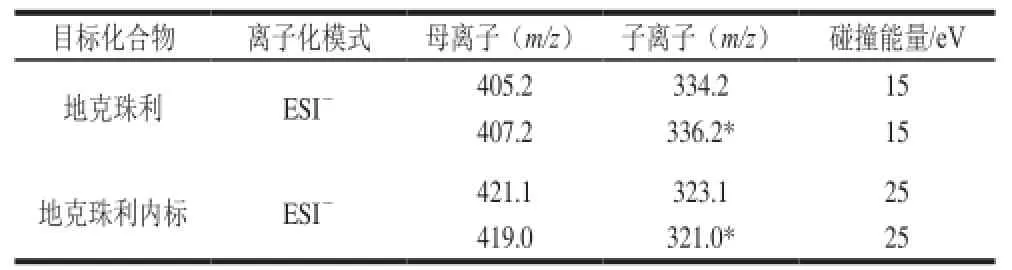
表2 选择反应监测母离子、子离子和碰撞能量Table 2 Precursor i on s,p roducti on s and c ollisi on energy of diclazuril and its in ter nalst and a rd u nd er S RM m od e
2 结果与分析
2.1 线性范围和检出限
用地克珠利标准工作液配制质量浓度分别为1、2、5、10、20、50、100 μg/L的标准溶液,内标添加质量浓度均为10 μg/L,进样后绘制标准工作曲线。结果表明,地克珠利在1~100 μg/L范围内线性关系良好,线性方程Y=0.015 554 8+0.015 072 8X,相关系数R2大于0.999。方法的检出限理论上为地克珠利丰度较弱子离子的信噪比不小于3。将加标质量浓度逐级稀释添加于空白样品中测定信噪比,最终确定该方法的检出限为0.50 μg/kg。
2.2 回收率和精密度
准确称取2.00 g阴性鲤鱼、草鱼、鳊鱼样品,添加水平分别为1.00、5.00、50.0 μg/kg,每个添加水平平行测定6 次,共测定3 个批次,计算回收率和精密度,见表3。结果表明,本方法在1.00~50.0 μg/kg添加水平的平均回收率在95.4%~108%之间,批内变异系数在5.68%~12.8%之间,批间变异系数在7.26%~10.2%之间,符合残留检测要求。地克珠利标准、空白样品及加标样品特征质量离子色谱图见图1~3。
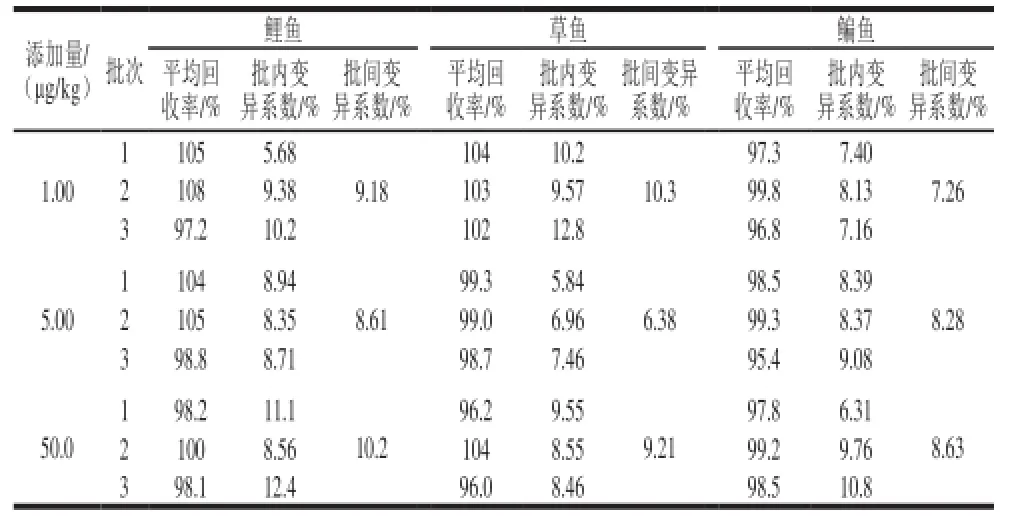
表3 地克珠利的平均回收率和变异系数(n=6)Table 3 Averager ecoveries and coefficients of v ariati on of diclazuril(n= 6)

图1 地克珠利标准特征离子质量色谱图(1μ g / L )Fig.1 Characteristic ion mass chromatogram of diclazuril standard
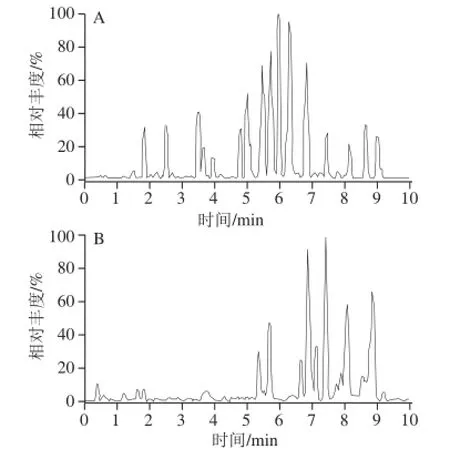
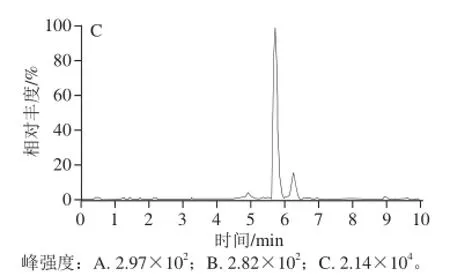
图2 鲤鱼空白样品特征离子质量色谱图Fig.2 Characteristic ion mass chromatogram of blank sample of common carp meat
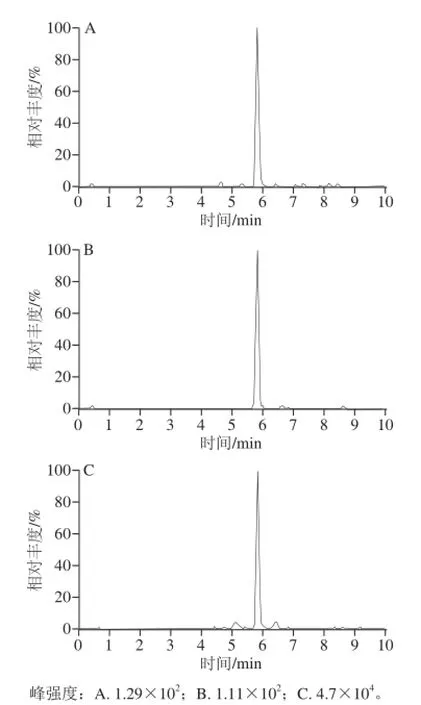
图3 鲤鱼加标样品特征离子质量色谱图 (0.50 μ g / k g )Fig.3 Characteristic ion mass chromatogram of spiked sample of common carp meat
2.3 实验条件优化
2.3.1 提取溶剂的选择
实验分别选择乙腈、乙酸乙酯、N,N-二甲基甲酰胺、乙腈-氯仿(10∶1,V/V)、氯仿-乙腈(9∶1,V/V)作为提取溶剂。结果表明,不论采用哪种提取溶剂,地克珠利的回收率均较低。比较这几种提取溶剂,乙腈和N,N-二甲基甲酰胺的回收率最高,样品平行性最好,乙酸乙酯不及乙腈的回收率高,乙腈与氯仿混合液的提取回收率最低,且样品之间的平行性差。综合考虑,乙腈与鱼肉组织的兼容性较好,兼有去除部分脂肪的功能,是药物残留检测的常规试剂,因此本实验选用乙腈作为提取溶剂。地克珠利在不同提取溶剂中的回收率见表4。Szilard等[18]研究了乙腈、甲醇、乙酸乙酯等提取剂对地克珠利的提取回收率,与本实验结果相近。
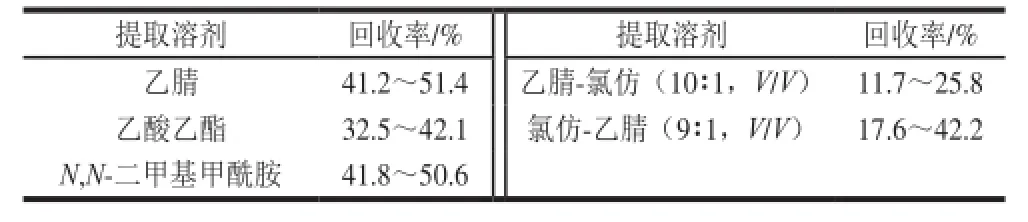
表4 地克珠利在不同提取溶剂中的提取回收率Table 4 Extracti on recoveries of diclazuril in differentsolvents
乙腈不仅将目标化合物提取出来,同时也将样品基质中的水分一起提取出来,因此在样品提取液中加入无水硫酸钠脱除水分,有利于下一步的浓缩操作。本实验对加入无水硫酸钠前后的提取液进行比较,发现无水硫酸钠对地克珠利没有吸附作用。
2.3.2 净化方式的选择
由于地克珠利的回收率较低,因此净化过程尽可能选择简单又能保证灵敏度和专一性的方式。本实验首先选择液液萃取净化,再采用基质分散固相萃取方式进行净化。水产样品种类繁多,样品基质复杂,有些样品含脂量较高,严重影响地克珠利的灵敏度,因此实验首先采用正己烷去除脂肪。常规的固相萃取净化方式既费时又费力,而基质分散固相萃取方法是一种简便、快捷的前处理方式,在兽药残留检测方面的应用也越来越多。本实验分别对C18、PSA、HLB、LC-Alumina-A、LC-Alumina-B、LC-Alumina-N、LC-SAX、LC-SCX、Florisil、ENVI-Carb、Cleanert Silica 这11 种吸附剂在不同添加量时对地克珠利回收率的影响进行研究,其结果见图4。
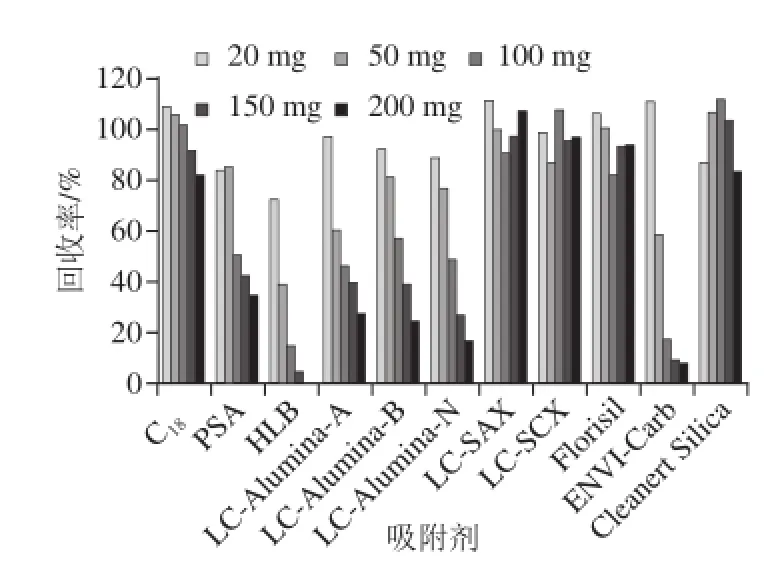
图4 不同吸附剂对地克珠利回收率的影响Fig.4 Influence of different sorbents on the recovery of diclazuril
通过比较不同吸附剂的加标回收率数据发现,C18、LC-SAX、LC-SCX、Florisil和Cleanert Silica这几种吸附剂随着用量的增加,地克珠利的回收率并没有显著下降,表明这几种吸附剂对地克珠利的吸附作用较差。相反,PSA、HLB、LC-Alumina-A、LC-Alumina-B、LCAlumina-N和ENVI-Carb这6 种吸附剂则随着用量的增加,地克珠利的回收率与之呈负相关,表明这6 种吸附剂对地克珠利有较强的吸附作用。C18填料既具有较高且较稳定的回收率,又具有很好的除杂效果,通过添加不同用量的C18发现,虽然地克珠利的回收率随添加量的增加有所下降,但即使添加量达到200 mg时,回收率仍然大于80%,当添加量为50 mg时,即可达到理想的除杂效果。因此本实验选择在基质中添加50 mg的C18填料作为吸附剂。
2.3.3 内标的选择
通过查阅文献[18]及实验验证,地克珠利的绝对回收率较低。由于没有商品化的内标物质,因此需选择与地克珠利结构和化学性质比较相似的化合物作为内标标准物质。分别实验了地克珠利内标1和地克珠利内标2两种物质作内标。地克珠利、地克珠利内标1和地克珠利内标2结构式如图5所示。
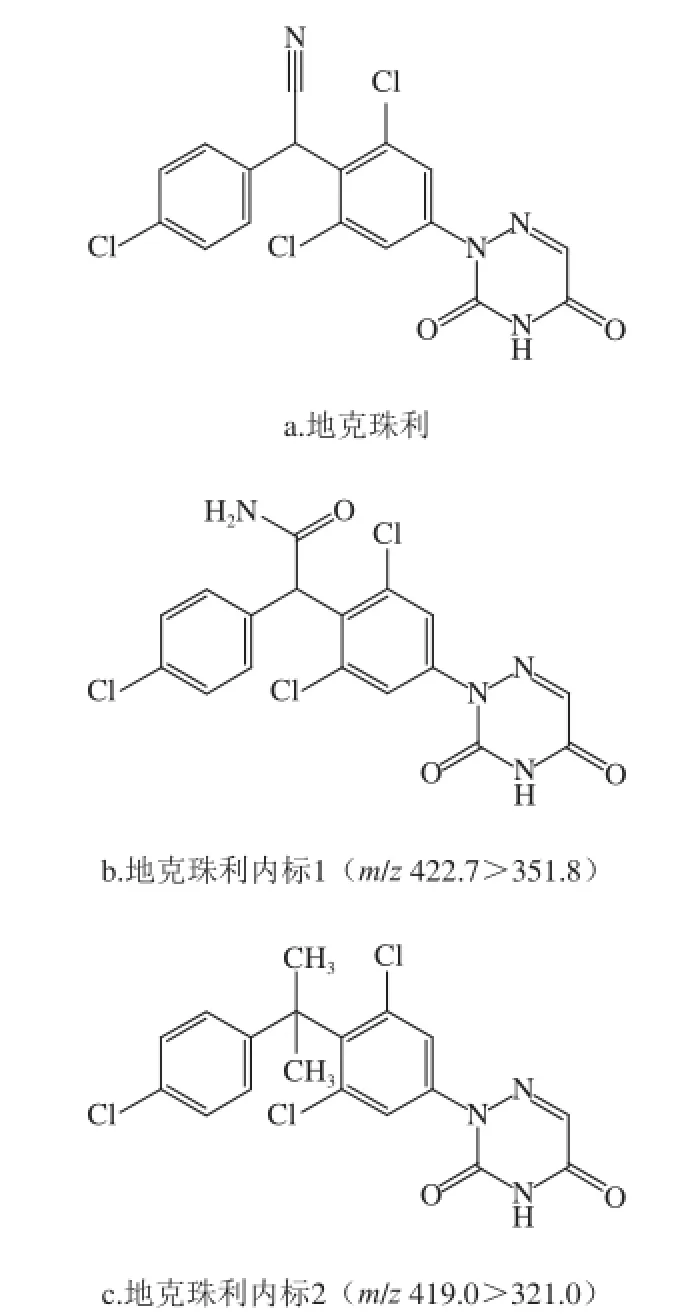
图5 地克珠利及其内标结构Fig.5 Structures of diclazuril and its internal standard
地克珠利内标1(m/z 422.7>351.8)结构如图5b所示,虽然内标1和地克珠利的化学结构比较相似,但其化学性质仍然存在差异。内标1的极性比地克珠利大,在色谱柱上的保留时间与地克珠利相差较大,以水产品为基质进行添加回收率实验,效果并不理想。实验选择Diclazuril methyl作为内标(图5c)进行实验验证。结果表明,Diclazuril methyl化学结构及性质与地克珠利相似,色谱保留时间及提取回收率均比较接近,通过反复实验验证,选择该物质作为内标进行添加回收率实验,可以取得较好的实验效果。
2.3.4 标准溶液的配制
地克珠利的化学性质几乎不溶于水,微溶于乙醇、乙醚,溶于N,N-二甲基甲酰胺、二甲基亚砜和四氢呋喃。实验发现,地克珠利在甲醇和乙腈中的溶解性较差,因此在配制标准储备液时,需先用N,N-二甲基甲酰胺将其溶解,再用甲醇稀释效果较理想。在配制地克珠利标准储备液时,大多数使用N,N-二甲基甲酰胺的量较大,本实验发现,先用1 mL N,N-二甲基甲酰胺溶解地克珠利,再加入甲醇定容,既能将地克珠利溶解,又能避免大量使用N,N-二甲基甲酰胺对质谱系统造成的损害。
2.3.5 定容溶液的选择
地克珠利几乎不溶于水,因此定容溶剂中水相所占比例对其灵敏度和回收率有至关重要的影响。分别实验了5%、50%、80%、100%甲醇溶液作为定容溶剂对测定结果的影响,结果表明,随着有机相比例的加大,灵敏度也随之提高,二者呈正相关。但定容溶剂采用100%甲醇,会导致峰形变差。经过前处理的样品如果用水相比例较高的溶液定容,因溶解性的原因也会导致其回收率大幅降低。综合考虑灵敏度和峰形的影响,最终决定采用80%甲醇溶液作为定容溶剂。
2.3.6 质谱条件的优化

图6 地克珠利的同位素峰质谱图Fig.6 Isotope peak spectrum of diclazuril
地克珠利及其内标在负离子模式下解离生成(M-H-)。分别对喷雾电压、鞘气、辅助气、碰撞能量等质谱参数进行优化。按照欧盟委员会2002/657/EC[25]对残留鉴定的技术文件规定,采用高效液相色谱-串联质谱法判定动物源性食品中的禁用化合物必须获得4 个鉴定分,即1 个母离子为1.0分,1 个子离子为1.5 分。对于高效液相色谱-串联质谱而言,1 个母离子和2 个碎片离子即可满足定性要求。但对于地克珠利而言,只生成1 个碎片离子。由于地克珠利分子结构中包含3 个氯分子,氯在自然界中有两个同位素35Cl和37Cl。地克珠利在负离子模式下可监测到分子离子峰m/z 411、409、407、405(图6),分别代表氯同位素37Cl3、35Cl37Cl2、35Cl237Cl和35Cl3形态的地克珠利。m/z 411、409、407、405在串联质谱模式下的碎片离子分别为m/z 340、338、336、334。根据天然同位素所占比例,地克珠利包含1.4%37Cl3、13.3%35Cl37Cl2、41.7%35Cl237Cl、43.5%35Cl3。
欧盟委员会2002/657/EC决议一方面它允许使用同位素峰,另一方面它要求不能所有的同位素碎片源于同一分子。地克珠利只产生1个碎片离子,只能选择同位素峰来满足判定要求。因此实验选择丰度最高的m/z 405 和m/z 407两个离子为母离子,以各自的子离子m/z 334和m/z 336作为子离子,共获得5 个确证分,符合欧盟对残留物的确证检测要求。m/z 407、405具有相同的丰度,本实验以m/z 407>336和m/z 405>334作为定性离子对,以m/z 407>336作为定量离子对。
2.3.7 色谱条件的优化
地克珠利采用负离子模式扫描,因此流动相的选择对其峰形及灵敏度有较大的影响。实验分别比较了乙酸铵-甲醇、乙酸铵-乙腈、甲酸-甲醇作为流动相,并实验了不同的梯度条件。结果表明,采用乙酸铵-甲醇作为流动相,在负离子扫描模式下,既有较高的灵敏度,又能获得良好的峰形。而有机相采用乙腈,其峰形会变差,且灵敏度也不及甲醇。水相采用0.1%甲酸,峰形也会变差,且在负离子扫描模式下,其灵敏度会降低约31%~49%。色谱柱分别实验了Waters XTerra C18(2.1 mm×150 mm,3.5 μm)和Agilent XDB C18(2.1 mm×150 mm,5 μm)及Venusil ASB C18(2.1 mm×150 mm,5 μm)3 种色谱柱,结果表明,Waters XTerra C18(2.1 mm×150 mm,3.5 μm)峰形尖锐、对称,分离效果最好。
3 结 论
通过乙腈提取样品中的地克珠利残留量,无水硫酸钠脱除水分,正己烷去脂,基质分散固相萃取净化,以及优化高效液相色谱及质谱条件,建立了一种测定鱼体中地克珠利残留量的方法。该方法前处理简单,无需固相萃取柱净化,降低了成本,准确度高、重复性好,是一种简便、快速、高效的测定方法,适用于鱼体中地克珠利残留量的测定,同时也为制定鱼体中地克珠利的MRLs提供了技术支持。
[1] 杨丽萍, 高淑霞, 张秀玲, 等.HPLC 法检测家兔血浆中地克珠利含量[J].中国兽药杂志, 2011, 45(10): 25-27.DOI:10.3969/ j.issn.1002-1280.2011.10.009.
[2] 赵岳, 沈建忠, 程林丽, 等.超高效液相色谱-串联质谱法测定鸡饲料中地克珠利的含量[J].中国饲料, 2012(3): 36-39.DOI:10.3969/ j.issn.1004-3314.2012.03.012.
[3] 罗浩师, 张丽芳, 薛飞群.高效液相色谱-串联质谱法测定鸡脂肪中地克珠利残留量[J].中国家禽, 2012, 34(20): 14-17.DOI:10.3969/ j.issn.1004-6364.2012.20.004.
[4] Commission Implementing Regulation (EU) No 115/2013[S/OL].http://eur-lex.europa.eu/legal-content/EN/TXT /?qid=1440748234917 &uri=CELEX:32013R0115.
[5] Codex Alimentarius Commission[S/OL].http://ftp.fao.org/codex/ weblinks/MRL2_e _2012.pdf.
[6] European Medicines Agency.European public MRL assessment report (EPMAR) Diclazuril (Rabbits)[R/OL].http://www.ema.europa.eu/docs/en_GB/document library/Maximum Residue Limits-Report/2014/02/WC500161938.pdf.
[7] 农业部.中华人民共和国农业部公告第235号[B/OL].http://yz.hzagri.gov.cn/uploadFiles/2005-10/1130221564406.doc.
[8] 刘永涛, 艾晓辉, 李乐, 等.超高效液相色谱法测定鱼体组织中地克珠利残留量[J].分析实验室, 2014, 33(4): 420-423.DOI:10.13595/ j.cnki.issn1000-0720.2014.0095.
[9] BLANCHFLOWER W J, HUGHES P J, CANNAVAN A, et al.Determination of diclazuril in avian feed and premixes with gaschromatography mass-spectrometry[J].Journal of AOAC International,1994, 77(5): 1061-1065.
[10] 施祖灏, 朱良强, 卢运站, 等.鸡组织中地克珠利和妥曲珠利残留HPLC检测方法的建立[J].中国兽医学报, 2009, 29(1): 79-81; 109.
[11] 董静, 宫小明, 张立, 等.QuEChERS-高效液相色谱法同时检测动物组织中的克球酚、地克珠利和磺胺类药物残留量[J].中国卫生检验检疫杂志, 2008, 11(1): 26-28.DOI:10.3969/ j.issn.1004-8685.2008.01.011.
[12] 宫小明, 孙军, 董静, 等.高效液相色谱-串联质谱法测定猪肉中的阿维菌素类、地克珠利、妥曲珠利及其代谢物残留[J].色谱,2011(3): 217-222.DOI:10.3724/SP.J.1123.2011.00217.
[13] 张涛, 张丽芳, 江善祥.液相色谱-串联质谱法测定鸡蛋中地克珠利的残留量[J].安徽农业科学, 2009, 37(14): 6314-6316.DOI:10.3969/ j.issn.0517-6611.2009.14.005.
[14] 张涛, 张丽芳, 薛飞群.液相色谱-串联质谱法测定鸡肝脏和肌肉中地克珠利残留量[J].中国农学通报, 2010, 26(15): 1-6.
[15] LEEN M, ELS D, CARLOS V P.Determination of the coccidiostat diclazuril in poultry feed and meat by liquid chromatography-tandem mass spectrometry[J].Analytica Chimica Acta, 2005, 529: 229-234.DOI:10.1016/j.aca.2004.09.088.
[16] ESTELLE D C, MELAINE B, BRIGITTE R, et al.Validation of a multi-residue liquid chromatography-tandem mass spectrometry confirmatory method for 10 anticoccidials in eggs according to Commission Decision 2002/657/EC[J].Journal of Chromatography A,2009, 1216: 8149-8157.DOI:10.1016/j.chroma.2009.04.048.
[17] MALGORZATA O, TERESA S J, PIOTR J.Multi-residue confirmatory method for the determination of twelve coccidiostats in chicken liver using liquid chromatography tandem mass spectrometry[J].Journal of Chromatography A, 2009, 1216: 8141-8148.DOI:10.1016/j.chroma.2009.04.097.
[18] SZILARD N, LAJOS D, TAMAS R, et al.Development and validation of a liquid chromatographic-tandem massspectrometric method for determination of eleven coccidiostats in milk[J].Food Chemistry,2012, 133: 536-543.DOI:10.1016/j.foodchem.2012.01.022.
[19] AI Lianfeng, SUN Hanwen, WANG Fengchi, et al.Determination of diclazuril, toltrazuril and its two metabolites in poultry tissues and eggs by gel permeation chromatography-liquid chromatography-tandem mass spectrometry[J].Journal of Chromatography B, 2011, 879: 1757-1763.DOI:10.1016/j.jchromb.2011.04.021.
[20] BROEKAERT N, van PETEGHEM C, DAESELEIRE E.Development and validation of an UPLC-MS/MS method for the determination of ionophoric and synthetic coccidiostats in vegetables[J].Analytical and Bioanalytical Chemistry, 2011, 401: 3335-3344.DOI:10.1007/s00216-011-05433-1.
[21] CRONLY M, BEHAN P, FOLEY B, et al.Determination of eleven coccidiostats in animal feed by liquidchromatography-tandem mass spectrometry at cross contamination levels[J].Analytica Chimica Acta,2011, 700: 26-33.DOI:10.1016/j.aca.2010.11.001.
[22] 河北出入境检验检疫局.SN/T 2318—2009 动物源性食品中地克珠利、妥曲珠利、妥曲珠利亚砜和妥曲珠利砜残留量的检测: 高效液相色谱-质谱/质谱法[S].北京: 中国标准出版社, 2009.
[23] 宫小明, 杨丽君, 王洪涛, 等.液相色谱-高分辨质谱测定动物源性食品中均三嗪类药物残留[J].安徽农业科学, 2015, 43(28): 114-117;121.DOI:10.13989/j.cnki.0517-6611.2015.28.046.
[24] 木合他拜尔, 严华, 徐姗, 等.QuEChERS-超高效液相色谱-高分辨串联质谱技术检测鸡肉中6 种抗球虫药物[J].色谱, 2015, 33(11): 1199-1204.DOI:10.3724/SP.J.1123.2015.06016.
[25] Commission Decision No 2002/657/EC[S/OL].http://eur-lex.europa.eu/legal-content/EN/TXT/PDF/?uri=CELEX:32002D0657&rid=1.
Determination of Diclazuril in Fish by High Performance Liquid Chromatography-Tandem Mass Spectrometry with Dispersive Solid Phase Extraction
XING Lihong, SUN Weihong*, SUN Xiaojie, LI Zhaoxin, GUO Jiangtao
(Yellow Sea Fisheries Research Institute, Key Laboratory of Testing and Evaluation for Aquatic Product Safety and Quality,Ministry of Agriculture, Laboratory of Quality and Safety Risk Assessment for Aquatic Products (Qingdao), Ministry of Agriculture,Chinese Academy of Fishery Sciences, Qingdao 266071, China)
A method has been developed for the determination of diclazuril in fish by high performance liquid chromatography-tandem mass spectrometry (HPLC-MS/MS) with dispersive solid phase extraction.Samples were dehydrated with anhydrous sodium sulfate, and extracted with acetonitrile.Then the extracts were concentrated under vacuum condition.The samples were degreased with hexane and cleaned up by dispersive solid phase extraction, analyzed by HPLC-MS/MS and quantified with internal standard method.Electrospray ionization was applied and operated in the negative ion mode.The calibration curve showed good linearity between peak area and the concentration of diclazuril in the range of 1-100 μg/L with a correlation coefficient over 0.999.The average recoveries from spiked sample at the three concentrations of 1.00, 5.00 and 50.0 μg/kg ranged from 95.4% to 108% with intra- and inter-batch relative standard deviations below 15%.The limit of detection (LOD) for diclazuril was 0.50 μg/kg.This efficient and simple method could be used to identify and quantify diclazuril in fish with satisfactory sensitivity and repeatability.
dispersive solid phase extraction; high performance liquid chromatography-tandem mass spectrometry (HPLC-MS/MS); fish; diclazuril
10.7506/spkx1002-6630-201614031
O657.63
A
1002-6630(2016)14-0174-06
邢丽红, 孙伟红, 孙晓杰, 等.分散固相萃取净化-高效液相色谱-串联质谱法测定鱼体中地克珠利残留量[J].食品科学,2016, 37(14): 174-179.DOI:10.7506/spkx1002-6630-201614031. http://www.spkx.net.cn
XING Lihong, SUN Weihong, SUN Xiaojie, et al.Determination of diclazuril in fish by high performance liquid chromatography-tandem mass spectrometry with dispersive solid phase extraction[J].Food Science, 2016, 37(14): 174-179.(in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201614031. http://www.spkx.net.cn
2015-11-15
2015年国家水产品质量安全风险评估项目(GJFP201501001);国家自然科学基金青年科学基金项目(21207162)
邢丽红(1981—),女,助理研究员,硕士,主要从事水产品质量安全检测研究。E-mail:xinglh@ysfri.ac.cn
*通信作者:孙伟红(1977—),女,高级工程师,博士,主要从事水产品质量安全及风险评估研究。E-mail:sunwh@ysfri.ac.cn

