干扰素-α治疗慢性丙型肝炎的疗效预测模型
陆晓梅,徐 银,黄 鹏,陈明珠,王 洁,苏 静,喻荣彬
(1.南京医科大学公共卫生学院 流行病学系,江苏 南京,211166; 2.南京医科大学护理学院,江苏 南京,210029)
干扰素-α治疗慢性丙型肝炎的疗效预测模型
陆晓梅1,徐银1,黄鹏1,陈明珠1,王洁2,苏静1,喻荣彬1
(1.南京医科大学公共卫生学院 流行病学系,江苏 南京,211166; 2.南京医科大学护理学院,江苏 南京,210029)
摘要:目的评价普通干扰素-α联合利巴韦林治疗慢性丙型肝炎的疗效,探讨其影响因素并建立预测模型。方法采用前瞻性队列研究,对句容市人民医院慢性丙型肝炎住院患者进行普通干扰素-α联合利巴韦林治疗48周并随访至治疗结束后24周,观察治疗不良反应及应答情况。采用Logistics回归分析其影响因素,并运用分类树建立预测模型。结果216例慢性丙型肝炎患者完成了治疗周期及随访,其持续病毒学应答率(SVR)为61.2%。SVR组与非SVR组基线病毒载量、白蛋白、血小板计数、甲胎蛋白及血糖存在显著差异。多因素Logistics回归分析显示,基线病毒载量高(≥106 IU/mL)者或血糖含量较高者更不易获得SVR。血小板计数较高者容易获得SVR(OR=1.02,95%CI=1.00~1.04)。SVR预测模型显示相对基线血小板计数低(<140×109/L)者,血小板计数高者获得SVR的可能性增加17.9%。高血小板计数者中,基线HCV RNA低者(<106 IU/mL)更易获得SVR(79.7%:57.9%)。治疗过程中不良反应有早期感冒样症状(51.9%)、胃肠道反应(14.8%)、血象的改变(58.8%)、血糖升高(18.1%)、精神症状(8.8%)、甲状腺功能亢进(1.4%)、皮疹(14.8%)、脱发(6.5%)。结论普通干扰素联合利巴韦林治疗慢性丙型肝炎疗效尚可,不良反应的程度较轻。基线病毒载量、血糖及血小板计数可能是丙型肝炎治疗效果的影响因素。
关键词:慢性丙型肝炎; 干扰素; 持续病毒应答; 不良反应
丙型肝炎是由丙型肝炎病毒(HCV)感染所致的血源性传播疾病,目前呈现全球流行趋势。最新统计数据[1]显示全球HCV感染率约为1.6%,中国成人HCV感染率高达1.3%,属于HCV中高度感染区。HCV感染后易慢性化,进而发展为肝硬化以及肝细胞癌的比例较高[2]。干扰素-α(IFN-α)是抗HCV的有效药物,但仍超过50%的患者无法达到病毒持续应答(SVR)[3]。干扰素治疗存在较多的副作用,如流感样症候群、疲劳、骨髓抑制(贫血、白细胞减少、中性粒细胞减少、血小板计数下降等)、诱发自身抗体(抗核抗体阳性、抗甲状腺抗体阳性)、神经精神异常等[4-7]。本研究采用前瞻性队列随访设计,观察普通干扰素-α联合利巴韦林的治疗效果以及不良反应的发生情况,并进一步分析其影响因素,建立治疗结局预测模型,现报告如下。
1资料与方法
1.1一般资料
选取句容市人民医院感染科2012年3月—2013年10月临床治疗的慢性丙型肝炎患者,符合2004年《丙型肝炎防治指南》中慢性丙型肝炎的临床诊断标准,并签署知情同意书。纳入标准:血清HCV抗体阳性超过6个月,HCV RNA持续阳性,且首次接受抗病毒治疗。排除标准:① 年龄<18周岁; ② 合并HAV、HBV、HEV及HIV感染; ③ 合并肿瘤及其他自身免疫性疾病; ④ 合并酒精性肝病、药物性肝病等肝损害性疾病、妊娠或哺乳期妇女; ⑤ 合并甲亢、抑郁症、癫痫、严重心肾疾病,器官移植者等。
1.2治疗方法
根据患者的体质量、耐受程度、年龄等给予IFN-α 3~5 μmol/L,隔天1次,皮下注射,联合口服利巴韦林(RBV) 800~1 000 mg/d,疗程为48周,停药随访24周。停药原则参照标准指南[8]。
1.3疗效评价
1.3.1疗程观察:治疗前,对所有研究对象进行流行病学问卷调查,包括年龄、性别、职业、家族史等可能的HCV暴露接触史。血、尿、粪常规、肝肾功能、HCV RNA、甲状腺功能及血糖等。治疗开始后4、8、12、24、48、72周随访上述指标。
1.3.2不良反应观察项目:① 早期感冒样症状; ② 食欲下降、恶心、呕吐等胃肠道反应; ③ 血常规异常:白细胞、中性粒细胞、血小板下降; ④ 精神症状:主要表现为兴奋、失眠、头晕、抑郁、注意力不集中等; ⑤ 甲状腺疾病:甲状腺功能减退或亢进; ⑥ 脱发及皮肤情况; ⑦ 糖代谢异常。
1.3.3疗效评估:采用2004年《中国丙型肝炎防治指南》中疗效判定标准。早期病毒学应答(EVR):治疗12周后HCV RNA下降2个对数级以上或低于检测下限。持续病毒性应答(SVR):治疗48周,且随访24周后HCV RNA低于检测下限。
1.4统计学方法
采用STATA 12.0统计学软件,计量资料用均数±标准差表示,采用t检验、单因素方差分析;计数资料用率表示,采用χ2检验。治疗结局与变量之间的关联分析采用单因素及多因素Logistics回归分析。持续病毒应答预测模型及变量筛选采用分类树法。P<0.05为差异有统计学意义。
2结果
2.1人口学特征
本研究共纳入216例完成治疗及随访的慢性丙型肝炎患者,其中持续应答者133例 (61.2%)。持续应答组与非持续应答组基线病毒载量、白蛋白、血小板计数、甲胎蛋白及血糖存在显著差异。见表1。持续应答组中基线病毒载量≥106IU/mL者比例、甲胎蛋白及血糖显著低于未达到持续应答组(P=0.033、0.002、0.002),而基线白蛋白和血小板计数持续应答组显著高于非持续应答组(P=0.001、0.037)。
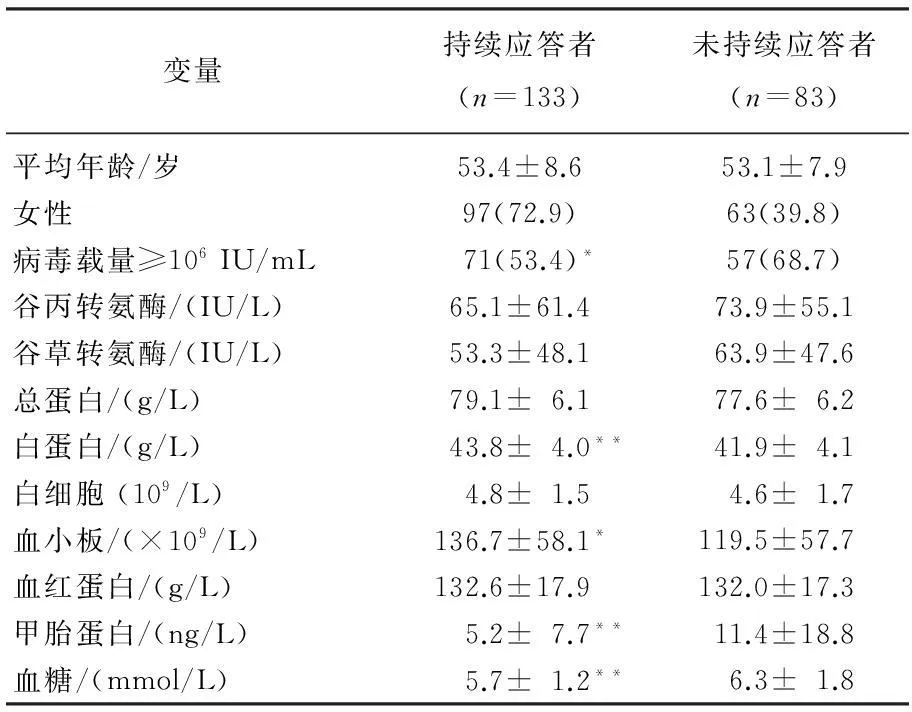
表1 慢性丙肝治疗不同结局组间人口学特征及基线变量比较[n(%)]
与未持续应答者比较,*P<0.05,**P<0.01。
2.2持续病毒学应答影响因素
单因素Logistics回归分析显示,基线病毒载量、白蛋白量、血小板计数、甲胎蛋白及血糖量可影响丙肝抗病毒治疗结局。调整这些因素后分析显示,基线病毒载量≥106IU/mL者或血糖含量较高者更不易获得持续应答,而血小板计数较高者容易获得持续应答(OR=1.02,95% CI为1.00~1.04),见表2。
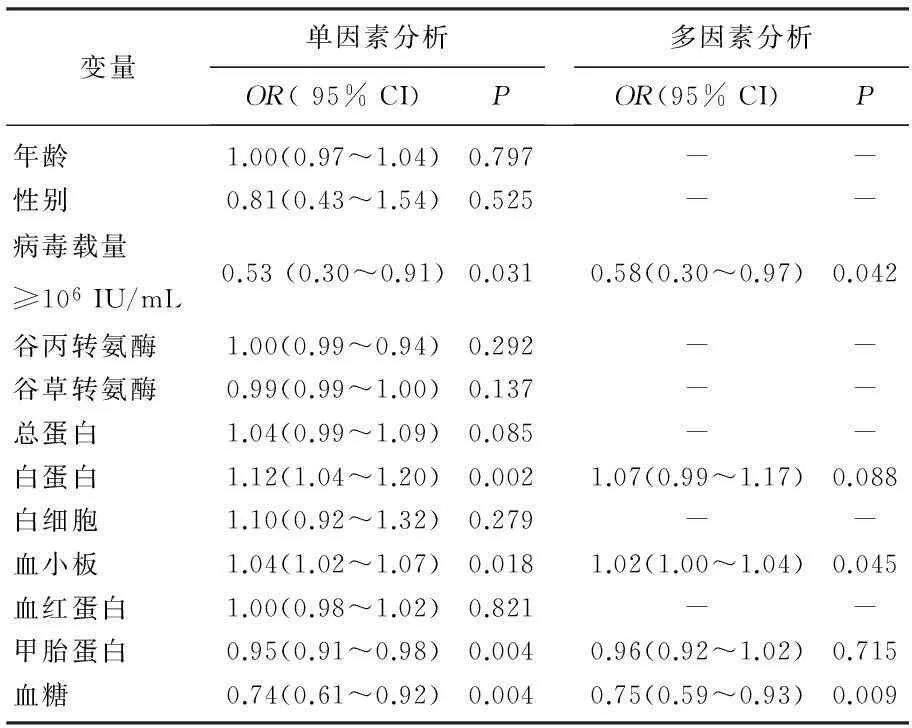
表2 丙型肝炎治疗持续应答影响因素分析
2.3基线病毒载量影响丙型肝炎病毒清除
根据基线病毒载量是否大于106IU/mL,将研究对象分成2组。观察2组治疗后4、8、12、24、48周及随访24周HCV RNA阴转率差别,结果显示低基线病毒载量组HCV RNA阴转率在各时间点上显著高于高病毒载量组(P<0.05)。基线病毒载量对持续病毒应答产生有重要影响。见图1。
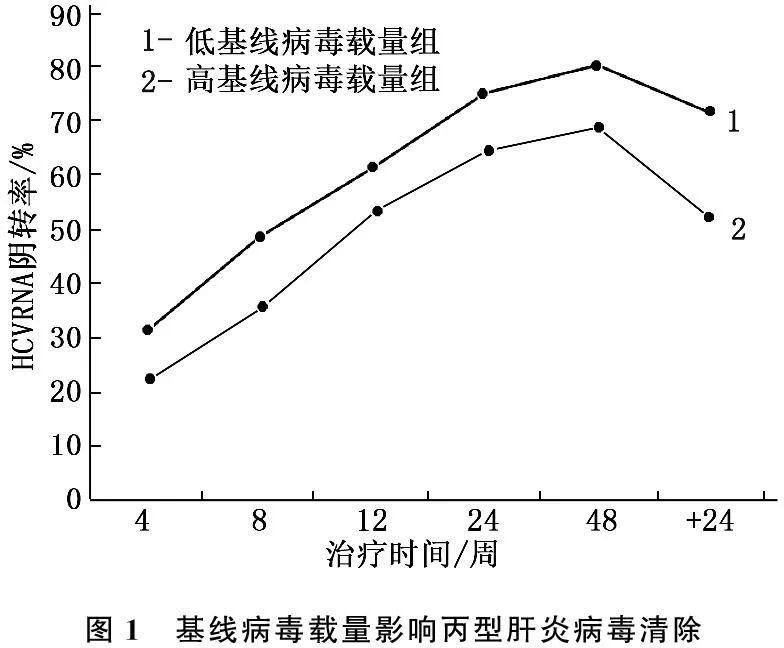
图1 基线病毒载量影响丙型肝炎病毒清除
2.4预测治疗结局模型
对数据进一步挖掘,建立持续病毒应答预测模型。选择基线血小板计数和病毒载量2个参数,将研究对象分为3个亚组。相对血小板计数<140×109/L患者,基线血小板计数高者获得SVR的可能性更大(分别为67.9%和50.0%)。经血小板计数分组后,基线HCV RNA低者(<106IU/mL)更易获得SVR(分别为79.7%和57.9%)。该模型的灵敏度和特异度分别为79.5%和70.2%。
2.5不良反应的观察
本组病例观察发现,主要的不良反应有早期感冒样症状、胃肠道反应、血象的改变、血糖升高、精神症状、甲状腺功能亢进、皮疹、脱发等,见表3。血象改变发生率最高,其中127例患者均有不同程度白细胞、中性粒细胞、血小板计数下降,其中白细胞减少112例(51.9%),中心粒细胞减少120例(55.6%),血小板减少98例(45.4%)。主要发生于用药早期,第2周明显下降,12周开始回升,治疗结束时可基本恢复到治疗前水平。18.1%的患者发生血糖值升高,且治疗结束时血糖≥7.00者由原来的14例上升为25例。3例因为发生甲亢而终止治疗,均为女性,分别发生于用药后第6、8、9个月。
3讨论
慢性丙型肝炎治疗是世界性难题,目前发达国家及国内部分发达地区已经推广聚乙二醇干扰素,效果比普通干扰素好,但价格昂贵,难以在经济条件不佳的地区普遍应用[9]。因此,在国内许多资源有限的地区,普通干扰素不可替代,研究普通干扰素的意义仍然重大。本研究纳入216例普通干扰素-α治疗慢性丙型肝炎患者,且进行前瞻性队列随访72周。本研究中患者全部来自于句容地区既往有偿献血人群,这部分人群大多是在上世纪90年代初通过有偿献血方式感染HCV,感染时间较明确,病程均为20年左右,大多数人未患有其他免疫性疾病,因此相对于静脉注射吸毒、肾透析等HCV高感染人群来说,该人群是研究丙肝治疗效果最好人群样本。另外,由于治疗费用较高,药物副反应大,且随访时间比较长,失访难以避免。但该人群长期居住在户籍地,流动性小,联系便捷,有效地降低了失访率。
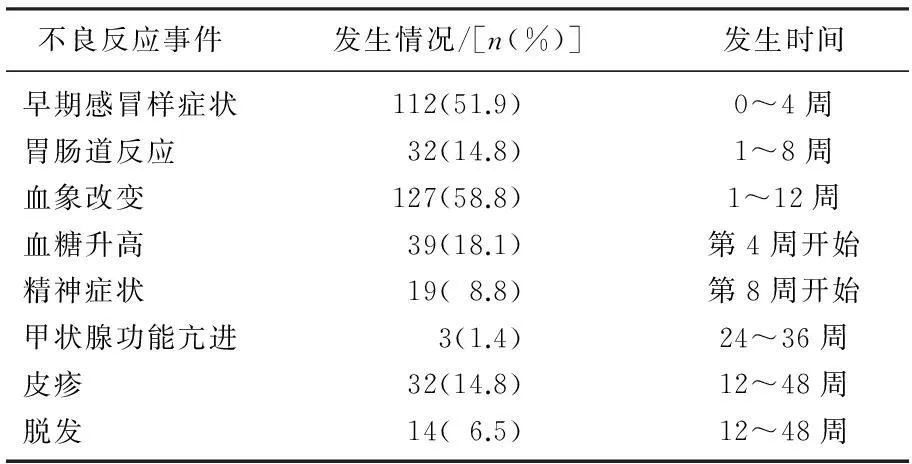
表3 丙型肝炎治疗不良反应发生情况
本研究结果显示,干扰素联合利巴韦林的治疗方案耐受性和安全性良好,大部分患者可以按预定方案完成治疗,不良反应比较轻微,而且这些副作用在患者停药之后都能迅速恢复。其中216例治疗患者最终达到持续性病毒学应答者有133例,持续应答率为61.6%,与国内其他报道一致[10]。本研究发现患者具有较低的基线病毒载量、低血糖及高血小板计数可能更易获得SVR,这与之前国内外的一些研究结果相一致[16-17]。分类树模型预测提示基线血小板计数较高者(≥140×109/L)较低者SVR率增加17.9%。高血小板计数者中,基线病毒载量较低者获得SVR的可能大大增加。这些均提示在抗病毒治疗前尽量增加患者血小板计数,降低病毒载量。但本研究模型的建立仍然具有局限性,灵敏度和特异度不高。丙肝治疗效果影响因素众多,本研究只针对治疗中常规检测的生化指标数据进行了分析,而诸如病毒基因型以及宿主IL28B基因多态性等因素也对丙肝治疗效果起着重要作用[18-19],但本研究未纳入,进而降低了预测模型效果。
本次治疗过程中血细胞下降发生率最高,58.8%的患者均有不同程度的白细胞、中性粒细胞、血小板计数下降,主要发生于用药早期,第2周明显下降,12周开始回升,治疗结束时可基本恢复到治疗前水平。其发生机制主要由于IFN有轻至中度的骨髓抑制,可逆性抑制粒系晚期前体细胞的增殖;使血小板生成素转录受阻,滞留于毛细血管引起血小板减少[11-12]。值得注意的是,本次治疗中18.1%的患者发生血糖值升高,且治疗结束时血糖≥7.00者由原来的14例上升为25例。更为严重的是有3例女性患者发生甲亢停止治疗。IFN治疗后发生糖代谢紊乱甚至糖尿病近来已有报道[13],但发生率较低。说明IFN治疗有可能会导致胰岛β细胞损伤,降低了组织利用胰岛素。因此,在治疗前要详细了解患者的背景,对于年龄偏大、肥胖、有家族史者要密切注意血糖、尿糖等变化。IFN治疗引起甲状腺功能紊乱的报道多发生于治疗的中后期,且认为女性是诱发甲状腺炎的危险因素[14-15]。本研究异常者均为女性,与报道一致。医师应密切观察患者临床表现,结合甲状腺功能指标,在内分泌科医生指导下,决定用药。
参考文献
[1]Gower E,Estes C,Blach S,et al.Global epidemiology and genotype distribution of the hepatitis C virus infection[J].J Hepatol,2014,61(1 Suppl):45-57.
[2]Lavanchy D.The global burden of hepatitis C[J].Liver Int,2009,29:4-81.
[3]Muir AJ.The rapid evolution of treatment strategies for hepatitis C[J].Am J Gastroenterol,2014,109(5):28-635.
[4]Sulkowski M S,Cooper C,Hunyady B,et al.Management of adverse effects of Peg-IFN and ribavirin therapy for hepatitis C[J].Nat Rev Gastroenterol Hepatol,2011,8(4):212-223.
[5]McHutchison J G,Lawitz E J,Shiffman M L,et al.Peginterferon alfa-2b or alfa-2a with ribavirin for treatment of hepatitis C infection[J].N Engl J Med,2009,361(6):580-593.
[6]陈吐芬,周勤,江晓静,等.干扰素联合利巴韦林治疗丙型肝炎不良反应的发病机制及处理[J].肝脏,2014(7):543-548.
[7]邓培媛,裴振峨,朱素君,等.干扰素不良反应综述[J].临床药物治疗杂志,2003,1(4):57-59,32.
[8]中华医学会肝病学分会,传染病与寄生虫病学分会.丙型肝炎防治指南[J].临床肝胆病杂志,2004,20(4):197-203.
[9]Manns M P,McHutchison J G,Gordon S C,et al.Peginterferon alfa-2b plus ribavirin compared with interferon alfa-2b plus ribavirin for initial treatment of chronic hepatitis C:a randomised trial[J].Lancet,2001,358(9286):958-965.
[10]赵文莉,胡勤明,王保春,等.干扰素联合利巴韦林治疗丙型肝炎临床疗效分析[J].中国药师,2009,12(5):639-640.
[11]曹学琳,孔晓清,闫凤英,等.干扰素不良反应机制[J].生物医学工程与临床,2010,14:340-342.
[12]吴金金,李成忠.干扰素不良反应及其处理[J].世界临床药物,2009,30(6):334-338.
[13]戴琳,周复元.干扰素治疗慢性病毒性肝炎致糖尿病2例报告[J].第一军医大学学报,2001,21(10):752-752.
[14]桑艳红.干扰素-α所致甲状腺功能异常6例诊治分析[J].中国现代医生,2010,48(21):121-122.
[15]黄雁翔,陈新月,马丽娜,等.慢炎抗病毒治疗患者甲状腺功能异常及其影响因素[J].中华肝脏病杂志,2012,20(3):216-220.
[16]Kurosaki M,Tanaka Y,Nishida N,et al.Pre-treatment prediction of response to pegylated-interferon plus ribavirin for chronic hepatitis C using genetic polymorphism in IL28B and viral factors[J].J Hepatol,2011,54(3):439-448.
[17]Romero-Gómez M,Fernández-Rodríguez C M,Andrade R J,et al.Effect of sustained virological response to treatment on the incidence of abnormal glucose values in chronic hepatitis C[J].J Hepatol,2008,48(5):721-727.
[18]Tanaka Y,Nishida N,Sugiyama M,et al.Genome-wide association of IL28B with response to pegylated interferon-[alpha] and ribavirin therapy for chronic hepatitis C[J].Nat Genet,2009,41(10):1105-1109.
[19]Wohnsland A,Hofmann WP,Sarrazin C.Viral determinants of resistance to treatment in patients with hepatitis C[J].Clin Microbiol Rev,2007,20(1):23-38.
收稿日期:2016-01-13
基金项目:国家自然科学基金面上项目(81473029,81273146); 江苏高校优势学科建设工程资助项目(PAPD)
通信作者:喻荣彬,E-mail:rongbinyu@njmu.edu.cn
中图分类号:R 512.6; R 453
文献标志码:A
文章编号:1672-2353(2016)15-005-04
DOI:10.7619/jcmp.201615002
Efficacy prediction model of interferon-α treatment for chronic hepatitis C
LU Xiaomei1,XU Yin1,HUANG Peng1,CHEN Mingzhu1, WANG Jie2,SU Jing1,YU Rongbin1
(1.Department of Epidemiology,School of Public Health of Nanjing Medical University,Nanjing,Jiangsu,211166; 2.Nuring College of Nanjing Medical University,Nanjing,Jiangsu,210029)
ABSTRACT:ObjectiveTo evaluate the curative effect of common interferon-α combined with ribavirin on the treatment of patients with chronic hepatitis C and to explore its influencing factors and establish the prediction model.MethodsThe patients with chronic hepatitis C were recruited from Jurong People′s Hospital.Prospective cohort study was used,and all the patients were treated with common interferon-α for 48 weeks,and were followed up at 24 weeks to observe the rate of sustained virological response (SVR) and adverse reactions.Effect factors were studied by Logistic regression analysis,and predication model was established by classification tree.ResultsTotally 216 patients completed the treatment and follow-up,and the SVR rate was 61.2%.There were significant differences in baseline viral load,albumin,platelet count,AFP (alpha fetoprotein) and blood glucose between SVR and non-SVR groups.Patients with higher baseline HCV RNA level (≥106 IU/mL) or blood glucose were less likely to get SVR.Patients with higher baseline platelet count (<140×109/L) were more likely to acquire SVR.The classification tree predication model of SVR showed that the probability of SVR increased by 17.9% in patients with higher baseline platelet count.In similar patients with high platelet count,those with lower baseline HCV RNA level (<106 IU/mL) were more likely to obtain SVR (OR=1.02,95%CI=1.00~1.04).Common adverse reactions were early flu-like symptoms (51.9%),gastrointestinal tract reaction (14.8%),hemogram changes (58.8%),hyperglycemia (18.1%),psychiatric symptoms (8.8%),hyperthyroidism (1.4%),rashes (14.8%) and alopecia (6.5%).ConclusionThe baseline HCV RNA level,blood glucose and platelet count may be associated with SVR of chronic hepatitis C.
KEYWORDS:chronic hepatitis C; interferon; sustained virological response; adverse reactions

