猪孕烷X受体基因真核表达载体的构建与表达
谢 旖,周 煜,黄卫梅,田亚南,文利新,邬 静
(湖南农业大学 动物医学院,湖南长沙 410128)
猪孕烷X受体基因真核表达载体的构建与表达
谢旖,周煜,黄卫梅,田亚南*,文利新,邬静
(湖南农业大学 动物医学院,湖南长沙 410128)
摘要:为构建猪的孕烷X受体(PXR)基因真核表达质粒,用RT-PCR技术从新鲜猪肝中扩增到猪孕烷X受体(pgPXR)基因,将其连接到真核表达载体pCI-neo 中,得到重组质粒pCI-pgPXR。对该重组质粒进行PCR、测序及酶切鉴定后,采用脂质体法将其转染到人肝癌细胞HepG2细胞,用RT-PCR和双荧光素酶检测系统进行鉴定。结果表明,猪孕烷X受体基因真核表达质粒pCI-pgPXR构建成功,可在HepG2细胞中表达,为猪孕烷X受体的药理学和毒理学研究奠定了基础。
关键词:孕烷X受体;质粒构建;真核表达
孕烷X受体(pregnane X receptor,PXR)为核受体超家族NRl Ⅰ亚家族成员,由Kliewer S A等[1]于1998年首次发现。PXR是一类配体依赖型转录因子,通过与位于某些基因上游的特异性PXR反应元件结合而调控基因表达[2-3]。
PXR的配体结合域(ligand binding domain,LBD)具有明显的种属差异,人和小鼠的LBD氨基酸序列仅80%相同,LBD序列的差异导致不同种属之间PXR配体激活的差异性。猪PXR(pgPXR)与人类PXR(hPXR)在蛋白序列上具有85%的同源性和95%的相似性,在配体结合上也具有较高的相似性,有研究发现pgPXR能被hPXR激动剂利福平(Rif)和贯叶金丝桃素激活,这表明猪可能是研究人类药物学和毒理学的最适当模型[4-5]。PXR与配体结合后能高效地参与调控异生代谢,在生理和病理过程中也起着重要作用,如炎症反应[6-7]。本试验旨在构建pgPXR的真核表达质粒并通过荧光素酶检测系统鉴定基因在真核细胞中的表达情况,为pgPXR的研究及其激活剂的高通量筛选奠定基础。
1 材料与方法
1.1材料
1.1.1质粒、菌株及细胞株pGL-3A4-Luc报告质粒(图1)和pCI-neo真核表达质粒由美国德克萨斯农工大学赠予;DH5α菌株和HepG2细胞系均由动物毒物学实验室保存。
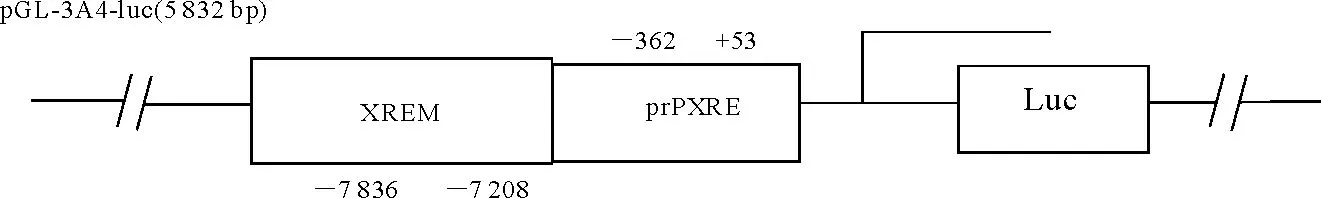
图1 pGL-3A4-Luc质粒结构示意图
1.1.2主要试剂EcoRⅠ、SalⅠ 、TaqDNA 聚合酶 、T4 DNA 连接酶、质粒提取试剂盒及凝胶回收试剂盒,TaKaRa公司产品;Lipofectine 2000和Trizol,美国Invitrogen 公司产品;RevertAidTM第1链cDNA合成试剂盒,Thermo scientific公司产品;胎牛血清、DMEM高糖培养基,Hycolone公司产品;DNA 凝胶回收试剂盒、PCR 产物回收试剂盒,Qiagen公司产品 ;双荧光素酶检测试剂盒,Promega公司产品。
1.2方法
1.2.1引物设计与合成根据GenBank上的pgPXR序列(NM-001038005),应用Premier6.0软件设计并合成引物,引物5′端分别添加了EcoRⅠ和SalⅠ酶切位点(下划线部分),引物由上海生工生物工程技术服务有限公司合成,用于pgPXR基因的扩增,预期扩增大小1 266 bp。引物序列如下:
FP:5′-GCGGAATTCGCCACCATGCAATGCAATGAAACAGACTCCA-3′;
RP:5′-GCGGTCGACTCAGCTTTCTGTGA- TGCTGAATAAC-3′。
1.2.2pgPXR基因的克隆从新鲜猪肝中提取总RNA,反转录后PCR扩增目的序列,反应体系20 μL;PCR程序为:94 ℃ 3 min;94 ℃ 20 s,59 ℃ 20 s,72 ℃ 1 min;共35个循环;最后72 ℃ 7 min。PCR产物用10 g/L琼脂糖凝胶电泳回收。
1.2.3重组质粒pCI-pgPXR的构建及鉴定EcoRⅠ和SalⅠ 酶切pCI-neo与PCR扩增纯化的目的片段pgPXR(约为1 266 bp处的条带),酶切产物纯化后37 ℃过夜连接,并转化至感受态大肠埃希菌DH5α中,Amp抗性筛选后提取质粒,PCR、酶切和测序鉴定正确后命名为pCI-pgPXR,大量制备与纯化,测定质粒浓度,用于细胞转染。
1.2.4 脂质体LipofectineTM 2000 介导的DNA 转染和RT-PCR检测将构建的pCI-pgPXR重组质粒同pGL-3A4-Luc报告质粒一起用脂质体法转染HepG2细胞,转染5 h后用PXR诱导剂Rif(终浓度为5 μmol/L)处理细胞,培养48 h~72 h后收集细胞,进行RT-PCR检测。
1.2.5双荧光素酶报告基因检测HepG2细胞以2×105个/孔的密度接种于24孔细胞培养板中,用含有100 mL/L胎牛血清的DMEM进行培养,待细胞长至80%~90%汇合时转染细胞。设pCI-neo空载体,pGL-3A4-Luc报告质粒共同转染和pGL-3A4-Luc报告质粒单独转染为阴性对照(表1),转染5 h后加入Rif(终浓度为5 μmol/L),48 h后收集细胞进行荧光素酶活性检测。

表1 转染质粒分组
2 结果
2.1pgPXR基因的克隆与鉴定
按照1.2.1的方法将反转录产物用特异性引物进行PCR扩增,在1 266 bp处可见明显扩增条带(图2),结果与预期相符,表明成功获得目的序列。

M.DNA标准DL 2 000;A~C.pgPXR PCR扩增产物;D.阴性对照
M.DNA Marker DL 2 000;A-C.PCR products of pgPXR; D.Negative control
图2 pgPXR的PCR扩增
Fig.2PCR amplication of pgPXR gene
2.2重组质粒pCI-pgPXR的鉴定
菌液送至公司测序,测序结果显示,成功获得pgPXR编码序列(图3);按照1.2.2的方法对初步筛选为阳性的重组质粒用SalⅠ 和EcoRⅠ双酶切得到约5 454 bp和1 266 bp的2个片段(图4),酶切结果与预期相符,表明目的基因正确插入到真核表达载体pCI-neo上,重组质粒构建成功。
2.3RT-PCR检测
转染细胞总RNA反转录为cDNA,经PCR扩增后,产物经琼脂糖凝胶电泳,表达质粒pCI-pgPXR转染细胞组可见大小约为1 300 bp的条带,大小与目的基因相符,而pCI-neo空载体,pGL-3A4-Luc报告质粒共同转染细胞和pGL-3A4-Luc报告质粒单独转染细胞对照组均无反应条带,表明所转染的目的基因在HepG2细胞中得到有效转录(图5)。

图3 pCI-pgPXR质粒结构示意图

M.DNA标准DL 5 000;A.pCI-pgPXR/SalⅠ、EcoRⅠ双酶切;B.pCI-pgPXR
M.DNA Marker DL 5 000;A.pCI-pgPXR/SalⅠ andEcoRⅠ enzyme digestion;B.pCI-pgPXR
图4重组质粒pCI-pgPXR的酶切鉴定
Fig.4Identification of recombinant plasmid pCI-pgPXR by enzyme digestion

M.DNA标准DL 2 000; A.pCI-pgPXR重组质粒与pGL-3A4-Luc报告质粒组RT-PCR产物;B.pCI-neo与pGL-3A4-Luc报告质粒对照组RT-PCR 产物;C.pGL-3A4-Luc报告质粒对照组RT-PCR产物
M.DNA Marker DL 2 000;A.RT-PCR products of pCI-pgPXR and pGL-3A4-Luc;B.RT-PCR products of pCI-neo and pGL-3A4-Luc;C.RT-PCR products of pGL-3A4-Luc
图5重组质粒pCI-pgPXR在HepG2的RT-PCR检测
Fig.5RT-PCR of recombinant plasmid pCI-pgPXR in HepG2
2.4转染细胞双荧光素酶活性检测
3个组的细胞在加入Rif 48 h后进行荧光素酶活性检测,pCI-pgPXR与pGL-3A4-Luc共转细胞的荧光比值明显高于其他2个组,证明pCI-pgPXR成功转入HepG2细胞,并在HepG2细胞内获得短暂表达,Rif激活pgPXR对CYP3A4的诱导作用,使荧光素酶活性增强(图6)。

“*”表示差异显著(P<0.05)
" * " means significant difference(P<0.05)
图6荧光素酶活性检测
Fig.6Detection of luciferase activity
3 讨论
饲料中添加抗生素能促进动物生长、生产、预防动物疾病的能力,但抗生素在给人们带来巨大经济效益的同时也将带来负面影响,如药物残留问题。天然活性物质能增强动物免疫、促生长、抗氧化、改善动物生产性能,且无(低)残留,不易产生耐药性。
细胞色素酶(CYP)是Ⅰ相代谢酶,参与体内外源性物质的转化,也是药物代谢的关键酶,而利福平作为pgPXR的强效激动剂可激活细胞内的pgPXR、pgPXR与RXR结合形成异源二聚体后随即与CYP基因启动子区调控序列中特异性的应答元件结合,使其调控CYP酶(如CYP1A1、CYP1B1、CYP3A29 等)的表达,从而参与外源性和内源性化合物的代谢[8-9]。先前对药物代谢的研究主要用人孕烷X受体作为实验模型[10-11],而pgPXR基因与真核表达载体的构建为筛选可在猪体内激活pgPXR,并增加相关药物代谢酶活性的化合物提供可能。研究表明,pgPXR除参与药物代谢外,在类固醇激素代谢和血脑屏障功能的调节等方面也都发挥重要作用[12-13],pgPXR天然活性物质作为饲料添加剂可能会提高动物免疫和抗炎能力,改善动物的营养与健康。因此,对pgPXR天然活性物质的筛选是未来研究的重点。
基于以上目的,我们构建pgPXR的重组质粒,并将其转染至HepG2细胞,被利福平作用后转录激活呈现高表达,同时,试验中pgPXR mRNA的表达与PGL-3A4-Luc报告基因的诱导保持一致,表明pgPXR的荧光素酶检测系统构建成功,这为今后pgPXR天然活性物质的筛选研究奠定了基础。
参考文献:
[1]Kliewer S A,Moore J T,Wade L,et al.An orphan nuclear receptor activated by pregnanes defines a novel steroid signaling pathway[J].Cell,1998,92(1):73-82.
[2]梁海伟,郭宣麟.孕烷X受体的研究进展[J].生物技术通讯,2013,24(3):441-445.
[3]谭亲友,方平飞,李焕德.核受体孕烷X受体和组成性雄甾烷受体介导的中草药对药物代谢酶的作用及其研究进展[J].中国药学杂志,2013,48(2):85-89.
[4]Pollock C B,Rogatcheva M B,Schook L B.Comparative genomics of xenobiotic metabolism:a porcine-human PXR gene comparison[J].Mamm Genome, 2007,18(3):210-219.
[5]Ott M,Fricker G,Bauer B.Pregnane X receptor (PXR) regulates P-glycoprotein at the blood-brain barrier:fimctional similarities between pig and human PXR[J].J Pharmacol Exp Ther,2009,329(1):141-149.
[6]Cheng J,Shah Y M,Gonzalez F J,et al.Pregnane X receptor as a target for treatment of inflammatory bowel disorders[J].Trends Pharmacol Sci,2012,33(6):323-330.
[7]Madhukumar V,Subhajit M,Hongwei W,et al.Symbiotic bacterial metabolites regulate gastrointestinal barrier function via the xenobiotic sensor PXR and Toll-like receptor 4[J].Immunity,2014,41(8):296-310.
[8]Messina A,Puccinelli E,Gervasi P G,et al.Expression and inducibility of CYP1A1,1A2,1B1 by p-naphthoflavone and CYP2B22,CYP3As by rifampicin in heart regions and coronary arteries of pig[J].Res Vet Sci,2013,94(1):77-83.
[9] Xiaowen Li,Xiue J,Xiaoqiao Z,et al.Pregnane X receptor is required for IFN-α-mediated CYP3A29 expression in pigs[J].Biochem Biophys Res Commun,2014,445(2):469-474.
[10]唐霞,辛华雯,李维亮,等.黄连素对HepG2细胞CYP3A4和P-gp的影响和作用机制研究[J].中国临床药理学与治疗学,2015,20(1):7-13.
[11]油文亭,周涛,马增春,等.人参皂苷F1通过激活孕烷X受体诱导CYP3A4的表达[J].中国药理学通报,2015,31(11):1536-1540.
[12]Gray M A,Squires E J.Effects of nuclear receptor transactivation on steroid hormone synthesis and gene expression in porcine Leydig cells[J].J Steroid Biochem Mol Biol,2013,133(133):93-100.
[13]Bauer B,Hartz A M,Lucking J R,et al.Coordinated nuclear receptor regulation of the efflux transporter,Mrp2,and the phase-Ⅱ metabolizing enzyme,GSTpi,at the blood-brain barrier[J].J Cereb Blood Flow Metab,2008,28(6):1222-1234.
收稿日期:2015-11-07
作者简介:谢旖(1991-),女,湖南益阳人,硕士,主要从事动物非传染性群发病与动物保健研究。*通讯作者
中图分类号:S858.28;Q786
文献标识码:A
文章编号:1007-5038(2016)07-0017-04
Construction and Expression of Eukaryotic Vector of Pig Pregnane X Receptor Gene
XIE Yi,ZHOU Yu,HUANG Wei-mei,TIAN Ya-nan,WEN Li-xin,WU Jing
(CollegeofVeterinaryMedicine,HunanAgriculturalUniversity,Changsha,Hunan,410128,China)
Abstract:To construct the pig pregnane X receptor (pgPXR) in eukaryotic expression plasmid,RNA was extracted from fresh pig liver,the pgPXR genes were amplified by reverse transcription and PCR technology.PgPXR was inserted to pCI-neo plasmid to get the recombinant plasmid pCI-pgPXR.After PCR,by sequencing and enzyme digestion to confirm its right plasmid,the recombinant plasmid pCI-pgPXR was transfected into human hepatoma HepG2 cells by using liposomes.The recombinant plasmid then was identified by RT-PCR and dual luciferase assay system.The results showed that the eukaryotic expression plasmid pCI-pgPXR was constructed successfully,which could be expressed in HepG2 cells.Therefore this study laid the foundation for the pharmacology and toxicology of pgPXR.
Key words:pregnane X receptor;plasmid construction;eukaryotic expression

