动态浸提提取栀子黄色素工艺研究
陈润强,税珺,梁日高,马锡权,刘一贞,李妙嫦,袁全孙
(广东江门市林业科学研究所,广东江门529000)
动态浸提提取栀子黄色素工艺研究
陈润强,税珺*,梁日高,马锡权,刘一贞,李妙嫦,袁全孙
(广东江门市林业科学研究所,广东江门529000)
以除油栀子粉为原料,乙醇水溶液为浸提溶剂,进行乙醇回流动态浸提提取栀子黄色素,考察各个因素对栀子黄色素的提取率的影响,并与传统浸提提取工艺对比,说明动态浸提提取工艺的先进性。通过单因素试验和正交试验确定最佳工艺条件为:60%乙醇溶液为浸提溶剂、溶液pH值7.0、提取温度60℃、每次提取时间1h、固液比1∶10g/mL、提取次数2次,在此条件下栀子黄色素的提取率达到94.23%,精制后栀子黄色价70、栀子苷含量0.2%(以色价10计进行换算);同时得到栀子苷和绿原酸,提取率分别为90.81 %和85.32 %。
栀子黄色素;动态浸提;提取工艺
1 实验
1.1材料、仪器与试剂
采用的栀子果实产自江门市林业科学研究所苗圃地,将剥壳后的栀子果实粉碎至80目(孔径约0.18mm)、经石油醚动态浸提提取栀子油后得到的除油栀子粉,置真空干燥箱干燥后备用。
752Pro紫外可见分光光度计,上海棱光技术有限公司;HH-1型数显单孔恒温水浴锅,常州澳华仪器有限公司;LY90型微型磁驱动齿轮泵,佛山市南海区利宇节能设备厂;PHS-3C精密/数显pH计,上海佑科仪器仪表有限公司;万分之一分析天平BSM-220.4,上海卓精电子科技有限公司;150T多功能粉碎机,永康市石柱铂欧五金厂。
无水乙醇,AR,天津大茂化学试剂厂;盐酸、氢氧化钠,均为AR,广州化学试剂厂。
1.2分析方法
1.2.1分光光度法确定最大波长
根据参考文献[3]可知440nm为栀子黄色素的最大吸收波长,238nm为栀子苷的最大吸收波长,325nm为绿原酸的最大吸收波长。
根据朗伯-比尔定律[4]A=εbc可知,吸光度在一定范围内与溶液的浓度成正比,即
A÷Kc=C
(1-1)
式(1-1)中,A为吸光度,Kc为与浓度有关的系数常数(mol/L),C为溶液的浓度(mol/L)。
又由C×V=N可以推出
A×V=N/Kc
(1-2)
式(1-2)中,V为溶液的体积(L),N为溶液中物质的量(mol)。
由于Kc在一定范围内是常数,所以用A×V代替物质的量、吸光度A代替溶液的浓度进行分析[5]。
1.2.2栀子黄色素吸光值的测定
栀子黄色素粗提液经离心后,定容,取一定量的上清液,稀释相同倍数,在440nm处测定栀子黄色素溶液的吸光值。
A=A测×F
(1-3)
式(1-3)中,A测为提取液稀释后在440nm测得的吸光度,F为稀释倍数。
1.2.3栀子黄色素色价的测定[6]
仪器和设备:采用分光光度计。
称取精制后栀子黄约0.15g粉末试样(精确至0.0002g)或称取约1g浸膏或液体试样(精确至0.0002g),用水溶解,转移至100mL容量瓶中,加水定容至刻度,摇匀。然后再吸取10mL试样液,转移至100mL容量瓶中,加水定容至刻度,摇匀。取此试样液置于1cm比色皿中,以水做空白对照,用分光光度计在(440nm±5nm)范围内的最大吸收波长处测定吸光度。(吸光度应控制在0.3~0.7,否则应调整试样液浓度,再重新测定吸光度。)
(1-4)
式(1-4)中,A为实际测定试样液的吸光度,c为被测试样液的浓度,单位:g/mL。
1.2.4栀子苷的测定[6]
仪器和设备:采用高效液相色谱仪:配紫外检测器(检测波长238nm)。
称取约0.01g栀子苷标准品(精确至0.0001g),用流动相(乙腈水溶液)溶解并定容至50mL,得到标样贮存液A。吸取0.25、0.75、1.25、2.0、2.5mL贮存液A,分别用流动相(乙腈水溶液)稀释并定容至50mL,得到5个标样。在参考色谱条件下,对梯度浓度的标样进行测定,重复实验2次,得到标样平均峰面积值。以标样峰面积为纵坐标,标样的栀子苷质量浓度(g/mL)为横坐标,做标准曲线。
称取适量试样(精确至0.0001g),用流动相(乙腈水溶液)溶解并定容至25mL,所得溶液用0.45μm滤膜过滤,滤液备用。
在参考色谱条件下,对试样液进行测定,根据栀子苷标准品的保留时间定性。重复进样1次,得到栀子苷平均峰面积值。根据标样峰面积和标样的栀子苷质量浓度之间的线性关系,得到试样液中栀子苷的质量浓度(g/mL)。若试样液中栀子苷浓度(g/mL)不在标准曲线范围内,则应调整试样液的浓度或者重新设计标准曲线。

(1-5)
式(1-5)中X1为试样中栀子苷的含量,单位为%;c1为根据标准曲线求得的栀子苷浓度,单位:g/mL;c2为试样液的浓度,单位:g/mL。最后将上述计算结果换算成以色价10计的栀子苷含量。
1.3栀子黄色素的提取方法
准确称取50.00g的除油栀子粉放入1000mL的四口烧瓶中,按一定的固液比r加入乙醇水溶液作提取溶剂、进行乙醇回流动态浸提和传统浸提提取栀子黄色素,用恒温水浴锅加热并控制温度。提取完毕,将抽滤后所得的滤液置于1000mL西林瓶中,避光保存;按1.2.2的方法测定提取液在440nm处的吸光度,并按公式(1-6)计算各条件下栀子黄色素的提取率。
总提取量=A总×V总
(1-6)
在实际应用时,由于藏花素和藏花酸的纯品难以获得,无法直接计算出浸出液中的栀子黄色素的浓度C,此时在计算提取率时可用吸光度A值来代表浓度C[5]。

(1-7)
式(1-7)中,A总为除油栀子粉提至几乎无黄色时,总提取液在440nm处的吸光度,V总为除油栀子粉提至几乎无黄色时,提取液的总体积(mL);A为单次试验除油栀子粉总提取液在440nm处的吸光度,V为单次试验除油栀子粉总提取液的体积(mL)。
1.4单因素试验
以除油栀子粉为原料进行动态浸提和传统浸提,分别考察溶液pH值1.0、2.0、3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0、11.0,提取次数(次)1、2、3、4、5,乙醇浓度(%)40、50、60、70,提取温度(℃)30、40、50、60、70,提取时间(h)0.5、1.0、1.5、2.0、2.5,固液比(g/mL)1∶6、1∶8、1∶10、1∶12、1∶14,共6因素对栀子黄色素提取率的影响。
1.5正交试验
根据单因素试验结果,选择乙醇浓度、提取温度、提取时间、固液比4个主要因素,通过正交试验优化提取栀子黄色素工艺,确定各个因素对其提取率影响。
2 结果与讨论
2.1提取栀子黄色素单因素试验
2.1.1溶液pH值对栀子黄色素提取率的影响。准确称取50.00g的除油栀子粉放入1000mL的四口烧瓶中,按1∶10的固液比加入50%乙醇水溶液,提取温度60℃、分别在不同的溶液pH 值进行动态浸提和传统浸提提取栀子黄色素,提取2次,每次1(或1.5)h,试验结果如图1所示。

图1 溶液pH值对栀子黄色素提取率的影响
试验条件:T=60℃,EtOH%=50%,r=1∶10、t=1(或1.5)h,n=2。
栀子黄色素主要成分为藏花素和藏花酸,显弱酸性至中性。若在碱性条件下浸提OH-与栀子黄色素的藏花酸反应,导致发生一定程度的降解;若在酸性条件下浸提,则栀子黄色素不稳定而易沉淀。因此调节溶液pH值在7.0浸提最好。
2.1.2提取次数对栀子黄色素提取率。准确称取50.00g的除油栀子粉放入1000mL的四口烧瓶中,按1∶10的固液比加入50%乙醇水溶液,提取温度60℃,在溶液pH值7.0进行动态浸提和传统浸提提取栀子黄色素,分别提取不同次数,每次1(或1.5)h,试验结果如图2所示。
试验条件:T=60℃,EtOH%=50%,r=1∶10,t=1(或1.5)h,pH=7.0。
在其他因素相同的条件下考虑提取次数对栀子黄色素提取率的影响,由图2可以看出,栀子黄色素的提取率随着提取次数的增加而增大;当提取次数达到2次以后,提取率随次数的增加而缓慢增大,故提取次数选择2次。
2.1.3乙醇浓度对栀子黄色素提取率的影响。准确称取50.00g的除油栀子粉放入1000mL的四口烧瓶中,按1∶10的固液比分别加入不同浓度乙醇水溶液,提取温度60℃、在溶液pH值7.0进行动态浸提和传统浸提提取栀子黄色素,提取2次,每次1(或1.5)h,试验结果如图3所示。
试验条件:T=60℃,r=1∶10,t=1(或1.5)h,n=2,pH=7.0。
由图3可以看出,随着乙醇浓度的增大栀子黄色素的提取率呈现出先上升后下降的趋势。当乙醇浓度从40%到60%时,栀子黄色素提取效果明显上升,乙醇浓度超过70%,栀子黄色素提取率呈现下降趋势。这是由于栀子黄色素为水溶性色素,易溶于水,栀子苷易溶于乙醇;采用浓度高的乙醇水溶液无法有效地提取栀子黄色素,而是浸提出大量的栀子苷,从而影响栀子黄色素的提取率;乙醇浓度过低,提取液中还含有较多的果胶等水溶性杂质。试验表明,60%乙醇水溶液提取栀子黄色素,效果最好。
2.1.4提取温度对栀子黄色素提取率的影响。准确称取50.00g的除油栀子粉放入1000mL的四口烧瓶中,按1∶10的固液比加入50%乙醇水溶液,分别在不同温度、溶液pH值7.0进行动态浸提和传统浸提提取栀子黄色素,提取两次,每次1(或1.5)h,试验结果如图4所示。
由图4可以看出栀子黄色素的提取率随着提取温度的升高而升高,温度达到50℃,提取率变化较为显著。由于栀子黄色素对热不稳定,高温易造成色素损失,在70℃附近,提取率有下降趋势。由此可以说明温度过高或过低均不利于栀子黄色素的提取。温度过低,栀子黄色素不易溶出;温度过高,又有可能造成栀子黄色素不稳定而带来的损失。试验表明,60℃是从除油栀子粉中提取栀子黄色素的合适温度。

图4 温度对栀子黄色素提取率的影响
试验条件:EtOH=50%,r=1∶10,t=1(或1.5)h,n=2,pH=7.0。
2.1.5提取时间对栀子黄色素提取率的影响。准确称取50.00g的除油栀子粉放入1000mL的四口烧瓶中,按1∶10的固液比加入50%乙醇水溶液,提取温度60℃、在溶液pH值7.0进行动态浸提和传统浸提提取栀子黄色素,提取2次,每次分别提取不同时间,试验结果如图5所示。

图5 时间对栀子黄色素提取率的影响
试验条件:T=60℃,EtOH%=60%,r=1∶10,pH=7.0,n=2。
由图5可以看出,采用动态浸提和传统浸提从提取开始到1(或1.5)h,提取物中栀子黄色素的提取率达到最高;然后随着时间延长浸提液中栀子黄色素的提取率反而缓慢下降。这可能是栀子的化学成分较为复杂、达100多种[7],加热时间过长,栀子黄色素的结构遭到破坏或其他杂质如绿原酸、果胶、蛋白等大量浸出,而使栀子黄色素的提取率出现降低。为防止栀子黄色素长时间受热发生结构变化,影响产品纯度和提取率,并提高效率,动态浸提每次提取时间选择1h作为提取栀子黄色素的最佳条件。
2.1.6固液比对栀子黄色素提取率的影响。准确称取50.00g的除油栀子粉放入1000mL的四口烧瓶中,分别按不同的固液比加入60%乙醇水溶液,提取温度60℃、在溶液pH值7.0进行动态浸提和传统浸提提取栀子黄色素,提取2次,每次1(或1.5)h,试验结果如图6所示。

图6 固液比对栀子黄色素提取率的影响
试验条件:T=60℃,EtOH%=60%,t=1(或1.5)h,n=2,pH=7.0。
根据液固萃取的基本理论,固液比太小,浸提不充分,浸提液过滤也很困难;固液比越大溶剂与溶质接触越充分,提取效果越好,但过大的固液比会增加溶剂的成本和后续浓缩干燥成本。由图6可以看出,当固液比大于1∶10时,继续增加固液比,提取率提高较少。综合考虑栀子黄色素提取率和溶剂用量、选择固液比为1∶10。
2.2正交试验结果与分析
根据单因素试验结果,选择乙醇浓度、提取温度、提取时间、固液比4个主要因素,通过正交试验优化提取栀子黄色素工艺,并对结果进行极差分析和方差分析,确定各个因素在提取栀子黄色素过程中对其提取率影响。正交试验结果见表1、方差分析结果见表2。
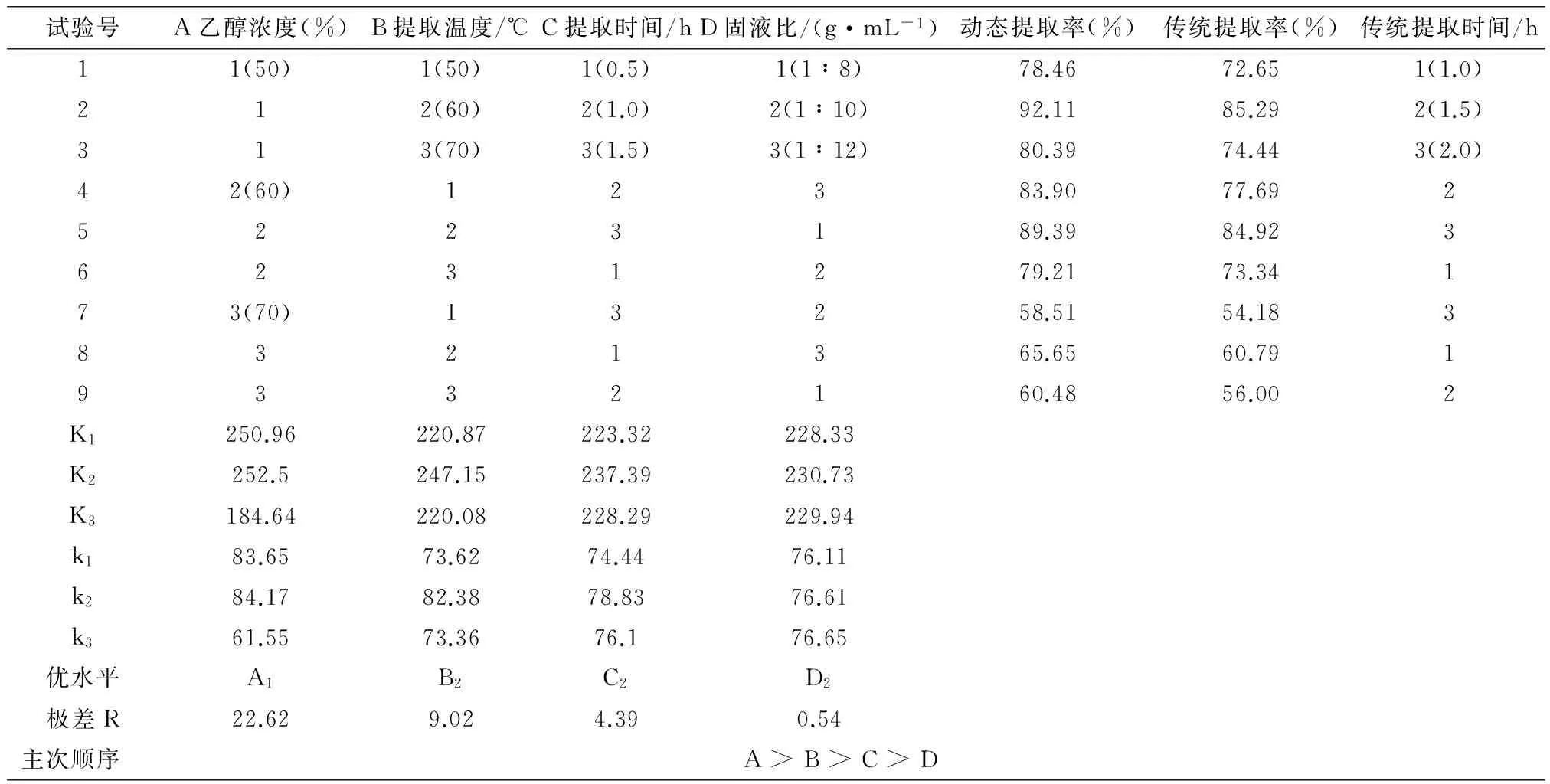
表1 正交试验结果

表2 方差分析表[8]
注:F0.05(2,2)=19.00,F0.01(2,2)=99.00;*、**分别表示差异在0.05和0.01水平上显著。
由表1可知,各因素的影响主次顺序是:乙醇浓度>提取温度>提取时间>固液比,这说明要获得良好的提取效果,在提取过程中对乙醇溶液的浓度控制是至关重要的。按照正交表的安排,试验后得到最佳因素组合是A1B2C2D2,即其他提取工艺条件相同时、50%乙醇溶液为浸提溶剂,动态浸提1h栀子黄色素提取率为92.11%;而传统浸提1.5h栀子黄色素提取率仅为85.29%。显然,动态浸提栀子黄色素提取率比传统浸提提高8%、提取时间缩短1/3。经综合考虑,动态浸提选择较佳提取工艺条件为A2B2C2D2,即60%乙醇溶液为浸提溶剂、溶液pH值7.0、提取温度60℃、每次提取时间1h、固液比1∶10g/mL、提取次数2次,动态浸提栀子黄色素提取率为94.23%。
由表2方差分析表可知,乙醇浓度对栀子黄色素提取率有极显著影响(P<0.01),提取温度有显著影响(P<0.05),提取时间、固液比均无显著影响,得到验证。
3 结论
3.1动态浸提提取栀子黄色素工艺的先进性
由于动态浸提使除油栀子粉固体界面处的浸提液流速大大增加,减少了固-液相界面处层流边界层的厚度,因而增大了液体的扰动,加大浸提过程的传质速率,加快达到浸提固液平衡,缩短了浸提时间,大大提高浸提装置的生产能力;动态浸提使浸提器物料无死角,浸提过程能平稳进行,比传统浸提(无液体循环的煎煮式浸提[2])工艺浸提速度快,提取率高,具有明显的先进性和生产实用性。动态浸提栀子黄提取率比传统高8%、提取时间缩短1/3。
3.2动态浸提提取栀子黄色素工艺条件的确定
通过单因素试验和正交试验确定动态浸提最佳工艺条件为:60%乙醇溶液为浸提溶剂、溶液pH值7.0、提取温度60℃、每次提取时间1h、固液比1∶10g/mL、提取次数2次,在此条件下栀子黄色素的提取率达到94.23%,精制后栀子黄色价70、栀子苷含量0.2%(以色价10计进行换算);同时得到栀子苷和绿原酸,提取率分别为90.81%和85.32%。
[1]孙宝国.食品添加剂[M].北京:化学工业出版社,2008.
[2]曹光明.中药浸提物生产工艺学[M].北京:化学工业出版社,2009.
[3]Ozaki A,Kitano M,Furusawa N,etal.Genotoxicity of gardenia yellow and its components[J].Food Chem Toxicol.2002,40(11):1603-1610.
[4]张兰桐.药物分析(供药学专业用)[M].北京:中央广播电视大学出版社,2002.
[5]辛莎.栀子果中栀子油、栀子黄色素、栀子苷和绿原酸的提取与精制工艺[D].中南林业科技大学,2011.
[6] GB7912-2010.食品安全国家标准 食品添加剂 栀子黄[S].北京:中国标准出版社,2011.
[7]任治军,张立明,何开泽.栀子主要成分的提取工艺及药理研究进展[J].天然产物研究与开发,2005,17(6):831-836.
[8]陈团伟,康彬彬,任琳毅,等.栀子黄色素提取工艺参数的优化[J].热带作物学报,2010,31(8):1388-1402.
Study on Extraction Technology of Gardenia Yellow Pigment by Dynamic Extraction
Chen Runqiang, Shui Jun*,Liang Rigao,Ma Xiquan,Liu Yizhen, Li Miaochang,Yuan Quansun
(Forestry Research Institute of Jiangmen City,Jiangmen,Guangdong,529000)
Taking Gardenia powder removing oil as raw material and ethanol solution as solvent, the extraction of gardenia yellow pigment by ethanol reflux extraction was carried out, to study the various factors influence on the rate of extraction of gardenia yellow pigment, And compared with the traditional extraction process , the advanced nature of the extraction process of dynamic extraction is described. Through single factor test and orthogonal test, the optimum conditions were determined as follows: 60% ethanol solution as extraction solution, solution pH value 7.0, extraction temperature 60 degrees C, extraction time 1 hours, solid-liquid ratio 1∶10g/ml, extraction times 2 times, Under these conditions, the extraction of gardenia yellow pigment rate reached 94.23%, 70 gradation, gardenia glycoside content of 0.2% (to gradation 10 conversion), and obtained geniposide and chlorogenic acid, extraction rate was 90.81% and 85.32 % respectively.
Gardenia yellow pigment; Dynamic extraction; Extraction process
2016-03-29
广东省林业科技创新项目(2013KJCX014-07)
陈润强(1966-),男,工程师,主要从事林产化工研究,E-mail:crqlks@163.com;*通讯作者:税珺,林业高级工程师,主要从事林业科研与调查规划设计,E-mail:13822469635@163.com。
S574;TQ35
A
DOI.:10.13268/j.cnki.fbsic.2016.04.001

