脾多肽注射液对晚期高侵袭性肝癌患者血清生化学及肿瘤指标的影响
谢莹,魏博
(第二军医大学附属长征医院 感染科,上海 200070)
脾多肽注射液对晚期高侵袭性肝癌患者血清生化学及肿瘤指标的影响
谢莹,魏博Δ
(第二军医大学附属长征医院 感染科,上海 200070)
目的探讨脾多肽对晚期高侵袭性肝癌患者血清生化学及肿瘤指标的影响。方法选取晚期高侵袭性肝癌患者60例,按随机数字表法分为2组,各30例,对照组予以肝动脉介入化疗联合常规治疗,研究组在对照组治疗基础上予以脾多肽注射液10 mL,1次/2天,治疗1月后改为2次/周,共治疗6个月为一疗程,测定血清肿瘤标志物,取肝肿瘤组织测定基质金属蛋白、侵袭性相关指标,同时随访对比安全性状况。结果与治疗前相比,对照组治疗后CD3+、CD4+水平升高,研究组治疗后CD3+、CD4+及CD4+/CD8+水平升高,2组治疗后甲胎蛋白(alpha fetal protein,AFP)、癌胚抗原(carcino embryonie antigen,CEA)、糖类抗原CA125及CA199水平降低,基质金属蛋白酶-2(matrix metalloproteinase-2,MMP-2)、基质金属蛋白酶7(MMP-7)、基质金属蛋白酶-9(MMP-9)及基质金属蛋白酶组织抑制因子-1(tissue inhibitor of metalloproteinase-1,TIMP-1)水平降低,肝癌衍生生长因子(hepatoma derived growth factor,HDGF)、血管内皮生长因子(vascular endothelial growth factor ,VEGF)及微血管密度(microvascular vascular density,MVD)水平降低(P<0.05);与对照组相比,研究组治疗后CD3+、CD4+及CD4+/CD8+水平较高,AFP、CEA、CA125及CA199水平较低,MMP-2、MMP-7、MMP-9及TIMP-1水平较低,HDGF、VEGF及MVD水平较低(P<0.05)。结论脾多肽可以提高晚期高侵袭性肝癌患者免疫功能,降低肿瘤标志物及侵袭性相关指标水平,安全性高。
脾多肽;晚期高侵袭性肝癌;免疫功能;肿瘤标志物;侵袭性相关指标
对于原发性肝癌,根治手术是公认的有效方案,然而早期诊断较为困难,大多数晚期患者存在多发转移及高侵袭性,80%~90%不能选择手术治疗[1]。经肝动脉化疗栓塞是晚期原发性肝癌非手术的首选措施,然而化疗药物不良反应多,部分患者难以耐受[2]。随着分子生物学及免疫学的进展,肿瘤标志物、基质金属蛋白及VEGF等侵袭性相关指标与肝癌高侵袭性和转移具有一定相关性。肝癌免疫治疗成为研究的重心,增强肝癌免疫功能,可以提高肿瘤特异性免疫能力,阻断肿瘤转移及高侵袭性,成为目前我国乃至全世界研究的重点[3]。医学者逐渐将免疫调节剂应用于肿瘤的治疗当中,脾多肽是从动物脾脏中提取的活性肽类药物,可以抑制肿瘤增殖,调节机体免疫功能,在晚期高侵袭性肝癌治疗中具有一定的潜力[4]。本次选取晚期高侵袭性肝癌患者60例,探讨脾多肽对血清生化学及肿瘤指标的影响,现报告如下。
1 资料与方法
1.1 一般资料 选取2014年11月~2015年8月第二军医大学附属长征医院感染科以及上海曙光医院肿瘤内科确诊的晚期高侵袭性肝癌患者60例,均符合纳入标准:①经影像学诊断及病理确诊,符合《新编常见恶性肿瘤诊治规范》[5]的相关标准,且患者肿瘤位置不适宜手术,且曾经进行过介入手术的患者;②入选患者年龄在40~69岁之间,治疗前卡氏评分≥70分,预计生存期>6个月;③均不能行手术切除及局部消融治疗;④自愿参与研究,并签署药物同意及化疗知情同意书;⑤无智力、精神功能障碍,遵医嘱按时服药;⑥经本院医学伦理委员会审核通过,符合伦理道德标准。按随机数字表法分为对照组和研究组,分别为30例,对照组予以肝动脉介入化疗联合常规治疗,其中男性20例,女性10例,年龄40~70岁,平均年龄(53.98±6.12)岁,平均病程为(1.35±0.41)年,肿瘤原因:乙型肝炎致肝癌患者22例,自身免疫性肝病或酒精性肝病致肝癌患者8例,肝内转移类型:门静脉转移27例,其他转移3例;研究组在对照组治疗基础上予以脾多肽注射液治疗,其中男性19例,女性11例,年龄41~69岁,平均年龄(54.03±5.91)岁,平均病程为(1.36±0.40)年,肿瘤原因:乙型肝炎致肝癌患者23例,自身免疫性肝病或酒精性肝病致肝癌患者7例,肝内转移类型:门静脉转移26例,其他转移4例2组间性别、年龄等基线数据对比差异无统计学意义。
排除标准:①入选患者年龄>70岁或<40岁;②合并心、脑血管等严重原发性疾病或凝血障碍难以完成化疗者;③对脾多肽注射液等研究药物存在禁忌或过敏者;④近期6个月内曾接受过可能影响免疫功能的其他药物者,或有静脉化疗禁忌症者;⑤妊娠或哺乳期妇女、精神障碍难以配合检查者;⑥治疗依从性差、未按规定服药者。
1.2 方法
1.2.1 治疗方法:行常规体格检查及生化、肝肾功能,均予以肝动脉介入化疗方案治疗,参照《2009原发性肝癌规范化诊治专家共识》[6]和《肿瘤化学预防及药物治疗》[7],采用改良式Seldinger技术穿刺右侧股动脉,将导管插入肿瘤供血动脉,尽可能选至肿瘤供血动脉后行化疗栓塞,通过导管注入化疗药物,包括注射用丝裂霉素(日本 Kyowa Hakko Kirin Co.,Ltd.,注册证号:H20090868),注射用氟尿嘧啶(黄石李时珍药业集团武汉喜素制药有限公司,国药准字H20050466),顺铂注射液(澳大利亚 Hospira Australia Pty Ltd,注册证号:H20090521),用药量根据患者肝功能及全身状态进行调整,超选择至肿瘤供血动脉近端透视下缓慢注入超液化碘油进行栓塞,分流量较大病灶采用明胶海绵(1/3~1/2)栓塞。对照组予以肝动脉介入化疗联合常规治疗,予保肝、补液支持治疗;研究组在肝动脉介入化疗联合常规治疗基础上予以脾多肽注射液(吉林丰生制药有限公司,国药准字H22026497)治疗,10 mL+5%葡萄糖注射液500 mL静脉滴注,1次/2天,治疗1月后改为2次/周,2组共治疗6个月为一疗程,治疗期间避免采用与本次研究无关的药物及措施。
1.2.2 血液学指标测定:标本选取:于治疗前后采集所有患者晨起空腹肘静脉血3~5 mL,离心机3000 r/min离心10 min,取上层清液,低温条件下统一保存,检测指标如下:①免疫功能指标:主要包括T淋巴细胞亚群(CD3+、CD4+、CD8+、CD4+/CD8+),上述指标均采用美国BD公司生产的流式细胞仪进行检测,试剂盒为美国BD公司提供,完全参照试剂盒要求进行;②肿瘤标志物指标:包括血清甲胎蛋白(alpha fetal protein,AFP)、癌胚抗原(carcino embryonie antigen,CEA)、糖类抗原CA125及CA199水平,上述指标均采用化学发光免疫分析法检测,仪器为德国罗氏全自动电化学发光免疫分析系统仪,试剂为Access专用试剂盒,完全参照试剂盒要求进行。
1.2.3 肝肿瘤组织学测定:于治疗前后取肝肿瘤标本,置于10%福尔马林中固定,常规脱水、石蜡包埋切片,检测指标如下:①基质金属蛋白测定:包括基质金属蛋白酶-2(matrix metalloproteinase-2,MMP-2)、基质金属蛋白酶7(MMP-7)、基质金属蛋白酶-9(MMP-9)及基质金属蛋白酶组织抑制因子-1(tissue inhibitor of metalloproteinase-1,TIMP-1)含量,上述指标均采用免疫组织化学法定量测定,鼠抗人MMP-2、MMP-9单克隆抗体由MaximBiotech.Inc提供,鼠抗人TIMP-1单克隆抗体由武汉博士德生物技术有限公司提供;②侵袭性相关指标:包括肝癌衍生生长因子(hepatoma derived growth factor,HDGF)、血管内皮生长因子(vascular endothelial growth factor ,VEGF)及微血管密度(microvascular vascular density,MVD)含量,采用免疫组织化学法定量测定高迁移率族蛋白(high mobility group box 1,HMGB1)及VEGF含量,兔抗人HDGF单克隆抗体由武汉三鹰生物技术有限公司提供,兔抗VEGF多克隆抗体由北京赛驰生物科技有限公司提供,采用酶标链亲和素-生物素(labeled streptavidin-biolin technique,LSAB)测定MVD含量,试剂盒由美国Zymed公司提供。
1.2.4 安全性分析:治疗过程中行常规体格检查,包括血/尿常规、肝/肾功能等检查,观察2组患者的术后不良反应及并发症。
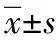
2 结果
2.1 2组间血清免疫功能指标测定状况 与治疗前相比,对照组治疗后CD3+、CD4+水平升高,研究组治疗后CD3+、CD4+及CD4+/CD8+水平升高(P<0.05);与对照组相比,研究组治疗后CD3+、CD4+及CD4+/CD8+水平较高(P<0.05)。见表1。

表1 2组间治疗前后血清免疫功能指标测定状况对比Tab.1 Comparison of serum immune function between two groups(±s)
*P<0.05,与同组治疗前比较,compared with the same group pre-treatment;#P<0.05,与对照组治疗后比较,compared with control group post-treatment
2.2 2组间血清肿瘤标志物指标测定状况 与治疗前相比,2组治疗后AFP、CEA、CA125及CA199水平降低(P<0.05);与对照组相比,研究组治疗后AFP、CEA、CA125及CA199水平较低(P<0.05)。见表2。

表2 2组间治疗前后血清肿瘤标志物指标测定状况对比Tab.2 Comparison of serum tumor markets between two groups(±s)
*P<0.05,与同组治疗前比较,compared with the same group pre-treatment;#P<0.05,与对照组治疗后比较,compared with control group post-treatment
2.3 2组间肝肿瘤组织基质金属蛋白测定状况 与治疗前相比,2组治疗后MMP-2、MMP-7、MMP-9及TIMP-1水平降低(P<0.05);与对照组相比,研究组治疗后MMP-2、MMP-7、MMP-9及TIMP-1水平较低(P<0.05)。见表3。

表3 2组间治疗前后肝肿瘤组织基质金属蛋白测定状况对比Tab.3 Comparison of serum matrix metalloproteinases in tumor tissue between two groups(±s,ng/mL)
*P<0.05,与同组治疗前比较,compared with the same group pre-treatment;#P<0.05,与对照组治疗后比较,compared with control group post-treatment
2.4 2组间肝肿瘤组织侵袭性相关指标状况 与治疗前相比,2组治疗后HDGF、VEGF及MVD水平降低(P<0.05);与对照组相比,研究组治疗后HDGF、VEGF及MVD水平较低(P<0.05)。见表4。

表4 2组间治疗前后肝肿瘤组织侵袭性相关指标状况对比Tab.4 Comparison of liver tumor tissue invasiveness between two groups(±s)
*P<0.05,与同组治疗前比较,compared with the same group pre-treatment;#P<0.05,与对照组治疗后比较,compared with control group post-treatment
2.5 安全性分析 随访截止到2016年9月,对照组1例失随,具体原因不详,研究组1例死亡,其余患者均获得随访,无病例脱落现象,治疗后均出现不同程度的疼痛、发热、恶心呕吐等反应,对症处理后逐渐缓解,均无感染、肝肾功能损害加重等情况出现,2组间不良率数据对比,差异无统计学意义。
3 讨论
肝细胞肝癌是较为常见的恶性肿瘤,死亡率居高不下,晚期原发性肝癌患者往往失去手术切除的机会,主要原因为高侵袭性及肝内和(或)肝外转移[8],而且现阶段常用的TACE手段不可避免地带来负面影响,如肝功损害、抑制机体免疫功能,对患者预后造成不良影响。近年来关于细胞分子生物学在恶性肿瘤中表达,并影响患者生存预后的研究受到关注,基质金属蛋白及相关高侵袭性指标,例如HDGF、VEGF过度表达促进肝癌微血管生成,与肝癌侵袭转移密切相关[9-10]。因此通过肝肿瘤细胞分子生物学特性研究判断和预测肝癌的复发、转移及生存预期具有重要意义。目前结合免疫治疗的综合治疗方法已经是晚期高侵袭性肝癌治疗的重要研究方向[11]。血清肿瘤标志物对恶性肿瘤的诊断及疗效观察有重要价值。现阶段临床常用的肝癌肿瘤标志物有血清AFP、CEA、CA125及CA199等,其中甲胎蛋白(AFP)被公认为原发性肝癌诊断的肿瘤标志物[12]。据报道原发性晚期肝癌患者血清CA125、CA199水平升高,与病情恶性发展、高侵袭性及肝功能恶变具有一定的相关性[13]。因此检测肿瘤标志物对判断脾多肽在晚期高侵袭性肝癌的效果有重要意义。采用脾多肽辅助治疗后血清AFP、CEA、CA125及CA199水平降低程度更加明显(P<0.05),说明脾多肽辅助治疗能够增强人体免疫功能,解除免疫抑制,极大限度地抑制原发性晚期肝癌病情发展及高侵袭性。
肝癌患者多存在细胞免疫功能紊乱和抗肿瘤免疫功能低下,尤其是晚期高侵袭性患者更为显著。提高晚期肝癌患者免疫功能可以抑制肿瘤恶性侵袭,对治疗及预后起到推动作用[14]。T淋巴细胞是机体免疫系统中最重要的细胞群,通过相互作用维持机体正常的免疫应答[15]。脾多肽中含有丰富的细胞营养成分及细胞因子,特别是细胞中的免疫调节因子等小分子多肽,可以改善机体的免疫状态。经脾多肽辅助治疗后CD3+、CD4+及CD4+/CD8+水平较高(P<0.05),说明脾多肽辅助治疗对机体免疫功能有调节作用,能够激活免疫系统,增强机体非特异性免疫功能。
肝癌细胞的增殖、侵袭能力较强,治疗后易发生肿瘤复发和转移,提高机体免疫力等措施可有效抑制癌细胞分化和增殖,抑制癌细胞的侵袭能力[16]。据报道肿瘤的侵袭和转移是恶性肿瘤的重要生物学特征,基底膜(basement membrane,BM)和细胞外基质(extracellular matrix,ECM)是肿瘤生长和扩散的基础屏障,ECM的降解是肿瘤侵袭和转移的关键环节[17]。以基质金属蛋白酶(MMPs)为代表,能够降解ECM各种成分,是肿瘤细胞浸润与转移的关键步骤,与肝癌侵袭、转移有关,可作为反映肝癌复发、转移潜能的生物学指标。经脾多肽辅助治疗后肝肿瘤组织MMP-2、MMP-7、MMP-9及TIMP-1水平降低程度更为明显(P<0.05),患者可以耐受,说明脾多肽辅助治疗对阻断肝脏肿瘤的转移、高侵袭性与复发具有重要意义。
有学者对肝癌、胃癌和肺癌瘤的肿瘤血管研究发现,肿瘤组织在生长过程中存在异常的微血管形成,说明MVD与肿瘤的脉管侵袭和转移行为具有一定相关性,可作为判定晚期肝癌转移及预后的指标。VEGF是血管生成关键的刺激因子,参与肿瘤血管生成的多个环节,与肝癌微血管形成过程相关,可作为判断肝细胞癌侵袭能力、血管生成及预后的重要标志。经脾多肽辅助治疗后HDGF、VEGF及MVD水平较低(P<0.05),说明脾多肽辅助治疗能够降低晚期肝癌侵袭能力、抑制血管生成,避免了实体肿瘤的恶性发生、发展及转移。
本次研究发现脾多肽可以提高晚期高侵袭性肝癌免疫功能,降低肿瘤标志物及侵袭性相关指标水平,安全性高。本次研究尚存在一定缺陷,关于脾多肽在晚期高侵袭性肝癌中的应用需要临床进一步研究。
[1] 李兆元,宁四清,易铁男,等.复方斑蝥胶囊联合化疗及放疗治疗中晚期原发性肝癌的疗效观察[J].中华全科医学,2013,11(8):1250-1251.
[2] 孙利,任君霞,田野,等.养正消积胶囊配合介入化疗治疗原发性肝癌随机双盲多中心临床研究[J].世界中医药,2013,8(6):688-691.
[3] 黄冠群,罗捷,周如建,等.miRNA-144对肝癌侵袭性的影响[J].岭南现代临床外科,2015,15(2):146-148.
[4] 袁叶,韩俊莉,刘宁.脾多肽注射液治疗原发性免疫性血小板减少症的临床疗效观察[J].中国现代应用药学,2016,33(6):815-817.
[5] 杨秉辉.原发性肝癌/中国抗癌协会.新编常见恶性肿瘤诊治规范[M].北京:中国协和医科大学出版社,1999:389-479.
[6] 中国抗癌协会肝癌专业委员会.原发性肝癌规范化诊治的专家共识[J].实用肝脏病杂志,2009,17(6):259-269.
[7] 韩锐.肿瘤化学预防及药物治疗[M].北京医科大学、中国协和医科大学联合出版社,1991.
[8] 龙欣欣,叶英楠,刘芃芃,等.神经降压素对肝细胞肝癌生长和侵袭的影响[J].中国肿瘤临床,2016,43(7):275-280.
[9] 彭利,王顺祥,张风瑞,等.基质金属蛋白酶-9和血管内皮生长因子与原发性肝癌侵袭转移关系研究[J].中华肝胆外科杂志,2003,9(1):42-44.
[10] 周宝勇,郑军,侯俊丞,等.HMGB1在肝细胞癌中的表达及其与VEGF、MVD的关系[J].重庆医科大学学报,2012,37(5):409-412.
[11] 赵玉山,温树伟,畅俊平,等.脾多肽注射液联合TACE治疗原发性肝癌及其对免疫功能的影响[J].世界华人消化杂志,2016,24(15):2384-2389.
[12] 付鸿江,裴效瑞,卢德宝.血清AFP、CA199及CA50水平与原发性肝癌的相关性研究[J].中国实验诊断学,2016,20(5):828-829.
[13] 张宪峰,李恒力,李新国,等.蝥酸钠维生素B6注射液对原发性肝癌患者的临床疗效、血清CA125和CA199水平的影响[J].中国生化药物杂志,2014,34(9):124-126.
[14] 孔丽,姚树坤,刘金星,等.原发性肝癌患者细胞免疫功能变化及其与转归的关系[J].中华肝脏病杂志,2005,13(3):194-197.
[15] 覃玉桃,韦长元,李挺.薏苡仁提取物注射液对晚期原发性肝癌患者免疫功能影响的研究[J].肿瘤防治杂志,2001,8(1):23-24.
[16] 陈耿标,陈锦丽,刘映芬.异嗪皮啶对肝癌患者MMP-7表达水平和癌细胞侵袭能力的影响[J].白求恩医学杂志,2016,14(2):148-151.
[17] 陈连周,王东,谢巧庆,等.基质金属蛋白酶-9及其抑制剂与肝癌侵袭转移的关系[J].中国热带医学,2008,8(11):1914-1916.
(编校:王俨俨)
Effectoflienalpolypeptideinjectiononserumbiochemicalandtumormarkersinadvancedhighlyaggressivelivercancer
XIE Ying, WEI BoΔ
(Department of Infectious Disease, Shanghai Changzheng Hospital Affiliated to Second Military Medical University, Shanghai 200070, China)
ObjectiveTo investigate the effect of lienal polypeptide injection on serum biochemical and tumor markers in the treatment of patients with advanced highly aggressive liver cancer.Methods60 cases of advanced highly aggressive liver cancer in our hospital were selected and randomly divided into 2 groups, 30 cases respectively.The control group
transcatheter arterial chemoembolization combined with routine treatment, and the experimental group received more with lienal polypeptide injection 10 mL once every 2 days, and after changed to two times weekly after 1 month, a total of 6 months for a course of treatment.Serum tumor markers, invasive and matrix metalloproteinase related indicators were determined, and the two groups were followed up, then compared safety condition after the treatment.ResultsCompared with before treatment, the levels of CD4+and CD3+in the control group after treatment increased, levels of CD3+, CD4+and CD4+/CD8+in the experimental group increased, levels of alpha fetal protein (AFP),carcino embryonie antigen (CEA), CA125 and CA199 decreased in the two groups, levels of matrix metalloproteinase-2 (MMP-2), MMP-7, MMP-9 and tissue inhibitor of metalloproteinase-1 (TIMP-1) decreased and levels of hepatoma derived growth factor (HDGF), vascular endothelial growth factor (VEGF) and microvascular vascular density (MVD) decreased (P<0.05), compared with the control group, the levels of CD3+, CD4+and CD4+/CD8+in the experimental group after treatment were higher, levels of AFP, CEA, CA125 and CA199 were lower, levels of MMP-2, MMP-7, MMP-9 and TIMP-1 were lower, and levels of HDGF, VEGF and MVD were lower (P<0.05).ConclusionLienal polypeptide injection can improve the immune function of patients with advanced highly aggressive liver cancer, and reduce the levels of tumor markers and invasive related indicators, with high safety.
lienal polypeptide injection; advanced highly aggressive liver cancer; immune function; tumor markers; invasive correlation indexes
10.3969/j.issn.1005-1678.2016.10.012
谢莹,女,硕士,住院医师,研究方向:慢性肝病、肝硬化、肝癌及不明原因发热,E-mail:xieyingmalalongxia@126.com;魏博,通信作者,男,硕士,主治医师,研究方向:慢性肝病、肝硬化、肝癌及不明原因发热,E-mail:Weibo0816@163.com。
R735.7
A

