化浊抗纤保肝汤对肝纤维化大鼠的影响及其机制
李瑞东
(邢台医学高等专科学校第二附属医院,河北 邢台 054000)
化浊抗纤保肝汤对肝纤维化大鼠的影响及其机制
李瑞东
(邢台医学高等专科学校第二附属医院,河北 邢台 054000)

目的探讨化浊抗纤保肝汤对肝纤维化大鼠的影响及其作用机制。方法将60只SD大鼠随机分为正常组、模型组、膈下逐瘀汤组及化浊抗纤Ⅰ组、Ⅱ组、Ⅲ组,每组10只。除正常组外,其余各组均采用猪血诱导大鼠肝纤维化。诱发肝纤维化同时,模型组给予蒸馏水灌胃至第9周,膈下逐瘀汤组和化浊抗纤Ⅰ组分别给予相应药物灌胃至第9周,化浊抗纤Ⅱ组自造模的第3周、化浊抗纤Ⅲ组自造模的第6周给予化浊抗纤保肝汤灌胃至第9周。检测各组大鼠血清AST、ALT、HA、LN和PCⅢ水平;取肝组织行HE和Mallory染色,观察大鼠肝组织病理学改变;采用免疫组化和Northern blot杂交技术检测肝组织中TGF-β1、TIMP-1和MMP-1表达情况。结果各造模组大鼠血清ALT、AST、HA、LN、PCⅢ水平及肝组织中TGF-β1、TIMP-1蛋白与mRNA表达水平均明显高于正常组(P均<0.05),各给药组上述指标水平均明显低于模型组(P均<0.05);各造模组大鼠肝组织中MMP-1蛋白与mRNA表达水平均明显低于正常组(P均<0.05),各给药组大鼠肝组织中MMP-1蛋白与mRNA表达水平均明显高于模型组(P均<0.05)。膈下逐瘀汤组与化浊抗纤Ⅰ组各指标水平比较差异均无统计学意义(P均>0.05),化浊抗纤Ⅰ组与化浊抗纤Ⅱ组、化浊抗纤Ⅲ组比较差异均有统计学意义(P均<0.05),化浊抗纤Ⅱ组与化浊抗纤Ⅲ组比较差异均有统计学意义(P均<0.05)。结论化浊抗纤保肝汤能明显减轻肝纤维化大鼠肝功能损伤和肝纤维化程度,其可能通过下调大鼠TGF-β1的表达而减少细胞外基质沉积,降低大鼠TIMP-1的水平而减轻对MMP-1的抑制作用进而促进细胞外基质降解。
化浊抗纤保肝汤;肝纤维化;膈下逐瘀汤;大鼠
肝纤维化(hepatic fibrosis,HF)是由于多种原因引起的肝脏炎症反应,诱导肝脏纤维组织异常增生的病理过程,是各种慢性肝病的病理学基础,是肝硬化的早期和必经阶段[1-2]。据统计,肝硬化年发病率达100/10万,且每年有3%~6%的人会进展为肝癌[3]。因此,如何有效控制肝纤维化的进展是防止晚期肝病形成的关键因素。目前西医对肝纤维化的研究比较深入,但临床治疗上并无特效良药;中药治疗肝纤维化的疗效较好,显示出广泛地开发和应用前景,但其作用机制尚不十分明确,探讨中药治疗肝纤维化的机制,对研发新的抗肝纤维化药物具有重要意义[4-5]。中药化浊抗纤保肝汤能解毒化浊、行气活血、滋阴柔肝,畅通瘀滞肝脉,在肝纤维化患者中具有较高应用价值,但其作用机制尚不明确。本研究观察了中药化浊抗纤保肝汤对猪血诱导的肝纤维化大鼠模型肝功能和肝纤维化指标以及肝组织中TGF-β1、TIMP-1和MMP-1表达的影响,旨在探讨化浊抗纤保肝汤对肝纤维化的影响及其可能的作用机制。
1 实验资料
1.1实验动物雄性SD大鼠60只,体质量200~220 g,购自中国科学院斯莱克实验动物中心,动物合格证号:SCXK(京)2011-0012。大鼠购回后饲养于本院实验动物中心,维持室温(20±2)℃,相对湿度60%,自由摄取固体全价饲料,自由饮水,适应性饲养7 d后使用。本实验遵循《实验动物保护条例》,对实验动物进行严格的检验检疫和饲育管理。
1.2实验药物自拟化浊抗纤保肝汤,由红景天12 g、田基黄15 g、绞股蓝15 g、黄芩15 g、黄连12 g、三棱12 g、鳖甲15 g、茵陈15 g、虎杖15 g组成。膈下逐瘀汤,由灵脂6 g、当归9 g、川芎6 g、桃仁9 g、丹皮6 g、赤芍6 g、乌药6 g、延胡索3 g、甘草9 g、香附4.5 g、红花9 g、枳壳4.5 g组成。方剂经2次水煎后,收集合并滤液,减压浓缩至1.5 g生药/mL,经高压灭菌后,4 ℃保存备用。
1.3造模和给药方法将60只SD大鼠随机分为正常组,模型组,膈下逐瘀汤组及化浊抗纤Ⅰ组、Ⅱ组、Ⅲ组,每组10只。除正常组外,其余各组均腹腔注射未经灭活的猪血清诱发大鼠肝纤维化,0.5 mL/kg,每周2次,共6周。诱发肝纤维化同时,模型组给予蒸馏水灌胃至第9周,膈下逐瘀汤组给予膈下逐瘀汤0.5 mL/(kg·d)灌胃至第9周,化浊抗纤Ⅰ组给予化浊抗纤保肝汤0.5 mL/(kg·d)灌胃至第9周,化浊抗纤Ⅱ组自造模的第3周给予化浊抗纤保肝汤0.5 mL/(kg·d)灌胃至第9周,化浊抗纤Ⅲ组自造模的第6周给予化浊抗纤保肝汤0.5 mL/(kg·d)灌胃至第9周。正常组腹腔注射生理盐水0.5 mL/只,每周2次,共6周,同时以蒸馏水灌胃至第9周。
1.4观察指标
1.4.1大鼠死亡情况末次灌胃后,统计各组大鼠死亡情况。
1.4.2大鼠肝功能及肝纤维化情况禁食24 h后,取血,分离血清,4 ℃保存备用,以检测肝功能(ALT、AST)及肝纤维化( HA、 LN和PCⅢ)指标。
1.4.3大鼠肝组织HE和Mallory染色病理表现颈部离断处死大鼠,暴露肝脏,取肝右叶,经4%中性甲醛固定,常规乙醇脱水,石蜡包埋,连续切片后封固。HE染色:4 μm组织切片,经二甲苯脱蜡,乙醇梯度水化,苏木素染色,1%的HCl乙醇溶液分化,0.2%的氨水返蓝,伊红染色,乙醇梯度脱水,二甲苯透明,中性树胶封片,10×10显微镜下观察。Malloy染色:4 μm组织切片,经二甲苯脱蜡,乙醇梯度水化,0.25%高锰酸钾溶液、2.5%草酸漂白,磷钨酸苏木素染色,95%乙醇分化,二甲苯透明,中性树胶封片,20×20显微镜下观察。
1.4.4大鼠肝组织中TGF-β1、TIMP-1、MMP-1蛋白表达情况采用免疫组化二步法检测:4 μm组织切片,二甲苯脱蜡,梯度乙醇水化;柠檬酸盐缓冲液(pH=6.0)高压抗原修复;滴加过氧化物酶阻断液,阻断内源性过氧化物酶活性,室温孵育10 min;滴加10%山羊血清封闭,室温孵育10 min;滴加一抗,4 ℃下孵育过夜;滴加生物素标记的二抗,室温孵育30 min;DAB显色,苏木素复染,梯度乙醇脱水,二甲苯透明,中性树胶封片。光学显微镜下观察判定免疫组化结果。
1.4.5大鼠肝组织中TGF-β1、TIMP-1、MMP-1mRNA表达情况提取各组大鼠肝组织总RNA,通过Northern blot杂交法检测各组大鼠TGF-β1、TIMP-1和MMP-1mRNA表达情况。

2 结 果
2.1各组大鼠一般情况实验结束时,模型组大鼠死亡3只,剩余7只;化浊抗纤Ⅱ组死亡2只,剩余8只;化浊抗纤Ⅲ组死亡1只,剩余9只。其他组大鼠无死亡。
2.2各组大鼠肝组织病理学表现
2.2.1HE染色表现正常组大鼠肝实质细胞正常,肝小叶完整,条索状的肝实质细胞围绕中央静脉呈放射状排列;模型组大鼠肝细胞严重肿胀,肝小叶破坏严重,大量肝细胞死亡,大量肝细胞脂肪变性呈空泡状,肝脏汇管区扩大可见大量纤维结缔组织增生,形成假小叶。膈下逐瘀汤组和化浊抗纤Ⅰ组大鼠肝小叶基本完整,肝细胞排列基本正常,未见各种明显病变;化浊抗纤Ⅱ组大鼠肝小叶基本完整,肝细胞排列基本正常,部分肝细胞脂肪变性呈空泡状;化浊抗纤Ⅲ组大鼠肝小叶尚正常,肝细胞排列尚整齐,许多肝细胞脂肪变性呈空泡状,病变区域较模型组小、较其他各组大,中央静脉周围可见空泡样变性。见图1~6。

图1 正常组大鼠肝组织HE染色病理表现(×100)

图2 模型组大鼠肝组织HE染色病理表现(×100)

图3 膈下逐瘀汤组大鼠肝组织HE染色病理表现(×100)

图4 化浊抗纤Ⅰ组大鼠肝组织HE染色病理表现(×100)
2.2.2Malloy染色表现正常组大鼠仅在肝脏汇管区偶见极少量胶原纤维,但未见纤维结缔组织增生,未形成假小叶;模型组大鼠肝小叶结构破坏严重,大量胶原纤维沉积,形成假小叶;膈下逐瘀汤组和化浊抗纤Ⅰ组大鼠肝小叶基本完整,汇管区可见极少量纤维细胞增生;化浊抗纤Ⅱ组大鼠肝小叶基本完整,可见胶原纤维沉积和纤维细胞增生;化浊抗纤Ⅲ组大鼠可见大量胶原纤维沉积和纤维结缔组织增生。见图7~12。

图5 化浊抗纤Ⅱ组大鼠肝组织HE染色病理表现(×100)

图6 化浊抗纤Ⅲ组大鼠肝组织HE染色病理表现(×100)

图7 正常组大鼠肝组织Mallory染色病理表现(×400)

图8 模型组大鼠肝组织Mallory染色病理表现(×400)
2.3各组大鼠血清ALT、AST水平比较模型组及各给药组大鼠血清ALT、AST水平均明显高于正常组(P均<0.05),各给药组大鼠血清ALT、AST水平均明显低于模型组(P均<0.05);膈下逐瘀汤组与化浊抗纤Ⅰ组各指标水平比较差异均无统计学意义(P均>0.05),化浊抗纤Ⅰ组与化浊抗纤Ⅱ组、化浊抗纤Ⅲ组比较差异均有统计学意义(P均<0.05),化浊抗纤Ⅱ组与化浊抗纤Ⅲ组比较差异均有统计学意义(P均<0.05)。见表1。
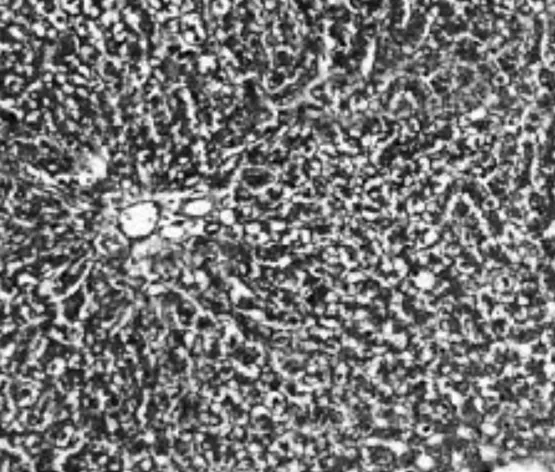
图9 膈下逐瘀汤组大鼠肝组织Mallory染色病理表现(×400)

图10 化浊抗纤Ⅰ组大鼠肝组织Mallory染色病理表现(×400)
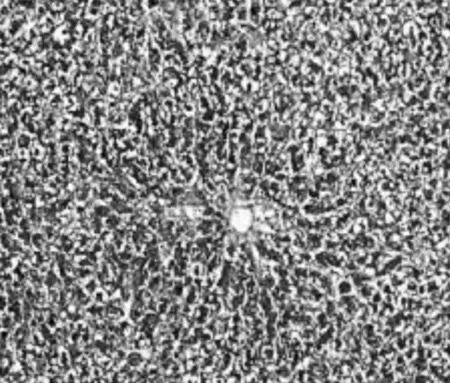
图11 化浊抗纤Ⅱ组大鼠肝组织Mallory染色病理表现(×400)

图12 化浊抗纤Ⅲ组大鼠肝组织Mallory染色病理表现(×400)

表1 各组大鼠血清ALT、AST水平比较
注:①与正常组比较,P<0.05;②与模型组比较,P<0.05;③与化浊抗纤Ⅱ组比较,P<0.05;④与化浊抗纤Ⅱ组比较,P<0.05。
2.4各组大鼠血清HA、LN和PCⅢ水平比较模型组及各给药组大鼠血清HA、LN和PCⅢ水平均明显高于正常组(P均<0.05),各给药组大鼠血清HA、LN和PCⅢ水平均明显低于模型组(P均<0.05);膈下逐瘀汤组与化浊抗纤Ⅰ组各指标水平比较差异均无统计学意义(P均>0.05),化浊抗纤Ⅰ组与化浊抗纤Ⅱ组、化浊抗纤Ⅲ组比较差异均有统计学意义(P均<0.05),化浊抗纤Ⅱ组与化浊抗纤Ⅲ组比较差异均有统计学意义(P均<0.05)。见表2。
2.5各组大鼠TGF-β1、TIMP-1、MMP-1蛋白与mRNA表达水平比较模型组及各给药组大鼠TGF-β1、TIMP-1蛋白与mRNA表达水平均明显高于正常组(P均<0.05),MMP-1蛋白与mRNA表达水平均明显低于正常组(P均<0.05)。各给药组TGF-β1、TIMP-1蛋白与mRNA表达水平均明显低于模型组(P均<0.05),MMP-1蛋白与mRNA表达水平均明显高于模型组(P均<0.05)。膈下逐瘀汤组与化浊抗纤Ⅰ组各指标水平比较差异均无统计学意义(P均>0.05),化浊抗纤Ⅰ组与化浊抗纤Ⅱ组、化浊抗纤Ⅲ组比较差异均有统计学意义(P均<0.05),化浊抗纤Ⅱ组与化浊抗纤Ⅲ组比较差异均有统计学意义(P均<0.05)。见表3及图13。

表2 各组大鼠血清HA、LN和PCⅢ水平比较
注:①与正常组比较,P<0.05;②与模型组比较,P<0.05;③与化浊抗纤Ⅰ组比较,P<0.05;④与化浊抗纤Ⅱ组比较,P<0.05。
3 讨 论
现代医学理论认为,肝细胞受到诸如病毒、乙醇等因素的刺激,导致肝枯否细胞分泌刺激因子,继而促进肝星状细胞转化为肌成纤维细胞,引起细胞外基质过度沉积,从而导致肝纤维化[6]。目前关于TGF-β1、TIMP-1、MMP-1和肝纤维化发生关系研究较多,其中TGF-β1属于对肝星状细胞具有广泛促进作用的活化因子之一,并且能够在该过程发生早期对肝星状细胞产生关键性调节作用,最终使得细胞外基质(ECM)大量沉积于肝脏中,诱导肝纤维化发生[7];TIMP-1是基质金属蛋白酶抑制剂中较为重要的组成部分,其过度表达可促进血管壁和胆管壁周围间质细胞增生,诱导肝纤维化形成;MMP-1是人类胶原纤维降解的关键因子,其表达水平越低,ECM沉积越严重,肝纤维化发生风险也越高[8]。由此可知,TGF-β1、TIMP-1过度表达和MMP-1表达受抑均在肝纤维化病理改变过程中具有重要推动作用。

表3 各组大鼠TGF-β1、TIMP-1、MMP-1蛋白表达水平比较
注:①与正常组比较,P<0.05;②与模型组比较,P<0.05;③与化浊抗纤Ⅰ组比较,P<0.05;④与化浊抗纤Ⅱ组比较,P<0.05。

A为正常组;B为模型组;C为膈下逐瘀汤组;D为化浊抗纤Ⅰ组;E为化浊抗纤Ⅱ组;F为化浊抗纤Ⅲ组
中医理论认为肝纤维化的病机为浊毒内结,使肝络瘀滞不通,气血壅滞,肝失濡养,导致坚积形成[9]。故应予化浊之法以断病之根本,行气活血以畅瘀滞肝脉,滋阴柔肝以滋耗伤之肝阴。化浊抗纤保肝汤即由此而设立,方中红景天益气扶正,绞股蓝、田基黄清热毒,利湿化浊,三者共为君药;黄芩、黄连苦寒燥湿浊,为臣药;佐以三棱行气破血,鳖甲滋养肝肾、养血生血;茵陈、虎杖活血、解热毒、利湿浊,共为佐使。现代药理研究表明,田基黄具有增强免疫、抗病毒、抗菌、抗氧化以及保肝等作用,田基黄中的主要成分田基黄苷、槲皮苷、异槲皮苷具有保肝退黄之效[10]。红景天具有清热解毒、扶正固本、理气养血和滋补强身及显著抗肝纤维化作用[11]。黄芩提取物具有抗肾间质纤维化作用[12],而黄连具有改善糖尿病肾纤维化作用[13]。鳖甲提取物有较强的抗肝纤维化作用,能有效抑制肝炎肝纤维化,改善肝功能[14]。
本研究结果显示,各造模组大鼠血清ALT、AST、HA、LN、PCⅢ水平及肝组织中TGF-β1、TIMP-1蛋白与mRNA表达水平均明显高于正常组,各给药组上述指标水平均明显低于模型组;各造模组大鼠肝组织中MMP-1蛋白与mRNA表达水平均明显低于正常组,各给药组大鼠肝组织中MMP-1蛋白与mRNA表达水平均明显高于模型组。膈下逐瘀汤组与化浊抗纤Ⅰ组各指标水平比较差异均无统计学意义,化浊抗纤Ⅰ组与化浊抗纤Ⅱ组、化浊抗纤Ⅲ组比较差异均有统计学意义,化浊抗纤Ⅱ组与化浊抗纤Ⅲ组比较差异有统计学意义。提示早期给予化浊抗纤保肝汤能明显减轻肝纤维化大鼠肝功能损伤和肝纤维化程度,其可能通过下调大鼠TGF-β1的表达而减少细胞外基质沉积,降低大鼠TIMP-1的水平而减轻TIMP-1对MMP-1的抑制作用,促进细胞外基质降解。
[1]Salazar-Montes AM,Hernández-Ortega LD,Lucano-Landeros MS,et al. New gene therapy strategies for hepatic fibrosis[J]. World J Gastroenterol,2015,21(13):3813-3825
[2]张凌云,王全楚. 肝纤维化的诊治进展[J]. 胃肠病学和肝病学杂志,2012,21(10):905-908
[3]张梦然,成军. 肝纤维化研究进展[J]. 国际消化病杂志,2014,34(6):374-379
[4]夏海珊,陈少茹,钟月春,等. 肝纤维化的发病机制和药物治疗现况[J]. 中国医药导报,2014,11(18):162-168
[5]Zhao CQ,Zhou Y,Ping J,et al. Traditional Chinese medicine for treatment of liver diseases:progress,challenges and opportunities[J]. J Integr Med,2014,12(5):401-408
[6]Trautwein C,Friedman SL,Schuppan D. Hepatic fibrosis:Concept to treatment[J]. J Hepatol,2015,62(1S):S15-S24
[7]欧阳灿晖,朱萱,张焜和,等. 熊果酸对肝纤维化大鼠肝组织TGF-β1和α-SMA表达的影响[J]. 世界华人消化杂志,2009,17(22):2237-2243
[8]杜宇琼,车念聪,赵晖,等. 黄芪对肝纤维化大鼠肝组织TIMP-1及MMP-1表达的影响[J]. 北京中医药大学学报,2013,36(11):775-778
[9]王永林. 肝纤维化的病因病机与中医药治疗初探[J]. 现代中西医结合杂志,2011,20(36):4693-4694
[10] 李沛波,杨翠平,王永刚,等. 田基黄苷抗大鼠肝纤维化作用的实验研究[J]. 中药材,2011,34(3):424-428
[11] 刘东璞,卢凤美,王明富,等. 红景天对大鼠肝纤维化肝脏组织中TIMP-1、Sand4表达的影响[J]. 中国老年学杂志杂志,2012,32(12):2556-2558
[12] 谢红东,杨珂,穆焕德,等. 黄芩提取物对大鼠肾间质纤维化的作用及其抗氧化机制[J]. 中国中西医结合肾病杂志,2009,10(3):240-242
[13] 刘慰华,刘世明,林双峰,等. 黄连素通过S1P2-MAPK信号通路抗糖尿病肾纤维化作用机制研究[J]. 中国药理学通报,2013,29(5):723-728
[14] 蔡庆春,王红玲,蒋士卿. 鳖甲丹红化纤方治疗慢性肝炎肝纤维化临床研究[J]. 中医学报,2015,30(5):728-730
Analysis of the effect and mechanisms of Huazhuo Kangxian decoction on liver fibrosis in rats with hepatitis
LI Ruidong
(The Second Affiliated Hospital of Xingtai Medical College, Xingtai 054000, Hebei, China)
Objective It is to investigate the effect and mechanism of Huazhuo Kangxian decoction on hepatitis liver fibrosis in rats. Methods 60 SD rats were randomly divided into normal control group, model control group, positive control group, Huazhuo Kangxian Ⅰ group, Ⅱ group, Ⅲ group, each group had 10 rats. All the rats in every group except in normal group were used to induce liver fibrosis by pig blood. All the groups were treated for 9 weeks by different approach. Liver function (AST, ALT) and serum HA, LN and PCⅢ of the rats were determined ; HE and Mallory staining was used to observe the changes of liver histopathology; immunohistochemistry and Northern Blot hybridization were used to detect the expression of TGF-β1, TIMP-1 and MMP-1. Results The levels of ALT, AST, HA, LN, PCⅢ, TGF-β1had significant differences in each group (P<0.05), the levels in model control group, positive control group, Huazhuo Kangxian Ⅰ group, Ⅱ group and Ⅲ group were significantly higher than that in the control group (P<0.05), the levels in positive control group, Huazhuo Kangxian Ⅰ group, Ⅱ group and Ⅲ group were significantly lower than that in model group (P<0.05). Compared with the positive control group, there was no significant difference in Huazhuo Kangxian Ⅰ group (P>0.05), but the levels increased in Huazhuo Kangxian Ⅱ and Ⅲ group (P<0.05). There were significant differences among Huazhuo Kangxian groups, in group Ⅰ was the lowest, in Ⅱ group was lower, and in Ⅲ group was the highest(P<0.05). The level of MMP-1 had significant differences in each group (P<0.05), the level in model control group, positive control group, Huazhuo Kangxian Ⅰ group, Ⅱ group and Ⅲ group were significantly lower than that in the control group (P<0.05), the level in positive control group, Huazhuo Kangxian Ⅰ group, Ⅱ group and Ⅲ group were significantly higher than that in model group (P<0.05). Compared with the positive control group, there was no significant difference in Huazhuo Kangxian Ⅰ group (P>0.05), but the level increased in Huazhuo Kangxian Ⅱ and Ⅲ group (P<0.05). There were significant differences among Huazhuo Kangxian groups, in group Ⅰ was the highest, in Ⅱ group was higher, and in Ⅲ group was the lowest(P<0.05). Conclusion Huazhuo Kangxian decoction can significantly relieve liver injury and hepatic fibrosis in rat liver. It may be mainly through the following two aspects to improve liver fibrosis in rats: on the one hand, by down-regulating the expression of TGF-β1in rats, reducing extracellular matrix deposition; on the other hand, decreasing TIMP-1 levels in rats, reducing TIMP-1 pair of MMP-1 inhibition, promoting degradation of extracellular matrix.
Huazhuo Kangxian liver decoction; liver fibrosis;impact mechanism
李瑞东,女,硕士,副主任医师,副教授,主要从事中西医结合诊治消化系统疾病的研究。
10.3969/j.issn.1008-8849.2016.17.005
R-332
A
1008-8849(2016)17-1837-05
2015-06-05

