血小板Gq活化与脑卒中的关系及相关药物研究进展
王思琪,杨李健,李运曼
(中国药科大学药学院,江苏南京211198)
血小板Gq活化与脑卒中的关系及相关药物研究进展
王思琪,杨李健,李运曼
(中国药科大学药学院,江苏南京211198)
脑卒中是世界上导致死亡的第二大病因,也是致残的主要原因.血小板Gq活化形成血栓并引发一系列炎症反应,在脑卒中的发生发展中起着关键作用.抑制血小板Gq功能可以有效降低脑卒中的发生风险,而且目前临床上常用的治疗脑卒中的药物也多与Gq通路有关.
血小板Gq活化;脑卒中;血栓;炎症;Gq通路药物
脑卒中是世界上导致死亡和残疾的主要原因[1].American Heart Association调查显示,在美国,脑卒中引起的死亡约占死亡率的5%,平均每40秒就有一人患此病,其中大约4分钟就会有一人死亡[2].在脑卒中的发病中,血小板活化起着重要作用.病理状况下的Gq介导的血小板异常活化会导致血栓形成,形成循环内的闭塞性血栓,最终导致脑卒中的发生[3].实验证明抑制血小板Gq功能可以有效降低脑卒中的发生风险[4],临床研究也表明,多种Gq功能拮抗药物,如阿司匹林、氯吡格雷、噻氯匹定,对脑卒中都有良好的效果[5].本文就血小板Gq活化在脑卒中发病中的作用及针对Gq通路的抗脑卒中药物的情况进行阐述.
1 Gq的结构和功能
G蛋白是一个能与鸟嘌呤核苷酸结合,具有GTP酶活性的蛋白家族,分为α、β、γ三种亚型,而Gq就是α亚型的成员.晶体结构研究显示,Gq是由三个胞外环和三个胞内环连接组成七个疏水跨膜区域,包含GTP酶结构域和一个螺旋结构域,其中GTP酶结构域参与对GTP的水解.Gq蛋白偶联的信号传导系统由Gq蛋白偶联受体、Gq蛋白和效应器分子组成.Gq蛋白是一个分子开关,传导由Gq蛋白偶联受体接收的信号,再以Gq蛋白解离亚基作为传导物,活化磷脂酶C(PLC),引起血小板活化[6].
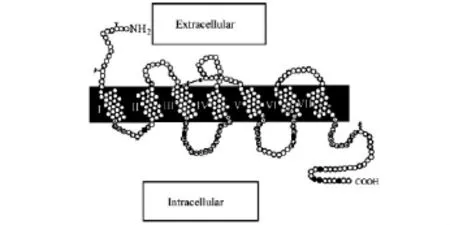
2 Gq介导的血小板活化过程
内源性的血小板激动剂,如ADP、TXA2和凝血酶与血小板膜上的Gq蛋白偶联受体相结合后,血小板被激活,Gq随之解离,继而PLC被活化.在PLC的作用下,磷脂酰肌醇分解生成三磷酸肌醇和二酰甘油,后者分别促进钙库中Ca2+动员和蛋白激酶(PKC)、丝裂原活化蛋白激酶(MAPK)的活化,最终导致糖蛋白Ⅱb-Ⅲa(GPⅡb-Ⅲa)变构暴露纤维蛋白原受体,在Ca2+作用下与纤维蛋白原结合,引发血小板聚集[7].同时,ADP、TXA2等内容物分泌至胞外作为次级激动剂进一步活化血小板.另外,血小板活化后胞内Ca2+浓度升高,Ca2+依赖的磷脂酶A2(PLA2)被激活并促进花生四烯酸大量释放[8],花生四烯酸在环氧合酶和血栓素合成酶作用下的分解为TXA2.总之,Gq介导的血小板活化是一个完整的网络.血小板的激活物与相应Gq偶联受体作用产生原发信号,通过几个信号转导通路的级联反应微妙的协调,调节血小板活性.
3 Gq活化与脑卒中
病理状况下,血小板膜Gq激活,血小板活化形成血栓,随血液循环流动,阻塞脑血管引发脑卒中,同时释放炎性介质诱发一系列炎症反应,加重脑组织损伤.而脑缺血再灌注也会导致Gq活化增强,使血小板黏附于白细胞和脑微血管内皮细胞,导致血栓和炎症,造成“无复流”现象和进一步的组织损伤[9].

3.1Gq活化与血栓
内源性激动剂与血小板膜Gq偶联受体结合激活胞内信号通路,引发血小板自身聚集及与白细胞等的黏附,随后凝血链锁反应被启动而产生凝血酶,同时Gq下游信号激活促进血小板颗粒不断分泌内容物加剧血小板活化,最终形成稳定的血栓[10].研究发现,血小板Gq缺陷的患者会表现出皮肤粘膜出血的症状[11].
3.1.1Gq偶联受体
3.1.1.1P2Y1受体:P2Y1是P2Y受体家族成员,在体内广泛分布并,在脑、前列腺、胎盘均有较高表达,也是血小板上的两种P2Y受体之一,但表达量相较于P2Y12较少,每个血小板约含有200-300个此受体.其胞外区结合核苷酸ADP,而胞内区则通过Gq蛋白激活PLC,促进胞内钙动员,升高磷酸肌醇含量,影响血小板变形,在血小板聚集的初始阶段发挥重要作用[12].实验证明,P2Y1缺失的血小板对诱导剂的反应性变弱,而过度表达P2Y1则会导致血栓发生率升高[13]. 3.1.1.2TXA2受体(TP):TP分为α、β两个亚型,在人体内分布广泛,其中在血小板上也有较高表达.TXA2与TP结合后,激活其偶联的G蛋白,一方面通过G12/13刺激血小板变形,另一方面通过Gq-PLC通路诱导血小板聚集和释放,促进形成稳定的聚集[14].研究表明,TP缺陷的小鼠血小板活性降低、出血时间延长[15],而TP突变的患者也表现出轻微的出血症状[11].
3.1.1.3蛋白酶激活受体(PAR):PAR是凝血酶受体,人血小板表达PAR1和PAR4两种亚型,凝血酶对PAR1亲和力较高,而PAR4则维持PAR1的功能.对小鼠的研究发现,鼠血小板不表达PAR1,而表达PAR3和PAR4两种亚型,PAR3和PAR4基因敲除小鼠动脉血栓形成受抑制,并且出血时间延长[16].
3.1.2Gq介导血小板分泌
3.1.2.1α-颗粒:α-颗粒是血小板内含量最丰富的分泌细胞器,内含黏附分子、生长因子、炎症因子等,颗粒膜表达P-选择素、CD36等蛋白[17].其中黏附分子vWF、纤维蛋白原介导血小板与内皮及血小板自身的黏附,在血栓形成过程中发挥重要作用.另有研究发现α-颗粒还含有GPⅠb-Ⅸ-Ⅴ、GPⅡb-Ⅲa、GPⅥ等黏附受体[18],约有1/2-2/3的GPⅡb-Ⅲa和1/3的GPⅥ贮存于静息血小板的α-颗粒,并随着血小板活化而表达,进一步刺激血小板,促进血栓形成.
3.1.2.2致密颗粒:致密颗粒是血小板内含量第二的分泌细胞器,内含ADP、ATP、5-HT、Ca2+等小分子物质,颗粒膜蛋白有P-选择素、CD63等并在血小板活化后转运至细胞膜.一方面致密颗粒分泌ADP作为次级诱导剂激活血小板,在血栓初级形成中起到关键作用;另一方面Ca2+对血小板变形依赖的肌动蛋白细胞骨架重组、血小板脱颗粒和GPⅡb-Ⅲa结合纤维蛋白原等血小板活化的多个阶段均发挥重要作用[19].除此以外,5-HT可以刺激血小板表面的5-HT2受体,引起Ca2+信号改变,放大血小板活化,导致血小板变形和血小板可逆聚集.同时,5-HT还能增强胶原、ADP等其他诱导剂对血小板的激活作用[20].
3.2Gq活化与炎症
血小板颗粒贮存黏附分子、细胞因子等多种炎性介质,随Gq激活而释放,加剧炎症细胞黏附渗出而致炎症恶性循环,又可损害细胞、血管和细胞外基质,结果致血脑屏障破坏、脑水肿和细胞死亡加剧.
3.2.1黏附分子:脑卒中发生后,P-选择素及免疫球蛋白超家族(ICAM、VCAM)表达升高,促进多形核白细胞迁移至缺血区,并沉积在缺血半球,同时加速微循环血栓形成,造成血管舒缩功能障碍,延迟脑血流恢复,造成“无复流”现象.实验证明,使用P-选择素、ICAM、VCAM抗体或抑制剂可以降低脑梗死率、改善神经功能、提高存活率,并可能成为重要的治疗靶点[21].
3.2.2白介素-1(IL-1):IL-1是一个重要的内源性促炎介质,在脑卒中发生后,加重脑血管内皮和神经元炎症反应,阻碍脑血流恢复并降低脑血管反应性,造成脑血管功能障碍,加重脑损伤[22].临床上抑制IL-1的作用可以有效缓解脑损伤症状,提高患者生存率.
4 针对Gq通路的抗脑卒中药物
4.1P2Y1拮抗剂
目前应用最广的P2Y受体拮抗剂氯吡格雷、普拉格雷均拮抗P2Y12受体,它们通过与P2Y12受体不可逆结合,有效降低脑卒中的复发率,氯吡格雷和普拉格雷分别为9.9%和12.1%,然而也具有较高的出血风险,分别为1.8%和2.4%[23].因此,拮抗P2Y1受体成为新的研究方向.MRS2500是一种稳定的P2Y1受体选择性拮抗剂,对动脉血栓形成具有抑制作用,并且对血栓综合症具有很强的保护作用,且仅伴随轻微的出血时间延长[24].
4.2PAR1拮抗剂Vorapaxar又名SCH530348,是目前世界上唯一完成了Ⅰ、Ⅱ、Ⅲ期临床试验的PAR1拮抗剂.临床结果表明,vorapaxar对血小板聚集有显著的抑制作用,在治疗心血管疾病方面具有一定的疗效,但同时也发现vorapaxar有出血不良反应,尤其是对有脑卒中病史的患者,脑颅内出血几率增加[25].另一种PAR1拮抗剂Atopaxar也完成了多项临床试验,并在安全性和有效性方面证明与vorapaxar无差异.F16618是近年来法国PierreFabre研究中心研发的PAR拮抗剂,已在动物体内显示出抗血小板、抗血栓活性[26].德国Bayer公司也发表了多篇PAR拮抗剂专利,如WO,2010136127和WO,2010136144.
4.3TXA2合成抑制剂
体内的TXA2源于花生四烯酸(AA)代谢,AA经环氧合酶(COX)分解为前列腺素(PGH2),再经血栓烷合成酶(TXS)转化成TXA2,作用于此过程的药物主要有COX抑制剂阿司匹林和TXS抑制剂奥扎格雷.阿司匹林通过非选择、不可逆地灭活血小板中COX活性,发挥抑制TXA2生成的作用,调查显示,高危患者长期应用阿司匹林可使复合血管事件的发生率降低25%,在美国,小剂量阿司匹林也被列为脑卒中急性期治疗的首选药物[27].然而近些年来,阿司匹林抵抗现象大量出现,促使研究者不断研发出新的COX抑制剂.三氟柳是一种类似于阿司匹林的药物,同样通过不可逆的抑制血小板COX,阻断TXA2的生成,在脑卒中的二级预防中与阿司匹林效果相当,但不同的是,三氟柳并不延长出血时间[28].奥扎格雷作为一种TXS抑制剂能够选择性抑制TXS,直接减少TXA2生成,并调节TXA2与PGI2之间的平衡,有效改善脑卒中患者的脑损伤.本实验室前期研究的药物N2也是一种TXS抑制剂,动物实验表明其对大鼠血小板聚集和血栓形成都有抑制作用,对脑缺血再灌注模型也有较好的保护作用,并且与氯吡格雷相比出血时间较短[29].
4.4TP拮抗剂
近些年研发出了大量的TP拮抗剂,然而由于毒性或疗效不佳,只有极少数进入了Ⅲ期临床试验,这其中就包括特鲁曲班(Terutroban).在一项针对脑卒中高发人群——外周动脉疾病患者的临床试验中显示,特鲁曲班耐受性良好,服药24小时后可以剂量依赖性的抑制血小板聚集,并与阿司匹林作用相当[30].另一项针对脑缺血患者的随机双盲实验显示,给予特鲁曲班(30mg/天)可将脑卒中发生率降低11%,与口服小剂量阿司匹林(100mg/天)效果相当,并且在出血倾向上无显著差异[31].除此之外,还有拮抗TP及抑制TXS的双靶点药物利多格雷、吡考他胺及EV-077.EV-077是一种新型的双靶点药物,对TP有很高的亲和性,可以有效抑制心血管疾病患者的血小板活性,并已经完成了Ⅱ期临床试验[32].
4.5中药
相比于化学药物显著的不良反应,中药以其疗效好、不良反应轻微的特点显示出独特优势.国家知识产权局受理的有关防治缺血性脑卒中的中药发明专利申请多达几十件,多种中药如银杏叶片、抗栓丸、葛根素注射液等均对脑卒中显示出良好的疗效.本实验室近期研究的药物丹参酮ⅡA是从唇形科植物丹参的干燥根及根茎提取的主要成分,对大鼠脑缺血再灌注模型的研究显示丹参酮ⅡA可以通过抑制ICAM-1、IL-1保护血脑屏障从而降低脑梗死、改善神经功能[33],另外有研究表明,丹参酮ⅡA对猪血小板聚集有抑制作用[34],因此推测丹参酮ⅡA对脑缺血的保护作用可能与其抑制血小板活化和血栓形成有关,后续研究还在进行中.
5 展望
综上所述,血小板Gq活化形成的血栓阻塞脑血流导致脑卒中发生,同时促进血小板分泌内容物加重这一过程,造成恶性循环;另一方面脑卒中再灌注后血小板Gq活性增强,造成“无复流”现象并加重脑损伤.目前针对TXA2通路相关靶点的药物依然是研究热点,上市数十年的阿司匹林仍然是临床试验的热点,但TXS抑制剂的临床结果却不尽如人意,不过这类药物及TXA2受体拮抗剂可能对伴有糖尿病的脑卒中患者有重要意义.另外针对P2Y1受体的拮抗剂也不断发现,是抗脑卒中治疗的新靶点.中药作为中国的传统药物,已在脑卒中的治疗中显示出良好的效果,并且相比之下副作用轻微,有望成为未来抗脑卒中治疗的重要研究方向.
〔1〕Rothwell PM,Algra A,Amarenco P.Medical treatment in acute and long-term secondary prevention after transient ischaemic attack and ischaemic stroke.The Lancet. 2011;377:1681-92.
〔2〕Mozaffarian D,Benjamin EJ,Go AS,Arnett DK,Blaha MJ,Cushman M,et al.Heart disease and stroke statistics--2015 update:a report from the American Heart Association.Circulation.2015;131:e29-322.
〔3〕Hansson GK.Inflammation,Atherosclerosis,and Coronary Artery Disease.New England Journal of Medicine. 2005;352:1685-95.
〔4〕Fuentes E,Fuentes F,Palomo I.Mechanism of the anti-platelet effect of natural bioactive compounds:role of peroxisomeproliferator-activatedreceptorsactivation. Platelets.2014;25:471-9.
〔5〕Gregory W.Albers M,Chair;Pierre Amarenco,MD;,J. Donald Easton MRLS,MD;and,Philip Teal M.Antithrombotic and Thrombolytic Therapy forIschemic StrokeThe SeventhACCPConferenceonAntithromboticand ThrombolyticTherapy.CHEST.2004;126:483S-512S.
〔6〕Sánchez-Fernández G,Cabezudo S,García-Hoz C, Benincá C,Aragay AM,Mayor F,et al.Gαq signalling:The new and the old.Cellular Signalling.2014; 26:833-48.
〔7〕Heber S,Volf I.Effects of Physical(In)activity on Platelet Function.BioMed research international.2015; 2015:165078.
〔8〕Burke JE,Dennis EA.Phospholipase A2 biochemistry. Cardiovascular drugs and therapy/sponsored by the International Society of Cardiovascular Pharmacotherapy. 2009;23:49-59.
〔9〕Pan J,Konstas AA,Bateman B,Ortolano GA,Pile-Spellman J.Reperfusion injury following cerebral ischemia:pathophysiology,MRimaging,andpotential therapies.Neuroradiology.2007;49:93-102.
〔10〕RUGGERI ZM.Platelets in atherothrombosis.NATURE MEDICINE.2002;8.
〔11〕Nurden A,Nurden P.Advances in our understanding of the molecular basis of disorders of platelet function. Journal of thrombosis and haemostasis:JTH.2011;9 Suppl 1:76-91.
〔12〕vonKugelgenI,HoffmannK.Pharmacologyand structure of P2Y receptors.Neuropharmacology.2015.
〔13〕B.HECHLER YZ,A.ECKLY,J-P.CAZENAVE,C.GACHET and K.RAVID.Lineage-specific overexpression of the P2Y1 receptor induces platelet hyper-reactivity in transgenic mice.Journal of Thrombosis and Haemostasis.2003;1:155-63.
〔14〕Offermanns S.Activation of platelet function through Gprotein-coupledreceptors.Circulationresearch. 2006;99:1293-304.
〔15〕Yan Cheng SCA,Bianca Rocca.Role of ProstacycUn in the Cardiovascular Response to Thromboxane A2. SCIENCE 2002;296:539-41.
〔16〕J.R.HAMILTON ICaSRC.Impaired hemostasis and protection against thrombosisin protease-activated receptor 4-deficient mice is due to lackof thrombin signalinginplatelets.JournalofThrombosisand Haemostasis.2004;2:1429-35.
〔17〕Blair P,Flaumenhaft R.Platelet alpha-granules:basic biology and clinical correlates.Blood reviews.2009;23: 177-89.
〔18〕Gaetan Berger J-MMaEMC.Alpha-Granule Membrane Mirrors the Platelet Plasma Membrane and Contains the Glycoproteins Ib,IX,and V.Blood.1996;87: 1385-95.
〔19〕Varga-Szabo D,Braun A,Nieswandt B.Calcium signaling in platelets.Journal of thrombosis and haemostasis:JTH.2009;7:1057-66.
〔20〕Bampalis VG,Dwivedi S,Shai E,Brandl R,Varon D, Siess W.Effect of 5-HT2A receptor antagonists on human platelet activation in blood exposed to physiologicstimuliandatheroscleroticplaque.Journalof thrombosis and haemostasis:JTH.2011;9:2112-5.
〔21〕Connolly ES,Winfree CJ,Prestigiacomo CJ,Kim SC, Choudhri TF,Hoh BL,et al.Exacerbation of Cerebral Injury in Mice That Express the P-Selectin Gene:Identification of P-Selectin Blockade as a New Target for the Treatment of Stroke.Circulation research.1997;81:304-10.
〔22〕Murray KN,Parry-Jones AR,Allan SM.Interleukin-1 and acute brain injury.Frontiers incellularneuroscience.2015;9:18.
〔23〕MackmanN.Triggers,targetsandtreatmentsfor thrombosis.Nature.2008;451:914-8.
〔24〕Hechler B,Nonne C,Roh EJ,Cattaneo M,Cazenave JP,Lanza F,et al.MRS2500[2-iodo-N6-methyl-(N)-methanocarba-2'-deoxyadenosine-3',5'-bisphosphate],a potent,selective,and stable antagonist of the platelet P2Y1 receptor with strong antithrombotic activity in mice.The Journal of pharmacology and experimental therapeutics.2006;316:556-63.
〔25〕David A.Morrow MD,M.P.H.,Eugene Braunwald, M.D.,Marc P.Bonaca,M.D.Vorapaxar in the secondary prevention of atherothrombotic events.N Engl J Med 2012;366:1404-13.
〔26〕Letienne R,Leparq-Panissie A,Calmettes Y,Nadal-Wollbold F,Perez M,Le Grand B.Antithrombotic activity of F 16618,a new PAR1 antagonist evaluated in extracorporeal arterio-venous shunt in the rat.Biochemical pharmacology.2010;79:1616-21.
〔27〕Edward C.Jauch M,MS,FAHA,Chair;Jeffrey L. Saver,MD,FAHA,Vice Chair.Guidelines for the Early Management of Patients With Acute Ischemic Stroke.A Guideline for Healthcare Professionals From the American Heart Association/American Stroke Association.Stroke.2013;44:870-947.
〔28〕European Stroke Organisation Executive C,Committee ESOW.Guidelines for management of ischaemic stroke andtransientischaemicattack2008.Cerebrovascular diseases.2008;25:457-507.
〔29〕Yang L,Chen X,Wang S,Fei Y,Wang D,Li Y,et al.N2 extenuates experimental ischemic stroke through platelet aggregation inhibition.Thrombosis research.2015.
〔30〕Fiessinger JN,Bounameaux H,Cairols MA,Clement DL,Coccheri S,Fletcher JP,et al.Thromboxane Antagonism with terutroban in Peripheral Arterial Disease: theTAIPADstudy.Journalofthrombosisand haemostasis:JTH.2010;8:2369-76.
〔31〕Marie-Germaine Bousser PA,Angel Chamorro,Marc Fisher,Ian Ford,Kim M Fox,Michael G Hennerici,Heinrich P Mattle.Terutroban versus aspirin in patients with cerebral ischaemic events(PERFORM)_a randomised,doubleblind,parallel-grouptrial.Lancet2011;377:2013-22.
〔32〕Rollini F,Tello-Montoliu A,Patel R,Darlington A, Wilson RE,Franchi F,et al.Pharmacodynamic effects of EV-077 in patients with diabetes mellitus and coronary artery disease on aspirin or clopidogrel monotherapy:results of an in vitro pilot investigation.Journal of thrombosis and thrombolysis.2014;37:131-8.
〔33〕Liu X,An C,Jin P,Liu X,Wang L.Protective effects of cationic bovine serum albumin-conjugated PEGylated tanshinone IIA nanoparticles on cerebral ischemia.Biomaterials.2013;34:817-30.
〔34〕Liu JQ,Lee TF,Miedzyblocki M,Chan GC,Bigam DL,Cheung PY.Effects of tanshinone IIA,a major component of Salvia miltiorrhiza,on platelet aggregation in healthy newborn piglets.Journal of ethnopharmacology.2011;137:44-9.
R743;R972
A
1673-260X(2016)03-0016-04
2015-12-25
李运曼教授,中国药科大学药学院生理教研室

