脑缺血后酪氨酸激酶1与神经细胞凋亡相关性及电针干预作用研究
刘荣, 余芳菲, 王琳, 许能贵
(广州中医药大学针灸康复临床医学院,广东广州 510006)
脑缺血后酪氨酸激酶1与神经细胞凋亡相关性及电针干预作用研究
刘荣,余芳菲,王琳,许能贵
(广州中医药大学针灸康复临床医学院,广东广州510006)
【目的】研究电针对局灶性脑缺血大鼠缺血侧皮层神经细胞凋亡及磷酸化酪氨酸激酶1(p-JAK1)表达的影响。【方法】采用热凝闭大脑中动脉法复制局灶性脑缺血模型,运用原位末端转移酶标记技术(TUNEL法)检测缺血侧病灶局部神经细胞凋亡指数,采用荧光免疫法观察局灶性脑缺血大鼠p-JAK1表达情况及电针干预作用。【结果】(1)电针组缺血侧皮质细胞凋亡表达在缺血后各时间段均低于模型组,以1 d、3 d时间相点尤为显著(P<0.01)。(2)模型组p-JAK1表达量与同时间段假手术组比较均显著增多(P<0.01),其中以1 d组表达量增高最为显著;电针组p-JAK1表达量增加,1 d、3 d组与同时段模型组比较差异均有统计学意义(P<0.05或P<0.01)。(3)p-JAK1与神经细胞凋亡相关性分析方面,JAK1磷酸化表达与神经元细胞凋亡在脑缺血高峰期(即缺血后1 d、3 d时间段)密切相关。【结论】电针治疗的介入能显著提高脑缺血早期缺血侧皮质JAK1的活性,激发机体自我保护机制,参与受损组织的修复。
脑缺血/针刺疗法;JAK1;细胞凋亡;脑/病理学;疾病模型,动物;大鼠
缺血性脑血管病是一种严重影响人类健康的常见病。针灸一直是缺血性中风的中医临床最常用的治疗手段,并在挽救缺血半暗带濒临死亡的神经元和促进损伤后神经功能的恢复方面有独特的疗效[1]。目前研究证明,脑缺血损伤引起的细胞凋亡多与白细胞介素、半胱氨酸蛋白酶(caspase)、原癌基因(c-fos)、肿瘤坏死因子-α(TNF-α)等家族参与有关,而酪氨酸激酶(JAKs)系统可能在以上因子发生作用的信号转导过程中起重要作用[2]。因此,研究JAKs在脑缺血后的调控机制,了解其在损伤区神经细胞凋亡发生过程中的作用机理及电针干预作用,对于探索电针治疗脑缺血的作用机理有着重要意义[3-4]。
本课题组前期研究工作初步证实,脑缺血后电针治疗可下调磷酸化酪氨酸激酶2(p-JAK2)、信号传导与磷酸化转录激活因子3(p-STAT3)蛋白的表达水平,阻断JAK2-STAT3信号转导通路的异常激活,为电针治疗脑缺血损伤的重要机制之一[5-7]。本研究采用TUNEL法检测各时段病灶局部神经细胞凋亡指数,采用荧光免疫法观察局灶性脑缺血大鼠p-JAK1表达情况及电针干预作用,以探讨脑缺血后JAK1与神经细胞凋亡相关性,进一步揭示电针治疗缺血性脑疾病的可能作用机制,现报道如下。
1 材料和方法
1.1实验动物SPF级SD大鼠90只,雄性,体质量200~220 g,由广州中医药大学动物实验中心提供,合格证号:SCXK(粤)2013-0020。按照区组随机化法将动物分为假手术组、模型组、电针组各30只,各组再分为2 h组、1 d组、3 d组3个时间段组,每小组10只大鼠。
1.2主要试剂原位末端细胞凋亡检测(TUNEL)试剂盒(天津灏洋生物工程有限公司);二氨基联苯胺(DAB)显色试剂盒(武汉博士德公司);山羊抗兔p-JAK1多克隆抗体(美国Santa公司);羊抗兔罗丹明B异硫氰酸标记抗体(RBITC/IgG,美国Santa公司)。
1.3主要仪器G6805-Ⅰ型电针仪(青岛鑫升厂);华佗牌无菌针灸针(0.3 mm×25 mm,苏州医疗用品厂);932型电热凝器(上海医疗器械八厂);Leica CM1950型冰冻切片机(德国Leica公司);蔡司AxioCam-MR显微镜(德国Zeiss公司)。
1.4局灶性脑缺血模型制备采用热凝闭大脑中动脉致局灶性脑缺血模型。用100 mg/L水合氯醛溶液,按3.3 mL/kg腹腔注射麻醉大鼠。沿耳眼连线中点切开皮肤,分离颞肌,暴露颞骨做一骨窗,显露大脑中动脉,用电热凝器轻触大脑中动脉,使之凝闭,造成局灶性脑缺血模型[8]。
1.5治疗方法电针组术后给予电针治疗,选取百会、大椎2穴。以1寸毫针(0.3 mm×25 mm,华佗牌,苏州医疗用品厂生产)向后平刺百会0.5寸,直刺大椎0.3寸,两穴接上G6805-Ⅰ型电针仪,采用疏密波,疏波为4 Hz,密波为20 Hz,疏密波调制频率为20次/min,强度1~2 mA,每次电针治疗30 min,每天治疗1次[6]。
1.6TUNEL法检测细胞凋亡步骤用新制备的40 g/L多聚甲醛溶液(溶于pH 7.4 PBS中)固定,用20 μg/mL蛋白酶K(试剂盒提供)于37℃恒温水浴箱孵育20 min;洗片后,与阻断剂(体积分数0.3%H2O2甲醇溶液)室温孵育30 min;PBS漂洗5 min×3次;通透液在冰浴中孵育2 min;PBS冲洗5 min×2次;滴加50 μL的TUNEL反应混合溶液(试剂盒提供),湿盒中37℃孵育60 min,阴性对照组滴加50 μL含有核苷酸混合液的反应液代替TUNEL反应混合溶液;PBS漂洗5 min×3次;信号转化与分析:吸干样品周围的水分,加入50 μL转化剂-POD(试剂盒提供),在湿盒中37℃孵育30 min;PBS漂洗5 min×3次;滴加DAB显色液,1 mL蒸馏水加显色剂A、B、C各1滴,混匀,加至标本上,室温孵育5~10 min,光镜下观察至显色程度恰当时,以蒸馏水洗终止反应;P BS漂洗5 min×3次;DAB显色,苏木精轻度复染。脱水,透明,晾干后中性胶封片。在目镜10×和物镜10×的视野下选取缺血灶周围区大脑皮质Ⅴ层大致相同部位为观察区域。在目镜10×和物镜40×的视野下,应用Image-PorPlus6.0图像分析系统测定凋亡细胞阳性反应物的平均光密度(Dmean)值。
1.7免疫荧光法检测将脑组织冰冻切片置于冷丙酮固定15 min,以0.01 mol/L的PBS(pH值7.4)漂洗10 min×3次,PBS/0.3%Triton浸泡5 min,PBS漂洗5 min×3次,5 g/L牛血清白蛋白(BSA)37℃封闭20 min,甩干封闭液。滴加p-JAK1山羊抗兔抗体(1∶200),37℃恒温水浴箱孵育1.5 h。阴性对照滴加PBS代替一抗。PBS漂洗5 min×3次。滴加RBITC/IgG(1∶50),37℃恒温水浴箱孵育1 h,PBS漂洗5 min×3次。晾干后,用抗荧光衰减封片剂封片,激光共聚焦扫描显微镜下进行荧光观察及拍片。光源用550 nm波长的激光激发绿色和红色荧光,扫描分辨率为1024×1024 pixel。以平均荧光强度的值来表示各组p-JAK1的表达量。
2 结果
2.1脑缺血后各组大鼠脑缺血灶周围区神经元凋亡的变化表1、图1结果显示:各时间段模型组凋亡细胞阳性反应物数量均显著增多,与假手术组比较,差异均有显著统计学意义(P<0.01);1 d、3 d电针组可显著降低凋亡细胞阳性反应物的数量,与模型组比较,差异均有统计学意义(P<0.01)。
表1 各组大鼠缺血灶皮质TUNEL阳性细胞检测结果比较Table 1 Comparison of TUNEL-positive cells in ischemic cortex of various groups (±s,Dmean)

表1 各组大鼠缺血灶皮质TUNEL阳性细胞检测结果比较Table 1 Comparison of TUNEL-positive cells in ischemic cortex of various groups (±s,Dmean)
①P<0.01,与假手术组比较;②P<0.01,与模型组比较
组别假手术组模型组电针组N 10 10 10 t=2 h 0.082 3±0.012 0 0.231 7±0.021 6①0.216 9±0.021 6①t=1 d 0.092 5±0.016 8 0.523 1±0.030 6①0.358 6±0.028 0②t=3 d 0.087 4±0.014 2 0.476 7±0.040 8①0.286 7±0.045 0②

图1 脑缺血后1d各组大鼠脑缺血灶周围区神经元凋亡情况(×400)Figure 1 Comparison of neuronal cell apoptosis in the area around cerebral ischemia foci of various groups on the first day after cerebral ischemia(×400)
2.2脑缺血后不同时间段各组脑组织p-JAK1免疫荧光检测结果激光共聚焦扫描显微镜下观察到p-JAK1荧光阳性反应物呈红色,神经元细胞核呈蓝色。表2、图2结果显示:各时间段模型组中p-JAK1荧光阳性反应物数量均显著升高,与假手术组比较,差异均有统计学意义(P<0.01);1 d、3 d电针组可显著增加p-JAK1荧光阳性反应物数量,与模型组比较,差异均有统计学意义(P<0.05或P<0.01)。
表2 各组大鼠缺血灶周围区p-JAK1免疫荧光法检测结果比较Table 2 Comparison of p-JAK1 level in the area around cerebral ischemia foci of various groups detected by immumofluorescence method (±s,I平均荧光强度)

表2 各组大鼠缺血灶周围区p-JAK1免疫荧光法检测结果比较Table 2 Comparison of p-JAK1 level in the area around cerebral ischemia foci of various groups detected by immumofluorescence method (±s,I平均荧光强度)
①P<0.01,与假手术组比较;②P<0.05,③P<0.01,与模型组比较
组别假手术组模型组电针组N 10 10 10 t=2 h 90.08±18.27 396.00±41.26①404.89±48.75①t=1 d 88.17±20.14 516.85±54.79①593.18±52.30②t=3d 86.33±35.18 473.95±40.24①568.11±46.77③
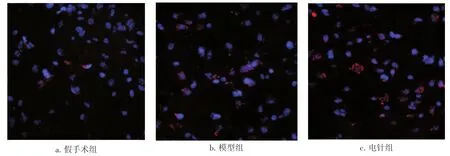
图2 脑缺血后1 d各组大鼠脑缺血灶周围区p-JAK1免疫荧光检测情况(×400)Figure 2 Immunofluorescence results of p-JAK1 in the area around cerebral ischemia foci of various groups on the first day after cerebral ischemia(×400)
2.3p-JAK1与神经细胞凋亡相关性分析表3显示:经正态分布检验后,双尾Pearson相关检验结果显示,脑缺血后2 h模型组p-JAK1平均荧光强度值与TUNEL细胞凋亡平均光密度值的相关系数r=-0.592,P>0.05,即相关无统计学意义,两个变量之间无相关性。脑缺血后1 d和3 d模型组p-JAK1平均荧光强度值与TUNEL细胞凋亡平均光密度值的相关系数分别为rs=-0.841,P<0.05,rs=-0.815,P<0.05,相关有统计学意义,脑缺血后1 d和3 d模型组p-JAK1与TUNEL细胞凋亡之间均存在负相关性。
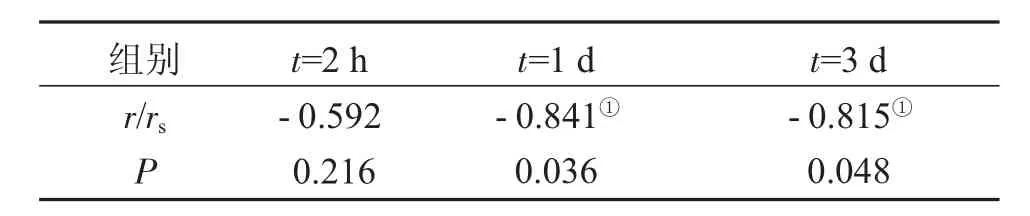
表3 p-JAK1与神经细胞凋亡相关性分析Table 3 Analysis of correlation of p-JAK1 with neural cell apoptosis
3 讨论
JAK1是JAKs激酶家族的成员之一,是一种重要的酪氨酸蛋白激酶,几乎在所有细胞中表达,其与γ链亚单位受体家族及gp130亚单位受体家族均可发生偶联反应。现有研究发现在发育及成年的脑内有广泛JAKs的表达及活化,随着脑发育的进程还存在着表达水平的变化,这表明JAKs激酶参与了脑的发育过程[9]。
脑缺血后脑组织JAK1的表达水平、分布以及活性等存在动态的变化,与脑缺血后的时程相关。Justicia等[10]用免疫荧光技术和 Western-blot检测JAK1在局灶性脑缺血大鼠模型大脑中的表达,研究发现,在缺血后第3天,缺血侧皮质和纹状体的星形胶质细胞中有大量JAK1免疫阳性细胞的表达,并一直持续到缺血第7天。其结果表明:大脑皮质缺血后,星形胶质细胞内JAK1活化可以诱导STAT3核转位,从而引发了胶质细胞在缺血后的各种反应。徐玉婷等[11]研究发现,在假手术组大鼠脑组织中仅有极少量的JAK1表达,脑缺血再灌注6 h后,JAK1表达开始增加,24 h达高峰,阳性细胞主要分布在梗死灶的边缘区及梗死区外的缺血区域内尚存活且结构完整的神经元中。于此同时,脑缺血半暗带神经元的凋亡发生于再灌注24~72 h,JAK1及其下游转录因子的表达高峰与神经元凋亡发生时间吻合,表明了JAK1信号通路的激活与脑缺血后神经细胞凋亡的基因调控过程密切相关。
本研究TUNEL细胞凋亡染色结果显示:假手术组大鼠脑组织内偶有少数细胞凋亡阳性反应物。大鼠脑缺血2 h后,在缺血侧脑组织皮质可见较多的凋亡细胞,脑缺血1 d后凋亡细胞的表达达到峰值,脑缺血3 d细胞凋亡阳性反应物仍处较高的表达水平。电针组在缺血后各时间段其细胞凋亡表达水平均低于模型组,以1 d、3 d时间相点尤为显著(P<0.01)。结果表明电针对神经元的保护作用在脑缺血后凋亡高峰时段更为突出,电针治疗对脑缺血后皮质神经元凋亡有明显的抑制作用。本研究运用免疫荧光结合激光共聚焦显微镜来观测电针对局灶性脑缺血大鼠缺血灶周围区JAK1磷酸化的影响。脑缺血后2 h大鼠缺血侧皮质即可检测到相当数量的JAK1磷酸化表达,缺血后1 d其含量继续上升。模型3 d组虽然较前有所下降,但与假手术组比较仍有显著性差异(P<0.01)。p-JAK1在脑缺血后缺血侧皮质的表达规律与以往研究的结果基本一致[6-9],其表达的峰值均是出现在脑缺血早期,可能是脑缺血后机体JAK1磷酸化介导的信号转导通路的应激反应,以起到减轻脑组织的损伤,提高受损神经元的修复能力的作用。电针1 d、3 d 组p-JAK1表达量与同时段模型组比较,差异有统计学意义(P<0.05)。表明电针治疗的介入能显著提高脑缺血早期缺血侧皮质JAK1的活性。
从p-JAK1与神经细胞凋亡相关性分析来看,JAK1磷酸化表达与神经元细胞凋亡在脑缺血高峰期(即缺血后1 d、3 d时间段)密切相关。此外,p-JAK1蛋白表达与TUNEL细胞凋亡分别呈负相关性,因此可认为JAK1和抗细胞凋亡有关。本研究结果显示:电针治疗的介入能显著提高脑缺血早期缺血侧皮质JAK1的活性,激发机体自我保护机制,参与受损组织的修复,这可能为电针治疗脑缺血损伤、抑制神经元凋亡的重要机制之一。
[1]刘荣,易玮,黄康柏,等.JAKs激酶在脑缺血损伤中的影响及针刺干预作用[J].辽宁中医药大学学报,2011,13(7):43.
[2]Planas A M,Gorina R,Chamorro A.Signalling pathway s mediating inflammatory responses in brain ischaemia[J].Biochem Soc Trans,2006,34(Pt 6):1267.
[3]Sun J J,Liu Y,Ye Z R.Effects of P2Y1 receptor on glial fibrillary acidic protein and glial cell line-derived neurotrophic factor production of astrocytes under ischemic condition and the related signaling pathways[J].Neurosci Bull,2008,24(4):231.
[4]Shyu W C,Lin S Z,Chiang M F,et al.Secretoneurin promotes neuroprotection and neuronal plasticity via the Jak2/Stat3 pathway in murine models of stroke[J].J Clin Invest,2013,118(1):133.
[5]刘荣,易玮,许能贵,等.脑缺血后JAK-STAT信号转导系统的调控及针刺干预作用[J].中国老年学杂志,2011,31(4):717.
[6]刘荣,许能贵,易玮,等.电针对局灶性脑缺血大鼠JAKSTAT信号转导通路的影响[J].神经解剖学杂志,2011,27(6):617.
[7]刘荣,许能贵.电针对局灶性脑缺血大鼠神经行为学及酪氨酸激酶JAK2的影响[J].中国老年学杂志,2015,35(8):4143.
[8]许能贵,易玮,马勤耘.电针对大鼠局灶性脑缺血后神经元损伤保护作用的研究[J].中国针灸,2000,20:237.
[9]刘荣.JAKs激酶在电针抗缺血性脑损伤中作用的研究[D].广州:广州中医药大学,2012:64.
[10]Justicia C,Gabriel C,Planas A M.Activation of the JAKs/STATs pathway following transient focal cerebral ischemia:signaling thigh Jakl and Stat3 in astrocytes[J].Glia,2000,30(3):253.
[11]徐玉婷,柳红,赵瑞波.亚低温对大鼠缺血性脑损伤后JAK1-STAT1通路的作用[J].临床与实验病理学杂志,2011,27(3):1862.
【责任编辑:黄玲】
Correlation of Janus Kinase 1 with Neuronal Cell Apoptosis After Cerebral Ischemia and Intervention Effects of Electroacupuncture
LIU Rong,YU Fangfei,WANG Lin,XU Nenggui
(Clinical Medical College of Acupuncture,Moxibustion and Rehabilitation,Guangzhou University of Chinese Medicine,Guangzhou 510006 Guangdong,China)
ObjectiveTo study the effect of electroacupuncture on neuronal apoptosis and phosphorylated-Janus kinase 1(p-JAK1)expression in the cerebral cortex of focal cerebral ischemia rats.Methods Rat model of focal cerebral ischemia was established by occlusion of the middle cerebral artery with heat-coagulation.We used TUNEL assay to detect the neuronal apoptosis in the cerebral cortex of focal cerebral ischemia rats,and applied fluorescence immunoassay to observe the p-JAK1 expression at different time points after ischemia. Results(1)The apoptotic neuron number of ischemic cortex in electroacupuncture group was lower than that in the model group,especially on the first day and third day of electroacupuncture(P<0.01).(2)The p-JAK1 expression level in the model group was obviously higher than that in the sham operation group at the same time period(P<0.01),the increase of the model group on the first day being more obvious.The differences of p-JAK1 expression between electroacupuncture group and model group on the first day and third day after ischemia were statistically significant(P<0.05 or P<0.01).(3)The p-JAK1 expression had close relation with neuronal apoptosis at the peak period of ischemia(on the first day and third day after ischemia).Conclusion Electroacupuncture intervention can significantly improve JAK1 activity of ischemic cortex on the early stage of cerebral ischemia,which can stimulate the body self-protection mechanism and participate in the repair of damaged tissue.
cerebral ischemia/acupuncture therapy;JAK1;apoptosis;brain/pathology;disease models,animal;rats
R246.9
A
1007-3213(2016)04-0510-05
10.13359/j.cnki.gzxbtcm.2016.04.017
2016-02-29
刘荣(1981-),女,医学博士,讲师;E-mail:liurong@gzucm.edu.cn
许能贵(1964-),男,博士研究生导师,研究员;E-mail:75093604@qq.com
广东省自然科学基金博士启动项目(编号:2014A030310051)

