人参皂苷Rh2对LoVo细胞迁移和转移能力的影响及机制研究
张晓圆, 李荣江, 孙继贤, 孙砚辉, 张苗苗, 伍志学, 张韧, 邝枣园
(1.广州中医药大学基础医学院生物技术系,广东广州 510006;2.深圳市宝安区中心医院普外科,广东深圳 518102)
人参皂苷Rh2对LoVo细胞迁移和转移能力的影响及机制研究
张晓圆1,李荣江2,孙继贤1,孙砚辉1,张苗苗1,伍志学1,张韧1,邝枣园1
(1.广州中医药大学基础医学院生物技术系,广东广州510006;2.深圳市宝安区中心医院普外科,广东深圳518102)
【目的】 探讨人参皂苷Rh2对人结肠癌LoVo细胞迁移和转移能力的影响。【方法】通过四甲基偶氮唑盐(MTT)比色法测定不同浓度Rh2对LoVo细胞增殖的影响,并确定用于研究抑制LoVo细胞迁移和转移功能作用的Rh2浓度和作用时间。设置空白对照组及Rh2实验组(5、10、20、40、60 μmol/L),通过划痕试验,对LoVo细胞划痕加药处理24 h后,观察不同浓度Rh2对细胞迁移的影响。采用Transwell法观察不同浓度Rh2对细胞转移的影响。采用Western blot检测不同浓度Rh2对CD44、基质金属蛋白酶2(MMP2)、基质金属蛋白酶抑制剂2(TIMP2)、E-Cadherin和β-catenin表达水平的影响。【结果】MTT结果显示:0~40 μmol/L Rh2处理LoVo细胞24 h对其生长无明显影响。随Rh2作用时间的延长和浓度的增加,Rh2对LoVo细胞抑制作用逐步增强。划痕试验和Transwell结果表明:随着Rh2浓度增加,其对LoVo细胞迁移和转移能力的抑制作用增强,20 μmol/L以上浓度的Rh2处理LoVo细胞24 h与空白对照组比较具显著抑制作用。Western blot结果表明:随着Rh2浓度的升高,CD44、MMP2蛋白表达水平下降,TIMP2、E-Cadherin和β-catenin蛋白表达水平上升。【结论】人参皂苷Rh2对人结肠癌LoVo细胞迁移和转移能力有抑制作用,其抑制作用具有时间和浓度依赖性。
人参皂苷Rh2;LoVo细胞;细胞迁移;细胞转移;蛋白表达;细胞培养
我国结肠癌的发病率呈逐年上升的趋势,联合化疗和生物治疗有助于提高患者的5年生存率,然而,其药物本身的毒副作用极大限制了其应用范围。随着传统医学的复兴,越来越多的中药以及中药单体被应用于临床科学试验[1-3]。人参皂苷Rh2是人参中分离提纯的一种单体,其在各种肿瘤的相关研究中有着较为显著的作用,研究表明:Rh2能有效抑制人肝癌细胞SMMC-7721[4]、人结肠癌细胞Caco-2和HT-29[5]、小鼠宫颈癌细胞U14[6]、人食管癌细胞Eca-109[7]、马立克氏病肿瘤细胞系MSB-1[8]、人白血病多药耐药(MDR)细胞K562/ VCR[9-10]的增殖,提高机体免疫力[11],引起肿瘤细胞凋亡,导致肿瘤生长受到抑制[12]。然而,针对人参皂苷Rh2对结肠癌转移的实验研究,目前尚无研究报道。
目前,体外研究肿瘤细胞的转移能力主要采用Transwell实验。Transwell实验通过检测体外肿瘤细胞的迁移和侵袭能力来判断肿瘤细胞转移能力的高低[1-2]。本研究拟采用Transwell实验检测人参皂苷Rh2对体外结肠癌LoVo细胞的迁移和侵袭能力的影响,并初步探讨其分子机制,现报道如下。
1 材料与方法
1.1细胞和试剂人结肠癌细胞LoVo株由香港科技大学赠送;Rh2购自上海雅吉生物科技有限公司(Cat No.A0241,纯度大于982.6 mg/g),溶于二甲基亚砜(DMSO)中配成10 mmol/L母液分装冻存备用;四甲基偶氮唑盐(MTT)购自美国Sigma公司;胎牛血清、液体培养基RPMI-1640和细胞培养用2.5 g/L胰酶购自美国Gibco公司;胶原预包被的Transwell(Cat No.3422)购自美国Corning公司;兔抗人 β-Tubulin(BM1453)、β-catenin (BA0426)、CD44(BA0321)、基质金属蛋白酶MMP2(BA3716)、基质金属蛋白酶抑制剂TIMP2 (BA0576-2)和E-Cadherin(BA0475-2)抗体均购自武汉博士德生物工程有限公司。
1.2主要仪器Boxun SW-CJ-2F型双人双面净化工作台(中国上海博迅实业有限公司医疗设备厂);Thermo Fisher Scientific细胞培养箱(美国赛默飞世尔科技公司);Motic AE2000倒置显微镜(中国麦克奥迪实业集团有限公司);IX71荧光显微镜(日本Olympus公司);i’Mark 680酶标仪(美国Bio-Rad公司);Bio-Rad电泳转膜仪(美国Bio-Rad公司)等。
1.3MTT法测定不同浓度Rh2对LoVo细胞增殖的影响5×103/孔LoVo细胞接种于96孔板内,完全培养基培养过夜,加入0、5、10、20、40、60 μmol/L Rh2分别处理24、48、72 h,每个浓度做6个平行孔,采用酶联免疫检测仪于490 nm处测取每孔的吸光度(D)值。
1.4Rh2对LoVo细胞迁移的影响将细胞密度为5×105个/mL的LoVo细胞铺于24孔板(每孔500 μL)上,加入含体积分数10%胎牛血清的RMPI-1640培养液,培养16~24 h,使形成单层细胞,换成无血清培养基继续培养过夜;用200 μL移液枪枪头在单层细胞上呈“一”字划痕,用磷酸盐缓冲液(PBS)清洗3次;加入5、10、20、40、60 μmol/L无血清培养基配制Rh2溶液,平行2个样本,孵育24 h,在倒置荧光显微镜下观察并拍照。最后通过计数爬入“一”字划痕空白区域内的细胞数来反映细胞的迁移能力。
1.5Rh2对LoVo细胞转移的影响待测细胞培养至对数生长期,消化细胞,用PBS和无血清培养基先后洗涤1次;用无血清培养基悬浮细胞,计数,调整浓度为2×105/mL,在24孔板(下室)加入600 μL含体积分数15%血清的培养基;上室用70 μL无血清培养基培养箱孵育3 min,吸弃培养基后加入经过不同浓度的人参皂苷Rh2处理的100 μL细胞悬液;继续在孵箱培养24 h,用镊子小心取出chamber,吸干上室液体,移到预先加入约800μL甲醇的孔中;室温固定30min,取出chamber,吸干上室固定液,移到预先加入约800 μL Giemsa染液的孔中;室温染色30 min,轻轻用PBS冲洗浸泡数次,取出chamber,吸去上室液体,用湿棉棒小心擦去上室底部膜表面上的细胞,用小镊子小心揭下膜,底面朝上晾干;移至载玻片上,显微镜下随机取9个大小一致的视野计数,统计结果。最后通过计数穿膜细胞数来反映细胞的转移能力。
1.6Western blot检测CD44、MMP2、TIMP2、ECadherin和β-catenin表达具体方法参见文献[12],对Rh2处理后的细胞进行裂解提取蛋白,经十二烷基硫酸钠—聚丙烯酰胺凝胶电泳(SDS-PAGE)分离后转印。转印好的聚偏二氟乙烯(PVDF)膜封闭后依次加入相应一抗和二抗,膜入发光液中孵育后,用化学发光荧光成像系统对图像进行扫描,最后对蛋白条带进行灰度值分析。
1.7统计方法应用SPSS 17.0统计软件进行数据统计分析。计量资料以均数±标准差(±s)表示,两组之间的比较采用t检验法分析;多组间的比较采用单因数方差分析法分析,组间两两比较采用SNK-q检验法分析。按α=0.05水平,以P<0.05为差异有统计学意义。
2 结果
2.1Rh2对LoVo细胞活性的影响为了排除药物的细胞毒性或细胞增殖作用对迁移和转移功能的影响,首先采用MTT法检测不同浓度Rh2对LoVo细胞生长的影响。表1结果显示:与空白对照组比较,采用浓度为5、10、20、40 μmol/L Rh2处理LoVo细胞24 h后,细胞生长无明显抑制,差异无统计学意义;当Rh2浓度≥60 μmol/L处理24 h、浓度≥40 μmol/L处理48 h、浓度 ≥ 20 μmol/L处理72 h时,LoVo细胞生长明显受到抑制,差异有统计学意义(P<0.05或P<0.01),提示人参皂苷Rh2对LoVo细胞活力的影响有时间和浓度依赖性。所以在后续实验中,把Rh2作用浓度控制在40 μmol/L以内,作用时间为24 h进行研究。
表1 不同浓度人参皂苷Rh2处理不同时间后对LoVo细胞生长的抑制作用Table 1 The inhibition of different concentrations of Rh2 on the growth of LoVo cells at different time points(±s)

表1 不同浓度人参皂苷Rh2处理不同时间后对LoVo细胞生长的抑制作用Table 1 The inhibition of different concentrations of Rh2 on the growth of LoVo cells at different time points(±s)
①P<0.05,②P<0.001,与对应时间点的空白对照组比较
组别 c/(μmol·L-1)N D(λ=490 nm)空白对照组Rh2 1组Rh2 2组Rh2 3组Rh2 4组Rh2 5组Rh2 6组0 5 1 0 20 40 60 80 6 6 6 6 6 6 6 t=24 h 0 0.02±0.03 0.03±0.01 0.05±0.02 0.06±0.03 0.10±0.02①0.21±0.04②t=48 h 0 0.03±0.02 0.07±0.03 0.08±0.02 0.10±0.02①0.23±0.04②0.29±0.07②t=72 h 0 0.04±0.05 0.06±0.04 0.10±0.02①0.15±0.02②0.31±0.04②0.45±0.05②
2.2Rh2对LoVo细胞迁移能力的影响图1、图2结果显示:5~60 μmol/L浓度Rh2对LoVo细胞迁移的影响结果,随着药物浓度增加对细胞迁移能力的抑制增强,20 μmol/L以上浓度的Rh2处理LoVo细胞24 h,与空白对照组比较有显著抑制作用(P<0.05)。

图1 不同浓度Rh2对LoVo细胞迁移的影响(×200)Figure 1 Effects of different concentrations of Rh2 on the migration of LoVo cells observed under inverted fluorescence microscope(×200)
2.3Rh2对LoVo细胞转移功能的影响图3、图4结果显示:5~60 μmol/L浓度Rh2对LoVo细胞转移的影响,随着药物浓度增加对细胞转移能力的抑制增强,20 μmol/L以上浓度的Rh2处理LoVo细胞24 h,与空白对照组比较有显著抑制作用(P<0.05),结果与抑制迁移能力一致。
2.4Rh2对CD44、MMP-2、TIMP-2、E-Cadherin、βcatenin蛋白表达的影响图5、图6结果显示:5~60μmol/L的Rh2对各蛋白表达的影响,随着Rh2药物浓度的升高,与空白对照组比较,CD44、MMP2蛋白表达水平显著下降(P<0.05),TIMP2、E-Cadherin、β-catenin蛋白表达水平显著上升(P<0.05)。

图2 各浓度Rh2对LoVo细胞迁移能力的影响Figure 2 Effects of different concentrations of Rh2 on the migration of LoVo cells(±s,N=3)

图3 不同浓度Rh2对LoVo细胞转移的影响(×400)Figure 3 Effects of different concentrations of Rh2 on the transfer of LoVo cells observed under inverted fluorescence microscope(×400)
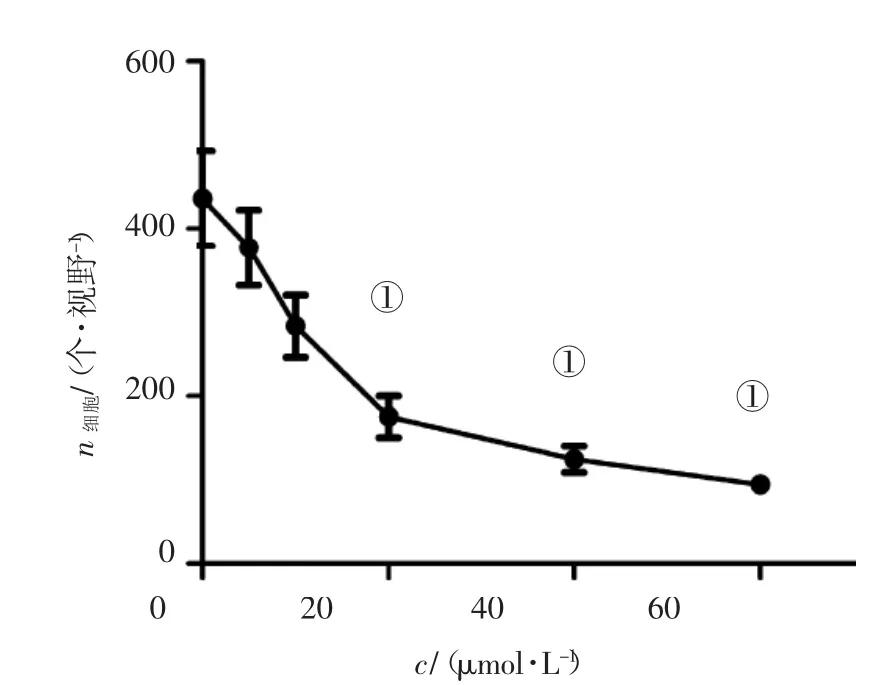
图4 各浓度Rh2对LoVo细胞转移能力的影响Figure 4 Effects of different concentrations of Rh2 on the transfer of LoVo cells (±s,N=9)

图5 各组CD44、MMP2、TIMP2、E-Cadherin和βcatenin表达凝胶电泳图Figure 5 Gel electrophoresis results for CD44,MMP2,TIMP2,E-Cadherin and β-catenin expression in different groups
3 讨论
结肠癌是胃肠道中常见的恶性肿瘤,晚期治疗效果不佳,恶性肿瘤发生侵袭和转移是最终导致患者死亡的主要原因。人参皂苷Rh2单体能抑制癌细胞生长并诱导其凋亡,逆转其异常分化,抑制肿瘤转移能力,与化疗药物联合应用能提高疗效、减少副作用。本研究结果显示:一定浓度的人参皂苷Rh2能显著抑制LoVo细胞的迁移和转移能力,且抑制作用随着药物浓度的增加而增强,结果与陶丽华、朴丽花、Kim和姚兴军等[13-17]关于人参皂苷Rh2能显著抑制肿瘤细胞的迁移和转移能力的报道相一致。

图6 各组CD44、MMP2、TIMP2、E-Cadherin和β-catenin表达比较Figure 6 Comprison of CD44,MMP2,TIMP2,E-Cadherin and β-catenin expression levels in different groups (±s,N=3)
肿瘤细胞的转移能力与肿瘤细胞内异常表达的某些分子密切相关。β-catenin和E-Cadherin基因介导细胞与细胞之间的黏附,与细胞黏附分子CD44相互作用,它们的低表达有助于肿瘤细胞的扩散和转移[18-20]。而细胞基底膜的降解是肿瘤远处转移的重要因素,基质金属蛋白酶(MMPs)与组织抑制因子(TIMP)的平衡对维持细胞基底膜的完整具有重要作用[21]。上调β-catenin、E-Cadherin基因表达,促进细胞黏附,下调MMP2并同时上调TIMP2基因表达,阻止细胞外基质的降解,并进而降低与肿瘤远处转移黏附分子CD44基因的表达,可以起到抑制肿瘤侵袭与转移的作用。
恶性肿瘤的主要生物学特性之一就是肿瘤的浸润与转移,恶性肿瘤从原位增殖性病变发展到侵袭、转移等复杂过程,其与降解酶类、黏附分子、癌细胞运动能力及其受体等多种原因都分不开,细胞外基质的降解、基底膜完整性的破坏,是肿瘤细胞完成浸润转移的先决条件[21]。阻止肿瘤细胞浸润扩散的天然屏障是基底膜,正常基底膜是由Ⅳ型胶原等成分构成的致密网状结构,固有细胞不能正常通过[22]。细胞外基质的降解主要由蛋白水解酶来完成,基质金属蛋白酶MMPs是一类锌离子依赖的细胞外蛋白水解酶,能够降解基底膜,促进恶性肿瘤细胞的侵袭和转移。MMPs活性的主要调节因子是组织金属蛋白酶抑制剂(TIMPs),TIMPs能够与激活状态的MMPs,即TIMP2与MMP2结合,从而能够抑制MMPs的产生及其活性,是肿瘤发生恶变与转移的阻抑因素[23]。陈磊峰等[24]研究证实在原发性肝癌细胞中降低MMP2的表达可以抑制肝癌细胞侵袭和迁移。王文祥等[21]实验结果表明TMIP2的表达与非小细胞肺癌伴淋巴结转移呈负相关,即伴有淋巴结转移的肺癌组织中TMIP2的表达减弱。卢锦娥等[25]研究说明在宫颈癌演变过程中,细胞通过TIMP2表达水平的上调从而起到抑制癌细胞的浸润、转移特性。本研究结果表明:随着Rh2药物浓度的升高,MMP2蛋白表达水平下降,TIMP2蛋白表达水平上升,二者维持在一个相对平衡稳定的状态,阻止了细胞外基质的降解,从而抑制了人结肠癌细胞LoVo细胞的迁移和转移。
E-Cadherin是广泛存在于各类上皮细胞中的钙依赖性跨膜糖蛋白,主要介导同型细胞间的黏附反应,除具有调节胚胎组织的发育、组织形成、参与细胞与细胞间信息传递交流等作用外,对促进细胞的黏附聚集、维持上皮形态结构完整性、维持细胞极性和参与分化调节也至关重要。E-Cadherin在肿瘤细胞中的表达缺失使细胞间的同质黏附力下降,导致肿瘤易于扩散和转移[20,26]。包俊杰等[26]通过实验发现,从正常乳腺组织发展到乳腺癌组织再到腋窝转移淋巴结组织的过程中,E-Cadherin表达逐渐减少。翁密霞等[20]也通过实验结果表明,ECadherin的下调与缺失和非小细胞型肺癌的进展、分化及转移密切相关。吴继锋等[27]的研究结果显示,E-Cadherin表达与肿瘤的类型及分化有关,恶性程度越高、分化越差的肿瘤其E-Cadherin丧失越明显。本研究结果表明:E-Cadherin蛋白表达水平与Rh2药物浓度呈正相关,也证明了Rh2在抑制人结肠癌细胞LoVo细胞的迁移和转移方面的作用。
β-catenin主要位于细胞膜,主要功能为介导细胞间黏附和参与基因的表达。李进展等[28]研究发现,β-catenin在胃癌组织中的低表达率提示其与肿瘤转移的相关性,而E-Cadherin与β-catenin的正相关表达与协同作用提示了它们在肿瘤恶性转移中的意义。本研究结果中,随着Rh2药物浓度的升高,E-Cadherin与β-catenin的表达也呈正相关性的增长,为Rh2抑制人结肠癌LoVo细胞的迁移和转移提示重要意义。
CD44分子作为一种细胞表面跨膜糖蛋白的黏附分子,分布十分广泛。其主要参与细胞间及细胞与基质间的特异性粘连过程,在细胞的黏附、血管的形成和肿瘤的浸润和增殖中发挥重要作用[19]。姚杰等[29]通过对肺癌的淋巴结转移灶中CD44的表达状态的研究,发现原发灶CD44表达与转移淋巴结CD44表达呈正相关,提示患者肺癌病灶中的肿瘤干细胞标记物CD44表达越高,其发生淋巴转移的风险也就越高。本研究结果中,CD44蛋白表达水平随着Rh2药物浓度的升高而下降,再次验证了Rh2在抑制人结肠癌细胞LoVo细胞的迁移和转移方面的作用。
近年来,不止一种中药成方或中药单体被用于研究其对人结肠癌细胞LoVo细胞侵袭或转移能力的影响,例如安昌勇等[30]研究证实了槲皮素对人结肠癌细胞LoVo细胞处理48 h后,LoVo细胞增殖、侵袭能力受到明显抑制,其半数抑剂量(IC50)值约为40 μmol/L;李素云等[31]研究证实上海中医药大学附属医院的临床使用方扶正抑癌方含药血清大剂量组能有效降低LoVo细胞侵袭力和运动能力;郭颖等[1]研究证实了青蒿琥酯亦可抑制大肠癌细胞的侵袭能力。然而上述药物与人参皂苷Rh2比较,人参皂苷Rh2的用药剂量较小而且作用时间较快,具有明显优势,这无疑为临床结肠癌转移的治疗提供了新的方向。
综上所述,人参皂苷Rh2在体外培养试验中证实能抑制人结肠癌细胞LoVo细胞的迁移和转移能力,为临床结肠癌转移的治疗提供了依据,然而其抑制肿瘤转移的具体作用机制仍有待进一步研究证实。
[1]郭颖,郭建华,符航,等.青蒿琥酯对人大肠癌LoVo细胞侵袭影响的初步研究[J].中国药理学通报,2016,32(1):60.
[2]陈茜,陈丽娟,党媛媛,等.姜黄素对人子宫内膜癌细胞HEC-1-B侵袭转移的影响[J].西安交通大学学报(医学版),2016,37(1):134.
[3]张醇,杨雪,范霞,等.吴茱萸碱对人结肠癌lovo细胞生长的抑制作用[J].中国生物制品学杂志,2010,23(8):866.
[4]王华,周滨,郭星,等.人参皂苷Rh2对肝癌SMMC-7721细胞增殖和细胞骨架的影响[J].中国病理生理杂志,2011,27 (6):1226.
[5]李秋影,颜璐璐,马晓慧,等.20(S)-人参皂苷Rh2对人结肠癌细胞增殖和周期的影响[J].中成药,2011,33(11):1874.
[6]张兰兰,高文远,马晓慧,等.人参皂苷Rh2对宫颈癌U14荷瘤小鼠的治疗作用研究[J].中成药,2013,35(2):215.
[7]李丽,齐凤英,刘俊茹,等.人参皂苷Rh2对食管癌细胞Eca-109细胞周期的影响[J].中国中药杂志,2005,30(20):1617.
[8]王帅玉,付本懂,申海清,等.人参皂苷Rh2对MSB-1细胞的增殖抑制作用及其机理[J].中国兽医学报,2009,29(8):1052.
[9]徐晓军,石淑文,汤永民,等.人参皂苷Rh2抗白血病多药耐药细胞K562/VCR作用研究[J].中草药,2010,41(7):1131.
[10]王占峰,罗毅男,洪新雨,等.人参皂苷Rh-2抗肿瘤作用机制的研究[J].北华大学学报:自然科学版,2005,6(1):50.
[11]Liu X J,Tan Y H,Wu Y Y,et al.Inhibition and induction of apoptosis effects of Diosgenin on rat hepatoma cells CBRH7919 [J].Chin J Mod Med,2010,20(7):980.
[12]杜标炎,张小贺,谭宇蕙,等.六味地黄丸含药血清调控黑色素瘤B16细胞株缝隙连接蛋白表达的作用[J].广州中医药大学学报,2009,26(2):152.
[13]陶丽华,刘红岩,韩锐.20(R)-人参皂苷Rh2抗B16-BL6黑色素瘤转移的作用[J].辽宁中医杂志,2006,33(11):1505.
[14]朴丽花,金政,蔡英兰,等.人参皂甙Rh2抗乳腺癌细胞细胞侵袭和转移的实验研究[J].中国临床药理学杂志,2011,11 (4):867.
[15]朴丽花,金政,蔡英兰,等.人参皂甙对肝癌Bel-7402细胞侵袭和转移能力的影响[J].延边大学医学学报,2011,34 (1):40.
[16]Kim S Y,Kim D H,Han S J,et al.Repression of matrix metalloproteinase gene expression by ginsenoside Rh2 in human astroglioma cells[J].Biochem Pharmacol,2007,74(11):1642.
[17]姚兴军,洪新雨,刘兴吉,等.人参皂甙Rh2对脑胶质细胞瘤侵袭性的影响[J].中国实验诊断学,2005,2(3):36.
[18]袁霜雪,王东旭,伍秋香,等.白藜芦醇抑制HCT116结肠癌细胞增殖与Wnt/β-catenin的关系研究[J].中国药理学通报,2015,31(4):537.
[19]张秋菊,刘斌,邢传平,等.结直肠癌组织中ESA和CD44的表达及其临床病理意义[J].世界华人消化杂志,2009,17(14):1417.
[20]翁密霞,吴翠环,杨秀萍,等.E-cadherin、CD44v6和PCNA在非小细胞肺癌组织中的表达及意义[J].癌症,2008,27(2):191.
[21]王文祥,陈胜喜,文继舫,等.MMP2、MMP9、TIMP1、TIMP2和CD44V6在非小细胞肺癌中的表达及与转移、预后的关系[J].中国医学工程,2007,15(2):122.
[22]Dunst J,Haensgen G.Simultaneous radiochemotherapy in cervical cancer:recommendationsfor chemotherapy[J].Strahlenther Onkol,2001,177(12):635.
[23]Ueno N T,Yu D,Hung M C.Chemosensitization of HER-2/neu overexpressing human breast cancer cells to paclitaxel(Taxol)by adenovirus type 5 E1A[J].Oncogene,1997,15(8):953.
[24]陈磊峰,刘天德,杜晓红,等.原发性肝癌细胞中Rock2调控MMP2对其侵袭迁移的作用[J].肿瘤防治研究,2014,41 (1):35.
[25]卢锦娥,梁立治,瘳灿,等.MMP2及其抑制物TIMP2在宫颈癌发展中的作用[J].现代医院:专业技术篇,2008,8 (7):31.
[26]包俊杰,吴诚义.E-cadherin、N-cadherin与CD44+/CD24-/low表型在乳腺癌中表达的相关性及其意义[J].中国癌症杂志,2010,20(8):596.
[27]吴继锋,马伟,张红,等.Snail基因及其蛋白、E-cadherin蛋白在胃癌中的表达及其临床意义[J].中国组织化学与细胞化学杂志,2009,18(2):167.
[28]李进展,王媛媛,詹晓芬,等.胃癌组织中E-Cadherin、βcatenin蛋白表达及意义[J].实用医学杂志,2012,28(20):3345.
[29]姚杰,王志刚,童文先,等.肿瘤干细胞标记物CD133和CD44在肺癌原发灶及转移淋巴结中的表达情况[J].西南国防医药,2010,20(12):1300.
[30]安昌勇,谢刚,汤为学,等.槲皮素对结肠癌LOVO细胞增殖侵袭能力及癌胚抗原CEA表达的影响[J].中国临床药理学与治疗学,2013,18(1):24.
[31]李素云,周春仙,卫洪昌,等.扶正抑癌方含药血清对结肠癌Lovo细胞侵袭转移能力及TGE-β1与TβRⅡ蛋白表达的影响[J].上海中医药大学学报,2010,24(1):68.
【责任编辑:黄玲】
Effect of Ginsenoside Rh2 on Migration and Transfer Ability of LoVo Cells and Its Mechanism
ZHANG Xiaoyuan1,LI Rongjiang2,SUN Jixian1,SUN Yanhui1,ZHANG Miaomiao1,WU Zhixue1,ZHANG Ren1,KUANG Zaoyuan1
(1.Dept.of Biotechnology,School of Basic Medicine,Guangzhou University of Chinese Medicine,Guangzhou 510006 Guangdong,China;2.Dept.of General Surgery,Bao’an Central Hospital,Shenzhen 518102 Guangdong,China)
ObjectiveTo investigate the effect of ginsenoside Rh2 on the migration and transfer of human colon cancer LoVo cells.Methods Effects of different concentrations of Rh2 on the proliferation of LoVo cells were determined by methyl thiazolyl tetrazolium(MTT)method,and the correlation of the effects with Rh2 concentration and intervention time was also investigated.We set up the blank control group and the experimental groups(at 5,10,20,40,60 μmol/L respectively),and then applied the scratch test for observing the effect of treatment with different concentrations of Rh2 for 24 h on cell migration,and used Transwell method for the evaluation of the cell transfer.Western blot was used for detecting the expression level of CD44,matrix metalloproteinase 2(MMP2)and tissue inhibitor of metalloproteinase 2(TIMP2),ECadherin and β-catenin after treatment with different concentrations of Rh2.Results The results of MTT method showed that treatment with 0-40 μmol/L of Rh2 for 24 h had no effect on the growth of LoVo cells.With the prolongation of Rh2 intervention time and the increase of Rh2 concentration,inhibition of LoVo cells was also increased gradually.Scratch assay and Transwell method results showed that with the increase of Rh2 concentration,the inhibitory effect on LoVo cell migration and transfer was enhanced,and Rh2 over 20 μmol/L had obvious inhibitory effect on LoVo cells compared with the blank control group.The results of Western blot showed that with the increase of Rh2 concentration,CD44 and MMP2 protein expression levels decreased,andthe expression levels of TIMP2,E-Cadherin and β-catenin protein increased.Conclusion Ginsenoside Rh2 has inhibitory effect on human colon cancer LoVo cell migration and transfer, and its inhibition is in time-and concentration-dependent manner.
ginsenoside Rh2;LoVo cells;cell migration;cell transfer;protein expression;cell culture
R285.5
A
1007-3213(2016)04-0545-07
10.13359/j.cnki.gzxbtcm.2016.04.024
2016-03-01
张晓圆(1988-),女,硕士研究生;E-mail:396373192@qq.com
张韧(1977-),男,副教授;E-mail:zhangrenn@foxmail.com。邝枣园(1966-),女,教授;E-mail:zykuang-2005@qq.com
国家自然科学基金资助项目(编号:81102714);深圳市科技计划项目(编号:JCYJ20140415105244226)

