绿豆分离蛋白的葡聚糖糖基化改性研究
韩飞飞,李 杨,王中江,隋晓楠,齐宝坤,王 瑞,毕 爽,李秋慧,江连洲,2,*
(1.东北农业大学食品学院,黑龙江哈尔滨 150030;2.国家大豆工程技术研究中心,黑龙江哈尔滨 150030)
绿豆分离蛋白的葡聚糖糖基化改性研究
韩飞飞1,李杨1,王中江1,隋晓楠1,齐宝坤1,王瑞1,毕爽1,李秋慧1,江连洲1,2,*
(1.东北农业大学食品学院,黑龙江哈尔滨 150030;2.国家大豆工程技术研究中心,黑龙江哈尔滨 150030)
为改善绿豆分离蛋白(MBPI)的理化特性,利用葡聚糖(Dextran)接枝改性MBPI,并对改性后蛋白的溶解性、乳化特性、表面疏水性、亚基结构的变化进行研究。SDS-PAGE凝胶电泳分析结果表明,MBPI和Dextran接枝反应后生成了分子量较大的共价复合物,表面疏水性分析表明,相比于未处理蛋白,MBPI-Dextran共价复合物的表面疏水性含量降低,溶解性和乳化特性的研究表明,改性后的蛋白质溶解性和乳化特性得到不同程度的改善。
绿豆分离蛋白,糖基化,蛋白质改性
绿豆(Vignaradiate(L.))又名青小豆,录豆、植豆,属于豆科,蝶花亚科豇豆属一年生直立草本植物,原产印度、缅甸地区,在我国已有2000多年的种植历史[1]。绿豆是蛋白质的良好来源,蛋白含量为20%~30%,并且几乎不含有胀气因子[2]。绿豆蛋白的氨基酸组成与大豆和菜豆相当,并且复合FAO/WHO的标准[3]。然而,绿豆的加工应用主要集中在淀粉的利用方面,绿豆蛋白则多作为生产废料或动物饲料使用,造成了蛋白资源的严重浪费。采用适当的改性方法提高绿豆蛋白的某些功能性质以满足食品加工工业的需求是绿豆高值化利用的基础。
美拉德反应能够在加热过程中进行而不需要添加额外的化学试剂,被广泛认为是有效和安全的提高蛋白质功能性质的方法,包括提高蛋白质的溶解性[4]、乳化性、热稳定性[5]、抗氧化活性[6]。目前,许多不同的蛋白质例如大豆蛋白[7]、乳清蛋白[8]、大米蛋白[9]等和不同种糖进行糖基化反应以提高其功能性质已经被研究。葡聚糖是糖基化反应中应用最多的多糖,研究表明,葡聚糖糖基化对蛋白质的功能性质具有良好的改善效果。Zhang等人[10]研究了葡聚糖糖基化燕麦蛋白的乳化性,结果表明,燕麦蛋白-葡聚糖共价复合物制备的乳液相比于天然燕麦蛋白粒径更小,并且具有更好的储存稳定性。Laura等人[11]研究了β-乳球蛋白和葡聚糖之间的接枝反应,结果表明,反应产物的溶解性和热稳定性得到显著提高。
本文以绿豆蛋白为研究对象,利用葡聚糖糖基化改性绿豆分离蛋白,研究了不同反应条件下得到的绿豆分离蛋白-葡聚糖共价复合物的溶解性和乳化特性,并对相关机理进行探究,为绿豆分离蛋白的开发利用提供理论基础。
1 材料与方法
1.1材料与仪器
东北绿豆、福临门牌大豆色拉油市售;1-苯胺基-8-萘磺酸(ANS)Sigma公司;SDS-PAGE凝胶配制试剂盒北京创根胜泰科技有限公司;Lowry法测溶解度试剂盒上海荔达生物科技有限公司;其他试剂均为分析纯。
电子分析天平(0.0001 g)北京赛多利斯仪器系统有限公司;FD 5-3型冷冻干燥机美国SIM公司;高速均质机上海昂尼仪器仪表有限公司;722型分光光度计上海菁华科技仪器有限公司;GL-20G-Ⅱ高速冷冻离心机上海安亭科学仪器厂;F-4500荧光分光光度计日本HITACHI公司。
1.2实验方法
1.2.1绿豆分离蛋白的制备绿豆—浸泡12 h(料液比为1∶10,4 ℃)—去皮—磨浆—用2 mol/L NaOH调节pH为9—室温下搅拌20 min—10000×g离心30 min(4 ℃)—上清液用2 mol/L HCl调节pH为4—10000×g离心30 min(4 ℃)沉淀加水分散—用2 mol/L NaOH调节pH至中性—真空冷冻干燥(﹣50 ℃)—绿豆分离蛋白[12]。
1.2.2绿豆分离蛋白-葡聚糖接枝物的制备绿豆分离蛋白和葡聚糖(w/w=1∶1)溶解于磷酸盐缓冲溶液(pH7.8 0.2 mol/L)中,使蛋白浓度为10 mg/mL,室温搅拌2 h至完全溶解,置于80 ℃水浴锅中反应1~6 h,反应结束后迅速冲冷水使其冷却至室温,离心后上清液置于蒸馏水中透析24 h(4 ℃),冻干成粉后置于冰箱中备用。
1.2.3接枝度测定采用OPA法[13]。配制OPA试剂,此试剂要现配现用。准确称取40.0 mg的OPA溶解于1.0 mL甲醇中,再加入20%(w/w)的十二烷基硫酸钠(SDS)2.5 mL,硼砂(0.1 mol/L)25.0 mL,β-巯基乙醇100 μL,最后用蒸馏水定容到50 mL。测定时,取4.0 mL OPA试剂于试管中,加入200 μL样品,混合均匀,放入35 ℃水浴中反应2 min后在340 nm下测吸光值A340,另取4.0 mL OPA试剂于试管中,加入200 μL水作为空白对照。
接枝度可以用此公式计算:
其中:A0:接枝反应前溶液的吸光值;A1:接枝反应后溶液的吸光值。

1.2.5绿豆分离蛋白-葡聚糖共价复合物乳液的制备将绿豆分离蛋白、绿豆分离蛋白-葡聚糖共价复合物分别溶于磷酸盐缓冲溶液中(0.01 mol/L,pH7.0),室温搅拌2 h,在4 ℃过夜使蛋白充分水合。次日10000×g离心20 min,取上清液。测定蛋白浓度并稀释一定倍数,并添加一定量的大豆油,使最终乳液中含有10%(v/v)的大豆油和0.5%(w/v)的蛋白质。用高速均质机进行均质,转速20000 r/min,时间为1 min。
1.2.6乳液粒径的测定利用Malvern Mastersizer 2000 激光粒度仪测定乳液液滴的平均粒径和粒度分布。乳液液滴的平均粒径采用体积平均直径(d43)来表示。所有的测试均在25 ℃条件下进行,并且平行测定三次。
1.2.7表面疏水性测定表面疏水性的测定采用ANS荧光探针法[15]。用0.01 mol/L的磷酸缓冲液(pH7.0)配制不同浓度的蛋白质溶液(0.05、0.1、0.2、0.5、1 mg/mL)和8.0 mmol/L的1-苯胺基-8-萘磺酸(1-anilino-8-naphthalene-sulfonate,ANS)溶液。取20 μL ANS溶液加到4.0 mL蛋白质溶液中,混合均匀,迅速测定混合液的荧光强度,激发波长和发射波长分别是390、470 nm,激发和发射狭缝宽均为5 nm。以荧光强度对样品浓度作图,曲线的初始斜率即为蛋白质的表面疏水性(H0)。
1.2.8SDS-PAGE凝胶电泳的测定本实验参考Laemmli[16]的方法并稍加修改。分离胶浓度12%(w/v),包括12%凝胶储备液,0.375 mol/L Tris-HCl(pH 8.8),0.1% SDS,0.1%过硫酸铵,0.1% TEMED;浓缩胶采用5%(w/v),包括5%凝胶储备液,0.125 mol/L Tris-HCl(pH 6.8),0.1% SDS,0.1%过硫酸铵,0.1% TEMED。蛋白样品与上样缓冲液(100 mg SDS,0.25 mLβ-巯基乙醇,2 mg溴酚蓝,2 mL pH为8.0,浓度0.05 mol/L Tris-HCl,甘油2.0 mL,定容至10 mL配至浓度为1 mg/mL,然后在95 ℃下进行5 min的加热,上样量为10 μL。电泳过程恒压,浓缩胶电压80 V,分离胶120 V。染色剂为0.1%考马斯亮蓝R-250(甲醇∶冰乙酸=4∶1∶5)的混合溶液,脱色剂为(甲醇∶冰乙酸∶水=4∶1∶5)混合溶液。
采用标准蛋白:鸡蛋清溶菌酶(14.4 ku),牛奶β-乳球蛋白(18.4 ku),大肠杆菌REase Bsp981(25.0 ku),乳酸脱氢酶(35.0 ku),鸡蛋乳清蛋白(45.0 ku),牛血清白蛋白(66.2 ku)和β-半乳糖苷酶(116 ku)[17]。
1.3数据处理
本实验所有数据均重复实验三次,采用Origin9.1软件对实验数据进行作图及分析。
2 结果与讨论
2.1接枝度(DG)和褐变程度(A(420 nm))的分析
接枝度和褐变程度常被用来评价糖基化反应的程度。糖基化反应过程中,蛋白质中的游离氨基可以与多糖的羰基发生反应,形成共价复合物,使体系中的游离氨基逐渐减少,接枝度升高[18]。MBPI和Dextran反应产物的接枝度随反应时间的变化如图1所示。随着反应时间的延长,产物的接枝度不断增加。这是由于随着加热时间的延长,蛋白质链展开,从而暴露出更多的游离氨基参与到反应中,使接枝度不断增大[10]。

图1 绿豆分离蛋白-葡聚糖复合物接枝度 和褐变程度的变化Fig.1 DG degree of the glycosylation and browning of mung bean protein isolates-dextran conjugates注:样品1~6:反应1~6 h后得到的 绿豆分离蛋白-葡聚糖共价复合物,图3~图5同。
MBPI-Dextran共价复合物的褐变程度随反应的时间延长逐渐增强。有报道称[8],Maillard反应的高级阶段,糖类中的还原性羰基和蛋白质中的游离氨基的反应会生成含氮的棕色聚合物或共聚物。褐变程度的增加表明绿豆分离蛋白和葡聚糖在反应过程中生成了Maillard高级反应产物,并随时间的延长含量逐渐增加。
2.2SDS-PAGE凝胶电泳分析
图2为反应不同时间后得到的MBPI-Dextran共价复合物的电泳谱图。反应1 h后,(条带3),分离胶上端逐渐出现较宽的条带,这表明绿豆分离蛋白和葡聚糖反应后产生了较大分子量的复合物[14],随着反应时间的延长,靠近分离胶顶端的条带颜色逐渐加深,表明有越来越多的大分子量物质的生成。同时,分子量在18.4~66.2 ku之间的条带随着反应时间的延长逐渐变浅直至消失,表明这些范围内的蛋白亚基参与了糖基化反应。MBPI-Dextran共价复合物电泳图谱的这种变化与接枝度及褐变程度的变化情况相符。

图2 绿豆分离蛋白-葡聚糖复合物电泳图谱Fig.2 SDS-PAGE profiles of mung bean protein isolates-dextran conjugates注:条带M:蛋白质标准品;条带1:未处理绿豆分离蛋白; 条带2:绿豆分离蛋白和葡聚糖的混合物;条带3~8: 反应1~6 h后得到的绿豆分离蛋白-葡聚糖共价复合物。
2.3溶解性分析
图3为MBPI-Dextran共价复合物溶解性随反应时间的变化情况,随反应时间的延长复合物的溶解性逐渐增加后呈现出略微的下降,但糖基化处理组整体上溶解度均高于未处理的绿豆分离蛋白。这是因为反应的开始阶段,随着接枝度逐渐增大,由于糖链的引入为绿豆分离蛋白带来了亲水性羟基,使得蛋白质分子表面形成水化层,增加了绿豆分离蛋白的亲水性[19],也有研究表明适度的热处理对蛋白质的溶解性有一定的改善作用。随着反应时间的继续延长,接枝物的溶解性发生略微的下降,这是由于蛋白质分子进一步交联聚合的结果。这个结果与已有报道的研究结果相符[20-22]。
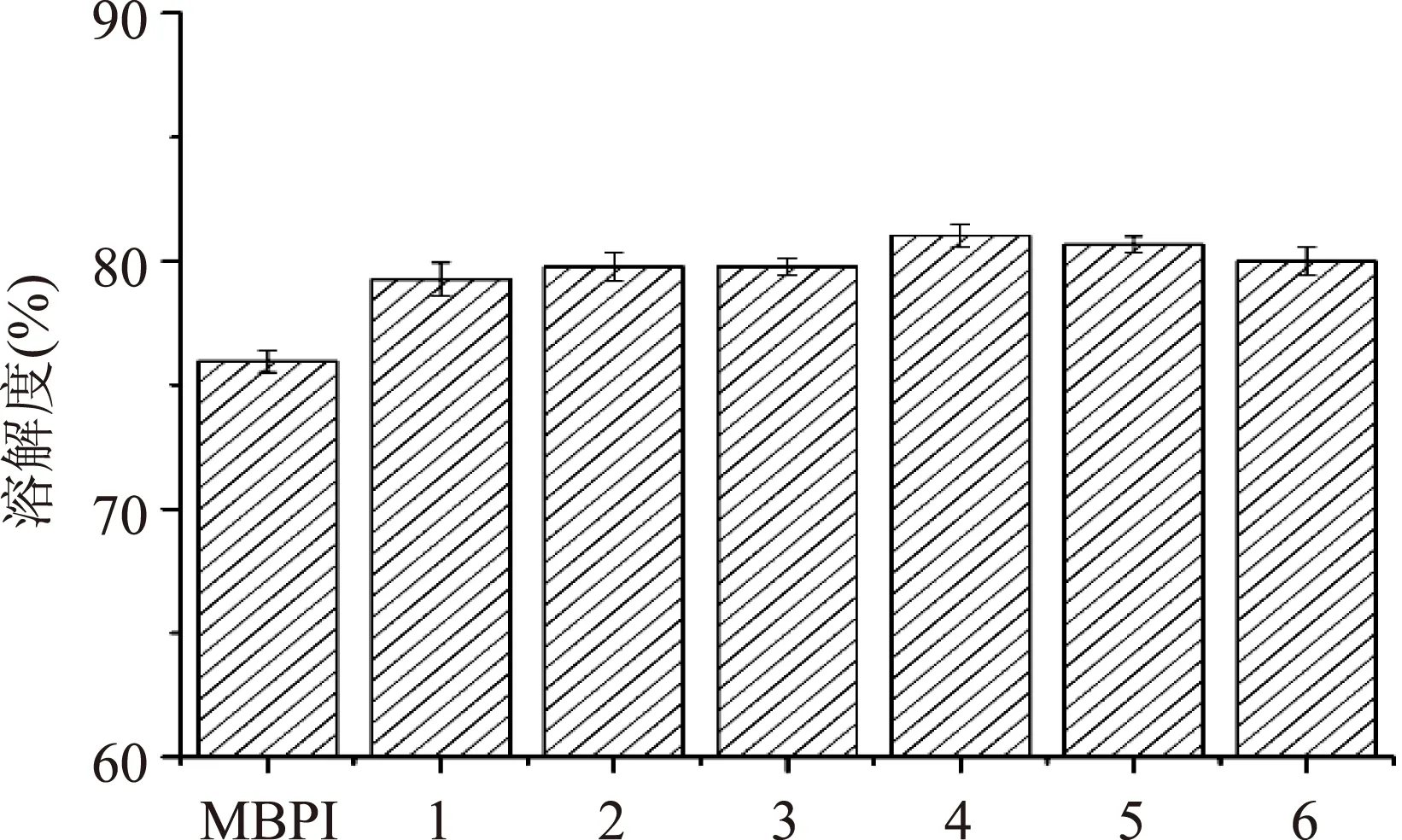
图3 绿豆分离蛋白-葡聚糖复合物的溶解性Fig.3 Solubility of mung bean protein isolates-dextran conjugates
2.4乳化特性分析

图4 绿豆分离蛋白-葡聚糖复合物乳液的 平均粒径及粒径分布Fig.4 The average particle size and particle size distribution of mung bean protein isolates-dextran conjugates emulsions
图4显示了MBPI-Dextran共价复合物制备的乳液的粒径大小及粒径分布情况。MBPI-Dextran共价复合物乳液的粒径比未处理MBPI的乳液粒径小,这是因为糖基化反应后多糖链中的亲水基团的引入,使得MBPI更有效的吸附到油-水界面上,界面的张力下降,从而提高蛋白的乳化活性[23],此外,液滴表面吸附的共价复合物分子由于具有较大的分子空间位阻效应,能够阻止新液滴的形成,从而促进了微小乳液颗粒的形成,使所得到的乳液体系更加稳定[24]。随着反应时间的延长,乳液液滴的粒径呈现出先减小后增大的趋势,但糖基化处理组的乳液液滴粒径整体上均小于未处理组。这是因为随着反应继续进行,接枝度不断增大,更多的亲水基团的引入会对油-水界面的平衡造成破坏,从而降低乳化活性[25]。
2.5表面疏水性分析
MBPI-Dextran共价复合物的表面疏水性(H0)如图5所示。可以看出,随着糖基化反应的时间延长,产物的H0不断下降。这是因为糖基化反应后Dextran和MBPI发生了共价结合,一方面,糖基化反应能减少蛋白分子内部疏水性基团的暴露,另一方面,具有亲水性基团的Dextran的接入增加了分子表面的亲水性[26]。结构紧凑的球蛋白内部包埋着大量的疏水性残基[27],当绿豆分离蛋白与葡聚糖发生共价复合后,多糖的遮蔽效应使得荧光探针难以进入蛋白质的内部与其发生结合,从而使H0下降[28]。此外,高温高湿的极性反应条件处理下,蛋白质分子之间会发生强烈的疏水相互作用和聚集作用,重新形成内部疏水区域,从而提高了蛋白质的亲水性[29]。研究表明[30],蛋白质的表面疏水性与蛋白质的溶解性、表面性质等功能性质有一定的联系,适当的减少蛋白分子的表面疏水性有利于蛋白质溶解度的提升,为其功能性的改善提供基础。

图5 绿豆分离蛋白-葡聚糖复合物的表面疏水性Fig.5 The surface hydrophobicity of mung bean protein isolates-dextran conjugates
3 结论
随着糖基化反应时间的延长,MBPI-Dextran接枝反应程度不断增加,接枝度和褐变程度不断增大;SDS-PAGE凝胶电泳分析表明,随着反应时间的延长,分子量较大的共价复合物逐渐形成,表明MBPI和Dextran之间发生了共价结合;疏水性的分析表明,糖基化处理能显著降低蛋白质的表面疏水性;经过改性后的蛋白质溶解性和乳化特性得到改善,改善效果随反应时间的延长呈现出先升高后降低的趋势。本研究表明在适当的反应条件下,利用Dextran共价修饰MBPI是一种有效的改善MBPI理化性质的途径。
[1]刘慧.我国绿豆生产现状和发展前景[J].农业展望,2012,8(6):36-39.
[2]Adsule R,Kadam S,Salunkhe D,Luh B.Chemistry and technology of green gram(Vigna radiata[L.]Wilczek)[J].Critical Reviews in Food Science & Nutrition,1986,25(1):73-105.
[3]El Adawy T.Chemical,nutritional and functional properties of mung bean protein isolate and concentrate[J].Menofiya Journal of Agricultural Research,1996.
[4]Saeki H,Inoue K.Improved solubility of carp myofibrillar proteins in low ionic strength medium by glycosylation[J].Journal of Agricultural and Food Chemistry,1997,45(9):3419-3422.
[5]O’Regan J,Mulvihill DM.Heat stability and freeze-thaw stability of oil-in-water emulsions stabilised by sodium caseinate-maltodextrin conjugates[J].Food chemistry,2010,119(1):182-190.
[6]Hattori M,Miyakawa S,Ohama Y,et al.Reduced immunogenicity ofβ-lactoglobulin by conjugation with acidic oligosaccharides[J].Journal of Agricultural and Food Chemistry,2004,52(14):4546-4553.
[7]Qi JR,Yang XQ,Liao JS.Improvement of functional properties of acid-precipitated soy protein by the attachment of dextran through Maillard reaction[J].International Journal of Food Science & Technology,2009,44(11):2296-2302.
[8]Jimenez-Castano L,Villamiel M,López-Fandio R.Glycosylation of individual whey proteins by Maillard reaction using dextran of different molecular mass[J].Food Hydrocolloids,2007,21(3):433-443.
[9]Li Y,Lu F,Luo C,et al.Functional properties of the Maillard reaction products of rice protein with sugar[J].Food Chemistry,2009,117(1):69-74.
[10]Zhang B,Guo X,Zhu K,et al.Improvement of emulsifying properties of oat protein isolate-dextran conjugates by glycation[J].Carbohydrate polymers,2015,127:168-175.
[11]Jiménez-Castao L,López-Fandio R,Olano A,et al.Study onβ-lactoglobulin glycosylation with dextran:effect on solubility and heat stability[J].Food Chemistry,2005,93(4):689-695.
[12]刘冬儿,吕天喜.绿豆分离蛋白的制备及其功能特性的研究[J].粮食与食品工业,2007,14(2):27-30.
[13]Church FC,Swaisgood HE,Porter DH,et al. Spectrophotometric assay using o-phthaldialdehyde for determination of proteolysis in milk and isolated milk proteins[J].Journal of Dairy Science,1983,66(6):1219-1227.
[14]Diftis N,Kiosseoglou V.Improvement of emulsifying properties of soybean protein isolate by conjugation with carboxymethyl cellulose[J].Food Chemistry,2003,81(1):1-6.
[15]Kato A,Nakai S.Hydrophobicity determined by a fluorescence probe method and its correlation with surface properties of proteins[J].Biochimica et Biophysica Acta(BBA)-Protein Structure,1980,624(1):13-20.
[16]Laemmli UK.Cleavage of structural proteins during the assembly of the head of bacteriophage T4[J].nature,1970,227(5259):680-685.
[17]李恒.人源 CFI_m 复合物识别 pre-mRNA 的分子机制及酵母 Pub1 蛋白结构的生物学研究[J].中国科学技术大学,2010.
[18]Laroque D,Inisan C,Berger C,et al.Kinetic study on the Maillard reaction.Consideration of sugar reactivity[J].Food Chemistry,2008,111(4):1032-1042.
[19]Bera M,Mukherjee R.Solubility,emulsifying,and foaming properties of rice bran protein concentrates[J].Journal of Food
Science,1989,54(1):142-145.
[20]Katayama S,Shima J,Saeki H.Solubility improvement of shellfish muscle proteins by reaction with glucose and its soluble state in low-ionic-strength medium[J].Journal of Agricultural and Food Chemistry,2002,50(15):4327-4332.
[21]Sato R,Sawabe T,Kishimura H,et al.Preparation of neoglycoprotein from carp myofibrillar protein and alginate oligosaccharide:improved solubility in low ionic strength medium[J].Journal of Agricultural and Food Chemistry,2000,48(1):17-21.
[22]Tanabe M,Saeki H.Effect of Maillard reaction with glucose and ribose on solubility at low ionic strength and filament-forming ability of fish myosin[J].Journal of Agricultural and Food Chemistry,2001,49(7):3403-3407.
[23]Ghosh S,Cramp GL,Coupland JN.Effect of aqueous composition on the freeze-thaw stability of emulsions[J].Colloids and Surfaces A:Physicochemical and Engineering Aspects,2006,272(1):82-88.
[24]Hall GM.Methods of testing protein functionality[J]. Springer Science & Business Media,1996.
[25]Dickinson E:Interfacial structure and stability of food emulsions as affected by protein-polysaccharide interactions[J]. Soft Matter,2008,4(5):932-942.
[26]Seo S,Karboune S,L’Hocine L,et al.Characterization of glycated lysozyme with galactose,galactooligosaccharides and galactan:Effect of glycation on structural and functional properties of conjugates[J].LWT-Food Science and Technology,2013,53(1):44-53.
[27]Hayakawa S,Nakai S.Relationships of hydrophobicity and net charge to the solubility of milk and soy proteins[J].Journal of Food Science,1985,50(2):486-491.
[28]Xue F,Li C,Zhu X,et al.Comparative studies on the physicochemical properties of soy protein isolate-maltodextrin and soy protein isolate-gum acacia conjugate prepared through Maillard reaction[J].Food Research International,2013,51(2):490-495.
[29]林花,于淑娟.牛血清白蛋白-葡聚糖接枝改性及机理研究[J].食品科学,2010(5):18-22.
[30]卓秀英.大分子拥挤环境下大豆蛋白接枝改性研究[D]. 广州:华南理工大学,2012.
Study on glycosylation of mung bean protein isolates and dextran
HAN Fei-fei1,LI Yang1,WANG Zhong-jiang1,SUI Xiao-nan1,QI Bao-kun1,WANG Rui1,BI Shuang1,LI Qiu-hui1,JIANG Lian-zhou1,2,*
(1.College of Food Science,Northeast Agricultural University,Harbin 150030,China;2.National Research Centre of Soybean Engineering and Technology,Harbin 150030,China)
In order to improve the physicochemical properties of mung bean protein isolates(MBPI),MBPI-dextran covalent conjugates were prepared via Maillard reaction,solubility,emulsifying properties,surface hydrophobicity and subunit structure were studied.SDS-PAGE gel electrophoresis analysis showed that larger molecular weight covalent conjugates were formed,surface hydrophobicity analysis showed that compared to the untreated protein,MBPI-dextran covalent conjugates had a lower surface hydrophobicity,physicochemical properties such as solubility and emulsifying properties were improved after glycosylation.
mung bean protein isolates;glycosylation;protein modification
2015-11-19
韩飞飞(1991-),女,在读硕士,研究方向:粮食、油脂及植物蛋白工程,E-mail:hffsunshine@163.com。
江连洲(1960-),男,博士,教授,研究方向:粮食、油脂及植物蛋白工程,E-mail:jlzname@163.com。
国家自然科学基金(31571876、31301501);国家科技支撑计划课题(2014BAD22B00);国家“863”计划(2013AA102101);黑龙江省自然科学基金项目(ZD201302);高等学校博士学科点专项科研基金(20132325110013);国家“863”计划(2013AA102104)。
TS214.9
A
1002-0306(2016)09-0049-05
10.13386/j.issn1002-0306.2016.09.001

