结合冠层光谱和叶片生理观测的小麦条锈病监测模型研究
艾效夷, 宋伟东, 张竞成, 王保通, 杨贵军, 黄文江
(1. 辽宁工程技术大学测绘与地理科学学院,阜新 123000; 2. 国家农业信息化工程技术研究中心,北京 100097; 3. 旱区作物逆境生物学国家重点实验室, 西北农林科技大学,杨凌 712100;4. 中国科学院遥感与数字地球研究所,数字地球重点实验室,北京 100094)
结合冠层光谱和叶片生理观测的小麦条锈病监测模型研究
艾效夷1,2,宋伟东1,张竞成2*,王保通3,杨贵军2,黄文江4
(1. 辽宁工程技术大学测绘与地理科学学院,阜新123000; 2. 国家农业信息化工程技术研究中心,北京100097; 3. 旱区作物逆境生物学国家重点实验室, 西北农林科技大学,杨凌712100;4. 中国科学院遥感与数字地球研究所,数字地球重点实验室,北京100094)
通过开展小麦条锈病接种试验,在多个关键生育期获取被动式的冠层光谱和主动式的叶片生理观测并开展病情调查。在此基础上,结合优选的光谱特征和生理特征采用偏最小二乘回归方法(PLSR)构建病情严重度反演模型,得到不同生育期精度表现最优的特征组合。结果显示,基于光谱观测的优选光谱特征和基于叶片生理观测的Flav(类黄酮相对含量)、Chl(叶绿素含量)的不同组合在小麦挑旗期、灌浆早期和灌浆期分别具有较佳表现,模型精度达到r2=0.90,RMSE=0.026。相比单纯采用光谱特征,综合冠层光谱和叶片生理观测能够使模型精度提高21%,表明两种数据的结合有利于提高病情严重度估测精度。上述研究可为小麦病害监测仪器的开发提供新的模式和思路。
光谱特征;叶片生理;小麦条锈病;PLSR;Dualex 4
小麦条锈病是一种发病率高的大区域流行性病害,给我国的小麦生产造成了极大损失[1]。每年国家投入大量农药用于防治该病。在田间对该病进行有效的监测,实时掌握病害发生的范围、程度,有助于判断病害的发展趋势,采取科学合理的防治措施,降低防治成本,减轻环境负荷。近年来,除传统病害田间调查外,一些无损快速诊断技术被应用于作物病害和其他胁迫的监测和诊断上[2]。这方面研究目前主要集中在基于光谱原理的探测方式上,包括被动式冠层光谱和主动式速测仪器等观测方式。在冠层光谱分析方面,目前,国内外学者对作物病虫害进行了大量研究,取得了一定的进展,研究内容大致分为以下两个方面:第一方面研究了病虫害胁迫光谱响应波段的位置,如竞霞等[3]利用ASD光谱仪测量棉叶光谱反射率,结果表明红光波段680~700 nm是棉花单叶黄萎病病情严重度识别的最佳波段;Liu等[4]通过ASD获取水稻稻穗的光谱信息,分析发现450~850 nm波段的反射率变化与水稻颖枯病具有相关性;第二方面研究基于各类植被指数进行病虫害监测,如Steddom等[5]利用归一化植被指数(NDVI)、花青素反射指数(ARI)对甜菜病害进行了监测;Yang等[6]采用绿度植被指数(GNDVI)和土壤调节植被指数(SAVI)对水稻病害进行监测,决定系数均达到0.8以上。另外值得注意的是,近年来基于光谱、荧光原理的主动式仪器被广泛应用于对作物生理活性及胁迫状态的诊断上。由于该类仪器以主动方式在相对密闭的环境中对作物进行观测,能够在很大程度上避免一些环境干扰,测量参数往往具有较高的精度和稳定性。Tremblay等[7-9]在玉米和小麦的研究中发现相对叶绿素含量(SPAD值)与相对多酚含量(Dualex值)的比值在氮营养状况诊断方面比单一指标更加敏感和稳定。Cerovic等[10]对玉米和小麦进行研究,结果表明Dualex估测叶片叶绿素浓度与实测值高度线性相关;余伟烽等[11]在对水稻的研究中也发现了类似的结果,Dualex估测的叶绿素值与水稻叶片叶绿素浓度成极显著线性相关(P<0.001)。
作物冠层光谱由于具有丰富的谱段信息,能够较灵敏地响应作物整体生长及环境状况。但引起冠层光谱变化的因素很多,关系较为复杂,因此冠层光谱与植物生理活性和生化状态的关系有时并不稳定。而基于光谱、荧光原理的主动式仪器由于能够获得较为稳定的植物生理活性和生化状态参量,与冠层光谱信息形成很好的互补关系。为此,本研究提出尝试将上述两种观测方式结合进行小麦条锈病监测。根据国内外文献调研,罕有该方面的研究或报道。本文以控制试验方式设置小麦条锈病发生现场及正常对照区域,基于经典的ASD Field Spec光谱仪和Dualex 4叶片测量仪在重要生育期中对作物进行观测,在特征优选的基础上构建小麦条锈病病情严重度反演模型,检验综合两种观测方式的模型是否有助于提高病情监测精度,并对应用可行性和可能存在的问题进行讨论。
1 材料与方法
1.1试验方案
试验地位于北京市昌平区小汤山国家精准农业示范研究基地。土壤有机质含量约为14 g/kg,碱解氮为63.3 mg/kg,速效钾为123.4 mg/kg。试验田块长100 m,宽50 m。本试验选用易感条锈病的‘京9843’。2014年4月5日采用喷雾法进行接种。接种菌源为甘肃省农业科学院植物保护研究所提供的条锈病夏孢子混合生理小种,设置0.03、0.09、0.12 mg/mL 3个不同的浓度梯度处理,以制造不同的发病梯度,每个处理设置2个重复。接种在17:00开始,用小型喷雾器将制备好的孢子悬浮液喷在植株叶片上,接种后盖上塑料薄膜,过夜,次日清晨9:30左右揭去塑料薄膜,完成接种。显症后分别在小麦挑旗期、灌浆早期和灌浆期进行冠层光谱和生理生化参数的测试。
1.2数据获取及测试
1.2.1冠层光谱测量
本研究冠层光谱获取采用美国ASD公司生产的ASD Field SpecPro FR(350-2500)便携式光谱仪(图1)。波长范围350~2 500 nm,波长精度±1 nm,采样时间10次/s,光谱采样间隔在350~1 050 nm范围内为1.377 nm;在1 000~2 500 nm范围内为2 nm;光谱分辨率在350~1 000 nm范围内为3 nm;在1 000~2 500 nm范围内为10 nm。观测时将探头垂直向下,高度始终保持离地面1.3 m,探头为25°视场角,地面视场范围直径为50 cm。每小区测量20次,每次测量前后均用标准的参考板进行校正,之后通过反射率值和DN灰度值进行转换。
(1)
计算出目标物的反射率值,将20次的反射率值平均,作为该小区小麦冠层光谱反射率值。所有测试均在晴朗无云天气条件下完成,并于地方时间10:00-14:00进行。

图1 ASD Field SpecPro FR (350-2500) 便携式光谱仪(左),Dualex 4叶片测量仪(右)Fig.1 ASD Field SpecPro spectrometer(left), Dualex 4(right)
1.2.2植物生理生化参数速测
采用法国Force-A公司开发的Dualex 4(Dx4)叶片测量仪获取小麦的类黄酮相对含量(Flav)、叶绿素相对含量(Chl)及氮平衡指数(NBI)(图1)。Dx4是新型的荧光传感器,通过双重激发的叶绿素荧光来获取叶片表皮的紫外光(375 nm)吸收率,进而评估叶片的类黄酮含量[12];Dx4估测叶片叶绿素含量所采用的波段为850 nm和710 nm,计算公式为:
(2)
其中Chl为Dx4估测的叶绿素浓度,T850和T710为850 nm和710 nm的叶片透射率,k为比例系数,c为校正系数[11]。当植物受到病害胁迫时,叶绿素被破坏,类黄酮作为植物抗毒素含量增加[13],引起NBI值的改变,即可对植物的病害状况进行实时监测。每个小区选取30片叶子进行测定,取其均值作为该小区的氮平衡指数、叶绿素相对含量和类黄酮相对含量。
1.2.3病情指数(DI)调查
主要采取5点调查法,即在条锈病开始出现病症后,在处理小区内调查反应型和严重度,每块小区选取对称的5点,每点约1 m2,随机选取30株小麦,分别调查其发病情况。病情严重度参照国家标准“小麦条锈病测报技术规范”(GB/T 15795)[14]进行量化。单叶严重度分为9个梯度,即:0%、1%、10%、20%、30%、45%、60%、80%和100%的叶片病斑覆盖。分别记录各严重度的小麦叶片数,计算病情指数。公式为:
(3)
其中,DI为病情指数,x各梯度的级值,n为最高梯度级值9,f为各梯度的叶片数。
1.3数据分析及处理
1.3.1植被指数计算
基于两种仪器获得的观测结果需要通过一些特征形式进行表示,作为病害监测模型输入变量。其中,冠层光谱数据则通过计算不同形式植被指数,用以表征作物某方面特征或状态。本研究系统归纳和整理了常用于作物病虫害监测的11个高光谱(Hyp)植被指数和9个多光谱(MS)植被指数(表1)。这些特征包括如SAVI等适用于减弱土壤背景影响的指数;短波红外水胁迫指数(SIWSI)、疾病水胁迫指数(DSWI)、水分胁迫指数(MSI)、水分指数(WI)等植被水分含量监测的指数;以及NDVI、ARI、三角植被指数(TVI)、比值植被指数(SR)、光化学植被指数(PRI)、氮反射率指数(NRI)、归一化叶绿素比值指数(NPCI)等在以往病害监测研究中被报道对小麦病害敏感的指数[15-16]。其中,多光谱植被指数参考Landsat-8 TM通道范围和响应,基于高光谱数据根据相关通道的通道响应函数进行积分得到宽波段反射率。再进一步基于这些转换后的宽波段反射率计算多光谱指数。本研究基于实测数据检验这些植被指数响应情况,对特征进行选择。
1.3.2植被指数优选
为提高模型效率和避免信息冗余,在1.3.1部分所述植被指数基础上,优选对病害敏感的植被指数作为模型输入变量。为此,本研究采用以下两个标准进行变量选择:首先,将植被指数逐一与DI进行相关性分析,相关性越高表明对病情严重度越敏感,保留相关性达到极显著水平(P<0.001)的植被指数进行后续分析。在此基础上,对植被指数进行逐对的相关分析,若R2>0.9,则淘汰与DI相关性相对较低的植被指数,直至剩余的指数间R2均低于0.9。上述流程对高光谱和多光谱指数独立进行分析,将满足条件的特征分别用于构建病情严重度反演模型。

表1 用于小麦条锈病病情监测的植被指数名称与形式1)Table 1 The names and forms of vegetation indexes for wheat stripe rust disease monitoring
1) RNIR表示近红外波段反射率;RR表示可见光-红波段反射率。
RNIR: Reflectance of near-infrared band; RR: Reflectance of red band.
1.3.3小麦条锈病病情严重度反演模型
本研究基于冠层光谱和植物生理生化两方面特征进行小麦条锈病病情严重度反演建模分析。其中,植物生理生化速测参数方面直接采用Dx4仪器测量的Chl、NBI、Flav;冠层光谱特征(SF)采用1.3.2部分优选特征。为比较不同特征组合对模型效果的影响,分别对下列8种变量组合形式逐一进行测试:(1)SFs;(2)SFs和Chl;(3)SFs和Flav;(4)SFs和NBI;(5)SFs和Chl、Flav;(6)SFs和Chl、NBI;(7)SFs和Flav、NBI;(8)SFs和Chl、Flav、NBI。在反演方法上,采用能够有效消减变量间相关性影响的偏最小二乘回归分析(partial least square regression,PLSR)进行建模和验证。在时相上,分别对小麦挑旗期和灌浆早期(S1)、灌浆期(S2)以及整个生育期进行独立的建模和验证分析,以得到不同时相下最优的特征组合及模型。由于小麦生育早期,病害发生程度较轻,植株生理生化组分变化不明显,因此本次将挑旗期和灌浆早期合并作为一个时期进行研究。在验证方面,采用留一的交叉验证方法进行评估,采用预测值与实测值的决定系数(R2)以及标准误差(RMSE)作为精度评价指标。
2 结果与分析
2.1光谱及与生理参数对病情的响应分析
由小麦条锈病病情指数与各生理生化参数之间在不同生育期及整个生育期的相关分析结果来看,小麦生理参数Chl、Flav、NBI在S1时期与DI之间相关性不显著(P>0.05),其中Flav和NBI相关系数分别为0.246和-0.317,Chl与DI几乎无相关性。而在S2和整个生育期,各参数特征与DI均达到极显著相关,Chl、Flav和NBI分别在S2和整个生育期与DI的相关系数达到最高值为0.663、0.601和0.714;以上结果可能的原因是,小麦被条锈病侵染初期,生理生化参数受病害影响较小,与DI相关性不高,但随着生育期的推进和病情严重度的加重,叶绿素大量被破坏,类黄酮含量增加,导致NBI减小,因而在发病率逐渐升高的小麦生育后期Chl、Flav、NBI可作为DI的估测因子。
基于1.2.4计算得到的11个高光谱植被指数和9个多光谱植被指数与DI进行相关性分析。小麦整个生育期多光谱植被指数与高光谱植被指数与DI间相关性均达到P<0.001的显著性水平(图2)。其中,多光谱植被指数MSI与DI的相关系数最高,R达到0.632。本次研究基于1.4.1部分内容分别筛选出MSI、ARI、NRI、PRI、WI5个高光谱植被指数和NDVI、GNDVI、SAVI、SIWSI、TVI5个多光谱植被指数共10个光谱特征用于构建病情反演模型。

图2 小麦整个生育期光谱特征与DI相关性分析结果Fig.2 The correlation analysis of wheat whole growth period spectrum characteristics and DI
图3展示了所选植被指数在小麦不同生育期与DI的相关系数,除GNDVI、SIWSI、MSI、WI这4个植被指数在S1时期与DI相关系数较小外,其余植被指数在小麦不同生育期与DI的相关性均达到显著相关,且S2时期的光谱特征对病害表现出较强的光谱响应。
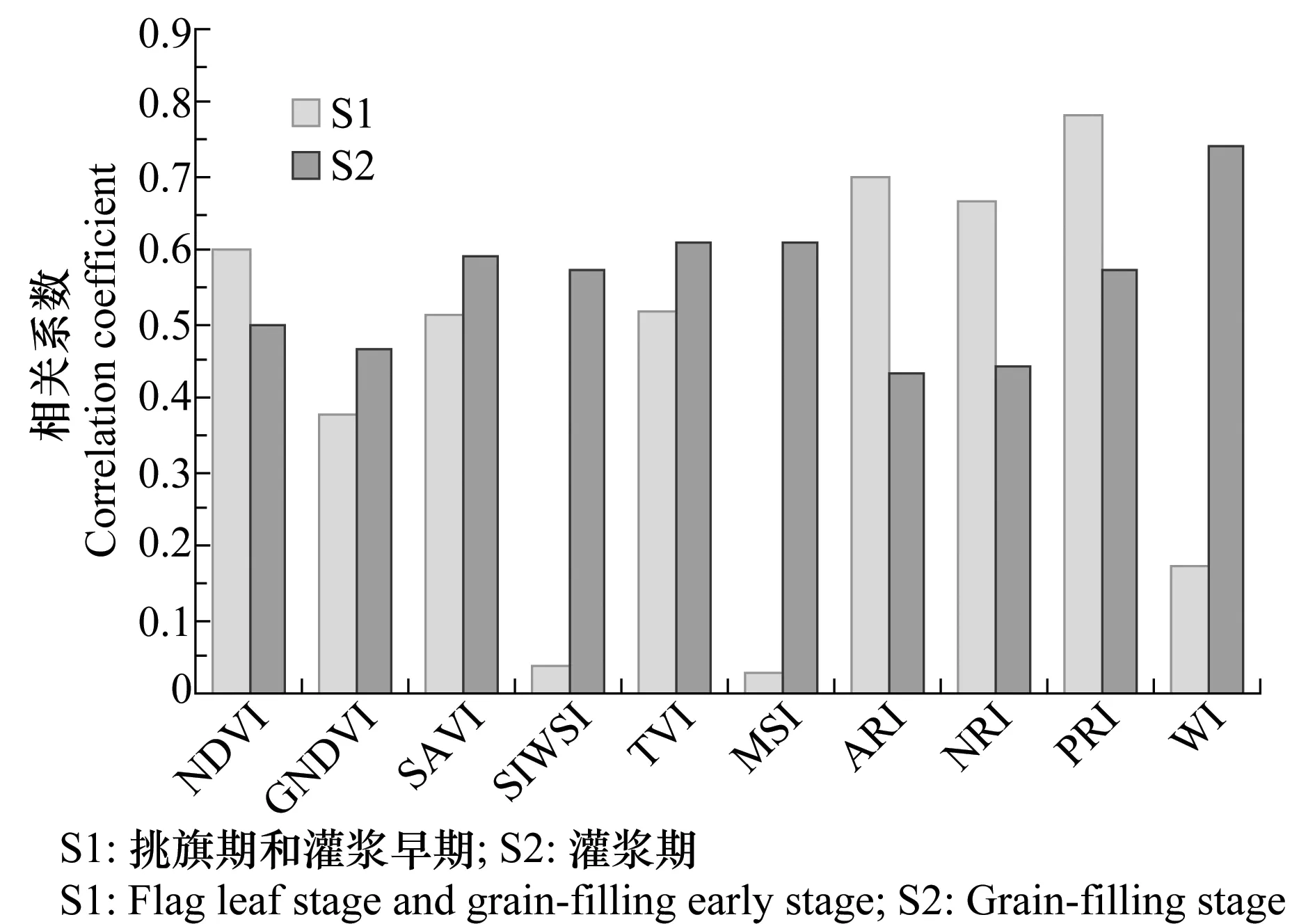
图3 小麦不同生育期光谱特征与DI相关性分析结果Fig.3 The correlation analysis of wheat spectrum characteristics and DI at different stages
在这些光谱特征中,多光谱植被指数NDVI、SAVI、TVI和高光谱植被指数PRI、ARI、NRI在S1和S2时期与DI都表现出较高的相关性。其中,NDVI和TVI因小麦叶绿色在可见光和近红外波段对电磁波的吸收辐射特性以及SAVI因可以有效减弱土壤背景对冠层光谱的影响对DI都表现出持续的光谱响应;ARI和NRI能够有效反映出病害胁迫下植物冠层的花青素和叶绿素浓度的变化;PRI能够直接反映出植物体光合效率的改变,而这种改变往往会先于色素含量的变化,因而对于小麦条锈病的早期监测具有一定的优势[38]。而多光谱植被指数SIWSI、MSI和高光谱植被指数WI3个水分监测指数在S1时期与DI相关性较低,而在S2时期相关性高达0.574、0.609和0.740,这种规律性和病害侵染小麦植株的生理过程有关。在较早的生育期中,条锈病菌大量繁殖,但病菌造成的破坏仍不明显,没有在叶片上大幅度显症,植株生化组分尚未产生显著变化[38]。随着病菌对植株侵染的加强,植株的部分器官开始出现明显的症状,从而引起一系列光谱特征的响应[39]。其中,Huang等[15]和Devadas等[16]曾报道PRI和ARI在冠层尺度对病害敏感,与本研究中结果一致。
2.2不同参数组合估算病情严重度模型比较
本研究根据小麦挑旗期和灌浆早期、灌浆期及整个生育期分别构建病情反演模型,将高光谱和多光谱植被指数分别和生理参数等多个敏感因子与DI建立回归模型。整体来看,S1时期的模型精度达到P=0.001极显著水平的变量组合最少;S2和整个生育期下基于8个变量组合构建的模型精度均达到极显著水平。由表2、3、4可知,大多数模型的估测精度的决定系数R2在0.3~0.9范围内,均方根误差RMSE在0.02~0.2范围内。

表2 挑旗期和灌浆早期小麦条锈病病情严重度反演模型精度1)Table 2 The precision of the inversion model of wheat stripe rust disease severity at flag leaf stage and grain-filling early stage
1)SFs表示光谱特征;Hyp表示高光谱;MS表示多光谱;优选组合以下画虚线标示。下同。
SFs: Spectrum features;Hyp: Hyperspectral;MS: Multispectral; The dotted line indicates the optimum combination. The same below.
从不同时期来看,小麦S1时期,高光谱植被指数与Flav为变量的模型决定系数最高达到0.905;多光谱植被指数与Flav的模型精度R2值为0.549。结果显示(表2),加入了Flav估测因子的模型(图4),因考虑到类黄酮含量在作物受到病害胁迫后显著增加以抑制病虫害增长的影响,在估测小麦条锈病病情方面的表现都要优于光谱特征。故选择SFs与Flav构建的模型为小麦S1时期的最优模型。

表3 灌浆期小麦条锈病病情严重度反演模型精度Table 3 The precision of the inversion model of wheat stripe rust disease severity at grain filling stage

表4 整个生育期小麦条锈病病情严重度反演模型精度Table 4 The precision of the inversion model of wheat stripe rust disease severity on the whole growth period

图4 挑旗期和灌浆早期小麦条锈病病情严重度反演模型预测DI值与实测值散点图Fig.4 Scatter plots between measured DI and estimated DI at flag leaf stage and grain-filling early stage
小麦S2时期(表3),SFs与Chl、Flav构建的估算模型,其决定系数为R2(SFHyp)=0.770,R2(SFMS)=0.714,标准误差RMSE(SFHyp)=0.133,RMSE(SFMS)=0.148。Chl、Flav的加入使得原有模型的拟合精度进一步提高(图5),这表明,由Dualex 4直接获取的Chl相对含量,因其操作稳定,测量科学,在一定程度上提高了数据的可靠性和精确性。故选择SFs与Chl、Flav构建的模型为小麦S2时期的最优模型。

图5 灌浆期小麦条锈病病情严重度反演模型预测DI值与实测值散点图Fig.5 Scatter plots between measured DI and estimated DI at grain filling stage
小麦整个生育期(表4),只采用高光谱和多光谱植被指数构建的模型R2(SFHyp)=0.387,RMSE(SFHyp)=0.192,R2(SFMS)=0.338,RMSE(SFMS)=0.200,精度较差,但Flav和Chl估测因子的加入,使得模型精度大幅度提高达到R2(SFHyp)=0.623,RMSE(SFHyp)=0.151,R2(SFMS)=0.620,RMSE(SFMS)=0.151。故选择SFs与Chl、Flav构建的模型为小麦整个生育期的最优模型(图6)。这与S2时期的研究结果相一致。
3 结论
本文利用ASD FieldSpec光谱仪和Dualex 4叶片测量仪两种观测方式对小麦条锈病的病情进行监测,建立相关模型进行对比分析得到以下结论:(1)综合ASD Field Spec光谱仪和Dualex 4叶片测量仪两种观测方式的小麦条锈病病情严重度监测是可行的。与光谱特征的反演模型相比,生理生化参数与光谱特征的结合提高了小麦条锈反演模型的精度;(2)用于估算小麦条锈病在S1、S2、整个生育期病情严重度的最佳模型,分别是以SFs和Flav,SFs和Flav、Chl,SFs和Flav、Chl为变量组合所构建的模型;(3)对于所筛选的最优模型,高光谱特征与生理参数组合反演结果优于同时期的多光谱特征与生理参数的组合,这说明在提取植被指数方面,高光谱数据体现出光谱分辨率高、连续性强和信息量丰富等优势。

图6 整个生育期小麦条锈病病情严重度反演模型预测DI值与实测值散点图Fig.6 Scatter plots between measured DI and estimated DI during the whole growth period
小麦生理生化参数与光谱特征的有效结合,提高了模型的反演精度,表明被动式冠层光谱和主动式速测仪器两种观测方式的结合对于小麦条锈病的监测是具有一定潜力的。然而,如何改进现有的仪器,使得能够同时获取冠层光谱反射率和生理生化参数,并保证测量精度,可能是后期仪器开发需要解决的问题。
[1]Saari E E, Prescott J M. World distribution in relation to economic losses[M]∥Roelfs A P, Bushnell W R. The cereal rusts vol.2:Diseases, distribution, epidemiology and control. Orlando: Academic Press, 1985: 259-298.
[2]Sankaran S, Mishra A, Ehsani R, et al. A review of advanced techniques for detecting plant diseases [J]. Computers and Electronics in Agriculture, 2010, 72(1):1-13.
[3]竞霞,黄文江,王纪华,等.棉花单叶黄萎病病情严重度高光谱反演模型研究[J].光谱学与光谱分析,2009,29(12):3348-3352.
[4]Liu Zhanyu, Wu Hongfeng, Huang Jingfeng. Application of neural networks to discriminate fungal infection levels in rice panicles using hyperspectral reflectance and principal components analysis [J].Computers and Electronics in Agriculture, 2010,72(2): 99-106.
[5]Steddom K, Heidel G, Jones D. Remote detection of rhizomania in sugar beets [J].Phytopathology,2003,93(6):720-726.
[6]Yang Chwenming, Cheng Chinghuan, Chen Rongkuen. Changes in spectral characteristics of rice canopy infested with brown planthopper and leaffolder [J].Crop Science, 2007, 47(1): 329-335.
[7]Tremblay N, Wang Zhijie, Bélec C. Evaluation of the dualex for the assessment of corn nitrogen status [J]. Journal of Plant Nutrition, 2007,30(9):1355-1369.
[8]Tremblay N, Wang Zhijie, Bélec C. Performance of Dualex in spring wheat for crop nitrogen status assessment, yield prediction and estimation of soil nitrate content [J]. Journal of Plant Nutrition, 2009, 33(1): 57-70.
[9]Tremblay N, Wang Zhijie, Cerovic Z G. Sensing crop nitrogen status with fluorescent indicators. A review [J]. Agronomy for Sustainable Development, 2012, 32(2): 451-464.
[10]Cerovic Z G, Masdoumier G, Ben Ghozlen N, et al. A new optical leaf-clip meter for simultaneous non-destructive assessment of leaf chlorophyll and epidermal flavonoids [J]. Physiologia Plantarum, 2012, 146(3): 251-260.
[11]余伟烽,胡珊珊,申建宁,等.应用叶片荧光传感器Dualex 4估测寒地水稻叶片叶绿素浓度的研究初报[J].北方水稻,2014,44(3):17-19.
[12]Goulas Y, Cerovic Z G, Cartelat A, et al. Dualex: a new instrument for field measurements of epidermal ultraviolet absorbance by chlorophyll fluorescence [J]. Applied Optics, 2004, 43(23): 4488-4496.
[13]周青.类黄酮及其植物生理学作用[J].生物学通报,1986(12):1-2.
[14]黄文江. 作物病害遥感监测机理与应用[M]. 北京:中国农业科学技术出版社, 2009.
[15]Huang Wenjiang, Lamb D W, Niu Zheng, et al. Identification of yellow rust in wheat using in-situ spectral reflectance measurements and airborne hyperspectral imaging [J]. Precision Agriculture, 2007, 8: 187-197.
[16]Devadas R, Lamb D W, Simpfendorfer S, et al. Evaluating ten spectral vegetation indices for identifying rust infection in individual wheat leaves [J]. Precision Agriculture,2009,10(6):459-470.
[17]Goel N S, Qi W. Influences of canopy architecture on relationships between various vegetation indices and LAI and FPAR:A computer simulation[J]. Remote Sensing Reviews, 1994, 10 (4): 309-347.
[18]Roujean J, Breon F. Estimating PAR absorbed by vegetation from bidirectional reflectance measurements [J]. Remote Sensing of Environment, 1995, 51(3): 375-384.
[19]Rouse J W, Haas R H, Schell J A, et al. Monitoring vegetation systems in the Great Plains with ERTS [M]∥Proceedings. Third ERTS Symposium,vol. 1, 1973: 48-62.
[20]Gitelson A A, Kaufman Y, Merzlyak M N. Use of a green channel in remote sensing of global vegetation from EOS-MODIS [J].Remote Sensing of Environment,1996,58(3):289-298.
[21]Baret F, Guyot G. Potentials and limits of vegetation indices for LAI and APAR assessment [J]. Remote Sensing of Environment, 1991, 35(2/3): 161-173.
[22]Chen J M. Evaluation of vegetation indices and a modified simple ratio for boreal applications [J]. Canadian Journal of Remote Sensing, 1996, 22(3): 229-242.
[23]Fensholt R, Sandholt I. Derivation of a shortwave infrared water stress index from MODIS near-and shortwave infrared data in a semiarid environment[J]. Remote Sensing of Environment, 2003, 87(1): 111-121.
[24]Broge N H, Leblanc E. Comparing prediction power and stability of broadband and hyperspectral vegetation indices for estimation of green leaf area index and canopy chlorophyll density [J]. Remote Sensing of Environment, 2000, 76(1): 156-172.
[25]Haboudane D, Miller J R, Pattery E, et al. Hyperspectral vegetation indices and novel algorithms for predicting green LAI of crop canopies: modeling and validation in the context of precision agriculture[J]. Remote Sensing of Environment, 2004, 90(1): 337-352.
[26]Merzlyak M N, Gitelson A A, Chivkunova O B,et al. Non-destructive optical detection of pigment changes during leaf senescence and fruit ripening [J]. Physiologia Plantarum, 1999, 106(1): 135-141.
[27]Zarco Tejada, P J, Berjón A, et al. Assessing vineyard condition with hyperspectral indices: leaf and canopy reflectance simulation in a row-structured discontinuous canopy [J]. Remote Sensing of Environment, 2005, 99(1): 271-287.
[28]Penuelas J, Baret F, Filella I. Semi-empirical indices to assess carotenoids/chlorophyll a ratio from leaf spectral reflectance[J]. Photosynthetica, 1995, 31(1): 221-230.
[29]Hunt E R, Rock B N. Detection of changes in leaf water content using near-and middle-infrared reflectances[J]. Remote Sensing of Environment, 1989, 30(1): 43-54.
[30]Ceccato P, Gobron N, Flasse S, et al. Designing a spectral index to estimate vegetation water content from remote sensing data [J].Remote Sensing of Environment,2002,82(1):188-197.
[31]Penuelas J, Gamon J, Fredeen A L, et al. Reflectance indices associated with physiological changes in nitrogen- and water-limited sunflower leaves [J]. Remote Sensing of Environment, 1994, 48(1): 135-146.
[32]Gitelson A A, Merzlyak M N, Chivkunova O B. Optical properties and nondestructive estimation of anthocyanin content in plant leaves [J]. Photochemistry and Photobiology, 2001, 74(1): 38-45.
[33]Galvao L S, Formaggio A R, Tisot D A. Discrimination of sugarcane varieties in southeastern Brazil with EO-1 Hyperion data [J].Remote Sensing of Environment,2005,94(1):523-534.
[34]Thenkabail P S, Smith R B, De Pauw E. Hyperspectral vegetation indices and their relationships with agricultural crop characteristics [J]. Remote Sensing of Environment, 2000, 71(1): 158-182.
[35]Filella I, Serrano L, Serra J, et al. Evaluating wheat nitrogen status with canopy reflectance indices and discriminant analysis[J]. Crop Science, 1995, 35(1): 1400-1405.
[36]Penuelas J, Pinol J, Ogaya R, et al. Estimation of plant water concentration by the reflectance water index WI (R900/R970)[J]. International Journal of Remote Sensing, 1997, 18(1): 2869-2875.
[37]Gamon J A, Penuelas J, Field C B. A narrow-waveband spectral index that tracks diurnal changes in photosynthetic efficiency [J].Remote Sensing of Environment,1992,41(1):35-44.
[38]Bushnell W R. Structural and physiological alterations in susceptible host tissue [M]∥Roelfs A P, Bushnell W R. The cereal rusts vol.1:Origins, specificity,structure,and physiology.Orlando: Academic Press, 1984:477-507.
[39]张竞成. 多源遥感数据小麦病害信息提取方法研究[D].杭州: 浙江大学, 2012.
(责任编辑:田喆)
Combined canopy spectral and leaf physiological observations in model development for wheat stripe rust detection
Ai Xiaoyi1,2,Song Weidong1,Zhang Jingcheng2,Wang Baotong3,Yang Guijun2,Huang Wenjiang4
(1. School of Geomatics, Liaoning Technical University, Fuxin123000, China; 2. National Engineering Research Center for Information Technology in Agriculture, Beijing100097, China; 3. State Key Laboratory of Crop Stress Biology in Arid Areas, Northwest A & F University, Yangling712100, China; 4. Key Laboratory of Digital Earth Science,Institute of Remote Sensing and Digital Earth, Chinese Academy of Sciences, Beijing100094, China)
This study attempted to combine measurements from both passive and active sensors to form a retrieving model of wheat stripe rust severity. In a disease inoculation experiment, besides the survey of disease severity, measurements of both the passive canopy spectra and active foliar fluorescence were carried out at two key growing stages. Prior to model development, a feature selection protocol is implemented to identify optimal features serving as model input variables. Based on different combinations of the selected features, the retrieving models of disease severity were developed and compared using the partial least squares regression (PLSR) method, to determine the best feature combinations at different growing stages. The results based on the optimal spectral features and leaf physiological observations onFlav(flavonoids),Chl(chlorophyll) of different combinations at wheat flag, early filling and grain filling stages had a better performance, with a precision ofr2=0.90, and RMSE=0.026. Compared to spectral characteristics alone, comprehensive canopy spectra and leaf physiological observations improved model accuracy by 21%, showing that the combination of the two kinds of data could improve the disease severity estimation precision. The study can provide a new pattern and idea for the development of wheat disease monitoring instrument.
spectral feature;leaf fluorescence;wheat stripe rust;partial least squares regression (PLSR);Dualex 4
2015-01-23
2015-02-16
国家自然科学基金(41301476);北京市自然科学基金(4132029);陕西省科技统筹项目(2012KTCL02-10)
E-mail:zhangjc_rs@163.com
S 431
A
10.3969/j.issn.0529-1542.2016.02.007

