Wilson病铜过量负荷大鼠肝损伤的代谢组学研究
蒋怀周, 王 键, 许晶晶, 董继扬
(1安徽中医药大学中医临床学院中医基础理论教研室,合肥 230031; 2厦门大学电子科学系,福建省等离子体与磁共振研究重点实验室)
Wilson病铜过量负荷大鼠肝损伤的代谢组学研究
蒋怀周1, 王键1, 许晶晶2, 董继扬2
(1安徽中医药大学中医临床学院中医基础理论教研室,合肥230031;2厦门大学电子科学系,福建省等离子体与磁共振研究重点实验室)
目的利用代谢组学技术研究铜负荷大鼠肝组织的小分子变化,探讨铜过量对肝脏小分子代谢的影响。方法16只Wistar大鼠随机分为正常组和模型组,以铜负荷法造模,通过核磁共振氢谱技术采集大鼠肝组织的代谢轮廓,以PLS-DA方法分析铜中毒后,大鼠肝组织代谢物的变化。结果与正常组对比,模型组大鼠肝组织中尿素囊、牛磺酸、肌醇、赖氨酸、尼克酰胺、乙醇胺、乙酸、谷氨酸、酪氨酸、尿苷、甲硫氨酸、苏氨酸、异亮氨酸、3-羟基丁酸、缬氨酸、乳酸、亮氨酸、苯丙氨酸、N-乙酰天冬氨酸、延胡索酸和腺苷/肌苷的含量升高(P<0.05),肌酸、天冬酰胺、天冬氨酸、磷酸胆碱和甘露醇的含量降低(P<0.05)。结论铜对大鼠肝组织的损伤可能涉及鸟氨酸和三羧酸循环、磷脂、氨基酸、能量、核苷酸和糖的代谢。
Wilson病;肝豆状核变性;代谢组学;铜负荷;核磁共振氢谱;肝损伤
Wilson病(Wilson’s disease,WD)是一种常染色体隐性遗传性铜代谢障碍疾病,由英国神经病学家Samuel Alexander Kinnier Wilson在1912年首次描述,又称肝豆状核变性(hepatolenticular degeneration,HLD)。WD的病理过程是过量的铜沉积于肝脏,当肝内铜饱和后,铜继续在脑、骨、肾脏、角膜等其他组织器官沉积,引发一系列损伤和相应临床表现[1]。肝脏是WD最早也是最主要的受累器官,肝损伤是多数WD患者的首发症状,其损害程度与本病预后密切相关,也是导致该病患者死亡的重要因素[2]。因此,研究铜对肝的损伤机制,对于探讨WD肝损伤及其治疗具有一定的意义。
代谢组学是系统生物学的一个重要组成部分,它是研究生理、病理或者药物等刺激下生物体代谢物的变化,可广泛应用于生物医学的诸多领域。前期研究发现,核磁共振(nuclear magnetic resonance,NMR)代谢组学技术可筛选出与铜负荷大鼠模型相关的差异代谢物[3],在探索铜过量对机体毒理方面具有良好的应用前景。肝脏是机体物质代谢的中枢器官,也是铜代谢和沉积所涉及的重要器官。本实验通过对铜负荷大鼠肝组织的代谢组学分析,探讨铜负荷对肝组织的小分子代谢影响,期望能对WD肝损伤机制及其治疗提供一定的研究思路。
1 材料与方法
1.1实验动物
12周龄雄性SPF级Wistar大鼠16只,体质量(180±20)g,实验动物许可证号:SCXK(皖)2011-002,由安徽医科大学实验动物中心提供,饲养于安徽中医药大学省部共建教育部重点实验室。
1.2主要试剂与仪器
硫酸铜(分析纯,上海国药集团);苏木精(上海化学试剂公司);伊红(上海化学试剂公司);乙醚(分析纯,上海苏懿化学试剂有限公司);TUNEL试剂盒(10279600,美国Roche公司);甲醇(分析纯,国药集团化学试剂有限公司);三氯甲烷(分析纯,国药集团化学试剂有限公司)。
Bruker 600 MHz核磁共振谱仪(Bruker-AV600 spectrometer,德国Bruker公司);全自动生化分析仪(Olmpus AU2700,日本Olympus公司);病理图像分析仪(HPIAS-1000,武汉清平影像技术有限责任公司);高通量组织研磨器(SCIENTZ-48,宁波新芝生物科技股份有限公公司);冷冻干燥机(北京博医康试验仪器有限公司)。
1.3铜负荷大鼠模型的建立及样本采集
适应性饲养1周后,大鼠被随机分为正常组和模型组,每组8只。饲养环境:室温20-22 ℃,相对湿度40%-60%,光照12 h、黑暗 12 h。正常组始终自由摄食基础饲料、饮用自来水;模型组以铜负荷法[3]造模,具体方法为:连续12周喂饲含硫酸铜的饲料(1 g/kg)和水(0.185%)。
造模结束,大鼠禁食12 h,乙醚吸入麻醉,腹主动脉采血,用于血清谷丙转氨酶(ALT)和谷草转氨酶(AST)检测;取新鲜肝组织分为两份,一份置于液氮快速冷冻,以超低温冰箱(-80 ℃)保存,用于NMR检测,另一份以10%中性缓冲甲醛固定,石蜡包埋,用于肝组织病理和细胞凋亡检测。
1.4血清谷丙转氨酶和谷草转氨酶检测
由全自动生化分析仪检测。将仪器比色参数设置为主波长340 nm,副波长405 nm。检测血清ALT时,取12 μl血清样品与试剂1(α-酮戊二酸65 mmol/L+还原型辅酶Ⅰ 0.37 mmol/L)混匀,37 ℃恒温静置5 min,加入试剂2(L-丙氨酸0.9 mol/L+乳酸脱氢酶25 kU/L),混匀,延迟1 min后,测第一测光点,温浴3-4 min,测第二测光点。测血清AST时,除试剂2为L-天门冬氨酸1.0 mmol/L+苹果酸脱氢酶5 kU/L,其余参数及步骤与测血清ALT相同。
1.5肝组织病理学检查
将甲醛固定的待测组织乙醇脱水,二甲苯透明,浸蜡过夜;石蜡包埋并切片;切片脱蜡至水,苏木精染色,分化,PBS蓝化;伊红染色;乙醇脱水,二甲苯透明,中性树胶封片,光学显微镜观察结果并摄片。
1.6肝组织细胞凋亡实验
以Roche公司原位细胞凋亡检测盒说明书操作实验过程。结果判定:阳性肝细胞核染色呈棕褐色,阴性肝细胞核染色呈蓝色。根据随机拍取的肝细胞TUNEL染色照片,光镜下(400倍)用单盲法计数,计算肝细胞凋亡指数(apoptosis index, AI)。具体计算方法为:AI=凋亡细胞数/总细胞数×100%。
1.7核磁共振氢谱技术采集大鼠肝组织的代谢轮廓
肝组织组织提取:取肝组织样品置于由甲醇和蒸馏水配置的溶液里,4 ℃匀浆;加入氯仿(1.4 ml),漩涡样品;加入蒸馏水(0.7 ml),再漩涡样品;4 ℃离心样品(10 000 r/min×10 min);将离心所得上清液移至离心管;真空干燥挥发甲醇;剩余溶液冻干成粉末状。
肝组织氢谱采集:将冻干粉加入重水配置的550 μl磷酸盐缓冲液里,震荡混匀;4 ℃离心10 min(10 000 r/min),以移液枪将上清液(500 μl)移至核磁管,样本采集于Bruker 600 MHz核磁共振谱仪完成,使用标准的预饱和脉冲序列ZGPR(RD-90°-ACQ)采集1H-NMR谱,实验温度296 K,谱宽12 kHz,弛豫延时长2 s,采样点数32 000,累加次数64次。
氢谱数据处理:MestreNova 9.0软件将fid数据傅里叶变换成NMR谱。将TSP谱峰为零点定标NMR谱,对所得NMR谱进行相位校正和基线校正。以自编软件[4]进行谱峰对齐,截除残余水信号和甲醇信号(分别为:δ5.23-4.68和δ3.40-3.31),自适应分段积分[5]剩余区域,对数据进行概率商归一化(probabilistic quotient normalization,PQN)[6]。最后导入SIMCA-P软件(version 14.0,Umetrics,Sweden)进行多变量分析。
1.8统计学分析
2 结果
2.1大鼠一般状态观察
正常组大鼠生长状态未见明显改变;模型组大鼠组于造模过程中逐渐出现食欲减退、毛发蓬松、光泽度差、精神萎靡、腹泻、对外界刺激反应减弱等状态改变。
2.2血清谷丙转氨酶、谷草转氨酶变化
与正常组相比,造模6周后模型组大鼠血清AST和ALT水平显著升高(P<0.01,见表1)。
2.3肝组织病理学变化
HE染色结果显示,正常组大鼠的肝细胞大小基本相同、界限明显,围绕中央静脉和汇管区呈有序排列,肝小叶结构清晰(见图1A);与正常组相比,模型组大鼠肝细胞之间界限不清,细胞核固缩,肝小叶结构较紊乱(见图1B)。
表1铜负荷造模6周后两组大鼠血清谷丙转氨酶、谷草转氨酶水平比较
Table 1Comparison of serum AST and ALT levels after copper overload for 6 weeks between the two groups

组别nALT(U/L)AST(U/L)正常组637.22±4.77120.53±16.79模型组670.31±11.17△201.92±21.60△
与正常组比较,△P<0.01
2.4肝组织细胞凋亡实验结果
如图2所示,正常组大鼠肝组织仅可见少数、散在凋亡细胞(见图2A),细胞凋亡指数为10.38±3.49;模型组较正常组凋亡细胞增多(见图2B),细胞凋亡指数为65.84±7.15。与正常组相比,模型组大鼠细胞凋亡指数显著增高(P<0.01)。

A.正常组 B.模型组图1 铜负荷造模6周后两组大鼠肝组织形态学变化 (HE染色,×400)Figure 1 Morphologic changes of rat liver tissues after copper overload for 6 weeks in the two groups (HE staining,×400)

A.正常组 B.模型组图2 铜负荷造模6周后两组大鼠肝组织细胞凋亡 (TUNEL,×400)Figure 2 Apoptosis of rat liver tissue cells after copper overload for six weeks in the two groups (TUNEL,×400)
2.51H-NMR代谢轮廓分析结果
本实验两组大鼠肝组织典型1H-NMR谱见图3。由于样品谱图低场部分信号强度较低,我们将谱图放大15倍显示,并根据HMDB数据库(http://www.hmdb.ca)和相关文献[7,8],对强度较高的谱峰进行代谢物归属。
为了寻找正常组和模型组之间代谢物的差异,我们对谱图进行偏最小二乘法-判别分析(partial least squares-discriminate analysis,PLS-DA),结果见图4。PLS-DA得分图(4A)中,每一个点代表一个肝组织样品,正常组和模型组分别处于图4A不同的区域,可明显区分,说明它们之间存在代谢差异。其中,正常组样品较为分散,可能是自由饮食大鼠个体差异较大所致。为验证正常组和模型组之间是否存在显著差异,我们对PLS-DA模型进行200次的排列实验,结果见图4B,验证通过,模型有效。

ADP:二磷酸腺苷;Ino:肌苷;Ade:腺嘌呤核苷;Ads:腺苷;α-Glu:α-葡萄糖;β-Glu:β-葡萄糖;EA:乙醇胺;Tau:牛磺酸;Glu:谷氨酸;Ala:丙氨酸;NA:烟碱;Phe:苯丙氨酸;Tyr:酪氨酸;Fum:延胡索酸;AMP:单磷酸腺苷;All:尿素囊;Lac,乳酸;Cr:肌酸;GPC:甘油磷酸胆碱;PC:磷酸胆碱;Asn:天冬酰胺;Gln:谷氨酰胺;Ace:乙酸;Eth:乙醇;Val:缬氨酸;m-I:肌醇图3 铜负荷造模6周后两组大鼠肝组织样品典型1H-NMR谱Figure 3 Typical 1H-NMR spectra of rat liver tissues in the two groups after copper overload for 6 weeks
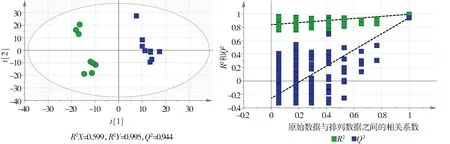
A.PLS-DA得分图(正常组,模型组) B.PLS-DA模型验证(正常组-模型组)图4 两组大鼠肝组织样品1H-NMR谱PLS-DA分析图Figure 4 PLS-DA analysis result of 1H-NMR spectra of rat liver tissues in the two groups
根据模型变量的VIP值和t检验结果,筛选出对组间区分贡献较大的代谢物(见图5)。铜负荷所致大鼠肝组织小分子变化包括尿素囊、牛磺酸、肌醇、赖氨酸、尼克酰胺、乙醇胺、乙酸、谷氨酸、酪氨酸、尿苷、甲硫氨酸、苏氨酸、异亮氨酸、3-羟基丁酸、缬氨酸、乳酸、亮氨酸、苯丙氨酸、N-乙酰天冬氨酸、延胡索酸、腺苷/肌苷含量升高,肌酸、天冬酰胺、天冬氨酸、磷酸胆碱、甘露醇含量降低。
3 讨论
铜是人类必需的微量元素,分布于人体各组织器官,参与造血、代谢、生长发育等多种生理功能。正常情况下铜自肠道被吸收,大部分被肝细胞摄取。在肝细胞内,β多肽铜转运ATP酶[9](ATPase Cu2+transporting beta polypeptide,ATP7B )将铜与前铜蓝蛋白结合成铜蓝蛋白并释放入血,循环中90%的铜以铜蓝蛋白形式存在;肝细胞含铜过多时,铜可在ATP7B蛋白作用下随胆汁排出。WD患者因ATP7B基因突变,导致铜蓝蛋白合成异常、胆汁排铜障碍,过量的铜沉积于肝脏,造成肝细胞凋亡、坏死等损伤,临床可表现为急、慢性肝炎,肝纤维化等[2,10]。由于本病临床表现复杂多样,目前尚无任何一种动物模型可复制其全部临床特征,但已证实,铜负荷饮食可在大鼠肝、脑、肾、骨等组织器官产生类似于WD的铜沉积,常用于WD铜损伤及药物治疗机制的研究[3,11,12]。本实验模型组大鼠AST和ALT升高,肝组织发生病理学改变,肝细胞凋亡指数增高。模型组与正常组大鼠肝组织样品在PLS-DA得分图上可明显区分,提示正常组和模型组之间存在代谢差异,且铜对模型组大鼠肝脏具有一定的损伤。

1.3-羟基丁酸;2.乳酸;3.赖氨酸;4.苯丙氨酸;5.N-乙酰天冬氨酸;6.缬氨酸;7.异亮氨酸;8.腺苷/肌苷;9.亮氨酸;10.磷酸胆碱;11.延胡索酸;12.天冬氨酸;13.尿素囊;14.肌酸;15.牛磺酸;16.肌醇;17.尼克酰胺;18.乙醇胺;19.天冬酰胺;20.乙酸;21.谷氨酸;22.酪氨酸;23.尿苷;24.甲硫氨酸;25.苏氨酸;26.甘露醇图5 铜负荷造模6周后两组大鼠肝组织样品相比较的差异代谢物Figure 5 Differences of metabolites of rat liver tissues between the two groups after copper overload for six weeks
前期研究证实,铜离子主要通过活性氧族介导的氧化应激,引起线粒体膜通透性增加,导致细胞凋亡[2]。肝细胞受损后,胞内的转氨酶可大量释放入血,造成血清转氨酶如AST、ALT的升高。磷脂是线粒体膜、细胞膜等生物膜的重要组成部分,对于维持线粒体和细胞功能起着重要作用,乙醇胺、肌醇、磷酸胆碱参与磷脂代谢[13],尼克酰胺是维生素PP的一种,可通过增加线粒体能量底物NAD+和 NADP+的合成,减少活性氧族的产生,稳定线粒体膜结构,实现抗氧化和凋亡[14]。本实验模型组大鼠以上代谢物含量皆发生改变,说明铜对肝细胞膜性结构的损伤,可能涉及这些小分子代谢的异常。
肝脏在机体某些代谢中起着独特的作用,是其他器官所不能取代的。比如,经鸟氨酸循环将氨合成无毒的尿素排出体外,即是肝特有的功能。以肝损伤为主要表现的肝型WD患者,随着肝脏受损程度的加重,鸟氨酸循环不能正常进行,可出现血氨增高,肝性脑病的表现[2]。基因组学和蛋白质组学发现,铜损伤大鼠肝脏时,与三羧酸循环和鸟氨酸循环密切相关的基因、蛋白质发生了一定改变[15]。这两个循环通过延胡索酸和天冬氨酸相连,且此处的天冬氨酸由谷氨酸转氨基作用生成。本实验模型大鼠肝组织这三种氨基酸含量改变,可能提示铜损伤肝脏时,鸟氨酸循环和三羧酸循环的连接环节发生了变化,或可为今后研究肝损伤与鸟氨酸循环和三羧酸循环的联系提供一定的线索。
肝脏富含参与氨基酸代谢的酶类,氨基酸的分解、合成在肝内十分活跃。苯丙氨酸和酪氨酸属于芳香族氨基酸,在肝中代谢分解;缬氨酸、亮氨酸、异亮氨酸为支链氨基酸,由胰岛素促进其进入骨骼肌分解,而胰岛素由肝脏灭活。肝损伤时,不能正常代谢芳香族氨基酸、灭活胰岛素,以上氨基酸代谢可发生异常。在同样是金属中毒的研究中发现,支链氨基酸的含量有所变化[16,17],而芳香族氨基酸含量的改变常见于肝损伤[18,19]。本研究结果与之相符合,说明铜损伤肝脏与支链氨基酸和芳香族氨基酸的变化可能具有一定联系。
此外,肌酸主要由甲硫氨酸提供甲基在肝脏合成,它是储存能量的重要化合物,被认为是评估肝损伤的一个重要指标[20];腺苷/肌苷、尿素囊、尿苷为核苷酸代谢的重要产物;铜可影响有氧氧化过程,使无氧代谢增加,糖酵解最终产物乳酸含量可因此升高。以上小分子含量均在模型组大鼠肝组织发生了变化,提示铜过量可导致肝组织能量、核苷酸和糖代谢发生一定的失调。
肝脏是机体最大的腺体、代谢最活跃的器官,它整合、调节机体各代谢途径,在代谢过程中发挥着关键的作用。本实验以核磁共振代谢组学技术分析了铜负荷大鼠肝组织样本,初步鉴定了铜对大鼠肝损伤的一些小分子代谢物,分析认为这些小分子变化可能涉及鸟氨酸和三羧酸循环、磷脂、氨基酸、能量、核苷酸和糖代谢,可为今后研究铜对WD肝损伤的机制提供一些参考。
[1]马仕坤,汪荣泉.肝豆状核变性误诊为药物性肝损害1例[J].第三军医大学学报,2009,31(17):1675-1684.
[2]梁秀玲,李洵桦.肝豆状核变性[M].北京:人民卫生出版社,2012:30-50.
[3]Xu J,Jiang H,Li J,etal.1H NMR-based metabolomics investigation of copper-laden rat:a model of Wilson’s disease[J].PLoS One,2015,10(4):e0119654.
[4]董继扬,周玲,邓伶莉.代谢组学数据挖掘软件(简称:MetaboMiner V1.0).计算机软件著作权登记证书(软著登字第0565977号,登记号:2013SR060215)[Z].2013.
[5]De Meter T,Sinnaeve D,Van Gasse B,etal.NMR-based characterization of metabolic alterations in hypertension using an adaptive,intelligent binning algorithm[J].Anal Chem,2008,80(10):3783-3790.
[6]Dieterle F,Ross A,Schlotterbeck G,etal.Probabilistic quotient normalization as robust method to account for dilution of complex biological mixtures.Application in1H-NMR metabonomics[J].Anal Chem,2006,78(13):4281-4290.
[7]Tang B,Ding J,Yang Y,etal.Systems biochemical responses of rats to Kansui and vinegar-processed Kansui exposure by integrated metabonomics[J].J Ethnopharmacol,2014,153(2):511-520.
[8]Bollard ME,Contel NR,Ebbels TM,etal.NMR-based metabolic profiling identifies biomarkers of liver regeneration following partial hepatectomy in the rat[J].J Proteome Res,2010,9(1):59-69.
[9]谷绍娟.肝豆状核变性遗传和致病机制研究[D].长沙:中南大学湘雅三医院,2013.
[10]王佳炜.四六钼酸铵调节Wilson病铜负荷大鼠铜代谢及MAPK相关信号转导机制的研究[D].合肥:安徽中医药大学,2013.
[11]徐磊,蔡永亮,王艳昕,等.大黄素和大黄多糖对铜负荷模型大鼠脂质过氧化的影响[J].中医杂志,2013,54(10):870-872.
[12]方向,金珊,鲍远程,等.清热利胆解毒方对铜负荷大鼠学习记忆及海马超微结构的影响[J].中华中医药杂志,2015,30(7):2564-2566.
[13]朱超.基于液相色谱质谱联用技术的磷脂组学平台的建立、改进及应用[D].上海:华东理工大学,2011.
[14]kim YH,Hwang JH,Noh JR,etal.Prevention of salt-induced renal injury by activation of NAD(P)H:quinone oxidoreductase 1,associated with NADPH oxidase[J].Free Radic Biol Med,2012,52(5):880-888.
[15]杨保华.利用基因组学和蛋白质组学技术研究纳米铜的肝肾毒性及作用机制[D].北京:军事医学科学院毒物药物研究所,2010.
[16]孙维琦.磁性Fe3O4纳米颗粒在体内的生物转运、生物转化及代谢组学研究[D].长春:吉林大学公共卫生学院,2013.
[17]Muratsubaki H,Yamaki A.Profile of plasma amino Acid levels in rats exposed to acute hypoxic hypoxia[J].Indian J Clin Biochem,2011,26(4):416-419.
[18]Wang JB,Pu SB,Sun Y,etal.Metabolomic profiling of autoimmune hepatitis:the diagnostic utility of nuclear magnetic resonance spectroscopy[J].J Proteome Res,2014,13(8):3792-3801.
[19]齐素文,戴勇,欧阳昕,等.轻微肝性脑病患者血清中代谢物组的研究[J].第三军医大学学报,2011,33(23):2503-2507.
[20]Longo N,Ardon O,Vanzo R,etal.Disorders of creatine transport and metabolism[J].Am J Med Genet C Semin Med Genet,2011,157(1):72-78.
Research on metabolomics of liver injury rats with Wilson’s disease due to copper overload
JIANG Huaizhou1, WANG Jian1, XU Jingjing2, DONG Jiyang2
(1TeachingandResearchOfficeofBasicTheoryofTraditionalChineseMedicine,SchoolofTraditionalChineseMedicine,AnhuiUniversityofTraditionalChineseMedicine,Hefei230031,China;2FujianProvincialKeyLaboratoryofPlasmaandMagneticResonance,DepartmentofElectronicScience,XiamenUniversity)
ObjectiveTo explore the changes of small molecules in liver tissues of rats with copper overload and the influences of copper overload on metabolism of small molecules in liver tissues.MethodsSixteen Wistar rats were randomly divided into normal control group and model group. Copper overload method was used to establish the model rats.1H-NMR was used to acquire the metabolic profile of rat liver tissues, and PLS-DA was used to analyze the changes of metabolites in rat liver tissues after copper poisoning.ResultsCompared with normal control group, the contents of allantoin, taurine, myoinositol, lysine, nicotinamide, ethanolamine, acetate, glutamate, tyrosine, uridine, methionine, threonine, isoleucine, 3-hydroxybutyrate, valine, lactate, leucine, phenylalanine, N-acetylaspartate, fumarate, and adenosine/inosine were increased(P<0.05), while the contents of creatine, asparagine, aspartate, phosphorylcholine and mannitol were decreased in model group(P<0.05).ConclusionCopper damage in rat liver tissues may be involved in the metabolism of ornithine and Krebs cycles, lecithin, amino acid, energy, nucleotides and glucose.
Wilson’s disease;hepatolenticular degeneration;metabonomics;copper overload;1H-NMR;liver damage
国家自然科学基金青年基金资助项目(81202691);安徽省高校自然科学基金重点基金资助项目(KJ2012Z228);安徽中医学院自然科学基金资助项目(2011ZR008B);安徽省高校博士后岗位项目基金资助项目;安徽省高校优秀青年骨干教师国外访问研修重点项目(gxfxZD2016121)
蒋怀周,女,1978-01生,博士,讲师,E-mail:jhzlindq@hotmail.com
2015-11-22
R596
A
1007-6611(2016)03-0199-06
10.13753/j.issn.1007-6611.2016.03.002

