HAG与CAG预激方案治疗高危骨髓增生异常综合征的疗效比较
王芳侠, 白 菊, 何爱丽, 张王刚, 曹星梅, 陈银霞, 刘 捷, 赵万红, 马肖容, 杨 云, 王剑利, 张鹏宇, 古流芳, 雷 博, 王 瑾
(西安交通大学第二附属医院血液科,西安 710004)
HAG与CAG预激方案治疗高危骨髓增生异常综合征的疗效比较
王芳侠, 白菊, 何爱丽, 张王刚, 曹星梅, 陈银霞, 刘捷, 赵万红, 马肖容, 杨云, 王剑利, 张鹏宇, 古流芳, 雷博, 王瑾
(西安交通大学第二附属医院血液科,西安710004)
目的比较高三尖杉酯碱(HHT)、阿糖胞苷(Ara-c)联合粒细胞集落刺激因子(G-CSF)的小剂量预激化疗方案(HAG方案)与阿克拉霉素(aclacinomycin)、Ara-c联合G-CSF的CAG方案治疗高危骨髓增生异常综合征(MDS)的效果及其安全性。方法52例初诊的高危MDS患者入选HAG方案组,50例初诊的高危MDS患者入选CAG组。1个疗程后初步评价疗效,未缓解者进行第2个疗程,2个疗程后评价治疗效果及不良反应。结果①HAG组2疗程后共25例获完全缓解(CR)(48.1%),11例获部分缓解(PR)(21.2%),总有效率69.2%。CAG组2疗程后23例获CR(46.0%),9例获PR(18.0%),总有效率64.0%。经统计学检验,HAG与CAG方案组比较无统计学差异。②HAG组在诱导治疗期间发生粒细胞缺乏的比例为53.8%(28例),平均持续时间4 d,血小板<20×109/L的比例为34.6%(18例),平均持续时间5 d;CAG组诱导治疗期间发生粒细胞缺乏的比例为58.0%(29例),平均持续时间6 d,血小板<20×109/L的比例为38.0%(19例),平均持续时间7 d。结论HAG及CAG预激方案治疗高危MDS均能取得较高的缓解率,HAG预激方案骨髓抑制较轻,临床应用较为安全,值得推广应用。
骨髓增生异常综合征;预激;高三尖杉酯碱;阿糖胞苷;阿克拉霉素
骨髓增生异常综合征(myelodysplastic syndromes,MDS)是一组以无效造血为特征的造血干细胞克隆性疾病,高危MDS是指按国际预后评分系统(IPSS)评分为中危-2、高危组及按FAB或WHO分型标准原始细胞≥5%的MDS患者,其中位生存率仅为1年左右, 约35%-40%进展为急性髓系白血病(acute myeloid leukemia,AML),多数患者在1年之内死于骨髓衰竭继发的出血或感染[1]。
小剂量预激方案应用于临床已有近20年历史,国内外应用较多的预激方案为CAG,多用于老年、低增生以及难治复发性AML,取得较好效果[2],但Acla 属于蒽环类化疗药物,具有一定的心脏毒性,对于某些高危MDS患者并不适合。HHT是从我国特有的三尖杉属植物中分离出来的抗肿瘤生物碱,实验证实体内外均可以诱导髓系肿瘤细胞分化及凋亡[3,4]。我们科自2004年开始应用高三尖杉酯碱联合阿糖胞苷的预激方案(HAG方案)治疗难治复发性AML,有效率达63%,效果优于国际报道的其他联合方案[5,6],此后我们将G-CSF预激方案用于治疗高危MDS患者,效果优于五氮杂胞苷和地西他滨。本研究中,总结我中心分别应用HAG和CAG预激方案治疗高危MDS的效果及不良反应,并将二者进行对比,希望能进一步提高高危MDS的治疗效果,并减低治疗相关毒副作用,为临床提供更多的治疗选择。
1 材料和方法
1.1入选标准和方法
病例来源为在我院血液科就诊的高危MDS患者,共102例,诊断标准参照2001年WHO分型标准,结合骨髓细胞形态学、骨髓活检及染色体分析确诊为MDS的患者,且按IPSS评分为中危-2、高危组及按FAB或WHO分型标准原始细胞≥5%的MDS患者。纳入HAG方案组的患者 52例,年龄24-80岁(中位年龄62岁),男 28例,女24例,其中IPSS评分中危-2 31例,高危 21例;FAB分型RAEB-1 27例,RAEB-2 23例,CMML 2例。纳入CAG方案组的患者 50例,年龄31-79岁(中位年龄64岁),男 29例,女21例,其中IPSS评分中危-2 28例,高危 22 例;FAB分型RAEB-1 23例,RAEB-2 26例,CMML 1例。
1.2治疗方案
1.2.1HAG方案HHT以1 mg剂量每日1次,持续静脉滴注,从第1天到第14天;Arac 以10 mg剂量每12 h 1次,皮下注射,从第1天到第14天;G-CSF 以每天300 μg剂量从化疗前1 d开始,皮下注射,直到化疗结束,化疗期间外周血白细胞数>20×109/L时停用,待外周血白细胞下降后再继续使用。疗程结束后若病人仍处于粒细胞缺乏状态,则继续使用G-CSF直至中性粒细胞>0.5×109/L。1疗程结束血象恢复后复查骨髓穿刺,未缓解者接受第2个疗程化疗,仍未缓解者,视为无效。
1.2.2CAG方案Acla每次20 mg,隔日一次静脉滴注,从第1天到第10天,Arac 和G-CSF用法用量同HAG方案。
1.2.3缓解后治疗2疗程未达CR者,换用其他方案。获得CR的患者,有条件者行造血干细胞移植术。无移植条件者,年龄>60岁者,应用常规方案及原预激方案进行巩固维持治疗;年龄<60岁者,在巩固维持治疗的同时,间断强化疗。方案包括:DA、TA、MA、HA、AA、IA等。
1.2.4支持治疗患者入住普通洁净病房,常规用1∶5比例稀释的复方硼砂溶液漱口,便后用1∶5 000高锰酸钾溶液坐浴。化疗期间常规水化、碱化尿液,口服别嘌醇,静脉使用止吐药,必要时给予营养支持及维持水电解质平衡。定期监测血常规、肝肾功能及心电图等,患者出现粒细胞缺乏时入住无菌层流病房,出现发热或感染症状时经验性使用抗生素治疗,待病原学检查结果回报后根据药敏结果调整治疗方案;血小板计数<20×109/L或有出血症状时配输机采浓缩血小板悬液,血红蛋白<80 g/L时配输红细胞悬液;出现肝功异常时加用保肝药物。
1.3疗效判定标准
根据《血液病诊断及疗效标准》,分为完全缓解(CR)、部分缓解(PR)及未缓解(NR),总有效率(RR)=CR+PR。早期死亡是指诱导治疗开始后8周之内死亡。
1.4统计学方法
率的比较采用四格表χ2检验,以P<0.05为差异有统计学意义。
2 结果
2.1两种方案的诱导缓解率
HAG治疗组的52例患者中,1疗程后获CR者19例,获PR者8例,33例未获CR的患者接受了第2疗程治疗,6例获得CR,11例PR,16 例仍为NR,总CR率 48.1%,总有效率 69.2%;CAG治疗组的50例患者中,1疗程获CR者18例,获PR者6例,32例未获CR的患者接受了第2疗程治疗,5例获得CR,9例PR,18例仍为NR,总CR率 46%,总有效率64%。经统计学检验,HAG组与CAG组的完全缓解率并无显著性差异(χ2=0.044,P= 0.834),有效率亦无显著性差异(χ2=0.314,P=0.575)。
2.2不良反应
两组患者中只有CAG组中发生1例早期死亡,死亡原因为颅内出血。最常见的不良反应为骨髓抑制。根据WHO标准,HAG组中共有34例(65.4%)发生4级血液系统不良反应。中性粒细胞缺乏症(<1.0×109/L)中位持续时间为 4 d(2-7 d),血小板<20×109/L中位持续时间为 5 d(2-8 d)。CAG组中共有36例(72.0%)发生4级血液系统不良反应。中性粒细胞缺乏症(<1.0×109/L)中位持续时间为6 d(2-8 d),血小板<20×109/L中位持续时间为 7 d(3-9 d)。非血液系统不良反应见表1。2.3影响疗效的因素分析
两种方案在不同年龄、原始细胞比例、染色体核型分组中的有效率见表2,各组之间有效率差异均无统计学意义。
2.4随访情况
HAG组中52例患者中位OS为25月(1-62个月),中位DFS为15月(0-61)。CAG组中50例患者中位OS为26月(1-48个月),中位DFS为16月(0-45)。
表1化疗期间的非血液系统不良反应(例)
Table 1Incidence of non-hematopoietic system adverse reactions during chemotherapy in two groups (cases)
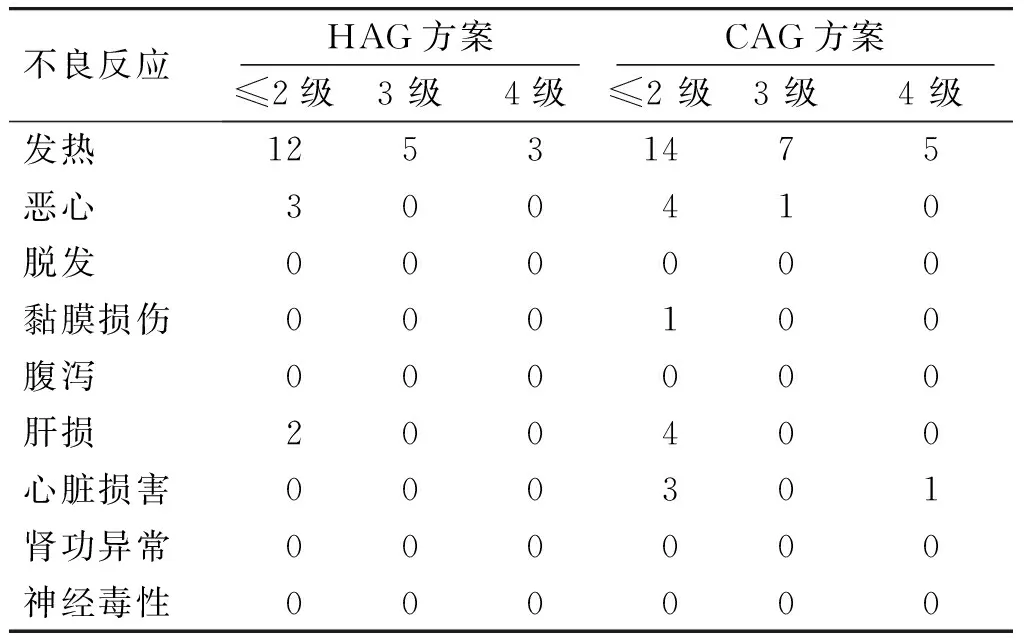
不良反应 HAG方案CAG方案≤2级3级4级≤2级3级4级发热12531475恶心300410脱发000000黏膜损伤000100腹泻000000肝损200400心脏损害000301肾功异常000000神经毒性000000
表2影响患者HAG及CAG方案化疗效果的相关因素
Table 2Factors affecting the response to HAG and CAG for patients
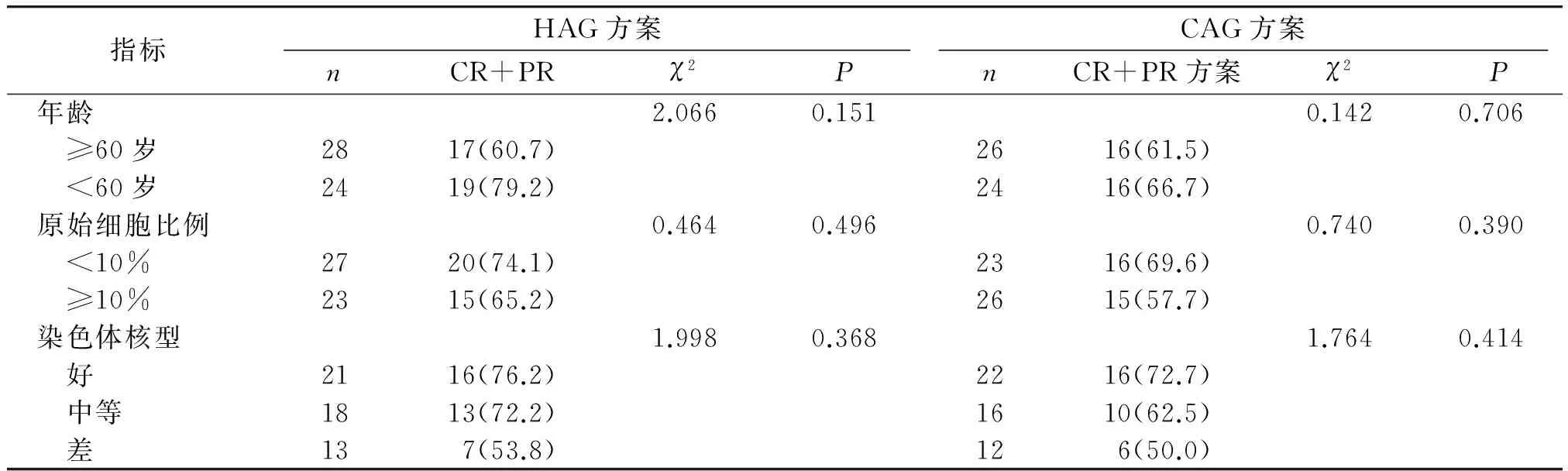
指标HAG方案nCR+PRχ2PCAG方案nCR+PR方案χ2P年龄2.0660.1510.1420.706 ≥60岁2817(60.7)2616(61.5) <60岁2419(79.2)2416(66.7)原始细胞比例0.4640.4960.7400.390 <10%2720(74.1)2316(69.6) ≥10%2315(65.2)2615(57.7)染色体核型1.9980.3681.7640.414 好2116(76.2)2216(72.7) 中等1813(72.2)1610(62.5) 差137(53.8)126(50.0)
3 讨论
高危MDS因其染色体的异常、原始细胞比例高而更易转化为AML。绝大多数的患者并无条件进行造血干细胞移植或常规方案化疗。随着肿瘤分子生物学的研究进展,人们意识到抑癌基因的甲基化是肿瘤发生发展的一个重要因素,作用于DNA甲基转移酶的去甲基化药物地西他滨和五氮杂胞苷用于治疗高危MDS已经得到美国FDA的批准,但是由于肿瘤的发生并不是单一因素或单个基因作用的结果,地西他滨和五氮杂胞苷治疗高危MDS的完全缓解率仅10%左右,总有效率仅20%-30%,而且副作用较大,地西他滨引起中性粒细胞缺乏的发生率高达70%-80%[7],此外,这两种药物价格昂贵,鉴于目前中国西北地区的实际情况,临床应用并不广泛。
G-CSF广泛表达于髓系细胞表面,且在髓系肿瘤细胞表面较正常细胞具有更高的表达率[8]。实验证实,G-CSF可以使更多的瘤细胞进入S期,从而增强S期特异的化疗药物Ara-C的细胞毒作用[9,10],在此基础上设计的G-CSF预激方案最早被Yamada应用于AML的治疗[2]。国内较多的是沿用了Yamada所采用的G-CSF预激联合小剂量ACR和Ara-C的方案,即CAG方案,ACR属于蒽环类化疗药物,具有一定的心脏毒性,临床上治疗高危MDS受到一定限制。因此,我们选择了毒性较小的HHT来与Ara-C联合,即HAG方案。HHT是从我国特有的三尖杉属植物中分离出来的抗肿瘤生物碱,是国内首先用于临床的细胞周期特异性药物,价格低廉,心脏毒性小,骨髓抑制轻,自20世纪70年代以来在中国被广泛用于治疗AML,近年来越来越多的基础及临床研究明确证实了它在体内外均可以诱导髓系肿瘤细胞凋亡,而且还可以诱导白血病细胞进入正常的分化状态,已经得到了国际社会的认可及广泛应用[11-14]。所以在治疗高危MDS中,应用HHT代替阿克拉霉素在理论上是可行的。
本研究中总结了我中心应用HAG及CAG预激方案治疗高危MDS的结果,将二者进行比较,HAG方案诱导治疗后CR为48.1%,总有效率69.2%,CAG方案诱导治疗后CR为46.0%,总有效率64.0%,二者之间无显著性差异,证明HAG预激方案诱导缓解治疗的效果与CAG预激方案是相似的,与文献报道一致[15-18],且明显优于传统HA方案,这提示G-CSF确实增强了化疗药物杀伤或抑制恶性克隆的作用。值得注意的是,HAG方案最常见的副作用为骨髓抑制,但中性粒细胞缺乏的发生率低,恢复时间短,非血液学不良反应中多为胃肠道反应,程度轻微,化疗相关的心、肝、肾等脏器损害少见,均优于CAG组,对于高危MDS患者,不失为CAG方案之外另一可选择的有效治疗方案。在老年患者的治疗中,可代替CAG方案。
Nakamura等[19]研究发现,预激方案化疗后不降低WT1基因的表达,不能用于长期的巩固治疗。在我们的研究中,取得CR的患者虽大多接受了后期的巩固和强化治疗,但部分患者在短期内出现骨髓及血液学复发,分析其原因,可能与诱导方案通常未能导致骨髓抑制有关(粒细胞缺乏者仅40%)。随访发现,巩固/强化治疗中含有骨髓抑制较强的方案(如MAE、TAE、中剂量阿糖胞苷等)或反复变换化疗方案的患者能获得相对较长的完全缓解期。这一结果提示对HAG诱导获得CR的患者应增加后期治疗的强度以更有力地抑制微小残留病灶,同时采用变换化疗方案的手段来减少肿瘤细胞耐药,以争取更理想的缓解和存活期。当然,对于条件允许的患者,应该早期进行异基因造血干细胞移植术。
我们的研究中,两组中原始细胞比例<10%的患者CR率均高于原始细胞≥10%的患者,染色体核型为低危、中危的患者CR率高于高危的患者,但经检验但均无统计学差异,表明对于原始细胞比例高以及高危染色体核型的患者来说,同样可以通过这两种预激方案获益。当然,这一结果还需要进一步扩大样本量进行验证。
[1]Greenberg P,Cox C,LeBeau MM,etal.International scoring system for evaluating prognosis in myelodysplastic syndromes[J].Blood,1997,89(6):2079-2088.
[2]Yamada K,Furusawa S,Saito K,etal.Concurrent use of granulocyte colonystimulating factor with low-dose cytosine arabinoside and aclarubicin for previously treated acute myelogenous leukemia:a pilot study[J].Leukemia,1995,9:10-14.
[3]Zhou JY,Chen DL,Shen ZS,etal.Effect of homoharringtonine on proliferation and differentiation of human leukemic cells in vitro[J].Cancer Res,1990,50:2031-2035.
[4]Ye XJ,Lin MF.Homoharringtonine induces apoptosis of endothlium and down-regulates VEGF expression of K562 cells[J].J Zhejiang Univ Sci,2004,5:230-234.
[5]Zhang WG,Wang FX,Chen YX,etal.Combination chemotherapy with low-dose cytarabine,homoharringtonine,and granulocyte colony-stimulating factor priming in patients with relapsed or refractory acute myeloid leukemia[J].Am J Hematol,2008,83(3):185-188.
[6]Gu LF,Zhang WG,Wang FX,etal.Low dose of homoharringtonine and cytarabine combined with granulocyte colony-stimulating factor priming on the outcome of relapsed or refractory acute myeloid leukemia[J].J Clin Oncol,2011,137(6):997-1003.
[7]Kantarjian H,Oki Y,Garcia-Manero G,etal.Results of a randomized study of 3 schedules of low-dose decitabine in higher-risk myelodysplastic syndrome and chronic myelomonocytic leukemia[J].Blood,2007,109:52-57.
[8]Graf M,Hecht K,Reif S,etal.Expression and prognostic value of hemopoietic cytokine receptors in acute myeloid leukemia(AML):Implications for future therapeutical strategies[J].Eur J Haematol,2003,72:89-106.
[9]Bhalla K,Birkhofer M,Arlin Z,etal.Effect of recombinant GM-CSF on the metabolism of cytosine arabinoside in normal and leukemic human bone marrow cells[J].Leukemia,1988,2:810-813.
[10]Lista P,Porcu P,Avanzi GC,etal.Interleukin 3 enhances the cytotoxic activity of 1-D-arabinofuranosylcytosine(ara-C) on acute myeloblastic leukaemia(AML) cells[J].Br J Haematol,1988,70:121-123.
[11]Zhou X,Xu N,Li R,etal.A comparative proteomic study of Homoharringtonine-induced apoptosis in leukemia K562 cells[J].Leuk Lymphoma,2015,56(7):2162-2169.
[12]卢雪莹,曹维克,叶丽霖,等.高三尖杉酯碱诱导K562细胞凋亡的时间节律性及其机制研究[J].中国实验血液学杂志,2014,22(3):712-716.
[13]Lü S,Wang J.Homoharringtonine and omacetaxine for myeloid hematological malignancies[J].J Hematol Oncol,2014,3;7(1):2.
[14]Daver N,Vega-Ruiz A,Kantarjian HM,etal.A phase Ⅱ open-label study of the intravenous administration of homoharringtonine in the treatment of myelodysplastic syndrome[J]. Eur J Cancer Care,2013,22(5):605-611.
[15]孙志强,何玲.CAG方案在骨髓增生异常综合征和急性髓系白血病中的应用[J].贵州医药,2007,31(1):37.
[16]肖红,邓胜林,黄力君,等.CAG方案治疗老年骨髓增生异常综合征RAEB和RAEB-T的近期疗效[J].医学临床研究,2007,24(1):108-109.
[17]刘惠杰,杨建峰.含有G-CSF的预激方案治疗难治性急性髓系白血病及骨髓增生异常综合征的临床观察[J].现代医学,2006,34(1):41-42.
[18]AlashiK,Eto T,Shibuya T,etal.Aclarubicin induces differentiation of leukemiac progenitors in myelodysplastic syndrome cooperating with granulocyte colony-stimulating factor[J].Leuk Res,2000,24:243-248.
[19]Nakamura Y,Arai Y,Gunji H,etal.WT1 gene expression in patients with acutemyelogenous leukemia or high riskmyelodysplastic syndrome successfully treated with CAG regimen[J].Rinsho Ketsuek,2002,43(10):960-962.
Comparison of efficacy of HAG and CAG priming regimen for patients with high-risk myelodysplastic syndrome
WANG Fangxia*, BAI Ju,HE Aili, ZHANG Wanggang,CAO Xingmei,CHEN Yinxia, LIU Jie,ZHAO Wanhong, MA Xiaorong,YANG Yun,WANG Jianli, ZHANG Pengyu, GU Liufang, LEI Bo, WANG Jin
(DepartmentofHematology,SecondAffiliatedHospital,Xi’anJiaotongUniversity,Xi’an710004,China)
ObjectiveTo compare the efficacy and safety of low-dose priming regimens, HAG[homoharringtonine, cytarabine and granulocyte colony-stimulating factor(G-CSF)] versus CAG(aclacinomycin, cytarabine and G-CSF) for the patients with high-risk myelodysplastic syndrome(MDS).MethodsFifty-two newly diagnosed adult patients with high-risk MDS were enrolled and treated with the HAG regimen, and fifty newly diagnosed patients with high-risk MDS were enrolled and treated with the CAG regimen. The efficacy was evaluated after a cycle, and the non-remission patients were given a second cycle and then the efficacy and the side effects were evaluated.Results①A total of 25 patients(48.1%) achieved complete response(CR) and 11 patients(21.2%) achieved partial response(PR) after two courses of HAG regimen, and the total effective rate was 69.2%.A total of 23 patients(46.0%) achieved CR and 9 patients(18.0%) achieved PR after two courses of CAG regimen, and the total effective rate was 64.0%.There was no statistical difference in the effective rate between HAG and CAG.②In the induction therapy of HAG regimen, a total of 28 patients(53.8 %) experienced neutropenia(median duration: 4 d), and 18 patients(34.6%) experienced platelets less than 20×109/L(median duration:5 d). In the CAG regimen, a total of 29 patients(58.0%) experienced neutropenia(median duration:6 d), and 19 patients(38.0%) experienced platelets less than 20×109/L(median duration: 7 d).ConclusionThe low-dose HAG chemotherapy regimen is as effective as CAG regimen in induction therapy for high-risk MDS, with slight myelosuppression and nonhematologic toxicities.
myelodysplastic syndrome;priming;homoharringtonine;cytarabine;aclacinomycin
西安交通大学自由探索与自主创新类资助项目(08143009)
王芳侠,女,1978-10生,博士,主治医师,E-mail:wfx197478@163.com
2015-10-08
R551.3
A
1007-6611(2016)03-0277-04
10.13753/j.issn.1007-6611.2016.03.018

