产胶原酶的琥珀葡萄球菌分离鉴定及其培养优化研究
柳 林,韦术敏,程仕伟,高美玲,孙虎山(鲁东大学 生命科学学院,应用生物技术山东省高校重点实验室,山东 烟台 264025)
产胶原酶的琥珀葡萄球菌分离鉴定及其培养优化研究
柳林,韦术敏,程仕伟,高美玲,孙虎山*
(鲁东大学 生命科学学院,应用生物技术山东省高校重点实验室,山东 烟台 264025)
针对胶原蛋白难消化利用的现状,自烟台近海分离筛选产胶原蛋白降解酶的微生物,获得高产菌株SM 12,并经形态观察、生理生化试验和16S rDNA鉴定,确定菌株SM 12为琥珀葡萄球菌(Staphylococcus succinus)。通过单因素试验确定最佳培养基成分及发酵条件为20 g/L葡萄糖,15 g/L牛肉膏,20 g/LNaCl,10 g/L明胶,初始pH 7.5,培养温度37℃,接种量7.5%(V/V),装液量100m L/500m L。在此最佳条件下,筛选的菌株SM 12在发酵24 h后获得最大胶原酶活力185.32 U/m L,具备在水产加工下脚料高值化加工领域的应用潜力。
胶原蛋白;胶原酶;琥珀葡萄球菌;发酵条件优化
胶原蛋白具有独特的超螺旋结构(3条α肽链的右手螺旋),性质稳定,一般加工温度及短时间加热都不能使其分解,不易被人体吸收利用[1-3]。而将胶原蛋白水解为胶原多肽,具有易吸收、抗溃疡、抗过敏、降血压、抗菌、抗氧化、降胆固醇、抗衰老、促进伤口愈合、预防骨质疏松及关节炎、促进角膜上皮损伤修复等多种生理活性[4-6],使得胶原多肽成为胶原蛋白高值化利用的研究热点[7-9]。
胶原酶是一种水解天然胶原的蛋白水解酶,能在适当的pH值和温度下只切割活性胶原螺旋区或明胶而不作用于其他蛋白底物。胶原酶的降解活力、稳定性等因素成为高效利用胶原蛋白关键[10]。胶原酶按照其来源可分为植物胶原酶、动物胶原酶和微生物胶原酶,其中细菌来源胶原酶可以分泌到细胞外,通过发酵大量获得,因此微生物来源的胶原酶在应用方面更加广泛。
目前研究最多的微生物胶原酶源于溶组织梭状芽孢杆菌(Clostridium histo lyticum),但其为病原菌,伴有毒素产生,并非理想的胶原酶来源[11-12]。基于目前水产加工企业产生大量鱼皮下脚料的现状,本研究以选育产胶原酶创新菌株为重点,确定菌属来源并优化其培养条件,期望获得容易培养且非病原菌、降解效果高效的胶原酶生产菌,实现鱼皮等下脚料的高值化利用。
1 材料与方法
1.1料与试剂
1.1.1品
样品采自养马岛、海滨浴场、芝罘岛和第一海水浴场中有机质丰富的水土混合样。
1.1.2学试剂
胶原蛋白、还原茚三酮、水合茚三酮:上海生工生物工程有限公司;DNA标准品、脱氧核糖核苷三磷酸、PCR引物、Taq PlusDNA聚合酶:北京鼎国昌盛生物技术有限公司;其余试剂均为国产分析纯。
1.1.3养基
初筛培养基:明胶20 g/L,酵母粉3 g/L,琼脂20 g/L,NaCl 5 g/L,K2HPO42 g/L,MgSO40.2 g/L,MnSO40.1 g/L,pH 7.0。
复筛培养基:明胶10 g/L,酵母粉15 g/L,琼脂20 g/L,NaCl5 g/L,pH 6.5。
初始发酵培养基:碳源10g/L,牛肉膏10g/L,明胶10 g/L,NaCl5 g/L,pH 7.0。
上述培养基均用陈海水配制。
1.2器与设备
TU-1810紫外可见分光光度计:北京普析通仪器有限公司;SWCJ-1B超净工作台:苏州安泰空气技术有限公司;H1850R离心机:湖南湘仪实验室仪器开发有限公司;HZQ-Q全温摇床:哈尔滨市东联电子技术开发有限公司;DYY-6C电泳仪:北京六一仪器厂;L96G型PCR分析仪:杭州朗基科学仪器有限公司。
1.3验方法
1.3.1株筛选
收集含有丰富有机质的海水淤泥,梯度稀释后涂布于初筛培养基,28℃培养至长出单菌落,观察并挑取产生透明圈的菌株。筛选的菌株接种于复筛培养基中,在28℃和180 r/min条件下培养48 h,8 000 r/min离心10min,取上清液测定酶活。
1.3.2属鉴定
单菌落形态观察,经简单染色、革兰氏染色和芽孢染色后镜检。生理生化鉴定方法参照《工业微生物实验技术》[13]。
提取的菌株基因组脱氧核糖核酸(deoxyribosenucleic acid,DNA),以16SrDNA的聚合酶链反应(polymerasechain reaction,PCR)通用引物进行扩增(16S-FAGAGTTTGATCCTGGCTCAG,16S-RAAGGAGGTGATCCAGCCGCA),PCR程序设定:预变性95℃、5min,循环95℃、30 s,55℃、30 s,72℃、90 s,35个循环,延伸10m in。电泳检测,切胶测序。将获得序列提交美国国家生物技术信息中心(national center of biotechnology information,NCBI),通过Blast进行同源性比较,构建系统发育树。
1.3.3酵条件优化
将菌种液体活化后接入发酵培养基,设定碳源、氮源、金属盐、初始pH值、培养温度、装液量和接种量为其中一变量,进行种类和浓度梯度优化,在一定培养组分和条件下发酵培养48 h后测定酶活。确定优化发酵条件后,测定产胶原酶的培养曲线,确定最佳培养时间。
1.3.4原酶活力的测定
1mg胶原蛋白用0.5m L磷酸缓冲液溶解(pH7.4),加入0.1m L酶液,37℃反应40min。加10%三氯乙酸0.5m L终止反应,再加入0.9m L乙酸缓冲液(pH 5.4)和1m L茚三酮显色液混匀。100℃水浴加热10m in,冷却后用3m L的体积分数60%乙醇稀释。在570 nm波长条件下比色测定。对照组:为消除干扰,首先取0.1m L的酶液在100℃水浴煮沸10min将酶进行灭活,其余步骤同酶活力测定。以每1m L酶液水解胶原蛋白每1m in生成1μg的甘氨酸的量为一个酶活力单位(U)[14]。为直观显示培养因素对胶原酶活力的影响,优化过程采用相对酶活力指标,其计算公式如下:

2 结果与分析
2.1原酶产生菌筛选
自烟台地区养马岛、海滨浴场、芝罘岛和第一海水浴场的水土混合样中分离获得产生明胶降解圈的菌株52株,对透明圈与菌落直径比数值大的部分菌株进行胶原酶活力测定,结果见表1。由表1可以看出,分离自养马岛海域的菌株SM 12产胶原酶活力最高,为33.63U/m L,故将其作为后续研究的菌株。

表1 部分菌种产胶原酶活力Table 1 Collagenase activity of a part of strains
2.2株SM 12的显微形态
对纯化后的菌株SM 12进行简单染色及革兰氏染色,观察其显微形态,结果见图1。

图1 菌株SM 12的显微形态Fig.1 Micromorphology of strain SM12
由图1可知,高胶原酶活力的产生菌株SM 12在固体平板培养基上呈现圆形且中央凸起,白色,表面干燥,周围粗糙,不透明也无光泽。显微观察呈现球状但是不成链,革兰氏阳性菌。
2.3株SM 12的生理生化试验
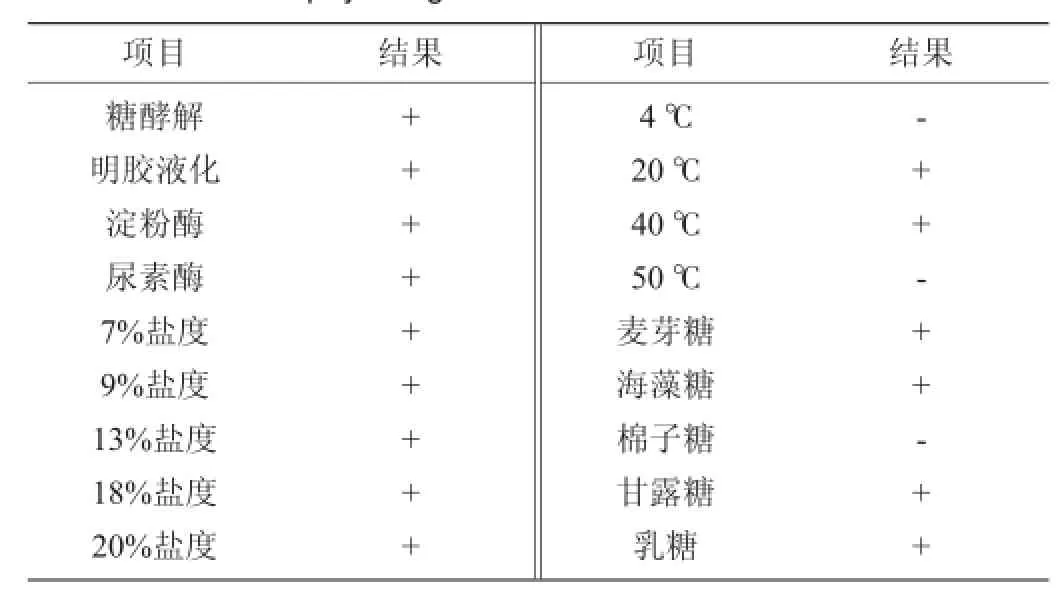
表2 菌株SM 12的生理生化试验结果Table 2 Results ofphysiologicaland biochemical tests of strain SM 12
菌株SM 12的生理生化试验结果见表2。由表2可知,生理生化测定发现其产淀粉酶,分解葡萄糖产酸,能使明胶液化,在质量分数20%盐度条件下仍能生长,在4℃和50℃培养温度下未见生长,不能利用棉子糖,对照《伯杰氏细菌鉴定手册》,该菌株具备葡萄球菌属的生化特征。
2.4株SM 12的分子生物学鉴定
以菌株SM 12的总DNA为模板,采用16S rDNA通用引物进行PCR扩增,结果见图2。由图2可知,检验得到一条1 414 bp的条带。切胶测序得16S rDNA序列,去掉杂峰区序列后的800 bp在NCBI上同源性比较,同源性较高的为琥珀葡萄球菌(Staphylococcus succinus),同源性>99%。采用MEGA6软件构建系统发育树,结果如图3所示。

图2菌株SM 12的16S rDNA的PCR扩增电泳图Fig.2 Electrophoretogram of16S rDNA PCR amplified ofstrain SM 12

图3 菌株SM 12 16S rDNA的系统发育树Fig.3 Phylogenetic tree of 16S rDNA sequence of strain SM 12
细菌分类学家认为当16S rDNA的同源性>97%时属内同种,<95%则是外成员。综合其形态与分子鉴定结果,将菌株SM 12鉴定为琥珀葡萄球菌(Staphylococcus succinus)。琥珀葡萄球菌是腌制食物中的常见菌,尚未见致病性和生产胶原酶的相关报道,具有生产胶原酶潜力。
2.5养基组分优化
2.5.1源及添加量对琥珀葡萄球菌SM 12产胶原酶的影响
选用葡萄糖、麦芽糖、果糖、甘油、糊精、蔗糖、淀粉和麦芽醇,添加量均为10 g/L,考察碳源种类对琥珀葡萄球菌SM 12产胶原酶相对酶活力的影响,结果见图4。由图4可知,最佳产胶原酶相对酶活力的碳源为葡萄糖,其次为麦芽糖、甘油和果糖,而蔗糖、淀粉和甘露醇为碳源时胶原酶的相对酶活力较低。因此,选择葡萄糖为最适碳源。
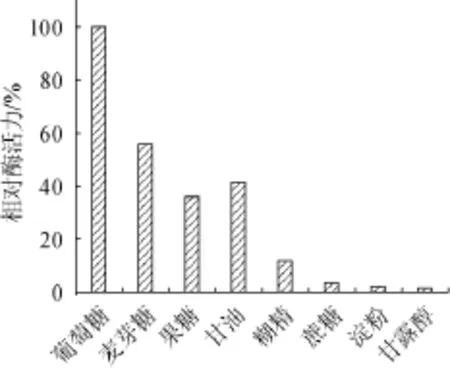
图4 碳源对相对酶活力的影响Fig.4 Effecto f carbon source on the relative enzyme activity
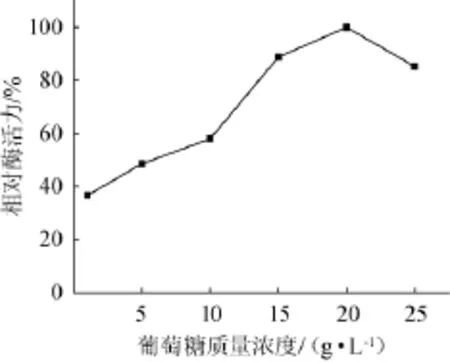
图5 葡萄糖质量浓度对相对酶活力的影响Fig.5 Effectof glucose concentration on the re lative enzyme activity
葡萄糖质量浓度对琥珀葡萄球菌SM 12产胶原酶相对酶活力的影响,结果见图5。由图5可知,随着葡萄糖质量浓度增加,胶原酶活力增加,当葡萄糖质量浓度为20 g/L时胶原酶活力达到峰值,相对酶活力为100%。此后随着葡萄糖质量浓度的继续增加,胶原酶的活力开始缓慢降低。因此,选择葡萄糖质量浓度20 g/L为宜。
2.5.2源及添加量对琥珀葡萄球菌SM 12产胶原酶的影响
不同氮源对琥珀葡萄球菌SM 12产胶原酶相对酶活力的影响,结果见图6,氮源添加量为10 g/L。由图6可知,最佳产酶氮源为牛肉膏,其次为速效氮源(尿素、硫酸铵和氯化铵)。因此,选择牛肉膏为最适氮源。
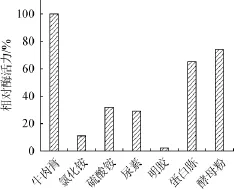
图6 氮源对相对酶活力的影响Fig.6 Effec t of nitrogen source on the rela tive enzym e ac tivity
牛肉膏质量浓度对琥珀葡萄球菌SM 12产胶原酶相对酶活力的影响,结果见图7。由图7可知,随着发酵培养基中牛肉膏质量浓度的增加,胶原酶的活力持续增加,并在牛肉膏质量浓度15 g/L时获得最大胶原酶活力,相对酶活力为100%。此后牛肉膏质量浓度继续增加,胶原酶的活力开始快速降低,故最佳牛肉膏质量浓度为15 g/L。
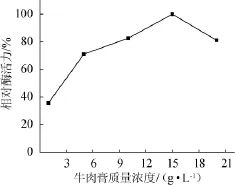
图7 牛肉膏质量浓度对产胶原酶相对酶活力的影响Fig.7 Effec t of beef extract content on the relative enzyme activity of collagenase
2.5.3属离子及添加量对琥珀葡萄球菌SM 12产胶原酶的影响
在金属盐添加量均为8 g/L时,金属盐种类对琥珀葡萄球菌SM 12产胶原酶相对酶活力的影响,结果见图8。由图8可知,产酶活力最高的金属盐为NaCl,其次为ZnSO4,这与以往报道胶原酶催化中心位点具有Zn2+存在一定相关性[15]。
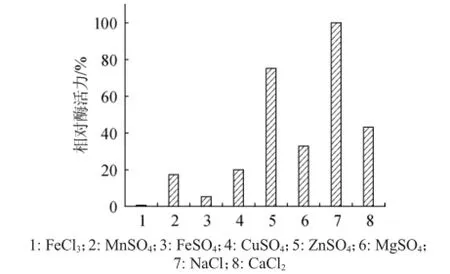
图8 金属盐对相对酶活力的影响Fig.8 Effectofmetalsalton the relative enzyme activity
鉴于产胶原酶的琥珀葡萄球菌SM 12分离自海洋样品,且在多数腌制食品中均有该菌的发现,故该菌株对金属盐应有一定耐受性。NaCl质量浓度对产胶原酶的影响,结果见图9。由图9可知,随着NaCl质量浓度上升,相对酶活力逐渐增加,并在NaCl质量浓度20 g/L时获得最大相对酶活力,且在NaCl质量浓度10~30 g/L区间内相对酶活差异不显著。因此,最佳的NaCl质量浓度为20 g/L。
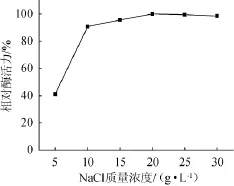
图9 NaC l质量浓度对相对酶活力的影响Fig.9 Effectof NaClcontenton the relative enzyme activity
2.6养条件优化
2.6.1同初始pH对琥珀葡萄球菌SM 12产胶原酶的影响
在最佳培养基条件(20g/L葡萄糖,15g/L牛肉膏,20 g/L NaCl,10 g/L明胶)下,考察不同初始pH对琥珀葡萄球菌SM 12产胶原酶相对酶活力的影响,结果见图10。由图10可知,在初始pH值为7.5时,即略偏碱性条件下产胶原酶相对酶活力最高。
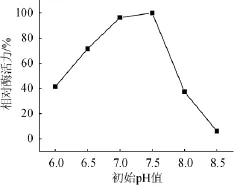
图10 初始pH对相对酶活力的影响Fig.10 Effectof initialpH on the relative enzyme activity
2.6.2不同装液量对琥珀葡萄球菌SM 12产胶原酶的影响
在最佳培养基条件下,考察不同装液量对菌株SM 12产胶原酶相对酶活力的影响,结果见图11。由图11可知,相对酶活随装液量的增加中于先增大后减小的趋势,装液量为100m L/500m L时,获得最大相对酶活力,最佳装液量为100m L/500m L。50m L/500m L装液量的产酶活力与100m L/500m L装液量时情形接近,故菌株SM 12对氧有一定趋向需求,在发酵放大过程中应考虑,选择装液量为100m L/500m L。
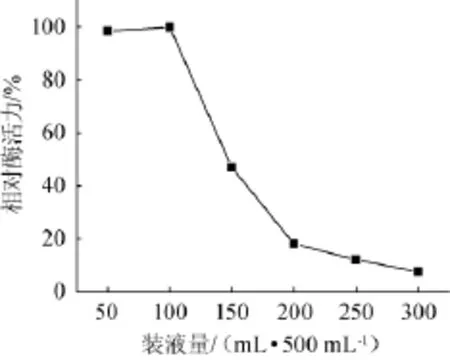
图11 装液量对相对酶活力的影响Fig.11 Effec t of liquid volume on relative enzym e ac tivity
2.6.3同接种量对琥珀葡萄球菌SM 12产胶原酶的影响
在最佳培养基条件下,考察不同接种量对琥珀葡萄球菌SM 12产胶原酶相对酶活力的影响,结果见图12。由图12可知,接种量为7.5%(V/V)时,获得最大相对酶活力。接种量太低或太高均不利于胶原酶的产生,原因在于接种量太低造成发酵时间延长,而接种量过高会使得菌种提前老化衰退。因此,最佳接种量为7.5%(V/V)。
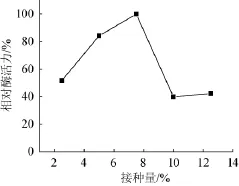
图12 接种量对相对酶活力的影响Fig.12 Effectof inoculum on the relative enzyme activity
2.6.4同培养温度对琥珀葡萄球菌SM 12产胶原酶的影响
在最佳培养基条件下,考察不同培养温度对琥珀葡萄球菌SM 12产胶原酶相对酶活力的影响,结果见图13。由图13可知,培养温度为37℃时,获得最大相对酶活力。在28~37℃的温度区间的产酶量均较高且差异不明显,而培养温度超过37℃后酶产量迅速降低,可能由于温度过高造成酶失活。因此,最佳产胶原酶的培养温度为37℃。
2.7珀葡萄球菌SM 12产胶原酶的培养时间曲线
采用优化后的培养条件:20 g/L葡萄糖,15 g/L牛肉膏,20 g/L NaCl,10 g/L明胶,pH 7.5,温度37℃,接种量7.5%(V/V),装液量100m L/500m L瓶,考察不同培养时间对琥珀葡萄球菌SM 12产胶原酶的影响,结果见图14。
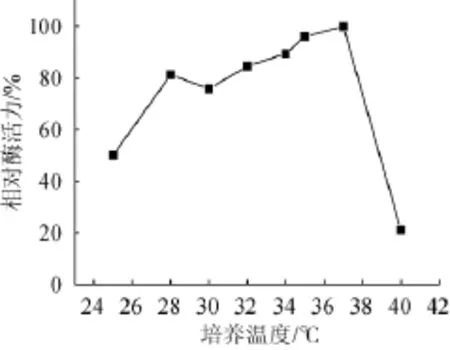
图13 培养温度对相对酶活力的影响Fig.13 Effectof culture temperature on the relative enzyme activity
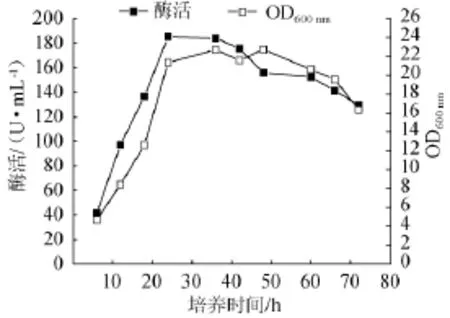
图14 琥珀葡萄球菌SM12产胶原酶的培养曲线Fig.14 Culture curve of S.succinus SM 12 for the co llagenase production
由图14可知,随着菌体的快速增殖,胶原酶活性迅速增加,在发酵24 h后获得最大酶活性(185.32U/m L)。随着发酵时间延长,当超过24 h时酶活呈现逐渐降低趋势,且在35~60 h区间下降缓慢。从发酵曲线看,进入微生物培养静止期后酶活性变化不大,菌株SM 12的产酶模式可能是生长偶联型,相关培养工艺还有待深入优化。
3 结论
自烟台近海海域的采集样品中分离筛选到高产胶原酶菌株SM 12,经形态、生理生化和分子鉴定确定为琥珀葡萄球菌(Seaphylococcus succinus)。在此基础上,优化碳源、氮源、金属盐、初始pH值、培养温度、接种量和装液量对产胶原酶的影响,确定最佳培养基成分及发酵条件为20 g/L葡萄糖,15 g/L牛肉膏,20g/LNaCl,10 g/L明胶,初始pH值7.5,温度37℃,接种量7.5%(V/V),装液量100m L/500m L。在优化条件下发酵24 h获得最大酶活力为185.32U/m L。
[1]吴丹,康怀彬,肖枫.鱼皮胶原蛋白研究进展[J].肉类研究,2007,21(6):23-25.
[2]刘娟,苏联解,张婞,等.乙酸提取齐口裂腹鱼皮胶原蛋白工艺优化[J].食品科技,2015,40(7):257-260.
[3]杨玲,赵燕,鲁亮,等.鲟鱼鱼皮胶原蛋白的提取及其理化性能分析[J].食品科学,2013,34(23):41-46.
[4]HAMDY H S.Extracellular collagenase from Rhizoctonia solani:production,purification and characterization[J].Indian J Biotechnol,2008,7(3):333-340.
[5]靳鸿蔚,刘桂兰,王耿,等.一株胶原酶产生菌的筛选及系统发育分析[J].华侨大学学报:自然科学版,2008,29(3):387-390.
[6]OTA-TSUZUKIC,MAYEM PA.Collagenase production and hemolytic activity related to 16S rRNA variability among Parvimonasm icraoral isolates[J].Anaerobe,2010,16(1):38-42.
[7]IIDRE D,RAMALINGAM K,BABU M.Isolation,purification and characterization of collagenase from hepatopancreas of the land snail Achatina fulica[J].Com p Biochem Phys A,2005,142(1):1-7.
[8]LIMA CA,RODRIGUESPM B,PORTO TS,etal.Production of a collagenase from Candidaalbicans URM 3622[J]. Biochem Eng J,2009,43(3):315-320.
[9]SAKURAIY,INOUEH,NISHIIW,etal.Purification and characterization of amajor collagenase from Streptomyces parvulus[J].Biosci Biotech Biochem,2009,73(1):21-28.
[10]ZHANG X X,LIY,WANG S Y,et al.Identification of a collagenase produced by Bacillus cereus R75E isolated from human colostrum[J]. App l Biochem M icrobiol,2015,51(5):511-521.
[11]LIMA CA,CAMPOSJF,FILHO JL L,etal.Antimicrobialand radical scavenging properties of bovine collagen hydrolysates produced by Penicillium aurantiogriseum URM 4622 collagenase[J].J Food Sci Tech,2015,52(7):4459-4466.
[12]白杨,钱斯日古楞,王红英.一株产胶原酶海洋微生物发酵条件的研究[J].中国农学通报,2011,27(4):321-325.
[13]杜连祥.工业微生物实验技术[M].天津:天津科学技术出版社,1992.
[14]LIMA C A,FREITAS-JUNIOR A C V,LIMA-FILHO JL,et al.Twophase partitioning and partial characterization of a collagenase from Penicillium aurantiogriseum URM 4622:Application to collagen hydrolysis[J].Biochem Eng J,2013,75(24):64-71.
[15]WU Q,LIC,CHEN H,etal.Purification and characterization ofa novel collagenase from Bacilluspumilus Col-J[J].Appl Biochem Biotechnol,2010,160(1):129-139.
Isolation and identification and culture optimization of Staphyloccus succinus for the collagenase profuction
LIU Lin,WEIShum in,CHENG Shiw ei,GAOMeiling,SUN Hushan*
(Key Laboratory ofApplied Biotechnology in Shandong Province,College ofLife Science,Ludong University,Yantai264025,China)
To solve the situation thatcollagen was difficult to be digested and utilized,them icroorganism which produce collagen degradation enzyme was isolated and screened from the Yantaioffshore,thehigh-yielding strain SM 12wasobtained and determ ined as Staphylococcussuccinus bymorphologic observation,physiologicalbiochemical testsand 16S rDNA identification.By single factor experiments,the optimum medium components and fermentation conditionswas determined as follows:glucose 20 g/L,beef extract 15 g/L,NaCl20 g/L,gelatin 10 g/L,pH 7.5,37℃,inoculum 7.5%(V/V)and liquid volume 100m l/500m l.Under the optimum conditions,the collagenase activity of strain SM 12 screened was themaximum 185.32U/m lat fermentation time24 h.Thestrain had thepotentialapplications in high valueprocessing foraquatic productsprocessingwaste.
collagen protein;collagenase;Staphylococcussuccinus;fermentation conditionsoptim ization
Q815
0254-5071(2016)01-0062-06
10.11882/j.issn.0254-5071.2016.01.014
2015-10-26
应用生物技术山东省高校重点实验室开放课题(KLABU-2014-01);国家级大学生创新创业训练计划项目(201410451010,201510451064),鲁东大学学生创新课题(ld151053)
柳林(1989-),男,硕士研究生,研究方向为生物技术。
孙虎山(1962-),男,教授,博士,研究方向为水产养殖病害防治。

