MRI对脑梗死继发皮质脊髓束华勒变性的动态研究
汤 敏TANG Min
张 鑫1ZHANG Xin
吴小红1WU Xiaohong
闵智乾1MIN Zhiqian
刘 鹏2LIU Peng
张小玲1ZHANG Xiaoling
MRI对脑梗死继发皮质脊髓束华勒变性的动态研究
汤 敏1TANG Min
张 鑫1ZHANG Xin
吴小红1WU Xiaohong
闵智乾1MIN Zhiqian
刘 鹏2LIU Peng
张小玲1ZHANG Xiaoling
作者单位
1.陕西省人民医院MRI室 陕西西安710068
2.陕西省人民医院神经内科 陕西西安710068
Department of MRI, Shaanxi Provincial People's Hospital, Xi'an 710068, China
Address Correspondence to: ZHANG Xiaoling
E-mail: zxl.822@163.com
2016-04-15
中国医学影像学杂志
2016年 第24卷7期:490-493
Chinese Journal of Medical Imaging
2016 Volume 24 (7): 490-493
目的 利用MRI观察脑梗死继发皮质脊髓束华勒变性的变化规律,探讨早期华勒变性扩散加权成像(DWI)信号特点与预后的关系,为临床认识华勒变性提供影像学依据。资料与方法 回顾性分析30例大脑中动脉、颈内动脉狭窄闭塞致脑梗死患者,依据脑梗死后所致皮质脊髓束变性DWI 呈高信号和等信号分为两组,所有患者于发病后1 d、1个月、6个月、12个月均行常规MRI及DWI检查,测量患侧与健侧大脑脚宽度比,采用美国国立卫生研究院卒中量表(NIHSS)评估病情严重程度,比较两组大脑脚宽度比及NIHSS评分。结果 随访1个月、6个月、12个月,急性期皮质脊髓束华勒变性DWI高信号组NIHSS评分均高于等信号组,差异有统计学意义(P<0.01),两组发病后1 d NIHSS评分差异无统计学意义(P>0.05)。随访12个月,急性期皮质脊髓束华勒变性DWI 高信号组患侧大脑脚宽度比小于等信号组,差异有统计学意义(P<0.05),DWI 高信号组大脑脚萎缩更明显;两组发病后1 d、随访1个月、6 个月患侧大脑脚宽度比差异无统计学意义(P>0.05)。结论 皮质脊髓束华勒变性1~6个月以轴突肿胀、髓鞘崩解、T2WI高信号为特征,6~12个月以有髓纤维容积减少、脑干不对称萎缩、胶质增生为特征。皮质脊髓束华勒变性DWI早期高信号提示预后较差。
脑梗死;Waller 变性;锥体束;磁共振成像,弥散;扩散加权成像;预后
【Abstract】Purpose To discuss the relationship between the features of early corticospinal tract (CST) Wallerian degeneration (WD) signals in DWI and its prognosis by observing characteristics of CST WD after cerebral infarction with MRI. This will provide imaging basis for a better clinical understanding in CST WD.Materials and Methods In this retrospective study, we assessed images and clinic data for 30 patients with acute middle cerebral/internal carotid artery stroke, and divided them into CST hyperintensity group and isointensity group in DWI at day 1. Then all the patients underwent MRI and DWI examinations at day 1, 30, 180, and 360 after stroke onset. The ratio of the cross-sectional width of the ipsilateral cerebral peduncle to the width of the contralateral cerebral peduncle were measured and the severity of dysfunction patients were assessed according to national institute of health stroke scale (NIHSS). The NIHSS scores and cerebral peduncle width ratio were compared between the two groups.Results The NIHSS scores were statistically higher in CST DWI hyperintensity group than in the isointensity group at day 30, 180, 360 (P<0.01), but there were no statistical differences in the NIHSS scores at day 1 between the two groups (P>0.05). The cerebral peduncle width ratio was significantly lower in CST DWI hyperintensity at acute stage compared with that in the isointensity group only at day 360 (P<0.05), and the cerebral peduncle atrophy was more obvious in the DWI hyperintensity group; there were no statistically differences in the cerebral peduncle width ratio at day 1, 30, and 180 between the two groups (P>0.05). Conclusion The corticospinal tract WD is characterized by axonal swelling, breakdown of myelin sheath and hyperintense on T2-weighted MRI during 1 to 6 months; and during 6 to 12 months, it is characterized by volume loss of myelinated fibres, unilateral brainstem atrophy and gliosis on MRI. At the same time, the hyperintense on DWI predicts unsatisfactory prognosis in corticospinal tract WD poststroke onset.
【Key words】Brain infarction; Wallerian degeneration; Pyramidal tracts; Diffusion magnetic resonance imaging; Diffusion weighted imaging; Prognosis
华勒变性(Wallerian degeneration,WD)是指神经元胞体或近端轴突损伤后,细胞胞体与轴突营养支持中断,导致远端轴突、髓鞘继发变性,广泛存在于中枢神经系统和周围神经系统[1-2]。WD病因繁多,其中以脑梗死、出血、肿瘤、脱髓鞘疾病较为常见[3]。本研究通过脑梗死引起急性皮质脊髓束(corticospinal tract,CST)WD的扩散加权成像(DWI)信号差异,预测患者神经功能恢复情况、大脑脚形态学和信号变化特点,为临床医师提供重要的诊疗信息,以对CST WD患者进行早期准确诊断和治疗,降低患者致残率。
1 资料与方法
1.1 研究对象 选择2011年9月—2014年1月陕西省人民医院30例大脑中动脉或颈内动脉闭塞致急性期(6~24 h)脑梗死患者,均符合《中国急性缺血性脑卒中诊治指南2010》[4]中的诊断标准,所有患者梗死范围均累及额顶叶或CST通路。排除标准:既往及随访过程中有脑出血、脑梗死、肿瘤等病史;脑干病变及脑部手术史;脑梗死未累及中央前后回。其中男23例,女7例;年龄47~79岁,平均(61.0±11.7)岁。临床表现:一侧肢体瘫痪30例,头痛16例,呕吐11例,失语13例,意识丧失8例。30例患者均经神经系统检查并采用美国国立卫生研究院卒中量表(national institute of health stroke scale,NIHSS)评定脑功能障碍情况。所有患者发病后1个月、6个月、12个月均进行理疗康复训练、神经系统检查和常规颅脑MRI检查。1.2 仪器与方法 30例患者均于发病24 h内行MRI检查,其中19例采用Philips Intera Achieva 1.5T超导MR仪,常规行T1WI、T2WI、FLAIR、DWI轴位及T1WI矢状位扫描,扫描参数:SE-T1WI:TR 380 ms,TE 16 ms;SE-T2WI:TR 4600 ms,TE 102 ms;FLAIR:TR 8500 ms,TE 133 ms,激励次数1,视野24 cm×24 cm,层厚5 mm,间隔1 mm,矩阵512×512;DWI:TR 7000 ms,TE 84 ms,激励次数1,矩阵128×128,b=0、1000 s/mm2。11例采用Toshiba Vantage 1.5T超导MR仪,行T1WI、T2WI、FLAIR、DWI轴位及T1WI矢状位扫描,扫描参数:SE-T1WI:TR 1466 ms,TE 15 ms;SE-T2WI:TR 5800 ms,TE 152 ms;FLAIR:TR 8500 ms,TE 133 ms,激励次数1,视野24 cm×24 cm,层厚5 mm,间隔1 mm,矩阵512×512;DWI:TR 5000 ms,TE 105 ms,矩阵128×128,b=0、1000 s/mm2。由2名主治医师以上职称的神经影像医师评估CST大脑脚水平信号及是否累及中央前后回,依据首次脑梗死后CST DWI高信号和等信号将30例患者分为两组,其中CST高信号组11例,CST等信号组19例。
1.3 大脑脚宽度测量 大脑脚是评价CST变性最理想的区域[5],本研究利用MRI T1WI轴位图像选择大脑脚最大层面作为测量大脑脚宽度层面,大脑脚内侧缘连接动眼神经处为起点,以中脑后外侧沟为终点作垂直于大脑脚长轴的垂线,即大脑脚宽度[6],每侧测量2次,取平均值。将患侧大脑脚宽度比健侧大脑脚宽度,对患侧大脑脚宽度进行标准化。
1.4 统计学方法 采用SPSS 17.0软件,计量资料组间比较采用独立样本t检验,P<0.05表示差异有统计学意义。
2 结果
2.1 脑梗死部位 13例大脑半球大面积脑梗死,额顶叶脑梗死7例,5例脑梗死位于侧脑室体旁(图1A),内囊后支3例,丘脑-基底节梗死2例,急性期所有脑梗死病灶DWI均表现为高信号,其中DWI序列CST呈等信号19例,高信号11例(图2A)。
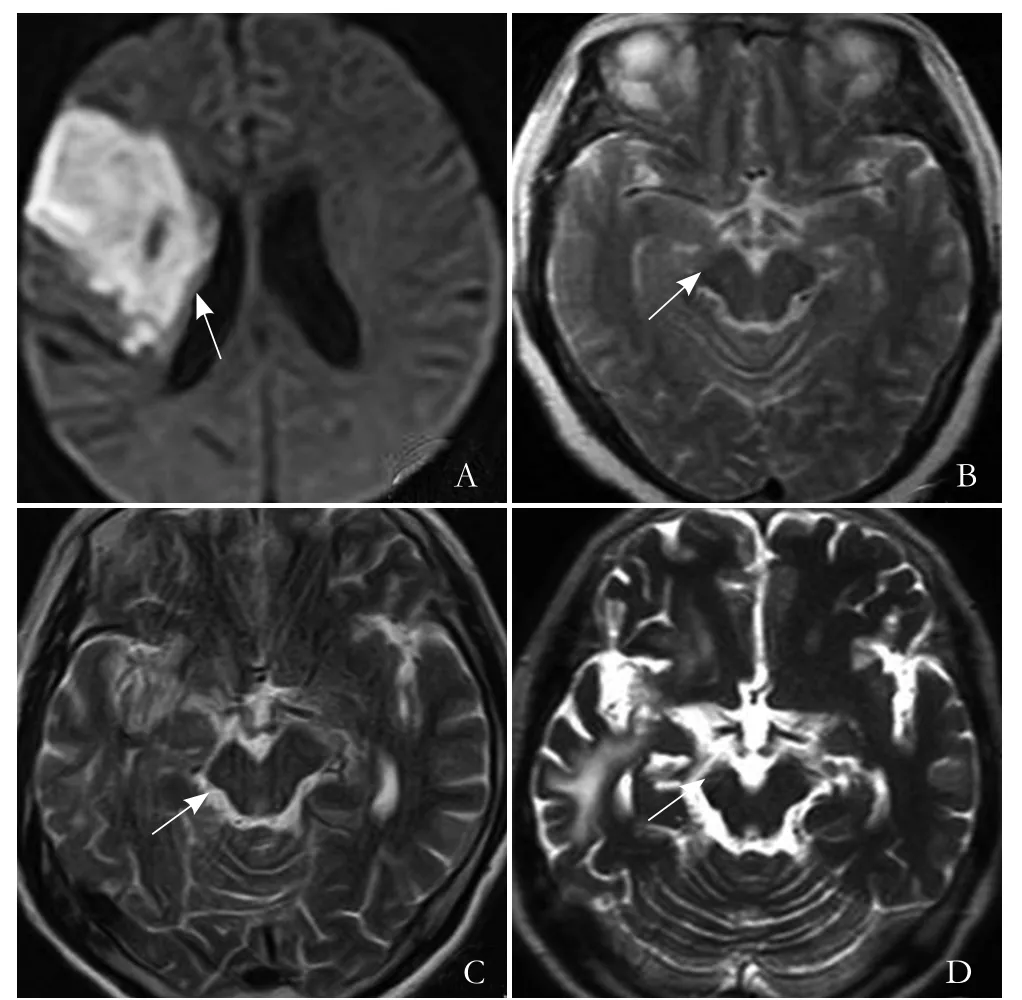

图1 男,56岁,右侧大脑额顶叶大面积脑梗死。DWI 示右侧额顶叶、侧脑室旁白质急性期脑梗死(箭,A);脑梗死发病1 d、随访1个月、6个月、12个月,T2WI示患侧大脑脚CST变化过程(箭,B~E)
2.2 随访影像资料 脑梗死1 d,11例患者T2WI及DWI CST走行区可见高信号,1例大脑脚体积略小(图2B),19例T2WI及DWI大脑脚形态及信号无异常(图1B)。随访1个月,15例患者T2WI及FLAIR患侧CST走行区出现线样、条片状高信号,T1WI呈低信号,DWI呈稍低信号,2例大脑脚宽度、脑桥、延髓缩小,15例T2WI、FLAIR、T1WI CST无明显异常(图1C)。随访6个月,30例患者患侧CST走行区T2WI及FLAIR呈条片状高信号,高信号范围扩大,T1WI呈低信号,17例患侧大脑脚、脑桥、延髓体积缩小(图1D)。随访12个月,30例患者CST走行区T2WI及FLAIR序列呈条片状高信号,T1WI呈低信号,30例患者患侧大脑脚均有不同程度的萎缩(图1E)。

表1 脑梗死致CST急性WD DWI高信号与等信号组不同时间点NIHSS评分及大脑脚宽度比的变化

图2 男,66岁,左侧额颞顶叶脑梗死。DWI 示左侧颞叶及大脑脚可见斑片状高信号(箭,A);脑梗死1 d,T2WI 示左侧大脑脚CST呈稍长T2信号(箭,B)
2.3 临床恢复情况评估 脑梗死1 d,评估30例急性期CST WD的神经功能障碍情况和大脑脚宽度比,建立急性期CST WD临床和影像学数据基线,随访1个月、6个月、12个月观察大脑脚宽度变化及神经功能恢复情况见表1,随访1个月、6个月、12个月DWI高信号组NIHSS评分高于DWI等信号组,差异有统计学意义(P<0.05);随访12个月DWI高信号组大脑脚宽度比小于DWI等信号组,差异有统计学意义(P<0.05)。
3 讨论
WD病理显示神经细胞染色浅淡,胞体表面不平,细胞核固缩或碎裂,轴突肿胀,髓鞘崩解,有髓纤维减少、萎缩,泡沫巨噬细胞浸润,伴有神经胶质细胞增生。WD按照不同时期病理改变及影像学差异分为4 期[7]。本研究显示,脑梗死所致CST急性WD的DWI可以呈高信号和等信号,与Jones等[8]的研究结果一致。由于细胞外大量水分子进入细胞内引起细胞肿胀,细胞外间隙缩小,导致水分子活动受限加重,表观扩散系数(ADC)值降低,DWI呈高信号。然而Liu等[9]研究显示,急性期CST ADC值增高,可能因为WD 引起神经元凋亡,髓鞘脱失,轴突外间隙增大,导致水分子扩散的受限因素减少。总之,WD水分子扩散情况改变是引起DWI信号改变的关键,但是在急性期CST WD的DWI信号变化的时间临界点尚不清楚,有待进一步研究。脑梗死后可能引起不同程度的神经功能障碍,梗死是否合并锥体束WD是影响梗死预后及神经功能恢复的重要因素[8,10-11]。本研究显示,急性期脑梗死CST变性DWI呈高信号组神经功能恢复较等信号组差,提示CST WD的DWI早期信号特点能预测脑梗死预后,帮助临床诊断和制订康复计划,为延缓CST轴突变性、早期治疗和预后评估提供准确的影像学信息,因此WD早期变化需要引起临床高度重视。然而在脑梗死急性期两组神经运动功能损害情况并无明显差异,可能由于脑梗死合并水肿、缺血半暗带、占位效应共同干扰CST功能所致,这与方珉等[12]对WD的扩散张量成像研究结果类似。扩散张量成像能早期、敏感地发现有髓纤维的完整性,且各向异性分数值减低与WD短期预后有相关性[10],但是扩散张量成像对MR要求高,成像时间长,影响因素多。然而,常规扩散在临床工作中得到普遍应用,重复性较好,相对容易执行,因此DWI可能在评价CST WD 更有实际意义。随着发病时间推移,WD变性组织亲水性明显增加,髓鞘脂质崩解破坏,胶质增生,引起CST变性萎缩[13]。本研究显示,常规MRI显示CST WD 的时间参差不齐,变性的范围和萎缩程度随时间延长逐渐明显。随访6个月内,CST DWI高信号组和等信号组大脑脚宽度比无明显差异,但本研究中CST DWI 高信号组1例患者大脑脚存在不对称性,这可能与发育变异有关。随访12个月,两组患侧大脑脚宽度比差异有统计学意义(P<0.05),CST DWI高信号组大脑脚宽度比明显低于等信号组,且WD 6~12个月大脑脚明显萎缩,提示WD 6~12个月是CST髓鞘脱失、神经元轴突减少的快速期,与Buss等[14]报道的髓鞘蛋白丢失时间存在差异。同时表明急性期CST DWI高信号WD程度更重,故DWI能远期预测大脑脚CST萎缩程度。Mark等[6]研究显示,大脑脚萎缩与脑梗死对椎体束损伤程度有关,提示WD与其胞体和近端轴突损伤程度密切相关。WD进一步发展,随着神经元轴突和髓鞘减少,神经胶质增生,CST萎缩是否趋于稳定,需要长期随访观察WD才能得到进一步证实。
本研究病例数较少,研究CST WD仅局限于脑梗死,对大脑脚萎缩的判断局限于传统方法。在今后的工作中将进一步开展多因素所致CST WD的变化差异,探讨评估大脑脚萎缩更精确的方法。
总之,脑梗死所致CST WD轴突和髓鞘减少随着时间变化存在一定的规律,1~6个月WD是轴突肿胀、髓鞘崩解、T2WI高信号的主要时期,6~12个月是WD有髓纤维容积减少、脑干不对称萎缩、胶质增生的重要阶段。CST DWI早期高信号可能提示脑梗死预后较差。
[1] 王润榕, 谭政帅, 张帅, 等. 纹状体内囊梗死上肢运动功能损害的脑桥基底部扩散张量成像. 医学影像学杂志, 2014,24(7): 1093-1097.
[2] Freeman MR. Signaling mechanisms regulating Wallerian degeneration. Curr Opin Neurobiol, 2014, 27: 224-231.
[3] Venkatasubramanian C, Kleinman JT, Fischbein NJ, et al. Natural history and prognostic value of corticospinal tract Wallerian degeneration in intracerebral hemorrhage. J Am Heart Assoc, 2013, 2(4): e000090.
[4] 中华医学会神经病学分会脑血管病学组急性脑卒中诊治指南撰写组. 中国急性缺血性脑卒中诊治指南2010. 中国临床医生, 2011, 2(3): 67-73.
[5] Virta A, Barnett A, Pierpaoli C. Visualizing and characterizing white matter fiber structure and architecture in the human pyramidal tract using diffusion tensor MRI. Magn Reson Imaging, 1999, 17(8): 1121-1133.
[6] Mark VW, Taub E, Perkins C, et al. Poststroke cerebral peduncular atrophy correlates with a measure of corticospinal tract injury in the cerebral hemisphere. Am J Neuroradiol,2008, 29(2): 354-358.
[7] Thomalla G, Glauche V, Weiller C, et al. Time course of Wallerian degeneration after ischaemic stroke revealed by diffusion tensor imaging. J Neurol Neurosurg Psychiatry, 2005,76(2): 266-268.
[8] Jones KC, Hawkins C, Armstrong D, et al. Association between radiographic Wallerian degeneration and neuropathological changes post childhood stroke. Dev Med Child Neurol, 2013,55(2): 173-177.
[9] Liu M, Gross DW, Wheatley BM, et al. The acute phase of Wallerian degeneration: longitudinal diffusion tensor imaging of the fornix following temporal lobe surgery. Neuroimage,2013, 74: 128-139.
[10] 李捷, 王大明, 胡浩宇, 等. 弥散张量成像动态观察脑出血及脑梗死引起锥体束继发损伤. 实用放射学杂志, 2011,27(4): 483-486, 563.
[11] Lindberg PG, Skejø PH, Rounis E, et al. Wallerian degeneration of the corticofugal tracts in chronic stroke: a pilot study relating diffusion tensor imaging, transcranial magnetic stimulation, and hand function. Neurorehabil Neural Repair,2007, 21(6): 551-560.
[12] 方珉, 谢瑞满, 周林江, 等. 应用扩散张量成像研究脑梗死后早期皮质脊髓束Waller 变性与运动功能的相关性. 中国医学计算机成像杂志, 2011, 17(3): 193-196.
[13] Saxena S, Caroni P. Mechanisms of axon degeneration: from development to disease. Prog Neurobiol, 2007, 83(3): 174-191. [14] Buss A, Brook GA, Kakulas B, et al. Gradual loss of myelin and formation of an astrocytic scar during Wallerian degeneration in the human spinal cord. Brain, 2004, 127(Pt 1):34-44.
(本文编辑 张春辉)
Dynamic Study of Corticospinal Tract Wallerian Degeneration After Cerebral Infarction with MRI
10.3969/j.issn.1005-5185.2016.07.003
张小玲
2015-12-10
R445.2

