共聚物接枝蛋白离子交换色谱介质制备及性能
张素玲,杨葳,余林玲,白姝,孙彦,史清洪
共聚物接枝蛋白离子交换色谱介质制备及性能
张素玲,杨葳,余林玲,白姝,孙彦,史清洪
(天津大学化工学院生物化工系,系统生物工程教育部重点实验室,天津 300354)
高容量蛋白质色谱介质是色谱过程高效化的材料基础和重要前提。采用原子转移自由基聚合(ATRP)技术,以甲基丙烯酸3-磺酸丙酯钾和甲基丙烯酸甲酯(MMA)为单体化合物合成了多种无规共聚物接枝离子交换色谱介质,并对其蛋白质吸附性能进行研究。单体总浓度一定情况下共聚物接枝色谱介质孔道半径(pore)随MMA浓度升高而增大,反映出接枝共聚物链渐趋塌陷的特征。蛋白质吸附结果表明,溶菌酶吸附容量取决于介质的离子交换容量;而抗体吸附容量则与pore及相应的聚合物层厚度变化密切相关。随着聚合物层厚度的增大,聚合物层对抗体的空间排阻作用增强,抗体吸附容量下降。此外,引入MMA优化共聚物分子链可显著提高蛋白质吸附量,在SEP-S30/M30介质中抗体和溶菌酶的饱和吸附量分别达到237 mg·g-1和380 mg·g-1。无规共聚物接枝离子交换色谱介质孔道内聚合物层厚度和蛋白质吸附也受无机盐浓度调控。
共聚物接枝离子交换色谱介质;原子转移自由基聚合;蛋白质;吸附;高容量;抗体
引 言
蛋白质离子交换色谱介质是蛋白质色谱技术的核心构件和技术创新的物质基础,开发高容量的蛋白质离子交换色谱介质成为色谱过程高效化的重要前提。
20世纪90年代起,以POROS灌注介质[1]、超大孔色谱介质[2-3]和整体柱介质[4-5]为代表的新型色谱材料相继问世。上述色谱介质的共同特征是引入微米级对流孔道强化色谱介质内蛋白质的传质速率,实现对介质结合位点的更有效利用,提高蛋白质结合容量。但传统色谱介质中蛋白质的结合仅发生在介质孔道的表面,饱和吸附容量受限于介质的比表面积[6]。HyperD[7]和Fractogel EMD[8]等杂化色谱介质通过引入聚丙烯酰胺凝胶或聚合物分子在介质孔道内构建“脚手架”,修饰于聚丙烯酰胺凝胶或聚合物分子上的色谱配基分布于整个孔道空间而非仅限于孔道表面,由此提供了更多的有效结合位点,显著提升了蛋白质的饱和吸附容量。作为此类介质的一个成功范例,Sepharose XL离子交换色谱介质是将葡聚糖分子接枝在琼脂糖凝胶粒子上,继而偶联离子交换配基,在介质孔道内获得三维的配基分布[9]。Ljunglof等研究表明SP Sepharose XL的Fab抗体饱和吸附容量和动态吸附容量(dynamic binding capacity, DBC)分别可达295 mg·ml-1和180 mg·ml-1 [10],并在其综述中对截至2011年的聚合物接枝离子交换色谱介质的研究进行了系统总结[9]。近来,Yu等[11-13]报道了聚乙烯亚胺直接接枝的琼脂糖离子交换色谱介质的制备方法,其牛血清白蛋白的饱和吸附容量达到274 mg·ml-1。鉴于介质孔道的空间位阻作用和聚合物分子多分散性及其在介质孔道内的多位点结合属性,前述介质孔道内聚合物接枝过程和接枝聚合物层特性都是难以控制的。本课题组公开了利用原子转移自由基聚合(ATRP)技术在琼脂糖色谱介质表面接枝单体化合物甲基丙烯酸3-磺酸丙酯钾(SPM)制备链结构可控的聚合物接枝离子交换色谱介质的方法[14],该介质的溶菌酶饱和吸附容量高达413 mg·ml-1。但上述介质的抗体饱和吸附容量随接枝聚合物链长度增大而急剧下降至32 mg·ml-1。
为了获得高抗体吸附容量的聚合物接枝离子交换色谱介质,本课题组引入甲基丙烯酸甲酯(MMA),通过其与单体化合物SPM掺杂合成了不同配基分布密度的无规共聚物接枝离子交换色谱介质,系统地研究了离子交换色谱介质中聚合物链长和配基分布密度对溶菌酶和抗体离子吸附行为的影响。
1 实验材料和方法
1.1 材料
琼脂糖凝胶Sepharose Fast Flow,购于通用医疗公司(Uppsala, Sweden);抗体(来源于牛血清,≥99%,w约155×103)、溶菌酶(来源于鸡蛋白,≥90%,w约14.3×103)、-溴异丁酰溴(BIBB)、MMA和SPM,Sigma-Aldrich公司(St. Louis, USA)试剂;,′-二甲基甲酰胺(DMF),购于天津大学江天化工科技开发公司;三乙胺(TEA)、溴化亚铜(CuBr)、溴化铜(CuBr2)和2,2′-联吡啶(Bpy),购自天津市光复精细化工研究所。化学试剂均为分析纯试剂。
1.2 方法
1.2.1 无规共聚物接枝离子交换色谱介质的合成
无规共聚物接枝离子交换色谱介质的合成工艺如图1所示。琼脂糖凝胶Sepharose Fast Flow置于G3漏斗中,经蒸馏水反复冲洗并抽干后,称取15 g抽干介质,并将溶剂置换为DMF。处理好的介质转入250 ml三口烧瓶,依次加入95 ml DMF和3 ml TEA后,置于冰浴中搅拌均匀。将含20%(体积分数)BIBB的12.5 ml DMF溶液置于恒压漏斗中,逐滴加入三口烧瓶,滴加结束后升温至30℃,反应12 h。产物依次经DMF、乙醇和去离子水清洗后,得到溴化Sepharose Fast Flow介质,记为SEP-Br。
SEP-Br介质的共聚物接枝反应在100 ml锥形瓶中进行。称取3g SEP-Br介质,转移至装有50 ml 50%(体积分数)甲醇水溶液的锥形瓶中,然后依次加入SPM、MMA、Bpy和CuBr2。化学试剂的加入量见表1。上述的锥形瓶连续通入纯氮30 min后,迅速加入CuBr,并继续通入纯氮30 min以完全排空氧气。锥形瓶密封后置于25℃水浴摇床中,在170 r·min-1下反应4 h,然后锥形瓶敞口暴露于空气中,直至溶液变为墨绿色。反应结束后,产物经0.1 mol·L-1EDTA溶液清洗除去Cu2+,再依次用大量乙醇和去离子水清洗,获得不同种类的无规共聚物接枝离子交换色谱介质,用于蛋白质吸附行为的实验研究。

表1 聚合物接枝离子交换色谱介质制备单体用量和介质性质参数 Table 1 SPM and MMA contents in synthesis of random copolymer-grafted cation-exchangers and properties of cation-exchangers
1.2.2 共聚物接枝离子交换色谱介质的表征
无规共聚物接枝离子交换色谱介质、溴化SEP-Br介质和Sepharose Fast Flow的红外光谱采用Nicolet 6700傅里叶红外光谱仪(MA, USA)测定。测试样品采用冷冻干燥24 h获得。色谱介质的粒径采用Mastersizer2000U 粒径分析仪(Malvern instruments, UK)测定。测定过程重复3次,得到色谱介质的平均粒径p。共聚物接枝离子交换色谱介质的离子交换容量IC采用酸碱滴定法测定[15]。
色谱介质的平均孔道半径pore是以不同分子量的葡聚糖为探针,采用逆体积排阻色谱(iSEC)方法测量[11,16]。待测色谱介质填充于TricornTM5/50色谱柱中,柱高控制在5.5 cm±0.2 cm。色谱柱用20 mmol·L-1Tris-HCl缓冲液(pH 8.0)平衡至少15个柱体积(CV),直至示差检测器(RID)的信号稳定并调零。葡聚糖溶液同样采用20 mmol·L-1Tris-HCl缓冲液制备后,在0.25 ml·min-1流速下上样20 µl。上样结束后,采用同一缓冲液冲洗色谱柱,记录不同葡聚糖的保留体积R。
利用式(1)计算出不同分子量溶质的分配系数D
式中,0为色谱柱空隙体积,ml,由分子量为521×103的葡聚糖分子测得;T为色谱柱总体积,ml,由葡萄糖分子测得。
iSEC实验数据采用单一圆柱孔模型拟合,得到介质的孔道半径pore
式中,s为不同溶质分子半径,nm,用黏性半径η表示;glu为葡萄糖分子半径,nm。
1.2.3 蛋白质静态吸附实验
无规共聚物接枝离子交换色谱介质的静态吸附实验在25 ml锥形瓶中进行[17]。离子交换色谱介质经蒸馏水清洗并抽滤后,用吸附缓冲液平衡不少于12 h。在本研究中,溶菌酶静态吸附实验采用20 mmol·L-1Tris-HCl缓冲液(pH 8.0)为吸附缓冲液,抗体静态吸附实验采用20 mmol·L-1醋酸盐缓冲液(pH 5.0)为吸附缓冲液。平衡后的色谱介质经G3漏斗抽干后,称取0.05 g介质,分别置于25 ml锥形瓶中,随后向锥形瓶中加入5 ml不同浓度的蛋白质溶液。锥形瓶置于25℃水浴摇床中,在170 r·min-1下振荡24 h后取出,在4000 r·min-1下离心5 min收集上清液。最后,以吸附缓冲液为参比,在280 nm下测定上清液中蛋白质浓度。
根据式(3),求得蛋白质的吸附量
式中,0为蛋白质溶液初始浓度,mg·ml-1;为蛋白质溶液体积,ml;为蛋白质吸附量,mg·g-1;为色谱介质湿重,g。
静态吸附实验数据与Langmuir吸附等温线[式(4)]拟合,可得到蛋白质饱和吸附量m和解离常数d
1.2.4 蛋白质吸附动力学实验
蛋白质在色谱介质上的吸附动力学实验采用间歇搅拌法测定[18],具体实验方法如下:100 ml蛋白质溶液置于100 ml三口圆底烧瓶中,并插入半月形搅拌桨后,烧瓶置于25℃水浴中,在100 r·min-1条件下匀速搅拌至恒温。烧瓶内蛋白质溶液在蠕动泵驱动下以25 ml·min-1的流速经孔径2 μm的不锈钢滤头流入UV-900紫外检测器的检测池,在280 nm下测定蛋白质浓度,检测池流出的溶液返回烧瓶中。本研究中,溶菌酶浓度为1 mg·ml-1,抗体浓度为0.3 mg·ml-1。当吸光度值稳定后,称取0.22 g经吸附缓冲液平衡并抽滤后的介质加入三口烧瓶中,在线测量蛋白质溶液吸光度值随时间变化情况。实验数据用本课题组此前建立的有效孔扩散模型分析[11],求解得到蛋白质在离子交换色谱介质中的有效孔扩散系数e。
1.2.5 动态吸附容量测定
蛋白质的DBC采用迎头分析法,在ÄKTA FPLC快速液相色谱系统中测定[15, 19]。在本研究中,溶菌酶的穿透实验色谱流动相为含有不同浓度NaCl的20 mmol·L-1Tris-HCl缓冲液(pH 8.0),抗体的穿透实验流动相为含有不同浓度NaCl的20 mmol·L-1醋酸盐缓冲液(pH 5.0);原料液为溶于色谱流动相的浓度0为2.0 mg·ml-1的蛋白质溶液。填充在Tricorn5/50色谱柱中的色谱介质经流动相平衡至少10个柱体积后,溶菌酶溶液以1 ml·min-1的流速、抗体溶液以0.2 ml·min-1的流速向色谱柱内连续输入,直至蛋白质在色谱柱出口处完全穿透。蛋白质穿透体积(10,ml)根据色谱柱出口处蛋白质浓度达到原料液浓度10%时的色谱进料体积;色谱柱死体积(0,ml)为蛋白非保留条件下的穿透体积。
抗体的DBC(10,mg·ml-1)可根据式(5)计算
式中,B为色谱介质填充体积,ml。
本研究的介质的动态吸附容量均重复5次,以评估合成色谱介质的实用性。
2 结果与讨论
2.1 共聚物接枝离子交换色谱介质的表征
本研究合成的无规共聚物接枝离子交换色谱介质的粒径见表1。可以看出,离子交换色谱介质的平均粒径介于92~103 μm之间,而且与合成过程中单体化合物无明确的关联。此外,离子交换色谱介质的平均粒径与本课题组此前测定的Sepharose Fast Flow平均粒径(92 μm±2 μm)相当[14]。这说明接枝过程对琼脂糖凝胶Sepharose Fast Flow结构没有显著的影响。
Sepharose Fast Flow、SEP-Br和共聚物接枝离子交换色谱介质SEP-S/M的红外光谱如图2所示。可以看出,SEP-Br的IR光谱[图2(b)]的1729 cm-1波数下存在BIBB分子羰基的不对称振动吸收峰,而Sepharose Fast Flow的IR光谱[图2(a)]对应波数处并无此吸收峰,这表明BIBB固定在Sepharose Fast Flow上。因单体化合物MMA和SPM均含有羰基基团,故图2(c)中共聚物接枝色谱介质SEP-S30/M60的1729 cm-1波数下羰基吸收峰显著增强,并在610 cm-1和523 cm-1波数下出现了磺酸基的伸缩振动峰。IR光谱结果表明单体化合物SPM和MMA通过ATRP方法已经成功接枝于Sepharose Fast Flow表面。
本研究制备的离子交换色谱介质的IC结果亦列于表1。IC结果显示,单体化合物总浓度一定条件下,随着单体化合物SPM的增大,共聚物分子链上SPM配基密度增大,离子交换色谱介质的IC值升高。IC的最大值(456 μmol·g-1)出现在SEP-S60介质上,为SEP-S06/M54介质IC值的7.2倍。在单体化合物SPM浓度一定的情况下,单体化合物MMA用量由0增至9 μmol时,表1中IC值仅在214~263 μmol·g-1之间变化。这说明引入MMA对离子交换色谱介质IC的影响是有限的。
表1列出了本研究合成的聚合物接枝离子交换色谱介质的pore。本研究测得Sepharose Fast Flow的pore为19.8 nm±1.4 nm。对比接枝前、后色谱介质pore的变化可知介质孔道因聚合物接枝而变小。单体化合物总浓度一定的条件下,SEP-S60具有最小的pore(12.8 nm)。这归因于SEP-S60中聚合物链上较高的SPM配基密度引发聚合物链间强烈的静电排斥作用。由此,聚合物分子链向孔道中心充分伸展,聚合物层厚度增大,介质pore减小。随着MMA的引入,共聚物链间的静电排斥作用逐渐减弱,分子链的柔性增加。这引起分子链塌陷,渐趋卷曲线团状[20],直接的表现就是色谱介质的pore增大。MMA含量高的两种介质SEP-S06/M54和SEP-S12/ M48具有最大的pore(表1),说明两种介质孔道内的共聚物链的塌陷最为显著。当SPM浓度一定时,随着MMA浓度的升高,单体化合物总浓度提高,因此接枝的共聚物具有更长的分子链。表1结果显示介质的pore由16.6 nm逐步降至9.3 nm。
2.2 离子交换配基密度对蛋白质吸附的影响
图3给出了初始蛋白质浓度为5 mg·ml-1条件下溶菌酶和抗体在不同IC值的共聚物接枝离子交换色谱介质内的吸附量。可以看出,SEP-S60介质上溶菌酶吸附量最大,抗体吸附量最小。这与本课题组此前的结果一致[14]。接枝过程中MMA的引入也对蛋白质的吸附量产生了显著影响。图3显示,SEP-S06/M54和SEP-S12/M48介质上溶菌酶和抗体的吸附量均较小,与非接枝离子交换色谱介质SP Sepharose FF的实验结果相当[14, 21]。SP Sepharose FF的IC值通常在200 μmol·ml-1左右[10],远高于本研究中SEP-S06/M54和SEP-S12/M48介质的63~81 μmol·g-1。两者相近的蛋白质吸附量与其在IC值上的差异反映出共聚物接枝离子交换色谱介质中孔道内三维的配基空间分布在蛋白质吸附上的优势。
随着IC的增大,溶菌酶和抗体的吸附量显著提高。在SEP-S24/M36中,溶菌酶和抗体的吸附量均达到220 mg·g-1以上。该吸附量也高于溶菌酶在Fractogel EMD介质上的吸附量[22],属于典型的蛋白质多层吸附。这也从蛋白质吸附角度印证了SEP-S24/M36介质中离子交换配基呈现空间分布的特征。当IC进一步增大至228 μmol·g-1及以上时,溶菌酶吸附量再次阶跃提升,在SEP-S30/M30、SEP-S36/M24和SEP-S48/M12中达到382~440 mg·g-1。与IC值增大相对应的是,此时pore并未发生改变(表1)。这意味着介质孔道内聚合物层中离子交换配基密度增加,可视为溶菌酶吸附量在SEP-S30/M30、SEP-S36/M24和SEP-S48/ M12介质中升高的直接原因。在上述介质IC值增大的同时,介质pore和抗体吸附量并未明显变化,各自维持在14.6~15.3 nm和231~262 mg·g-1。而在IC值最大的SEP-S60介质中抗体吸附量急剧降低至78 mg·g-1。与之相应的是介质pore降至12.8 nm。上述结果充分说明抗体的吸附量很大程度上与pore和聚合物层厚度的变化相关。已有研究表明[23],接枝聚合物层对蛋白质分子的空间排阻作用随聚合物层厚度和蛋白质分子量增大而增强。聚合物层厚度增大表现为SEP-S60介质pore下降,进而导致抗体(w约155×103)吸附量降低。在单体化合物总浓度一定的情况下,这种聚合物层的空间排阻作用对溶菌酶(w约14.3×103)等小蛋白质而言可基本忽略[23]。因此,高容量聚合物接枝离子交换色谱介质的设计应当IC和pore并重,同时具备高离子交换配基密度和一定孔道半径的色谱介质(如SEP-S30/M30、SEP-S36/M24和SEP-S48/M12)更加适合于蛋白质的高容量吸附。
2.3 共聚物链长对介质吸附性能的影响
进一步研究了共聚物链长对蛋白质在离子交换色谱介质内吸附平衡的影响,结果如图4所示。可以看出,溶菌酶在SEP-S30中有最小的吸附量,而抗体正好相反。表2中Langmuir吸附等温线拟合的蛋白质饱和吸附容量也验证了这一点。这一结果与SEP-S60介质中抗体吸附量(78 mg·g-1)形成鲜明的对照,体现介质孔道内较大厚度的聚合物层对抗体强烈的空间排阻作用[23]。随着MMA浓度的增大,介质pore减小及对应的聚合物层厚度增大,与之相伴的是介质的抗体吸附量降低[图4(b)]。表2的结果显示抗体饱和吸附容量最终降至77 mg·g-1。实验结果进一步验证了抗体在聚合物接枝离子交换色谱介质内的吸附容量与介质pore和聚合物层厚度密切相关。在IC值稳定条件下,单体化合物MMA浓度增大引起SEP-S30/M30、SEP-S30/M60和SEP-S30/M90 3种介质内溶菌酶的吸附容量由380 mg·g-1逐渐降低至276 mg·g-1(表2)。这一结果也展现了聚合物层对溶菌酶排阻作用随其厚度增大而逐渐显现。
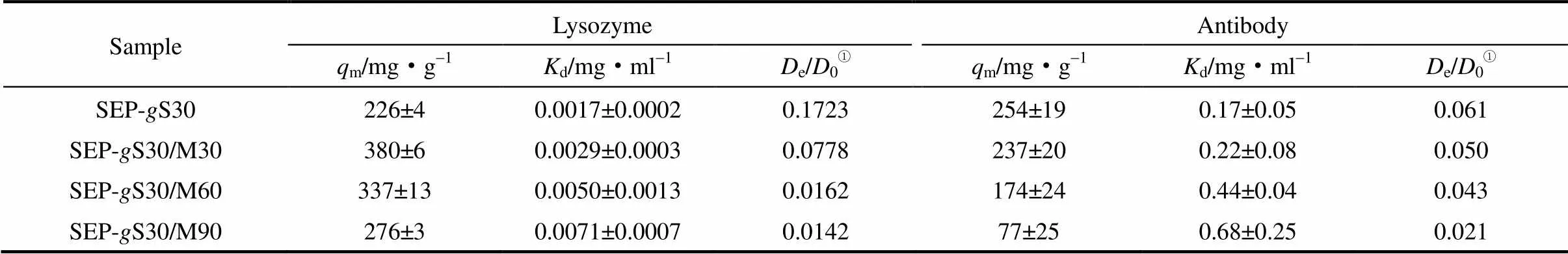
表2 溶菌酶和抗体在聚合物接枝离子交换色谱介质上的吸附等温线和动力学参数 Table 2 Langmuir parameters and effective diffusivities of lysozyme and antibody adsorption on copolymer-grafted cation-exchangers
①0is the diffusivity of proteins in free solution.
2.4 盐浓度对蛋白质吸附的影响
进一步考察了无机盐浓度对蛋白质在SEP-S30/M30上吸附的影响,结果如图5所示。随着无机盐浓度的增大,溶菌酶在SEP-S30/M30上的吸附量下降[图5(a)]。随着无机盐浓度的增加,蛋白质与离子交换配基间的亲和力降低,并且聚合物分子链塌陷。后者的影响已见诸此前的研究报道[13-14]。因此,溶菌酶吸附容量随无机盐浓度增大而降低。对于抗体吸附而言,由此带来聚合物层厚度的降低,弱化了聚合物层对抗体的空间排阻作用,有利于改善抗体的吸附,结果如图5(b)所示。进一步增大无机盐浓度,溶菌酶和抗体吸附量均降低。上述结果表明,无机盐对蛋白质在聚合物接枝离子交换色谱介质中吸附的调控作用不仅反映在对蛋白质结合作用的影响上,也表现在其对聚合物层的调控以及由此带来的对蛋白质吸附的影响上。
2.5 吸附动力学
溶菌酶和抗体在SEP-S30、SEP-S30/M3、SEP-S30/M60和SEP-S30/M902上的吸附动力学结果如图6所示。有效孔扩散系数的拟合结果列于表2。从图6可以看出,介质吸附蛋白质的动力学曲线均缓慢下降,100 min后才趋于稳定。由表2中拟合得到的参数可以看出介质孔道内聚合物层厚度增加引起介质内蛋白质有效扩散系数下降。溶菌酶在共聚物接枝离子交换色谱介质内的有效扩散系数也明显小于SP Sepharose FF和由SPM单体合成的离子交换色谱介质的有效扩散系数[14]。
2.6 蛋白质的动态吸附
基于上述结果进一步测量了溶菌酶和抗体在介质SEP-S30和SEP-S30/M30上的DBC值,实验结果如图7所示。从图7(a)可以看出,当盐浓度在0~100 mmol·L-1范围时,溶菌酶在两种介质上的DBC值都在135 mg·ml-1左右;当盐浓度增加到200 mmol·L-1时,溶菌酶在介质SEP-S30上的DBC值降到43 mg·ml-1,在介质SEP-S30/M30上的DBC值降到88 mg·ml-1,后者为SEP-S30介质DBC的2倍并表现出更强的盐的耐受性。从图7(b)可以看出,抗体在介质SEP-S30上的DBC值随盐浓度增加而下降,而抗体在介质SEP-S30/M30上的DBC值随盐浓度增加呈现先增加后降低的趋势,并且最大值达到33 mg·ml-1。从中可以看出,SEP-S30/M3色谱介质具有较高的抗体DBC值,展现了较好的应用潜力。
3 结 论
引入新单体化合物MMA,利用ATRP技术合成了不同离子交换配基密度和共聚物链长的无规共聚物接枝离子交换色谱介质,系统地研究了溶菌酶和抗体在离子交换色谱介质内的吸附行为。在单体化合物总浓度一定的情况下,单体化合物MMA浓度增大导致无规共聚物接枝离子交换色谱介质IC下降及pore增大,后者反映出介质孔道内共聚物链逐渐塌陷的特征。蛋白质的吸附表明,溶菌酶的吸附主要取决于介质的离子交换配基密度,抗体的吸附则在更大程度上与pore和共聚物层厚度相关。这主要体现在聚合物层对抗体的空间排阻作用。蛋白质在不同链长的共聚物接枝离子交换色谱介质中的吸附结果也证实了这一结论,而且进一步表明优化无规共聚物分子链可显著提高蛋白质吸附量。此外,蛋白质的吸附和介质孔道内聚合物层厚度均受无机盐浓度调控。吸附动力学的结果反映出pore导致介质内蛋白质有效扩散系数下降。上述研究结果对设计和开发高容量聚合物接枝离子交换色谱介质具有重要的指导意义。
符 号 说 明

c——蛋白质溶液浓度,mg·ml-1 c0——蛋白质溶液初始浓度,mg·ml-1 De——介质内蛋白质有效扩散系数 D0——溶液中蛋白质扩散系数 dp——色谱介质粒径,μm IC——离子交换容量,μmol·g-1 KD——葡聚糖分子分配系数 Kd——解离常数,mg·ml-1 Mw——蛋白质分子量 m——色谱介质湿重,g q——蛋白质吸附量,mg·g-1 qm——蛋白质饱和吸附容量,mg·g-1 q10——蛋白质动态结合容量,mg·ml-1 rglu——葡萄糖分子半径,nm rpore——介质孔道半径,nm rs——葡聚糖分子半径,nm VB——色谱柱介质填充体积,ml VR——葡聚糖分子在色谱柱内保留体积,ml VT——色谱柱总体积,ml V0——色谱柱空隙体积,ml V10——10%穿透条件下色谱进样体积,ml
References
[1] AFEYAN N B, GORDON N F, MAZSAROFF I,. Flow-through particles for the high-performance liquid chromatographic separation of biomolecules: perfusion chromatography [J]. Journal of Chromatography, 1990, 519(1): 1-29.
[2] SHI Q H, ZHOU X, SUN Y. A novel superporous agarose medium for high-speed protein chromatography [J]. Biotechnology and Bioengineering, 2005, 92(5): 643-651.
[3] WANG D M, HAO G, SHI Q H,. Fabrication and characterization of superporous cellulose bead for high-speed protein chromatography [J]. Journal of Chromatography A, 2007, 1146(1): 32-40.
[4] SVEC F, FRECHET J M. New designs of macroporous polymers and supports: from separation to biocatalysis [J]. Science, 1996, 273(5272): 205-211.
[5] SVEC F. Porous polymer monoliths: amazingly wide variety of techniques enabling their preparation [J]. Journal of Chromatography A, 2010, 1217(6): 902-924.
[6] PARHI P, GOLAS A, BARNTHIP N,. Volumetric interpretation of protein adsorption: capacity scaling with adsorbate molecular weight and adsorbent surface energy [J]. Biomaterials, 2009, 30(36): 6814-6824.
[7] HORVATH J, BOSCHETTI E, GUERRIER L,. High-performance protein separations with novel strong ion exchangers [J]. Journal of Chromatography A, 1994, 679(1): 11-22.
[8] HAHN R, SCHULZ P M, SCHAUPP C,. Bovine whey fractionation based on cation-exchange chromatography [J]. Journal of Chromatography A, 1998, 795(2): 277-287.
[9] LENHOFF A M. Protein adsorption and transport in polymer-functionalized ion-exchangers [J]. Journal of Chromatography A, 2011, 1218(49): 8748-8759.
[10] LJUNGLOF A, LACKI K M, MUELLER J,. Ion exchange chromatography of antibody fragments [J]. Biotechnology and Bioengineering, 2007, 96(3): 515-524.
[11] YU L L, TAO S P, DONG X Y,. Protein adsorption to poly(ethylenimine)-modified Sepharose FF (Ⅰ): A critical ionic capacity for drastically enhanced capacity and uptake kinetics [J]. Journal of Chromatography A, 2013, 1305: 76-84.
[12] HONG Y, LIU N, WEI W,. Protein adsorption to poly(ethylenimine)-modified Sepharose FF (Ⅲ): Comparison between different proteins [J]. Journal of Chromatography A, 2014, 1342: 30-36.
[13] YU L L, SUN Y. Protein adsorption to poly(ethylenimine)-modified Sepharose FF (Ⅱ): Effect of ionic strength [J]. Journal of Chromatography A, 2013, 1305: 85-93.
[14] 王宏燕. 基于ATRP的聚合物接枝琼脂糖色谱介质合成及其性能表征 [D]. 天津: 天津大学, 2015.
WANG H Y. Synthesis and characterization of agarose-based polymer-grafted chromatographic gelsatom transfer radical polymerization [D]. Tianjin: Tianjin University, 2015.
[15] SHI Q H, JIA G D, SUN Y. Dextran-grafted cation exchanger based on superporous agarose gel: adsorption isotherms, uptake kinetics and dynamic protein adsorption performance [J]. Journal of Chromatography A, 2010, 1217(31): 5084-5091.
[16] YAO Y, LENHOFF A M. Pore size distributions of ion exchangers and relation to protein binding capacity [J]. Journal of Chromatography A, 2006, 1126(1/2): 107-119.
[17] SHI Q H, SHEN F F, SUN S. Studies of lysozyme binding to histamine as a ligand for hydrophobic charge induction chromatography [J]. Biotechnology Progress, 2010, 26(1): 134-141.
[18] ZHANG S P, SUN Y. Ionic strength dependence of protein adsorption to dye-ligand adsorbents [J]. AIChE Journal, 2002, 48(1): 178-186.
[19] SHI Q H, CHENG Z, SUN Y. 4-(1-imidazol-1-yl)aniline: a new ligand of mixed-mode chromatography for antibody purification [J]. Journal of Chromatography A, 2009, 1216(33): 6081-6087.
[20] 李海普, 李星, 张莎莎, 等. 高分子在固液界面吸附构象的研究方法及手段 [J]. 化学通报, 2011, 74(5): 417-423.
LI H P, LI X, ZHANG S S,. Methods and techniques for studying the adsorption conformation of polymers at solid/liquid interface [J]. Chemistry Bulletin, 2011, 74(5): 417-423.
[21] DISMER F, PETZOLD M, HUBBUCH J. Effects of ionic strength and mobile phase pH on the binding orientation of lysozyme on different ion-exchange adsorbents [J]. Journal of Chromatography A, 2008, 1194(1): 11-21.
[22] DISMER F, HUBBUCH J. A novel approach to characterize the binding orientation of lysozyme on ion-exchange resins [J]. Journal of Chromatography A, 2007, 1149(2): 312-320.
[23] SHI Q H, JIA G D, XU L,. Effect of electric field on the partitioning behavior of solutes in entropic interaction chromatography [J]. Journal of Separation Science, 2013, 36(18): 3075-3085.
Synthesis and characterization of copolymer-grafted cation-exchangers for protein adsorption
ZHANG Suling, YANG Wei, YU Linling, BAI Shu, SUN Yan, SHI Qinghong
(Key Laboratory of System Bioengineering of Ministry of Education, Department of Biochemical Engineering, School of Chemical Engineering and Technology, Tianjin University, Tianjin 300354, China)
High-capacity chromatographic packings for protein adsorption are the material prerequisite for the development of efficient protein chromatography processes. In this work, random copolymer-grafted cation-exchangers for protein adsorption were synthesized by grafting 3-sulfopropyl methacrylate and methyl methacrylate (MMA) to Sepharose Fast Flowatom transfer radical polymerization, and lysozyme and antibody adsorption on to these cation-exchangers was investigated. In case of a given total concentration of the monomers for the grafting reaction, the pore radii of the copolymer-grafted cation-exchangers increased with an increase of MMA concentration, indicating a typical characteristic of a decreasing depth of polymer layer and gradual collapse of the random copolymers. Adsorption equilibria showed that the adsorption capacity for lysozyme was dominated by ionic capacity of the cation-exchangers whilst for antibody it was related to pore radius and corresponding the change in depth of polymer layer. With an increase in depth of polymer layer, there was stronger steric excluded interaction between antibody and polymer layer, and thus decreasing the adsorption capacity for antibody. Moreover, the results demonstrated that the adsorption capacities for proteins on random copolymer-grafted cation-exchangers were improved by optimizing the conformation of random copolymer chains. The adsorption capacities for antibody and lysozyme reached 237 and 380 mg·g-1 in the optimized random copolymer-grafted cation exchangers, respectively. The research revealed that both layer depth of copolymer and protein binding were also regulated by ionic strength in copolymer-grafted cation-exchangers.
copolymer-grafted cation-exchanger; atom transfer radical polymerization; protein; adsorption; high-capacity; antibody
supported by the National Natural Science Foundation of China (21476166, 21236005) and the Natural Science Foundation of Tianjin (15JCYBJC48500).
date: 2016-03-28.
Prof. SHI Qinghong, qhshi@tju.edu.cn
TQ 936.2
A
0438—1157(2016)09—3738—09
10.11949/j.issn.0438-1157.20160349
国家自然科学基金项目(21476166,21236005);天津市应用基础与前沿技术研究计划一般项目(15JCYBJC48500)。
2016-03-28收到初稿,2016-05-09收到修改稿。
联系人:史清洪。第一作者:张素玲(1989—),女,硕士研究生。

