晚期垃圾渗滤液厌氧氨氧化脱氮及其抑制动力学
李 芸,李 军*,蔡 辉,陈 刚,侯爱月,胡 啸,卞 伟,国瑞峰,刘一夫
晚期垃圾渗滤液厌氧氨氧化脱氮及其抑制动力学
李 芸1,李 军1*,蔡 辉2,陈 刚2,侯爱月1,胡 啸2,卞 伟1,国瑞峰2,刘一夫2
(1北京工业大学建筑工程学院,北京市水质科学与水环境恢复工程重点实验室,北京 100124;2.中国城市建设研究院有限公司,北京 100012)
采用晚期垃圾渗滤液对UASB反应器中无机环境培养条件下厌氧氨氧化菌进行驯化,探讨基质浓度和水力停留时间对系统运行性能的影响,通过批式试验分别对基质和垃圾渗滤液抑制厌氧氨氧化动力学进行测定并建立相应的动力学模型.结果表明,经过75d的运行,系统逐渐适应垃圾渗滤液并实现高效脱氮.基质的去除量随进水基质浓度的升高呈先升高后降低的变化趋势.随着HRT的延长,进水基质及渗滤液浓度逐渐升高,系统脱氮效果降低.厌氧氨氧化基质抑制的阈值是NH4+-N浓度为489.03mg/L和NO2--N浓度为192.36mg/L.当以铵盐为抑制剂时,max(NH4+-N)为0.1893mg/(mg·d),半饱和常数为39.39mg/L,抑制动力学常数为3482.27mg/L.当以亚硝酸盐为抑制剂时,max(NO2--N)为0.246mg/(mg·d),半饱和常数为43.19mg/L,抑制动力学常数为701.15mg/L.厌氧氨氧化受垃圾渗滤液影响尤为显著,垃圾渗滤液条件下厌氧氨氧化活性被完全抑制的浓度为1450.69mg/L (以COD计) .
晚期垃圾渗滤液;厌氧氨氧化;脱氮;抑制动力学
垃圾填埋场所产生的垃圾渗滤液具有有机物和氨氮浓度大、高盐度以及重金属繁多等特点[1-2],如果处置不当则会对周围的地表和地下水造成危害.垃圾渗滤液根据填埋时间的长短分为早期、中期和晚期,早期垃圾渗滤液中的碳氮比较高,且有机物大多易生化降解,在常规硝化反
硝化脱氮工艺中可为反硝化菌利用,从而节省碳源投加;而晚期垃圾渗滤液中的碳氮比较低,且大多为难降解有机物,在采用常规硝化反硝化工艺脱氮过程中需要补充大量碳源,造成处理成本增高[3].此外,常规硝化反硝化脱氮工艺会产生大量污泥,增加水厂运行负担.实现晚期垃圾渗滤液的高效低耗脱氮是目前的难题之一.
厌氧氨氧化工艺是一种新兴的高效节能脱氮工艺,其原理为厌氧氨氧化菌利用氨氮和亚硝氮为基质,并以无机碳作为碳源,以实现自养脱氮[4];该工艺是目前最为经济快捷的脱氮途径[5-6],在污废水生物脱氮领域(尤其是低有机碳高氨氮污废水)应用前景广阔.对于晚期垃圾渗滤液来说采用厌氧氨氧化工艺进行脱氮是比较适合的[7].然而,厌氧氨氧化菌生长缓慢,繁殖周期长[8-9],且其活性易于被污废水中的有机物[10-11]、盐度[12-13]和重金属[14]等毒性物质抑制.此外,高浓度的基质也会对其活性产生抑制作用[15-16],从而导致工艺难于高效稳定的运行.
因此,本文拟采用晚期垃圾渗滤液对无机环境培养条件下厌氧氨氧菌化进行驯化,稳定运行后分别提高基质进水浓度和调节系统水力停留时间,考察基质及垃圾渗滤液对系统运行性能的冲击以及探讨运行过程中的基质及垃圾渗滤液抑制,并通过批试试验分别对基质及垃圾渗滤液的抑制动力学进行测定并建立相应的动力学模型.以期为晚期垃圾渗滤液厌氧氨氧化工艺脱氮的实际应用及运行提供参考和依据.
1 材料与方法
1.1 试验种泥和装置
种泥为本实验室升流式厌氧污泥床(up- flow anaerobic sludge blanket, UASB)厌氧氨氧化反应器(有效体积为50L)中采用无机配水培养的ANAMMOX颗粒污泥,颜色为砖红色,反应器中ANAMMOX细菌种属主要为(JX852965-JX8529 69), 该反应器已稳定运行2~3年.试验接种污泥浓度(MLVSS)为5g/L左右.
图1为试验所采用的UASB反应器,其有效容积为10L,采用黑色软性材料包裹以避光,内部上1/3部分添加直径为10cm的球形填料以减少污泥的流失.进水由蠕动泵泵入反应器底部,控制温度为25℃左右,HRT为1.2h,进水pH值为7.5~8.0.
1.2 抑制动力学批试试验
取UASB反应器中厌氧氨氧化颗粒污泥(第74d),采用磷酸缓冲盐溶液(phosphate buffer saline, PBS)清洗3遍以去除基质,经滤纸过滤后用分析天平称取湿污泥12g加入至500mL血清瓶,瓶口橡胶塞开有3个孔,分别用于取样、水封及插温度探头.温度控制在(25±1)℃,pH值为7.5~7.8,采用10mL注射器取样,厌氧氨氧化活性和反硝化活性试验用高纯氮气(99.999%)曝气30min以脱氧.采用磁力搅拌器控制溶液混合均匀,磁力搅拌器转子转速控制在200r/min左右.以NH4+-N为单因子抑制的序批式试验中,控制其他条件一定, NH4+-N所设梯度分别为:60,100, 150,200,300,500,700,900mg/L左右.以NO2--N为单因子抑制的序批式试验中,同样控制其他条件一定,而NO2--N所设梯度分别为:80,100,150, 200,250,300,400,500mg/L左右.渗滤液抑制序批式试验中,以COD计,所取垃圾渗滤液浓度梯度分别为:0,120,230,460,780,980,1260mg/L左右,并以氯化铵调节各梯度NH4+-N浓度至460mg/L左右,以消除基质浓度的影响.以碳酸氢钠和盐酸调节碱度和pH值恒定,在恒温培养箱中进行试验,每间隔1h取样测定NH4+-N、NO2--N和NO3--N,反应结束后,采用干燥称重法求得MLSS,并计算氨氮和亚氮的去除速率.所有测试设3个平行并求平均值.
1.3 垃圾渗滤液与试验水质
试验所用渗滤液取自北京某垃圾填埋厂(填埋年限大于5年),为晚期渗滤液,取回后密闭贮存于塑料桶中,平均每月更新一次.具体水质如下: NH4+-N为900~1500mg/L, NO2--N为0~2mg/L,硝态氮为0~8mg/L,COD 2000~4000mg/L,pH值7.5~8.5,碱度6000~10000mg/L.试验进水以自来水稀释垃圾渗滤液至所需氨氮浓度,并配以适量的亚硝酸钠以提供厌氧氨氧化所需的电子受体.
1.4 测试分析方法
采用纳氏试剂光度法测定NH4+-N[17];采用N-(1-萘基)-乙二胺分光光度法测定NO2--N[17];采用麝香草酚分光光度法测定NO3--N[17];采用过硫酸钾氧化—紫外分光光度计法测定TN[17];采用重量法测定悬浮固体(MLSS)[17];采用WTW/Multi3420便携式测定仪测定pH值、DO、温度.
2 结果与讨论
2.1 晚期垃圾渗滤液对厌氧氨氧化菌的驯化
实验接种污泥为无机环境下培养的ANAMMOX颗粒污泥,运行的前7d进水为无机模拟废水,接种ANAMMOX菌活性较高,第7d时NH4+-N、NO2--N及TN去除率分别为94.96%、98.59%和79.73%;在第8d加入渗滤液,其COD容积负荷为0.63kg COD/(m3·d),如图2所示,渗滤液中的有机物以及一些毒性物质对反应器中的ANAMMOX菌造成一定影响,NH4+-N、NO2--N及TN去除效果分别降低至71.51%、78.77%和64.14%;后经过大约7d的培养运行,其去除效果逐渐恢复至86.46%、98.84%和85.56%,并连续7d在高效脱氮的状态下稳定运行;第25d时,提高系统进水渗滤液浓度,COD容积负荷为1.60kg COD/(m3·d),渗滤液浓度提高带入大量的有机物及毒害物质对污泥活性产生抑制,NH4+-N、NO2--N及TN去除率逐渐降低,在第33d时,其去除率仅为34.45%、47.60%和37.66%,而后活性污泥逐渐适应该浓度渗滤液下的水质,其活性逐渐恢复,到47d时,去除率恢复至70.69%、88.01%和72.62%;之前进水NO2--N/NH4+-N平均比值为1.16,低于厌氧氨氧化反应理论比值1.32;且在加入垃圾渗滤液后,因为有机物的存在,有部分NO2--N会因系统内的反硝化反应同步去除,从而导致用于厌氧氨氧化的NO2--N不足;因此,第48d时在维持进水NH4+-N及进水渗滤液浓度不变的情况下,适当提高NO2--N的浓度,以满足厌氧氨氧化所需的电子受体;进水NO2--N/NH4+-N平均为1.42,稍微高于厌氧氨氧化理论比值1.32;此阶段,NH4+-N和NO2--N出水平均浓度分别为6.09mg/L和5.97mg/L,在后10d(65~75d)NH4+-N、NO2--N和TN的平均去除率分别为96.12%、95.24%和86.66%;由此可见,ANAMMOX菌已经逐步适应垃圾渗滤液,并获得了较高的脱氮效果.
2.2 基质浓度对厌氧氨氧化的影响
NH4+-N和NO2--N是厌氧氨氧化的基质,然而如果浓度过高也会抑制其活性.为考察反应器运行效能及基质浓度对系统的影响,通过投加氯化铵和亚硝酸钠分阶段提高进水基质浓度,直至TN出水去除率低于50%,共6个阶段,每个阶段运行10d;6个阶段进水基质NH4+-N和NO2--N的平均浓度浓度分别为59.66mg/L和82.29mg/ L(阶段Ⅰ)、81.22mg/L和110.74mg/L(阶段Ⅱ)、105.49mg/L和147.11mg/L(阶段Ⅲ)、153.17mg/L和199.75mg/L(阶段Ⅳ)、180.35mg/L和243.48mg/L(阶段Ⅴ)、206.31mg/L和266.36mg/ L(阶段Ⅵ).由图3可知,前面3个阶段随着基质浓度的升高,反应器对基质NH4+-N和NO2--N的平均去除率均保持在93%以上,对TN的平均去除率也保持在86%以上;当进水NH4+-N和NO2--N平均浓度浓度升高至153.17mg/L和199.75mg/L时,反应器对NH4+-N、NO2--N和TN的平均去除率分别为77.44%、82.49%和74.83%.逐步提高基质浓度,至阶段Ⅴ时NH4+-N、NO2--N和TN的平均去除率分别为62.10%、63.50%和58.11%,至阶段Ⅵ时NH4+-N、NO2--N和TN的平均去除率分别为51.06%、54.84%和49.04%.由此可见,在整个基质浓度提高实验中(NH4+-N平均浓度由59.66mg/L提高至206.31mg/L,亚氮平均浓度由82.29mg/L提高至266.36mg/L),随着进水基质浓度的提高,各氮素的去除效率先是基本维持不变(阶段Ⅰ~Ⅲ),再呈逐步降低的变化(阶段Ⅳ~Ⅵ).此外,从表1中数据可以看出,在阶段Ⅰ~Ⅳ,随着基质浓度的逐渐提高,NH4+-N、NO2--N和TN的去除量逐渐升高;至阶段Ⅳ时,NH4+-N、NO2--N和TN的去除量分别为118.63,164.78, 229.61mg/L,说明该基质浓度为系统达到最高去除负荷所需要的进水基质浓度.在阶段Ⅳ~Ⅵ,随着基质浓度的逐渐提高,NH4+-N、NO2--N和TN的去除量有所降低;其可能是基质浓度的升高对厌氧氨氧化菌产生抑制所造成的[18-19].
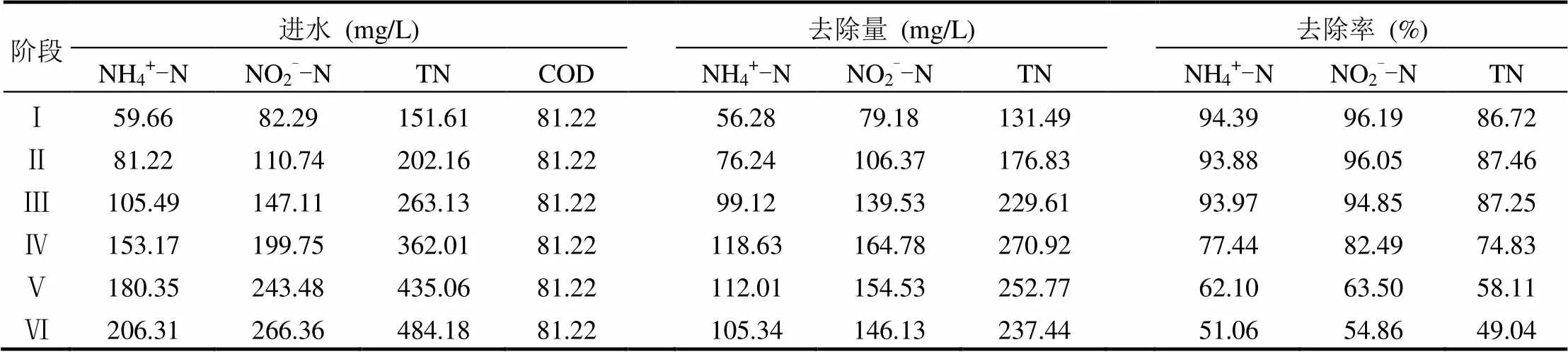
表1 基质浓度实验各阶段氮素去除特性Table 1 The nitrogen removal characteristics in different stages of the substrate concentration experiment
2.3 水力停留时间对厌氧氨氧化的影响
基质浓度实验结束后,将进水基质恢复至上述阶段Ⅰ水平(NH4+-N和NO2--N的平均进水浓度分别为56.81,83.07mg/L),此时NH4+-N和NO2--N的平均去除量分别为54.31mg/L和79.10mg/L,NO2--N/NH4+-N的平均消耗比率为1.45,NH4+-N、NO2--N和TN的平均去除率分别为95.19%、93.21%和83.49%,可见在基质溶度降低后,基质抑制作用解除,厌氧氨氧化系统脱氮性能迅速恢复.此后进行HRT实验,实验通过调节HRT和进水浓度维持进水总氮容积负荷()基本稳定(NLRTN为2.7~3.1g/(L·d)),共分3个阶段,第1、2和3阶段HRT分别为1.20,1.75,3.70h,各运行15d.各阶段进水基质平均浓度如表2所示,在第1阶段NH4+-N和NO2--N的平均去除率维持在95%以上,TN的平均去除率在85%以上.水力停留时间提高至1.75h,此时,进水NH4+-N和进水NO2--N平均浓度分别为85.02,113.48mg/L,与基质浓度实验的阶段Ⅱ基本一致,该浓度下没有基质抑制现象,然而对比两者各氮素的去除率可以明显看出,HRT实验较基质浓度实验大有降低,说明此时的抑制作用主要为垃圾渗滤液中毒性物质的抑制.当水力停留时间提高至3.70h时,进水NH4+-N和进水NO2--N平均浓度分别为174.32,247.69mg/L,与基质浓度实验的阶段Ⅴ基本一致,同样HRT实验中各氮素的去除率较基质浓度实验显著降低,此时的抑制作用为基质抑制和垃圾渗滤液中毒性物质的抑制共同作用的结果.
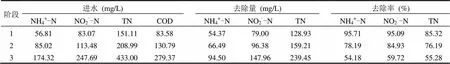
表2 HRT实验各阶段氮素去除特性Table 2 The nitrogen removal characteristics in different stages of HRT experiment
2.4 基质和渗滤液对厌氧氨氧化的抑制及其动力学
厌氧氨氧化菌以无机碳为碳源, NH4+-N和NO2--N为基质,实现自养脱氮. NH4+-N和NO2--N作为厌氧氨氧化菌的底物,在较低浓度时厌氧氨氧化菌以其为基质,然而,在高浓度时则反而会抑制厌氧氨氧化菌的活性.此外,大多数有机物和重金属等物质都是厌氧氨氧化菌的抑制剂.垃圾渗滤液有高NH4+-N、高有机物和含有大量重金属等特点,在利用厌氧氨氧化菌对其进行脱氮时,高浓度的基质、有机物和重金属等毒性物质会抑制厌氧氨氧化菌的活性.通过批试实验对反应器中厌氧氨氧化污泥进行不同因子的抑制动力学测定并建立相应的动力学模型.
2.4.1 基质抑制及其动力学 基质浓度对厌氧氨氧化活性的影响如表3所示,在实验浓度范围内,随着基质浓度的升高, NH4+-N和NO2--N的去除速率呈现先升高后降低的变化.在NH4+-N浓度为295.62mg/L时,厌氧氨氧化活性最高, NH4+-N的去除速率为0.154);而当NH4+-N浓度升高至930.51mg/L时, NH4+-N的去除速率降低至0.1455mg/(mg·d),为最高时的94.51%.在NO2--N浓度为151.10mg/L时, NO2--N的去除速率为0.1649mg/(mg·d),而当NO2--N浓度升高至497.82mg/L时, NO2--N的去除速率降低至0.1395mg/(mg·d),为最高时的84.59%.有研究认为,基质NH4+-N和NO2--N对厌氧氨氧化的抑制实质上是游离氨和游离亚硝酸的作用[20-21].铵根离子在水溶液中存在以下动态平衡:NH4++OH-NH3+H2O,同样,亚硝酸盐在水体中也存在电离平衡:HNO2NO2-+ H+,两个动态平衡随pH值的变化而变化.未质子化的游离氨(FA)和游离亚硝酸(FNA)能够通过脂质细胞膜,而铵根离子(NH4+)和亚硝酸根离子则不易透过[22];并且多数学者认为氨(NH3)是微生物正真的基质[23].
基质抑制动力学可采用Haldane模型[24-25]来进行描述,Haldane模型方程为
式中:为基质去除速率,mg/(mg·d);max为最大转化速率,mg/(mg·d);为基质浓度, mg/L;s为半饱和常数, mg/L;h为Haldane抑制动力学常数, mg/L.
厌氧氨氧化基质抑制动力学特性如图5所示,通过Origin8.0对所测铵盐和亚硝酸盐的抑制动力学数据分别进行Haldane模型拟合,所得拟合曲线的相关系数2分别为0.9901和0.9985,说明Haldane模型可以较好的描述两种基质对厌氧氨氧化的抑制动力学行为.当以铵盐为抑制剂时,最大NH4+-N去除速率(max(NH4+-N))为0.1893mg/(mg·d),对NH4+-N的半饱和常数为39.39mg/L,抑制动力学常数为3482.27mg/L.当以亚硝酸盐为抑制剂时,最大NO2--N去除速率(max(NO2--N))为0.246mg/(mg·d),对NO2--N的半饱和常数为43.19mg/L,抑制动力学常数为701.15mg/L.同时对比而言,在两种基质中厌氧氨氧化菌受NO2--N的抑制作用更为显著.
2.4.2 渗滤液抑制及其动力学 垃圾渗滤液中成分十分复杂,其有机物种类就多达近百种,且大多数有机物对厌氧氨氧化菌具有毒害作用,此外还有大量重金属和盐离子等物质,均会抑制厌氧氨氧化菌的活性.垃圾渗滤液浓度以COD计,从表4可以看出,实验考察了其浓度在0~ 1262.37mg/L之间时的厌氧氨氧化活性,随着垃圾渗滤液浓度(COD)的升高,NH4+-N去除速率呈逐步降低的趋势,当COD为1262.37mg/L时, NH4+-N去除速率降低至16.16%.
渗滤液对厌氧氨氧化的抑制实质上是渗滤液中的毒性物质的抑制, 渗滤液对厌氧氨氧化的抑制动力学模型引用乙酸降解时氯酚抑制作用的动力学模型[26],其方程如下:
式中:为基质去除速率,g/(g·d);max为最大基质去除速率,g/(g·d);为基质浓度, mg/L;s为半饱和速率常数, mg/L;0和1为抑制系数.
抑制系数0和1按以下公式计算:
式中:为垃圾渗滤液浓度, mg/L;为垃圾渗滤液完全抑制浓度, mg/L;和为常数.
通过引入速率比对上式进行经修正,得出反映垃圾渗滤液对基质去除速率的抑制方程为[27]
式中:=/0,为速率比;为垃圾渗滤液在各浓度下基质去除速率,g/(g·d);0为未投加垃圾渗滤液条件下基质去除速率,g/(g·d).该式可描述垃圾渗滤液浓度对基质去除速率的抑制作用,其中,值越大说明需要更高浓度的垃圾渗滤液才能完全抑制微生物活性,其毒性越弱.当值相近时,和值越大说明垃圾渗滤液的抑制作用越弱.用修正的抑制方程[式(5)]对实验结果进行拟合.
厌氧氨氧化垃圾渗滤液抑制动力学特性如图6所示,通过Origin8.0对实验数据分别进行模型拟合,所得拟合曲线的相关系数2为0.9714,说明修正的垃圾渗滤液抑制模型可以较好的描述垃圾渗滤液对厌氧氨氧化的抑制动力学行为.通过垃圾渗滤液抑制动力学模型可得在垃圾渗滤液条件下厌氧氨氧化活性被完全抑制的浓度为1450.69mg/L (以COD计),动力学常数和分别为2.49和0.99.
3 结论
3.1 采用晚垃圾渗滤液对厌氧氨氧化菌进行驯化,在进水NH4+-N和NO2--N浓度分别为50~ 60mg/L和70~80mg/L时,经过75d的运行,系统逐渐适应垃圾渗滤液实现高效脱氮.随着进水基质浓度的提高,基质的去除量呈先升高后降低的变化趋势,而去除效率则先是基本维持不变再呈缓慢降低的变化.随着HRT的升高,各氮素的平均去除率逐渐降低.
3.2 厌氧氨氧化基质抑制的阈值是NH4+-N浓度为489.03mg/L和NO2--N浓度为192.36mg/L.其对NH4+-N和NO2--N的半饱和常数分别为为39.39mg/L和43.19mg/L,抑制动力学常数分别为3482.27mg/L和701.15mg/L.厌氧氨氧化受垃圾渗滤液影响尤为显著,在垃圾渗滤液条件下厌氧氨氧化活性被完全抑制的浓度为1450.69mg/L (以COD计).
3.3 在应用厌氧氨氧化工艺处理高浓度晚期垃圾渗滤液过程中,应同时关注基质和渗滤液对厌氧氨氧化的抑制作用,并据此设置进水浓度.
[1] Michał B, Ewa Ł Moysa, Marlena Z, et al. Removal of organic compounds from municipal landfill leachate in a membrane bioreactor [J]. Desalination, 2006,198:16-23.
[2] Farah N A, Christopher Q L. Treatment of landfill leachate using membrane bioreactors: A review [J]. Desalination, 2012,287: 41-54.
[3] Iaconi C D, Ramadori R, Lopez A. Combined biological and chemical degradation for treating a mature municipal landfill leachate [J]. Biochemical Engineering Journal, 2006,31:118-124.
[4] Van De Graaf A A, Mulder A, Bruijn P D, et al. Anaerobic oxidation of ammonium is a biologically mediated process [J]. Applied and Environmental Microbiology, 1995,61(4):1246- 1251.
[5] Jetten M S M, Wagner M, Fuerst J, et al. Microbiology and application of the anaerobic ammonium oxidation (anammox) process [J]. Current Opinion in Biotechnology, 2001,12:283-288.
[6] 丛 岩,黄晓丽,王小龙,等.厌氧氨氧化颗粒污泥的快速形成 [J]. 化工学报, 2014,65:664-671.
[7] Shen L D, Hu A H, Jin R C, et al. Enrichment of anammox bacteria from three sludge sources for the startup of monosodium glutamate industrial wastewater treatment system [J]. Journal of Hazardous Materials, 2012,199-200:193-199.
[8] Tang C J, Zheng P, Chen T T, et al. Enhanced nitrogen removal from pharmaceutical wastewater using SBA-ANAMMOX process [J]. Water Research, 2011,45:201-210.
[9] Gilbert E M, Agrawal S, Karst S M, et al. Low temperature partial nitritation/anammox in a moving bed biofilm reactor treating low strength wastewater [J]. Environmental Science & Technology, 2014,48(15):8784-8792.
[10] Chamchoi N, Nitisoravut S, Schmidt J E. Inactivation of ANAMMOX communities under concurrent operation of anaerobic ammonium oxidation (ANAMMOX) and denitrifcation [J]. Bioresource Technology, 2008,99(9):3331-3336.
[11] Tang C J, Zheng P, Zhang L, et al. Enrichment features of anammox consortia from methanogenic granules loaded with high organic and methanol contents [J]. Chemosphere, 2010,79(6): 613-619.
[12] Dapena Mora A, Vázquez Padín J R, Campos J L, et al. Monitoring the stability of an Anammox reactor under high salinity conditions [J]. Biochemical Engineering Journal, 2010, 51(3):167-171.
[13] Kartal B, Koleva M, Arsov R, et al. Adaptation of a freshwater anammox population to high salinity wastewater [J]. Journal of Biotechnology, 2006,126(4):546-553.
[14] Jetten M S M, Strous M, Van De Pas Schoonen Kt, et al. The anaerobic oxidation of ammonium [J]. FEMS Microbiology Reviews, 1998,22(5):421-437.
[15] Isaka K, Sumino T, Tsuneda S. High nitrogen removal performance at moderately low temperature utilizing anaerobic ammonium oxidation reactions [J]. Journal of Bioscience and Bioengineering, 2007,103(5):486-490.
[16] Dapena Mora A, Fernandez I, Campos J L, et al. Evaluation of activity and inhibition effects on Anammox process by batch tests based on the nitrogen gas production [J]. Enzyme and Microbial Technology, 2007,40(4):859-865.
[17] 国家环保局.水和废水监测分析方法(第四版) [M]. 北京:中国环境科学出版社, 2002:238-366.
[18] Chen T T, Zheng P, Shen L D, et al. Kinetic characteristics and microbial community of Anammox-EGSB reactor [J]. Journal of Hazardous Materials, 2011,190:28-35.
[19] Jin R C, Xing B S, Yu J J, et al. The importance of the substrate ratio in the operation of the Anammox process in upflow biofilter [J]. Ecological Engineering, 2013,53:130-137.
[20] Waki M, Tokutomi T, Yokoyama H, et al. Nitrogen removal from animal waste treatment water by Anammox enrichment [J]. Bioresource Technology, 2007,98(14):2775-2780.
[21] Fernández I, Dosta J, Fajardo C, et al. Short- and long-term effects of ammonium and nitrite on the Anammox process [J]. Journal of Environmental Management, 2010,95:170-174.
[22] Kadam P C, Boone D R. Influence of pH on ammonia accumulation and toxicity in halophilic, methylotrophic methanogens [J]. Applied and Environmental Microbiology, 1996,62(12):4486-4492.
[23] Tang C J, Zheng P, Mahmood Q, et al. Effect of substrate concentration on stability of anammox bioflm reactors [J]. Journal of Central South University of Technology, 2010,17(1):79-84.
[24] Sheintuch M, Tartakovsky B, Narkis N, et al. Substrate inhibition and multiple states in a continuous nitrification process [J]. Water Research, 1995,29:953-963.
[25] Surmacz-Gorska J, Gernaey K, Demuynck C, et al. Nitrification monitoring in activated sludge by oxygen uptake rate (OUR) [J]. Water Research, 1996,30:1228-1236.
[26] Kim I S, Tabak H H, Young J C. Modeling of the fate and effect of chlorinated phenols in anaerobic treatment processes [J]. Water Science and Technology, 1997,36(6/7):287-294.
[27] 陈 皓,陈 玲,黄爱群,等.重金属对2-氯酚厌氧降解的抑制动力学研究 [J]. 中国环境科学, 2010,30(3):328-332.
* 责任作者, 教授, jglijun@bjut.edu.cn
Nitrogen removal and inhibition kinetics of ANAMMOX reactor fed with the mature landfill leachate
LI Yun1, LI Jun1*, CAI Hui2, CHEN Gang2, HOU Ai-yue1, HU Xiao2, BIAN Wei1, GUO Rui-feng2, LIU Yi-fu2
(1.The College of Architecture and Civil Engineering, Beijing University of Technology, Beijing 1000124, China;2.China Urban Construction Design and Research Institute Co., Ltd., Beijing 100012, China)., 2016,36(5):1409~1416
The mature landfill leachate was adopted to cultivated anaerobic ammonia oxidation bacteria in the UASB reactor which fed with inorganic wastewater, the running performance of the system was explored in different substrate concentration and hydraulic retention time, the activity inhibition of anaerobic ammonia oxidation by substrate and landfill leachate and the inhibition kinetics were analyzed. The system adapted to the landfill leachate gradually and implement efficient denitrification when the system run 75d. The removal amount of substrate was increased at first and then decreased with the increasement of the substrate concentration. As the extension of HRT, the concentrations of substrate and landfill leachate was increased, the effect of denitrification was decline in system. The thresholds of substrate inhibition were that NH4+-N concentration was 489.03mg/L and NO2--N concentration of 192.36mg/L. when NH4+-N was inhibitor,max(NH4+-N)was 0.1893mg/(mg·d), the half-saturation constant was 39.39mg/L, the inhibiting kinetic constant was 3482.27mg/L; when NO2--N was inhibitor,max(NO2--N)was 0.246mg/(mg·d), the half-saturation constant was 43.19mg/L, the inhibiting kinetic constant was 701.15mg/L. Anaerobic ammonia oxidation is very susceptible especially by the landfill leachate, the activity of anammox was inhibited completely when the landfill leachate concentration was 1450.69mg/L (which calculated in COD).
mature landfill leachate;nitrogen removal;inhibition kinetics
X703.5
A
1000-6923(2016)05-1409-08
李 芸(1985-),男,江西宜春人,北京工业大学博士研究生,主要研究方向为污水处理理论与技术.发表论文5篇.
2015-10-21
国家水体污染控制与治理科技重大专项(2014ZX07201- 011);中国城市建设研究院院级课题(Y07H13074);建筑室外水系维护与节水关键技术研究(2013BAJ02B02);北京市教委委员会资助(PXM2015-014204-500271)

