重组结核分枝杆菌MPT64的克隆与表达
蒋华科,袁仕善,谢 琳,郭靖玮,任琪琪
(1.湖南师范大学医学院医学检验系,长沙410013;2.湖南省胸科医院,长沙410013)
重组结核分枝杆菌MPT64的克隆与表达
蒋华科1,袁仕善1,谢 琳1,郭靖玮2,任琪琪1
(1.湖南师范大学医学院医学检验系,长沙410013;2.湖南省胸科医院,长沙410013)
目的:克隆和表达结核分枝杆菌抗原MPT64,并分析其免疫活性。方法:以结核分枝杆菌H37Rv基因组DNA为模板,PCR扩增mpt64基因,克隆至T载体pMD18-T,转化入E.coli DH5α,菌落PCR鉴定阳性克隆并测序分析。将测序正确的pMD18-T-mpt64的mpt64基因亚克隆至表达载体pET-28a,构建重组质粒pET-28ampt64,转化E.coli BL21中,PCR和双酶切鉴定阳性重组子,IPTG诱导MPT64表达,亲和层析纯化,western-blot分析其免疫活性。结果:成功构建pET28a-mpt64重组表达质粒,表达、纯化获得分子量约为26kDa的MPT64,并能被结核病人血清识别。结论:克隆表达获得具有免疫活性的重组结核分枝杆菌MPT64蛋白。
结核分枝杆菌;MPT64;克隆;表达
结核病是继艾滋病毒/艾滋病之后,在全世界由单一传染性病原体引起的最大杀手。据WHO统计,2014年,全球有960万人罹患结核病,150万人死于该疾病,而我国2014年新发肺结核人数为93万,高居全球第三位[1]。鉴于结核病的预防性疫苗卡介苗保护性不完善以及流行的严峻形势,如何快速诊断结核病并研制新型疫苗已成为结核病防控的关键。MPT64分泌蛋白是结核分枝杆菌主要抗原之一,约占其早期上清滤液蛋白总量的8%。mpt64基因只存在于致病性结核分枝杆菌群中,用于生产疫苗的卡介苗菌株缺乏该基因[2],动物实验显示MPT64具有很高的抗结核分枝杆菌感染的免疫保护力[3],MPT64蛋白在预防和诊断结核均具有重要的作用。本文克隆和表达MPT64蛋白,分析其免疫活性,为其用于结核病诊断及疫苗研制提供参考。
1 材料与方法
1.1 材料 结核分枝杆菌标准株H37Rv标准株由湖南省胸科医院提供,大肠杆菌DH5α、BL21和质粒pET-28a由本室保存,pMD18-T载体、DNA凝胶回收试剂盒和限制性内切酶、连接酶购自大连宝生物工程公司。20肺结核病患者血清取自湖南省胸科医院,20例健康体检者血清取自湖南省人民医院。His-Binding Resin购自美国Novogen公司,硝酸纤维素(NC)膜购自美国Bio-rad公司,HRP标记的羊抗人IgG购自美国Thermo公司,DAB显色试剂盒购自北京鼎国生物公司。
1.2 方法
1.2.1 引物设计与合成 根据GenBank中结核分枝杆菌mpt64基因序列,设计引物:上游:5‘-GGATCCGT GCGCATCAAGATCTTC-3’(划线为BamHI位点),下游:5‘-AAGCTT CTAGGCCAGC ATCGAGT-3’(划线为HindIII位点),由上海铂尚生物科技公司合成。
1.2.2 mpt64基因克隆与测序 提取结核分枝杆菌H37Rv基因组DNA并以其为模板,PCR扩增mpt64基因。扩增条件:94°C预变性 5 min;94°C 变性30s,56°C 退火30s,72°C 延伸45s,反应32个循环;72°C终延伸5 min。扩增产物经胶回收试剂盒纯化后与pMD18-T载体连接,转化E.coli DH5α,菌落PCR和质粒DNA序列分析鉴定阳性克隆。
1.2.3 重组表达载体pET28a-mpt64的构建 分别扩增与提取pET28a和pMD18-T-mpt64质粒,并经双酶切与胶回收试剂盒纯化。将酶切后的mpt64与pET-28a连接,转化入大肠杆菌BL21,含卡那霉素LB培养基筛选。菌落PCR与BamHI、HindIII双酶切鉴定阳性重组子。

图1 结核分枝杆菌mpt64 PCR 扩增图谱M.标准分子量DNA

图2 重组质粒pET28a-mpt64酶切图谱M.标准分子量DNA
1.2.4 重组蛋白的表达与纯化 挑取重组菌株于含卡那霉素的LB液体培养基中过夜培养,按1:100比例转入1L含50mg/L卡那霉素的LB培养基中,37°C培养至OD600约0.6时,加入β-D-硫代半乳糖苷(IPTG)至终浓度0.5mmol/L,继续培养3h。集菌后用裂解液(20mmol/L Tris-HCl,0.5mol/L NaCl,pH7.4)充分重悬,反复冻融三次,冰浴超声破碎菌体(200W,超声2S,间隔4S,15 min),离心后上清用于His-bindTM柱层析纯化。纯化后的重组蛋白放入半透膜中,置于4°C用PBS缓慢透析,透析后PEG-6000进行浓缩,并取样进行12% SDS-PAGE电泳。
1.2.5 纯化蛋白的免疫活性 纯化后的重组蛋白经12% SDS-PAGE电泳分离后,120mA恒流2h电转至硝酸纤维素膜上,用5%脱脂奶粉37°C封闭2h;TBST洗涤3次;加入1:100稀释的20例结核病患者混合血清,另设健康人血清对照,37°C孵育2h;TBST洗涤3次,加入HRP标记的羊抗人IgG(1:3000稀释),37° C孵育2h;TBST洗涤3次,置于室温微晾干,DAB显色10 min,蒸馏水终止反应。
2 结果
2.1 结核分枝杆菌MPT64基因的扩增与克隆 结核分枝杆菌MPT64扩增的电泳图谱见图1。由图1可知,PCR扩增获得约700bp的片段,与预期mpt64基因687bp大小相符。测序分析克隆的MPT64基因序列,与GenBank中H37Rv mpt64基因序列99%同源,仅在254bp处由A突变成G。
2.2 重组表达质粒 pET28a-mpt64的构建 重组质粒BamHI、HindIII双酶切电泳图谱见图2。由图2可知,PCR和双酶切均获得大小约700bp的条带,提示重组表达质粒 pET28a-mpt64的构建成功。
2.3 pET28a-mpt64重组菌的诱导表达 阳性重组菌未诱导与诱导后产物的SDS-PAGE电泳结果见图3:诱导后的重组菌明显多了一条带,大小约为26kDa,即为24kDa的天然的MPT64蛋白与pET-28a标签蛋白之和;SDS-PAGE检测发现,0.5mmol/L IPTG 诱导重组菌表达2~5h,诱导3h 时MPT64蛋白表达量最高;而对比0.5 mmol/L和1.0 mmol/L IPTG诱导表达超声破菌后的上清与沉淀见图3和图4,0.5 mmol/L IPTG 诱导的MPT64蛋白主要在上清以可溶性表达,而1.0 mmol/L IPTG诱导的主要在沉淀以包涵体形式表达。
2.4 重组蛋白的纯化及免疫活性分析 纯化的重组MPT64蛋白 SDS-PAGE电泳结果见图4,纯化后的重组蛋白纯度达到90%以上。由纯化蛋白MPT64的免疫印迹结果见图5,。由图5可知,纯化的重组蛋白MPT64能被结核病患者混合血清识别,提示纯化的重组蛋白MPT64具有良好的免疫学活性。
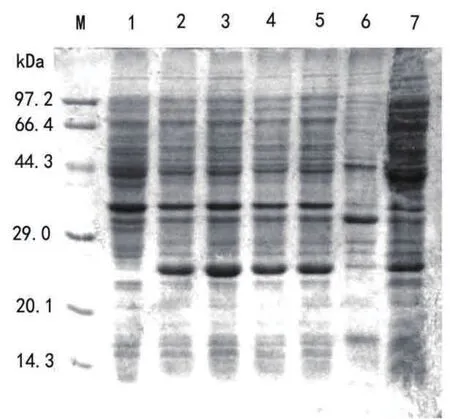
图3 诱导表达的电泳图谱

图4 诱导表达蛋白纯化后的电泳图谱

图5 重组蛋白的western-blot图谱
3 讨论
本文从结核分枝杆菌标准株H37Rv基因组DNA中扩增mpt64基因,DNA测序发现其在254bp处由A突变成G,即MPT64蛋白第84位氨基酸由苏氨酸突变成丙氨酸,而western-blot表明,表达的重组蛋白仍具有良好的抗原活性。Roche等[3]测定MPT64蛋白的B细胞抗原表位主要位于124~143aa残基区域;仇艳等[4]发现,mpt64基因 63bp缺失会造成检测的假阴性,其它单位点突变对检测效率无影响,以上研究均支持本研究mpt64基因的 254bp处点突变对其抗原活性无影响。
MPT64蛋白是结核分枝杆菌早期培养滤液主要的分泌蛋白之一,由位于DR2区的Rv1980c基因编码,开放式阅读框(ORF)为688bp。MPT64能刺激结核病患者CD4+Th1和CD8+细胞,产生高水平的IFN-γ,具有重要的细胞免疫功能[5];在小鼠和豚鼠的动物实验中,MPT64蛋白能引发T细胞反应和皮肤迟发性超敏反应(DTH),显示MPT64蛋白是种保护性抗原[6,7]。Geisbrecht等[8]通过动物实验证明了大肠杆菌表达的rMPT64和从结核分枝杆菌培养基滤液中纯化的天然MPT64蛋白具有相同的抗原作用,都能诱使动物产生迟发型超敏反应。Sartain等[9]通过蛋白质芯片筛选结核病人血清诊断标志物,发现MPT64能够特异性诊断空洞型结核病;Mijung等[10]建立MPT64双抗夹心ELISA方法检测结核病;Tadele等[11]研究发现MPT64能够提高对肺外结核的诊断;Jyoti和Martin通过双抗夹心ELISA检测MPT64蛋白来鉴定结核杆菌MTB复合群[12,13]。MPT64蛋白在预防、诊断结核病方面受到了国内外研究者的广泛关注。
本实验构建的pET28a-mpt64表达载体在E.coli BL21中表达,通过优化 IPTG诱导浓度,获得可溶性重组MPT64蛋白,避免包涵体复性等问题,简化了纯化程序。纯化的重组蛋白能被结核病人血清识别,基于其良好的抗原活性,下一步我们将建立免疫学诊断方法,探讨其对结核病人的诊断价值,从而为结核病的诊断提供新的实验依据。
[1] http://www.who.int/tb/publications/global_report/zh/
[2] Gaillard T,Fabre M, Martinaud C,et al. Assessment of the SD Bioline Ag MPT64 Rapid(TM) and the MGIT(TM) TBc identification tests for the diagnosis of tuberculosis[J].Diag Microbiol Infect Dis, 2011, 70 (1):154-156.
[3] Roche PW,Winter N,Triccas JA,et al. Expression of Mycobacterium tuberculosis MPT64 in recombinant Mycosmegmatis:purification,immun ogenicity and application to skin tests for tuberculosis [J]. Clin Exp Immunol, 1996, 103 (2): 226-232.
[4] Geisbrecht BV,Nikonenko B,Samala R, et al. Design and optimization of a recombinant system for large-scale production of the MPT64 antigen from Mycobacterium tuberculosis[J]. Protein Expr Purif,2006,46(1):64-72.
[5] Mustafa AS,Shaban F. Mapping of Th1-cell epitope regions of Myco-bacterium tuberculosis protein MPT64 (Rv1980c) using synthetic peptides and T-cell lines from M. tuberculosis-infected healthy humans[J]. Med Princ Pract, 2010,19(2):122-128.
[6] Nicolo C,Sali M,Di Sante G,et al.Mycobaterium smegmatis expressing a chimeric protein MPT-proteolipid protein(PLP) 139-151 reorganizes the PLP-specific T cell repertoire favoring a CD8-mediated response and induces a relapsing experimental autoimmune encephalomyelitis [J]. J Immunol,2010,184(1):222-235.
[7] 柏银兰,薛莹,王丽梅,等.结核分枝杆菌MPT64抗原DNA疫苗在小鼠体内诱导的免疫应答[J].中国人兽共患病学报,2009,25(5):418-421.
[8] Qiu Y, Wan L, Liu H,et al.Impact of 63-bp deletion and single-base mutation in mpt64 gene on M.tb diagnosis [J]Int J Clin Exp Pathol,2015,8(3):3210-3214.
[9] Sartain MJ,Slayden RA,Singh KK,et al. Disease state differerntiation and identification of tuberculosis biomarkers via native antigen array profiling[J]. Mol Cell Proteomics,2006, 5(11):2102-2013.
[10] Ji M, Cho B, Cho YS,et al.Development of a Quantitative Sandwich Enzyme-Linked Immunosorbent Assay for Detecting the MPT64 Antigen of Mycobacterium tuberculosis[J].Yonsei Med J,2014,55(3):746-752.
[11] Tadele A, Beyene D, Hussein J,et al. Immunocytochemical detection of Mycobac- teriumTuberculosis complex specific antigen, MPT64,improvesdiagnosis of tuberculous lymphadenitis and tuberculous pleuritis [J] . BMC Infect Dis, 2014,14:585.
[12] Arora J, Kumar G, Verma AK,et al. Utility of MPT64 Antigen Detection for Rapid Confirmation of Mycobacterium tuberculosis Complex[J]. J Glob Infect Dis, 2015,7(2):66-69.
[13] Martin A, Bombeeck D, Mulders W,et al. Evaluation of the TB Ag MPT64 Rapid test for the identification of Mycobacterium tuberculosis complex [J].Int J Tuber Lung Dis,2011,15(5):703-705.
Cloning and Expression of Mycobacterium tuberculosis MPT64
Jiang Hua-ke1,Yuan Shi-shan1,Xie Lin1,Guo Jing-wei2,Ren Qi-qi1
(1.Deptemant of Clinic Laboratory,Medical College in Hunan Normal University, Changsha 410013,China;2.The Chest Hospital of Hunan Province,Changsha 410013,China)
Objective To clone and express antigen MPT64 of Mycobacterium tuberculosis and analyze its immunological activity. Methods The gene mpt64 was amplified by PCR from bacterium tuberculosis H37Rv genomic DNA was cloned into T vector pMD18-T.The positive clone was identified by clony PCR and sequencing. The recombinant plasmid pET28a-mpt64 was constructed through subcloning gene mpt64 into prokaryotic expression vector pET28a and then transformed into compentent cell of E.coli BL21 .The protein MPT64 was induced by IPTG and purified with affinity chromatography, the immunological activity of MPT64 was analyzed by western-blot. Results The recombinant expression plasmid pET28a-mpt64 was constructed. The recombinant protein MPT64 was expressed in E.coli BL21 and purified by affinity chromatography. The purified MPT64 reacted with positive sera of TB. Conclusion Recombinant protein MPT64 recognized specifically by sera of TB patients was obtained through cloning and expression.
mycobacterium tuberculosis ; MPT64;cloning; expression
R346
A
1673-016X(2016)02-0009-04
2015-08-20
湖南省高药学校科学研究项目(10C0920)
袁仕善 ,E-mail:yuanshishan@aliyun.com

