兼具MRI显影增强及p H敏感释药性能的载药Fe3O4纳米颗粒
王曦阳, 王 灏, 郭和泽, 窦红静(上海交通大学材料科学与工程学院,金属基复合材料国家重点实验室,上海200240)
兼具MRI显影增强及p H敏感释药性能的载药Fe3O4纳米颗粒
王曦阳, 王 灏, 郭和泽, 窦红静
(上海交通大学材料科学与工程学院,金属基复合材料国家重点实验室,上海200240)
以聚丙烯酸(PAA)修饰的超顺磁性Fe3O4纳米颗粒(MNPs-PAA)为基础,利用p H敏感的腙键将抗肿瘤药物阿霉素(DOX)与磁性颗粒表面的PAA链偶联,制备了载药Fe3O4磁性纳米颗粒(MNPs-DOX)。通过透射电镜、X射线衍射、紫外、红外、热失重以及体外磁共振显影(MRI)等手段对MNPs-DOX的形貌、结构、MRI及载释药效果进行了表征。结果证实,MNPs-DOX具有超顺磁性,在MRI中具备良好的横向弛豫(T2)显影增强效果。此外,其DOX负载率达15%(质量分数),且在p H=5.0的酸性环境中药物释放量明显高于pH=7.4的中性环境,具有对环境p H的敏感性。
Fe3O4纳米颗粒;磁共振显影;阿霉素;p H敏感释药;腙键
近年来,随着人类平均寿命的提高,恶性肿瘤已成为人类健康最大的杀手之一,因而抗肿瘤药物的研究受了到广泛关注。阿霉素(DOX)作为环蒽类抗肿瘤药物,由于其优秀的抗肿瘤效果,已在临床上用于治疗各种实体瘤、白血病以及淋巴瘤等。然而,对正常组织细胞较强的毒性限制了DOX的应用,因此通过DOX的肿瘤靶向输运与释放成了相关领域的研究重点[1-2]。其中,针对肿瘤附近微环境的p H呈酸性这一特点[3],通过在酸性环境下容易断裂的腙键结构来构建p H敏感性载药体系成为一种构筑DOX控释体系的有效方法[4-7]。
磁性纳米颗粒由于其本身的磁学性能,已在临床上作为显影剂被广泛应用于磁共振显影(MRI)[8-9]。在各类化学组成的磁性纳米颗粒中,Fe3O4纳米颗粒由于生物相容性好,制备方法简便,易于表面修饰等特点,得到了广泛关注。当磁性纳米颗粒(MNPs)的粒径小于某一临界值而产生的超顺磁时现象时[9],它作为MRI显影剂能够在外加磁场的作用下产生强烈的局域磁场,影响周围水分子中氢质子的弛豫过程,缩短横向弛豫(T2)的弛豫时间,从而作为T2显影剂表现出负增强效果[10],具有较高的临床医学诊断价值[11-13]。
将这类功能性Fe3O4纳米颗粒通过腙键连接DOX构建的载药颗粒,将会兼具MRI显影增强效果及p H敏感的释药能力,从而成为一种富有特色的诊、疗一体化功能材料[14-19]。近年来相关领域的研究组报道了各种方法来实现上述构思。如Wang等[16]首先通过一系列反应,将DOX及一种短链肽(SP94)连接到右旋糖酐(Dextran)大分子上,而后通过化学偶联将其偶联至Fe3O4纳米颗粒表面,形成载药体系,通过SP94肽对肝癌细胞靶向作用实现了DOX的靶向释放。Forrest等[18]则将DOX通过腙键连接到聚醚酰亚胺(PEI)上,连接到聚乙二醇(PEG)修饰的Fe3O4纳米颗粒表面,形成载药体系,并通过实验证实了这一体系可有效抵抗ABC(ATP-binding cassette)的作用,克服肿瘤细胞的多药耐药性,实现DOX在肿瘤细胞内的稳定释放。Poujavadi等[19]首先用聚酰胺-胺树形高分子(PAMAM)修饰Fe3O4纳米颗粒并连接长链高分子(PEG),在此基础上通过腙键连接DOX形成载药体系,这一体系具有胶体稳定性高的特点。可见,构建这一载药体系的关键在于通过对纳米颗粒的表面修饰及腙键连接实现DOX的p H敏感负载。
本文采用一种简便高效的方法来制备p H敏感性载药Fe3O4纳米颗粒,为这类载药体系的构建提供了一种新的选择。其制备通过两个步骤完成:首先制备表面由聚丙烯酸(PAA)修饰并具有良好分散性的Fe3O4磁性纳米颗粒(MNPs-PAA)[20-21];然后利用p H敏感的腙键将DOX与磁性颗粒表面的PAA链偶联,从而得到表面有化学键偶联DOX的载药纳米颗粒(MNPs-DOX)。研究证实:其在MRI中显示出了良好的T2显影增强效果,并可在弱酸性的肿瘤微环境中加速抗肿瘤药物的释放,在肿瘤诊疗中具备良好的应用前景。
1 实验部分
1.1试剂
FeCl3·6H2O:分析纯,国药集团化学试剂有限公司;聚丙烯酸(PAA):Sigma-Aldrich公司,Mw= 1.8×103;盐酸阿霉素(DOX):分析纯,浙江海正集团有限公司;氢氧化钠、一缩二乙二醇(DEG)、三乙胺:分析纯,国药集团化学试剂有限公司;水合肼:ω=85%,国药集团化学试剂有限公司;二甲亚砜(DMSO):分析纯,国药集团化学试剂有限公司,经氢化钙干燥后减压蒸馏提纯。
1.2MNPs-PAA的合成
将2 mmol NaOH分散于20 m L DEG中,在N2保护下加热至100℃,以500 r/min的转速搅拌30 min,直至NaOH完全溶解形成NaOH-DEG溶液,并置于90℃保温待用。将5.4 g FeCl3·6H2O和3 g PAA溶于15 m L DEG中,以500 r/min的转速进行搅拌,在N2保护下加热至220℃,取1 m L NaOH-DEG溶液注入其中,反应液迅速变为黑色,继续在220℃下保温1 h后,取反应液用丙酮反复洗涤,通过磁铁分离纳米颗粒,冻干,制得MNPs-PAA。
1.3MNPs-DOX的合成
取100 mg MNPs-PAA分散于15 m L水中,升温至100℃,700 r/min搅拌下逐滴滴加5 m L水合肼,回流下反应3 h后冷却到室温,转入截留分子量为1.8×104的透析袋中透析3 d,冻干,制得MNPs-NHNH2。取冻干后的MNPs-NHNH2,分散于20 m L精制DMSO中,加热到100℃,氮气保护下加入5 m L含有20mg DOX的无水DMSO,并随后加入100μL三乙胺,避光搅拌48 h。反应结束后,将溶液转入截留分子量为1.8×104的透析袋中,在p H=9的碱水中透析3 d,除去未反应的DOX和DMSO,冻干,制得MNPs-DOX。

图1 MNPs-DOX的合成过程示意图Fig.1 Schematic diagram depicting the fabrication of MNPs-DOX
1.4MRI显影增强效果的测定
依照不同的铁元素浓度,分别配制MNPs-PAA及MNPs-DOX的水溶液,并用琼脂固定,样品质量浓度如表1所示。测定各组样品在MRI显影时的T2弛豫时间,并分别计算T2弛豫率r2=1/T2。
1.5载药量的测定及其在不同p H下的释放

表1 MNPs-PAA与MNPs-DOX的质量浓度Table 1 Mass concentration of MNPs-PAA andMNPs-DOX
药物负载:MNPs-DOX的药物负载量通过紫外光谱吸收测定。测定MNPs-DOX水溶液(ρ=0.2 mg/m L)的紫外吸收峰位及吸收值(y),在该峰位下,通过改变MNPs-PAA水溶液的浓度,确定基体颗粒MNPs-PAA的吸收定标曲线(斜率k1),并根据DOX水溶液峰值处的标准曲线(斜率k2)共同求解出MNPs-DOX中DOX的载药量(L)及载药效率(E),公式如下。同时,MNPs-PAA与MNPs-DOX热重(TG)测定结果的计算可作为DOX载药量的佐证。

其中:m1为MNPs-DOX上负载DOX的质量;m2为合成MNPs-DOX时加入的DOX质量。
在高职院校中所开展的教学就是要围绕将学生培养成为技术应用型人才来进行,以此来实现现代化建设与发展的目标。只有认识到高职院校教学管理的重要性,才能将科学发展看作是改革中的重点。所以在教学中就要从高职院校教育特点上出发,做好科学的创新工作。在传统的教学中,学生主动从事基础性的技术类型工作,但是从今天的就业发展趋势来讲,对高级技术人才的要求不断增强,所以在高职院校中就要从培养目标上入手,做好调整与完善工作,在满足市场发展需求的同时来实现教育的目标。在高职院校中就要从展现学生特点上入手,锻炼学生的实践操作能力,在关注学生学习特点的同时来实现教育发展的目标[2]。
体外释药:将MNPs-DOX分别分散于p H=5.0,6.0,7.4的缓冲液中,配制成2 mg/m L的溶液,各取1 m L转入截留分子量为1.8×104的透析袋中,并用同种缓冲液9 m L作为外液,置于37℃、120 r/min的摇床上,每隔一段时间更换全部外液,并测定外液中的DOX荧光强度(480 nm激发,记录590 nm处荧光强度值),根据DOX荧光标准曲线确定DOX释放量。
1.6测试表征
透射电子显微镜(TEM):采用日本JEOJ公司JEM-2100型透射电子显微镜测定;红外光谱(FT-IR):采用美国ThemoFisher公司Nicolet6700型傅里叶红外光谱仪测定;X射线衍射(XRD):采用德国Bruker公司D8 ADVANCE型X-射线衍射仪测定;磁滞回线:采用美国LakeShore公司7404型振动样品磁强计测定;MRI显影:采用德国Siemens公司3TMAGNETOM Trio型MRI扫描系统测定;热重曲线(TG):采用美国TA公司TGA2050型热重分析仪测定;紫外可见吸收光谱(UV-Vis):采用日本Shimadzu公司UV-2550型紫外可见光分光光度计测定;荧光激发光谱:采用日本Shimadzu公司RF-5301PC型荧光分光光度仪测定。
2 结果与讨论
2.1纳米颗粒的表征
2.1.1形貌表征 MNPs-PAA和MNPs-DOX的TEM照片见图2。MNPs-PAA(图2(a))Fe3O4纳米颗粒呈球形,颗粒晶核完整边界明显,而MNPs-DOX(图2(b))中Fe3O4颗粒相对不规则,颗粒表面存在一定缺陷。选取200个MNPs-PAA及MNPs-DOX粒子各进行粒径统计分析,其数均粒径分别为(10.4± 0.1)nm和(10.1±0.2)nm。由于DOX为小分子(分子量为543.52),对TEM下的颗粒粒径几乎没有影响。由此可见,在Fe3O4纳米颗粒表面负载DOX的过程中,纳米颗粒受到了一定的侵蚀[22]。但是,这种侵蚀作用极微,说明配体修饰只在MNPs表面进行,并未改变MNPs的结构。

图2 MNPs-PAA(a)和MNPs-DOX(b)的透射电子显微镜图(插图为两者的水溶液照片及粒径分布情况)Fig.2 TEM images of MNPs-PAA(a)and MNPs-DOX(b)(The two insets are the size distribution histograms of corresponding nanoparticles and the optical images of their aqueous solutions)
2.1.2结构与性能 纳米颗粒的XRD结果如图3所示,MNPs-PAA、MNPs-NHNH2及MNPs-DOX 在30.4°(220)、35.7°(311)、43.2°(400)、57.4°(511)、62.9°(440)均有明显峰,与Fe3O4标准卡片(JCPDS,88-0315)相符[21],说明其结构是Fe3O4的立方尖晶石结构,表明PAA等配体仅在颗粒表面修饰。根据Scherrer公式D=kλ/βcosθ[23](其中:D为颗粒直径,常数k=0.94,X射线波长λ=0.154 056 nm,β为半高宽),计算可得MNPs-PAA中Fe3O4晶粒尺寸为8.8 nm,MNPs-DOX晶粒尺寸为8.3 nm,与TEM图粒子统计结果相比,略有偏小,原因是通过Scherrer公式计算得到的是Fe3O4纳米颗粒的单晶的粒径,而制备得到的纳米颗粒表面会存在一定缺陷[9]。MNPs-DOX谱图中出现的多余峰来自于反应环境对纳米颗粒造成的晶格缺陷和畸变。
图4为纳米颗粒及DOX的红外谱图,其中3条谱线在580 cm-1附近的峰值为Fe3O4中的Fe-O特征伸缩、振动峰,而1 640 cm-1附近的峰值来自于表面配体PAA中的-CH2-结构,表明粒子修饰有大量的PAA。与MNPs-PAA相比,MNPs-NHNH2谱线在1 300~1 400 cm-1处出现一个较为平缓的峰,该峰归属于新引进官能团所形成的C-N键。MNPs-DOX谱图在1 730 cm-1和1 070 cm-1处出现了归属于DOX(分别来自于DOX中的δN-H键和DOX糖元柔红糖的-C-O-C-结构)的特征峰[24],而谱线中并未出现这些吸收峰,说明MNPs-DOX纳米颗粒表面修饰有一定数量的DOX。
图5为样品的热重曲线,50、250、420(MNPs-PAA)、435℃(MNPs-DOX)附近处出现失重曲线一阶导数的峰值,其中50℃附近的大量失重来自纳米颗粒表面附着水分子的气化;250℃纳米颗粒表面的PAA开始分解;在420℃附近PAA大量分解,而阿霉素则在435℃附近大量分解。在600℃时,MNPs表面有机分子基本分解完毕,根据失重量可以估算MNPs表面配体的含量,MNPs-PAA表面配体的质量分数为38.2%,MNPs-DOX表面配体质量分数为47.6%,在此基础上估算出MNPs-DOX表面阿霉素的质量分数约为15%,亦即MNPs-DOX的载药量为15%。
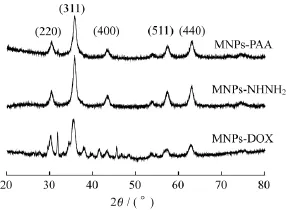
图3 样品的XRD谱图Fig.3 XRD spectra of samples
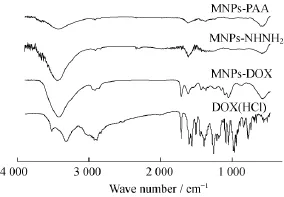
图4 样品的FT-IR谱图Fig.4 FT-IR spectra of samples
图6为MNPs-PAA、MNPs-NHNH2及MNPs-DOX的磁滞回线。3种纳米颗粒载药前后均为S型磁化曲线,具有良好的超顺磁性能。3者的磁饱和强度依次为54.4、60.5 emu/g和30.7 emu/g,对比可知,MNPs-DOX的磁性能比MNPs-PAA略有下降,其原因是在阿霉素的偶联负载过程中,反应环境致使纳米颗粒产生了一定的晶格缺陷和畸变。此外,对MNPs-PAA及MNPs-DOX的Zeta电位测量表明,DOX偶联负载前后纳米颗粒的Zeta电位分别为:(-36±1)m V及(-42±2)m V,说明纳米颗粒载药前后始终保持一定的负电性,这使得载药纳米颗粒可以与大分子聚合物通过电荷相互作用进一步制备微囊等复合结构,在医学诊疗领域具有良好的应用前景。

图5 样品的热失重和DTA曲线Fig.5 TG and DTA curves of samples

图6 样品的磁滞回曲线Fig.6 Magnetization curves of samples
2.2纳米颗粒的MRI显影效果
图7为MNPs-PAA与MNPs-DOX的MRI的T2增强效果及T2弛豫率。由图7(a)可知,随着Fe浓度的增加,MRI信号减弱,出现明显的反增长效果。T2显影剂的效果通常通过T2弛豫时间的倒数1/T2随Fe浓度变化,即弛豫率r2来衡量。如图7(b)所示,通过曲线计算得到MNPs-PAA与MNPs-DOX的弛豫率,分别为99(mmol·L-1·s)-1与38(mmol·L-1·s)-1,载药后纳米颗粒弛豫率的下降与其磁性能的降低有一定关系[21](参照商用T2显影增强用的磁性纳米粒子(Resovist®,151(mmol·L-1·s)-1,45~60 nm)[25]),说明两种纳米颗粒显示出一定的MRI显影增强效果。
2.3 DOX的负载和释放

图7 MNPs-PAA与MNPs-DOX的MRI显影T2增强效果(a)及T2弛豫率(b)Fig.7 T2-weighter MRI(a)and T2relaxation rate(1/T2)(b)as a function of Fe concentration of MNPs-PAA and MNPs-DOX
2.3.1DOX的负载 图8为MNPs-PAA,MNPs-DOX及DOX的紫外-可见光吸收曲线。如图8所示,DOX在481 nm附近有一处明显的吸收峰,而相较于MNPs-PAA,MNPs-DOX在497 nm附近出现了DOX的峰,峰位的红移是由于DOX与基体材料之间的共价键合[13],这从另一个角度说明了DOX是通过化学键合而非电荷吸引连接到纳米颗粒表面的。在此基础上,可计算出MNPs-DOX表面DOX的载药量为15%,相应地,负载过程的包封效率约为59%。相较于文献中[19,26]的DOX负载微结构,本文制备的MNPs-DOX具有较高的载药效率。根据以上结果,可以进一步计算出平均每个纳米颗粒的表面约连接有870个DOX分子。MNPs-PAA表面修饰的PAA为亲水性结构,而DOX主体为疏水性的蒽环结构,这在一定程度上影响了DOX的负载与包封能力。

图8 MNPs-PAA、MNPs-DOX以及DOX的UV-Vis谱图Fig.8 UV-Vis absorbance of MNPs-PAA,MNPs-DOX and DOX

图9 MNPs-DOX在酸性和中性p H下的DOX释放Fig.9 Drug release behaviors of MNPs-DOX in acidic and neutral environment
2.3.2DOX在不同p H下的释放 通过测定在p H=5.0,6.0,7.4缓冲液中的药物释放可知,在释放24 h时,MNPs-DOX在p H=5.0的环境中释放约30%,在p H=6.0环境中释放约17%,在p H=7.4环境中释放约12%,三者的平均释放速率分别为1.23%h-1,0.7%h-1和0.5%h-1;释放144 h时,MNPs-DOX 在p H=5.0环境中释放约42%,在p H=6.0环境中释放约23%,在p H=7.4环境中约为16%,三者在24~144 h内的平均释放速率分别为0.1%h-1,0.04%h-1以及0.03%h-1。三者在相同时间内的释放量及释放速率存在明显差距,这说明MNPs-DOX对环境p H具有显著的敏感性。在酸性环境下纳米颗粒与DOX间的腙键大量水解,释放明显增加。相较于文献中的类似的DOX载体在酸性环境下60%甚至更高的释药效果[4-5,26],本文合成的MNPs-DOX释药量最高约为45%,这可能是由于所合成的MNPs-DOX中纳米颗粒由PAA修饰,颗粒表面存在大量羧基,腙键断裂释放DOX后,MNPs-PAA仍会吸附一部分DOX,从而在实验中显示为释药量一定程度的降低。但对于MNPs-DOX体外模拟释药的研究充分证实了该纳米颗粒在弱酸性环境中对DOX的加速释放性能。而这里模拟的弱酸性环境与多数肿瘤部位的弱酸性环境相仿[27],从而预示了MNPs-DOX在肿瘤部位靶向释放DOX的潜能。
3 结 论
(1)制备了一种负载DOX的Fe3O4磁性纳米颗粒MNPs-DOX。
(2)MNPs-DOX粒径为10 nm左右,具有超顺磁性,在MRI显影中显示出了良好的T2显影增强效果。
(3)通过腙键负载DOX的结构特点使MNPs-DOX能够在酸性环境下释放DOX,具有良好的p H环境响应能力。
[1] CAO Jing,GUENTHER R,SIT T,et al.Loading and release mechanism of red clover necrotic mosaic virus derived plant viral nanoparticles for drug delivery of doxorubicin[J].Small,2014,10(24):5126-5136.
[2] 陶磊,申夏夏,朱利民.含乳糖酸修饰的多壁碳纳米管复合载药体系的合成及表征[J].功能高分子学报,2014,27(4):392-398.
[3] CHEN Bo,POLL D,JERGER K,et al.Synthesis and properties of star-comb polymers and their doxorubicin conjugates [J].Bioconjugate Chem,2011,22(4):617-624.
[4] 赵鑫,曹明,冯晓双,等.阿霉素化学键接聚合物纳米颗粒的合成及p H敏感释放[J].功能高分子学报,2015,28(3):281-287.
[5] LIU Shuhuan,GUO Yubo,HUANG Rongqi,et al.Gene and doxorubicin co-delivery system for targeting therapy of glioma[J].Biomaterials,2012,33(19):4907-4916.
[6] YU Jingshuang,DENG Hongping,XIE Furong,et al.The potential of p H-responsive PEG-hyperbranched polyacylhydrazone micelles for cancer therapy[J].Biomaterials,2014,35(9):3132-3144.
[7] PAGE S,HENCHEY E,CHEN Xiangji,et al.Efficacy of poly MPC-DOX prodrugs in 4T1 tumor-bearing mice[J]. Molecular Pharmaceutics,2014,11(5):1715-1720.
[8] CHANG Yulei,LIU Nian,CHEN Liang,et al.Synthesis and characterization of DOX-conjugated dendrimer-modified magnetic iron oxide conjugates for magnetic resonance imaging,targeting,and drug delivery[J].J Mater Chem,2012,22 (19):9594-9601.
[9] CHEN Weihong,CAO Yuhua,LIU Min,et al.Rotavirus capsid surface protein VP4-coated Fe3O4nanoparticles as a theranostic platform for cellular imaging and drug delivery[J].Biomaterials,2012,33(31):7895-7902.
[10] JUNY,SEO J,CHEON J.Nanoscaling laws of magnetic nanoparticles and their applicabilities in biomedical sciences[J]. Accounts of Chemical Research,2008,41(2):179-189.
[11] LI Jingchao,HE Yao,SUN Wenjie,et al.Hyaluronic acid-modified hydrothermally synthesized iron oxide nanoparticles for targeted tumor MR imaging[J].Biomaterials,2014,35(11):3666-3677.
[12] KHANDHARA,FERGUSON R,ARAMI H,et al.Monodisperse magnetite nanoparticle tracers for inυiυo magnetic particle imaging[J].Biomaterials,2013,34(15):3837-3845.
[13] CHENG K,CHAN P,FAN Shujuan,et al.Curcumin-conjugates magnetic nanoparticles for detecting amyloid plaques in Alzhimer's disease mice using magnetic resonance imaging(MRI)[J].Biomaterials,2015,44(1):155-172.
[14] NIGAM S,CHANDRA S,NEWGREEN D,et al.Poly(ethylene glycol)-modified PAMAM-Fe3O4-Doxorubicin triads with the potential for improved therapeutic efficacy:Generation-dependent increased drug loading and retention at neutral p H and increased release at acidic p H[J].Langmuir,2014,30(4):1004-1011.
[15] ELBIALY N,FATHY M,KHALIL W.Preparation and characterization of magnetic gold nanoparticles to be used as doxorubicin nanocarriers[J].Physica Medica,2014,30(7):843-848.
[16] WANG Ya,JIA Huizhen,HAN Kai,et al.Theranostic magnetic nanoparticles for efficient capture and in situ chemotherapy of circulating tumor cells[J].J Mater Chem B,2013,1(27):3344-3352.
[17] BARICK K,SINGH S,JADHAV N,et al.p H-responsive peptide mimic shell cross-linked magnetic nanocarriers for combination therapy[J].Adv Funct Mater,2012,22(23):4975-4984.
[18] KIEVITF,WANG F,FANG Chen,et al.Doxorubicin loaded iron oxide nanoparticles overcome multidrug resistance in cancer inυitro[J].J Control Release,2011,152(1):76-83.
[19] POURJAVADIA,HOSSEINI S,ALIZADEH M,et al.Magnetic p H-responsive nanocarrier with long spacer length and high colloidal stability for controlled delivery of doxorubicin[J].Colloids Surface B,2014,116(4):49-54.
[20] GE Jinping,HU Yongxing,BIASINI M,et al.One-step synthesis of highly water-soluble magnetite colloidal nanocrystals [J].Chem Eur J,2007,13(25):7153-7161.
[21] TAO Ke,SONG Sheng,DOU Hongjing,et al.Carbonyl groups anchoring for the water dispersibility of magnetite nanoparticles[J].Colloid Polym Sci,2011,289(4):361-369.
[22] 蒋泽权,宋晟,窦红静,等.配体交换法制备水中高分散稳定性的多羧基修饰Fe3O4纳米颗粒[J].高等学校化学学报,2012,33(12):2609-2616.
[23] LIANG Chaolun,ZHAI Teng,WANG Wang,et al.Fe3O4/reduced graphene oxide with enhanced electrochemical performance towards lithium storage[J].J Mater Chem A,2014,2(20):7214-7220.
[24] DAS G,NICASTRI A,GENTILE F,et al.FT-IR,Raman,RRS measurements and DFT calculation for doxorubicin[J]. Microse Res Tech,2010,73(10):991-995.
[25] SKOPALIK J,POLAKOVA K,HAVRDOVA M,et al.Mesenchymal stromal cell labeling by new uncoated superaramagnetic maghemite nanoparticles in comparison with commercial Resovist—an initial inυitro study[J].Int J Nanomedicine,2014,9(1):5355-5372.
[26] WANG Feng,PAULETTI G,WANG Juntao,et al.Dual surface-functionalized janus nanocomposites of polystyrene/ Fe3O4@SiO2for simultaneous tumor cell targeting and stimulus-induces drug release[J].Adv Mater,2013,25(25):3485-3489.
[27] YANG Chunyu,GUO Wei,CUI Liru,et al.p H-responsive magnetic core-shell nanocomposites for drug delivery[J]. Langmuir,2014,30(32):9819-9827.
Fe3O4Drug Loading Nanoparticles with MRI Enhancement and p H-Sensitive Drug Release Dual Capability
WANG Xi-yang, WANG Hao, GUO He-ze, DOU Hong-jing
(State Key Laboratory of Metal Matrix Composites,School of Materials Science and Engineering,Shanghai Jiaotong University,Shanghai 200240,China)
Monodispersed magnetic Fe3O4nanoparticles(MNPs)capped with polyacrylic acid(MNPs-PAA)were synthesized.On this basis,anticancer drug doxorubicin was loaded onto the PAA chain of magnetic nanoparticles(MNPs-DOX)surface by a p H-sensitive hydrazone bond.The morphology,structure,Magnetic Resonance Imaging(MRI)enhancement and drug release properties of MNPs-DOX were characterized by Transmission Electron Microscope(TEM),X-Ray Diffractometer(XRD),Fourier Transform Infrared spectrometer(FT-IR),Thermal Gravimetric(TG)analyzer,UV-Visible spectrophotometer(UV-Vis)and inυitro MRI.MNPs-DOX exhibited great MRI T2-weighted enhancement capability.The drug-loading capacity of MNPs-DOX was 15%(mass fraction).Inυitro experiment demonstrated that the release of DOX was p H-sensitive,and was accelerated at acid environment(p H=5.0)compared with neutral environment(p H=7.4).
Fe3O4magnetic nanoparticles;magnetic resonance imaging;doxorubicin;p H-sensitive release;hydrazone bond
O614.8
A
1008-9357(2016)02-0193-007DOI: 10.14133/j.cnki.1008-9357.2016.02.008
2016-03-15
国家自然科学基金(21174082,21374061);教育部新世纪优秀人才支持计划(NCET-13-0360);上海市科委国际合作基金资助(14520710300)
王曦阳(1990-),男,辽宁阜新人,硕士生,主要从事生物医用材料研究。E-mail:wangxiyang@sjtu.edu.cn
窦红静,E-mail:hjdou@sjtu.edu.cn

