撕裂蜡孔菌的发酵优化及其开放式发酵
邵国兵,杨萍,姜文侠
(1.天津市工业生物系统与过程工程重点实验室,中国科学院天津工业生物技术研究所,天津300308;2.天津科技大学生物工程学院,天津300457)
撕裂蜡孔菌的发酵优化及其开放式发酵
邵国兵1,2,杨萍1,*,姜文侠1,*
(1.天津市工业生物系统与过程工程重点实验室,中国科学院天津工业生物技术研究所,天津300308;2.天津科技大学生物工程学院,天津300457)
以生物量为指标对撕裂蜡孔菌TIB.BPE.11002的液体发酵进行了优化。优化后的液体培养基配方为:玉米淀粉60 g/L、玉米浆干粉8 g/L、KH2PO45 g/L、α-淀粉酶733 U/L,pH自然。优化后的摇瓶培养条件为:培养温度25℃,接种量5%,500 mL三角瓶装液量150 mL,转速150 r/min。优化后的生物量达7 g/L以上。进一步探索发现,该菌株具有在非无菌环境中大量生长的能力,可以进行开放式发酵。
撕裂蜡孔菌;发酵优化;开放式发酵
撕裂蜡孔菌(Ceriporia lacerata)是一种白腐真菌,日本[1]、韩国[2]和我国华北、华中、华东及四川的天然林和人工林内均有分布[3-4]。撕裂蜡孔菌在工业废水处理[5-7]、医药和保健食品[8-15]等领域都有一定的应用前景,目前国内外对该菌的研究还较少。韩国Kim Byoung-Cheon等[9-11]研究发现撕裂蜡孔菌发酵液的粗提物具有降血糖作用,能明显抑制a-淀粉酶和a-葡萄糖苷酶的活性,含有保护胰岛素分泌细胞不受损伤的药理成分,可有效预防和缓解糖尿病,有可能成为糖尿病的治疗药物和保健功能食品。高冬[12]公开了一株撕裂蜡孔菌,该菌具有营养丰富、食药兼用的特点,用于治疗贫血、心脏病、肺癌和白血病等。此外,还有通过撕裂蜡孔菌的发酵制备2′,4′-二羟基-6′-甲氧基-3′,5′-二甲基查耳酮[8]、石杉碱甲[13]及其衍生物[14]、甘露糖赤藓糖醇脂[15]等功效成分的中国专利公开。
对撕裂蜡孔菌TIB.BPE.11002的液体培养基和培养条件进行了优化,进而探索了该菌的开放式发酵,为撕裂蜡孔菌的进一步研究开发提供参考。
1材料与方法
1.1菌种
撕裂蜡孔菌(Ceriporia lacerate)TIB.BPE.11002:保藏于中国科学院天津工业生物技术研究所。
1.2主要试剂和仪器
玉米淀粉:天津中英保健食品有限公司;玉米浆干粉:山东盛泰生物科技有限公司;KH2PO4(分析纯):国药集团化学试剂有限公司;中温α-淀粉酶(3 700 U/g):北京索莱宝科技有限公司。恒温振荡器(IS-RDS3型):美国精骐有限公司;电子天平(PL4002型)、台式pH计(S20K型):梅特勒-托利多仪器(上海)有限公司;BIOSTATRD-DCU D20-3型液体发酵罐、BIOSTATRC plus C20-3型液体发酵罐、BIOSTATRD-DCUD200-3型液体发酵罐:SartoriusGroup;ZFD-5090型鼓风干燥箱:上海智城分析仪器制造有限公司。
1.3培养基
种子培养基:可溶性淀粉20g/L,玉米浆干粉6 g/L,KH2PO41 g/L,pH自然,121℃灭菌20 min。
摇瓶基础培养基:可溶性淀粉20 g/L,玉米浆干粉6 g/L,KH2PO41 g/L,pH自然,121℃灭菌20 min。
1.4方法
1.4.1液体菌种的制备
挑取菌苔约3 cm2接入种子培养基,装液量为150 mL/500 mL挡板三角瓶,25℃摇床150 r/min培养3.5 d~4 d。
1.4.2摇瓶液体发酵
将7.5 mL液体菌种接入摇瓶基础培养基,装液量为150 mL/500 mL三角瓶,25℃摇床150 r/min培养5 d。通过改变摇瓶基础培养基中碳源、氮源和无机盐等的添加量,以及摇瓶的培养温度、接种量、装液量、初始pH和摇床转速等条件,以生物量为指标进行发酵优化试验。
1.4.3开放式发酵
1.4.3.1开放式摇瓶发酵
将液体菌种按体积比5%分别接入经高温灭菌和未经任何灭菌处理的培养基,前者的接种无菌操作;后者则在非无菌环境下进行接种。装液量为150 mL/ 500 mL三角瓶,25℃摇床150 r/min培养5 d。观察两种培养方式的培养基中菌丝体的生长情况,测量其生物量。
1.4.3.220L发酵罐开放式发酵
以工作体积20 L的D20-3型液体发酵罐为培养容器,培养基不经任何灭菌处理,按体积比5%直接接入液体菌种,发酵培养过程中发酵罐的接种口不密闭。发酵罐接种后的装液量为18.9 L,培养温度25℃,初始通风量16 L/min,初始搅拌转速50 r/min,溶氧控制在30%左右。开放式发酵培养6 d,观察发酵液中菌丝体的生长情况,每12 h取样1次,测量其生物量。
1.4.3.3200L发酵罐开放式发酵
以工作体积200 L的液体发酵罐为培养容器,培养基不经任何灭菌处理,按体积比5%直接接入液体菌种,该液体菌种以工作体积20 L的C20-3型液体发酵罐通过无菌培养的方式制备。发酵培养过程中,发酵罐的顶盖完全敞开,通入的压缩空气不经过除菌过滤。发酵罐接种后的装液量为168 L,培养温度25℃,初始通风量80 L/min,初始搅拌转速100 r/min,溶氧控制在30%左右。开放式发酵培养6 d,观察发酵液中菌丝体的生长情况,每12 h取样一次,测量其生物量。
1.4.4生物量的测量方法
发酵液经过400目滤布过滤,水洗2次~3次,置105℃鼓风干燥箱中烘至恒重,称量菌丝体的干重。
2结果与讨论
2.1液体培养基的优化
2.1.1碳源对生物量的影响
分别以不同的碳源替代摇瓶基础培养基中的可溶性淀粉,摇瓶培养菌株TIB.BPE.11002的试验结果见图1。
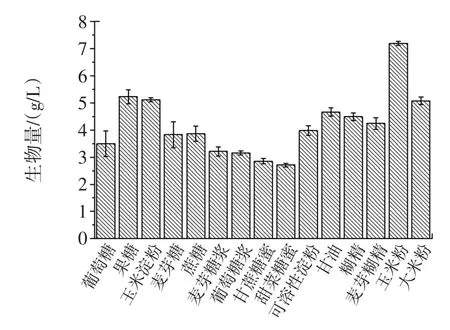
图1 碳源对生物量的影响Fig.1Effect of carbon sources on the biomass
以玉米粉为碳源时,生物量的测定值最高,但因玉米粉中的不溶物对测定结果的影响,其实际的生物量应低于测定值。生物量次高的是果糖,但果糖的价格较高。以玉米淀粉为碳源的仅略低于以果糖为碳源的,因此选择玉米淀粉为碳源。
2.1.2氮源对生物量的影响
分别以不同的氮源替代摇瓶基础培养基中的玉米浆干粉,摇瓶发酵菌株TIB.BPE.11002的试验结果见图2。
综合考虑氮源的价格及某些不溶性氮源对生物量测定值的影响,依然以玉米浆干粉作为氮源。
2.1.3碳氮比对生物量的影响
为确定玉米浆干粉的最佳添加量,将摇瓶基础培养基中的玉米淀粉添加量固定为20 g/L,通过改变玉米浆干粉的添加量来分析氮源添加量对生物量的影响结果见图3。

图2 氮源对生物量的影响Fig.2Effect of nitrogen sources on the biomass
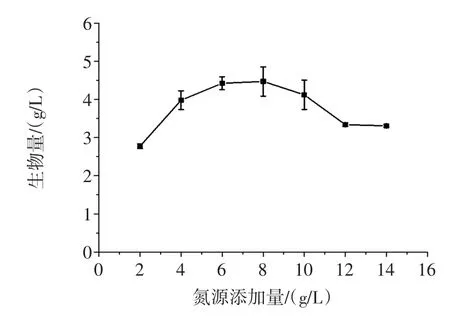
图3 氮源添加量对生物量的影响Fig.3Effect of the additive amount of nitrogen source on the biomass
试验结果(图3)表明,玉米浆干粉添加量在8 g/L时生物量最高,因此将玉米浆干粉的添加量定为8g/L。
为确定玉米淀粉的最佳添加量,将摇瓶基础培养基中的玉米浆干粉添加量固定为8 g/L,通过改变玉米淀粉的添加量来确定其最佳添加量结果见图4。
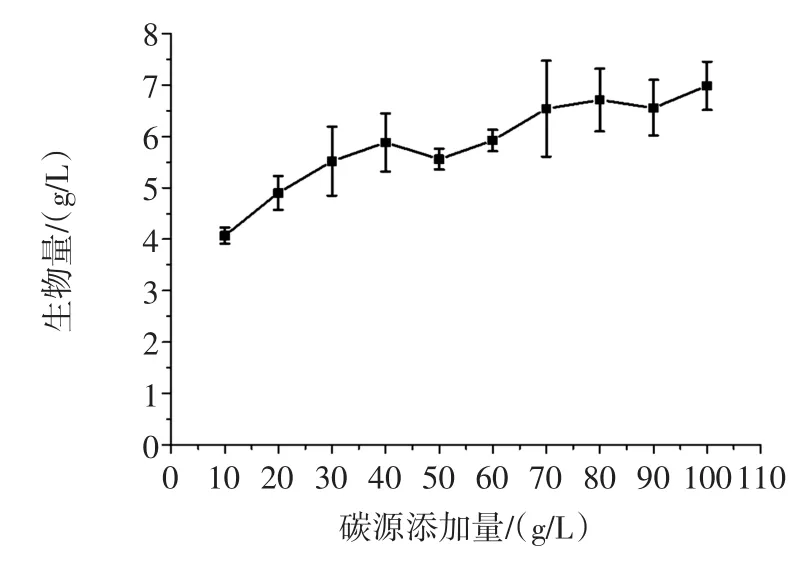
图4 碳源添加量对生物量的影响Fig.4Effect of the additive amount of carbon source on the biomass
试验结果(图4)表明,玉米淀粉添加量为80 g/L时,菌株TIB.BPE.11002的生物量达到最高。综合分析误差范围及成本因素的影响,选择玉米淀粉的添加量为60 g/L。
2.2摇瓶发酵条件的优化
用上述优化后的培养基,优化菌株TIB.BPE.11002的摇瓶发酵条件。
2.2.1温度对发酵的影响
在不同的温度摇瓶发酵菌株TIB.BPE.11002,试验结果见图5。
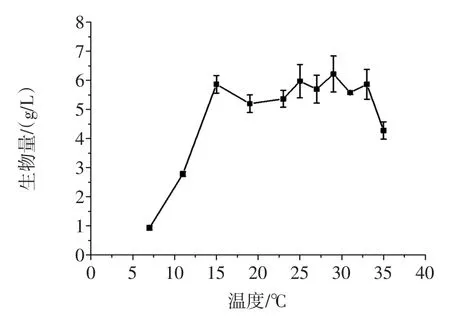
图5 温度对生物量的影响Fig.5Effect of temperature on the biomass
在15℃~33℃时,生物量较高,而低于15℃和高于33℃时生物量都明显地降低,表明该菌发酵的适宜温度范围较宽。综合考虑,选择25℃作为该菌株液体发酵的温度。
2.2.2接种量对发酵的影响
分别以2%、5%、8%、10%和12%的接种量培养菌株TIB.BPE.11002,试验结果见图6。
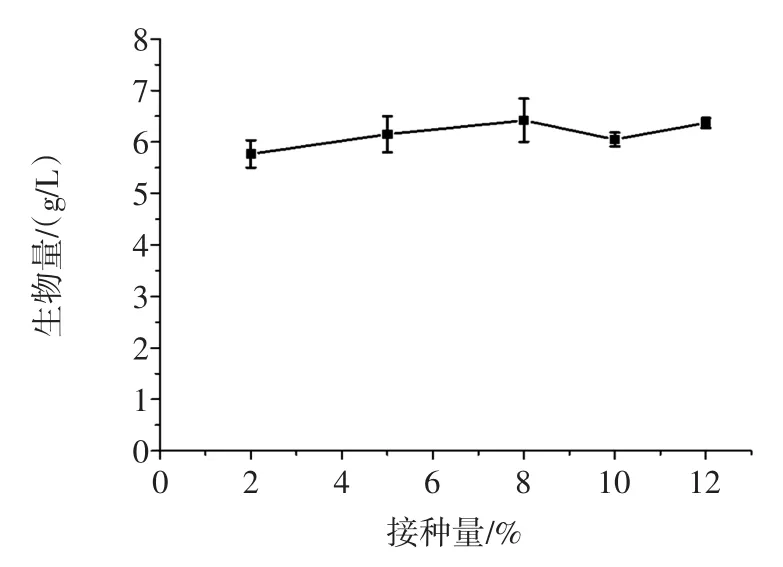
图6 接种量对生物量的影响Fig.6Effect of inoculation amount on the biomass
接种量对菌株TIB.BPE.11002生物量的影响较小,2%~12%接种量发酵的生物量相差不大。综合考虑,选用5%作为该菌株液体发酵的接种量。
2.2.3装液量对发酵的影响
分别采用不同的装液量来培养菌株TIB.BPE. 11002,试验结果见图7。
装液量越低,单位体积中的生物量越高。从经济角度考虑,装液量不宜过低,因此装液量选择150mL/500mL三角瓶。
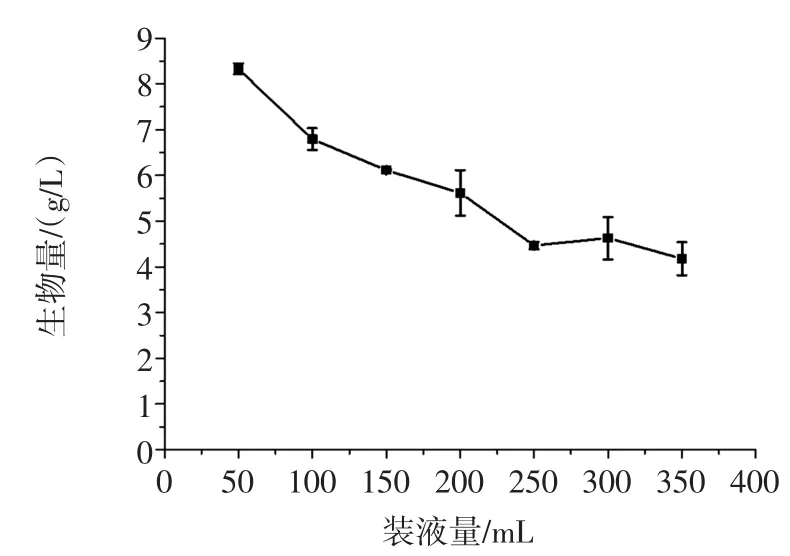
图7 装液量对生物量的影响Fig.7Effect of liquid medium volume on the biomass
2.2.4培养基初始pH对发酵的影响
采用盐酸或氢氧化钠将培养基的初始pH值调为2、3、4、5、6、7、8,考察培养基的不同初始pH值对TIB. BPE.11002生长的影响,试验结果见图8。
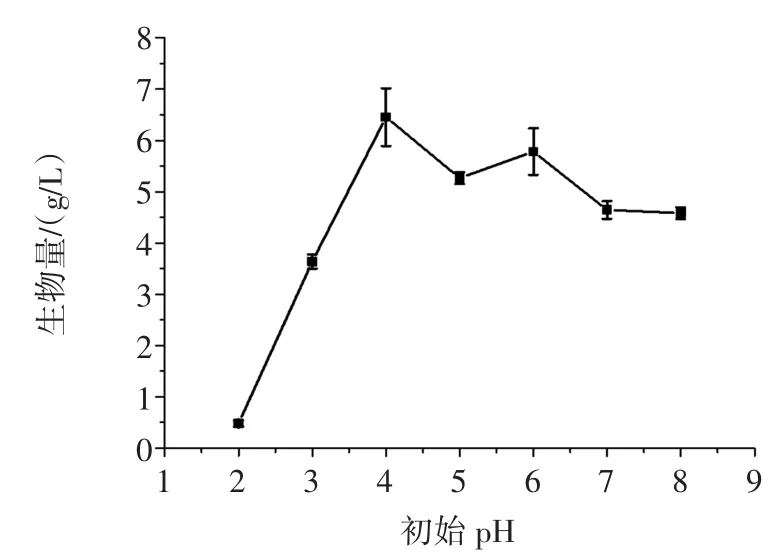
图8 培养基初始pH对生物量的影响Fig.8Effect of initial pH on the biomass
培养基的初始pH为4时,TIB.BPE.11002的生物量最高。由于该培养基的自然pH为4.1,因此选择不调整培养基的初始pH。
2.2.5摇床转速对发酵的影响
分别以50、100、150、200 r/min和250 r/min的摇床转速培养菌株TIB.BPE.11002,试验结果见图9。
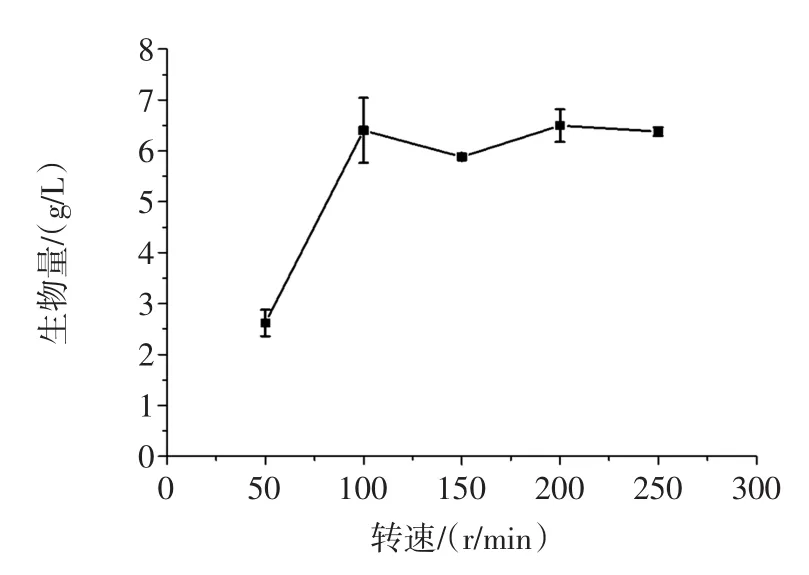
图9 摇床转速对生物量的影响Fig.9Effect of shaking speed on the biomass
转速在100 r/min以上时,生物量均能保持较高水平,但由于100 r/min时的数据误差较大,而200 r/min以上时摇瓶中的菌丝聚集,易出现大团的菌丝体,菌团的形态发生了明显变化,因此,摇床培养的转速确定为150 r/min。
2.3无机盐及维生素对发酵的影响
在上述优化的基础上,继续优化液体发酵培养基中的无机盐和维生素。
以KH2PO4、MgSO4·7H2O、CaCl2和VB1共4种物质为因素,做正交试验,确定其对菌株TIB.BPE.11002液体发酵的影响及其添加量,各因素水平见表1。
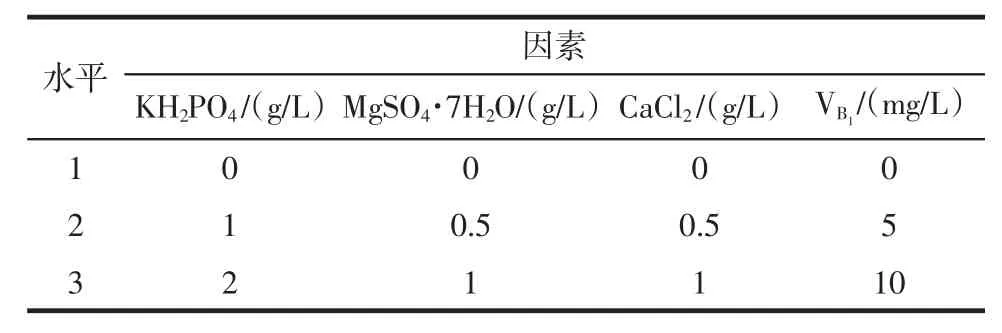
表1 正交试验因素水平表Table 1The table of factor and level in L9(34)orthogonal experiment
采用SPSS 19.0软件对试验结果进行方差分析(由于MgSO4·7H2O所在列显著性水平ɑ>0.25,故作为空白列),直观分析结果表明KH2PO4、MgSO4·7H2O、CaCl2和VB1最佳添加量分别为2 g/L、0、0、0。方差分析结果见表2。

表2 方差分析结果Table 2Variance analysis of orthogonal experiment
MgSO4·7H2O、CaCl2和VB1均不是显著因素(P>0.05),KH2PO4是显著因素(P<0.05)。
对正交试验结果进行试验验证的结果见图10。
KH2PO4对生物量有一定的影响,其添加量为5 g/L时的生物量最高,达到7.6 g/L。因此,选用5 g/L作为KH2PO4的添加量。
2.4开放式发酵
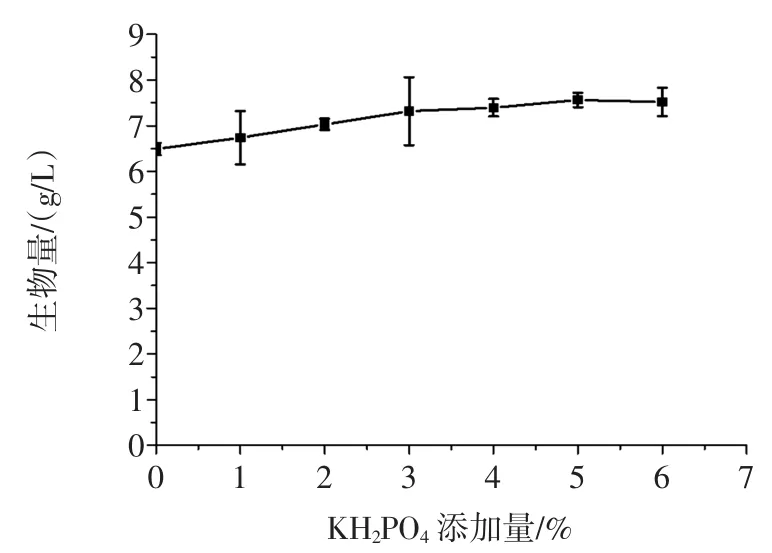
图10 KH2PO4添加量对生物量的影响Fig.10Effect of the additive amount of KH2PO4on the biomass
分别采用经高温灭菌处理的发酵培养基和未经高温灭菌处理的发酵培养基,摇瓶培养TIB.BPE.11002菌株,发酵5 d的摇瓶见图11。
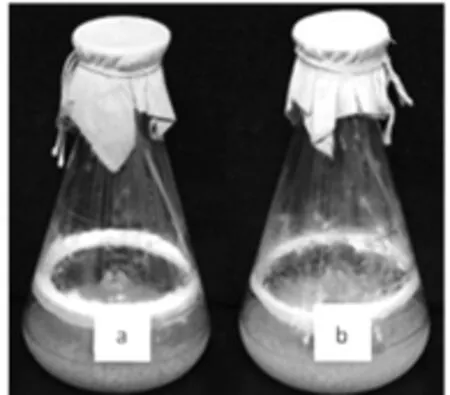
图11 培养基经灭菌处理的发酵(a)和培养基未经任何灭菌处理的发酵(b)Fig.11Cultured in sterilized medium(a)and cultured in unsterilized medium(b)
采用未经任何灭菌处理的培养基,摇瓶发酵的撕裂蜡孔菌不仅能够生长,外观无杂菌生长的迹象,而且菌丝团的形态、生物量及发酵液气味与培养基经过高温灭菌的摇瓶发酵均没有可以判别的区别。
以20 L发酵罐和200 L发酵罐开放式发酵培养菌株TIB.BPE.11002,生物量及发酵液pH的变化见图12。
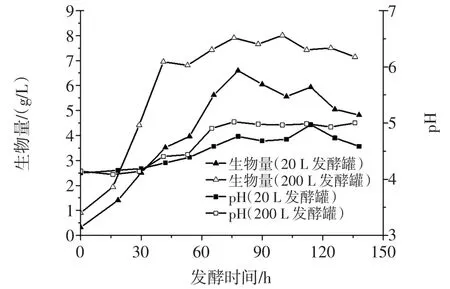
图12 开放式发酵中生物量和pH的变化曲线Fig.12The changes of the biomass and pH with open fermentation
经20 L发酵罐和200 L发酵罐的开放式发酵验证,该菌株都能够正常生长,外观无杂菌生长的迹象,发酵液的气味和无菌培养的相同,pH变化在4~5之间,生物量均在75 h前后达到最高,分别为6.6、8.0 g/L,与摇瓶无菌培养的生物量接近。
通过摇瓶和发酵罐的开放式发酵试验表明,菌株TIB.BPE.11002可以进行完全开放式的发酵培养,该菌株可能产生某些抗菌或抑菌物质,拮抗杂菌的生长。
3结论
通过优化液体发酵培养基和摇瓶培养条件,撕裂蜡孔菌TIB.BPE.11002摇瓶发酵的生物量达到7 g/L以上。优化后的培养基为:玉米淀粉60 g/L,玉米浆干粉8 g/L,KH2PO45 g/L,α-淀粉酶733 U/L,pH自然。优化后的摇瓶培养条件为:温度25℃,接种量5%,装液量150 mL/500 mL三角瓶,转速150 r/min。
发现并试验验证了撕裂蜡孔菌TIB.BPE.11002可以进行常温开放式发酵,不仅培养基无需灭菌,也无需无菌操作,而且通入的压缩空气也无需除菌过滤。如果该发酵方式用于工业生产,将大幅度降低投资、生产和管理成本。对于该菌株拮抗杂菌的机理,是否产生抑菌或抗菌物质,有待进一步的研究。
[1]Suhara H,Maekawa N,Kaneko S,et al.A new species,Ceriporia lacerata,isolated from white-rotted wood[J].Mycotaxon,2003,86(41):335-347
[2]Jang Y,Choi H E,Lim Y W,et al.The first report of Ceriporia lacerata(Phanerochaetaceae,Basidiomycota)in Korea[J].Mycotaxon,2012,119(7):397-403
[3]崔宝凯,魏玉莲,戴玉成.江苏紫金山的多孔菌[J].菌物学报,2006,25(1):9-14
[4]戴玉成.中国木本植物病原木材腐朽菌研究[J].菌物学报,2012,31(4):493-509
[5]Lin Y H,He X B,Han G M,et al.Removal of Crystal Violet from aqueous solution using powdered mycelia biomass of Ceriporia lacerata P2[J].Joumal of Environmental Sciences,2011,23(12):2055-2062
[6]Choi Y S,Seo J Y,Lee H,et al.Decolorization and detoxification of wastewater containing industrial dyes by Bjerkandera adusta KUC9065[J].Water,Air,&Soil Pollution,2014,225(1):1-10
[7]田启建,林永慧,何兴兵,等.耐高盐撕裂蜡孔菌P2对模拟橙黄G染料废水的脱色及废水脱色前后的毒性测试[J].应用与环境生物学报,2011,17(6):876-882
[8]Wang J,Yao L Y,Lu Y H.Ceriporia lacerata DMC1106,a new endophytic fungus:isolation,identification,and optimal medium for 2',4'-dihydroxy-6'-methoxy-3',5'-dimethylchalcone production[J]. Biotechnology and Bioprocess Engineering,2013,18:669-678
[9]Kim J E,Kim H J,Lee S P.Hyperglycemic effect of submerged cultureextract of Ceriporia lacerata in streptozotocin-induced diabetic rats[J].Food Science and Biotechnology,2012,21(6):1685-1693
[10]Kim J H,Park Y K,Kim J E,et al.Crude extract of Ceriporia lacerata has a protective effect on dexamethasone-induced cytotoxicity in INS-1 cells via the modulation of PI3K/PKB activity[J].International Journal of Molecular Medicine,2013,32:179-186
[11]Kim B C.Pharmaceutical composition for prevention or treatment of steroid-induced diabetes and health functional food:US,2014 0193455[P].2014-07-10
[12]高冬.撕裂蜡孔菌及其用途:中国,ZL 201110433356.0[P].2013-06-26
[13]吴水生,张方方,郑雅媗,等.闽浙马尾杉内生真菌及其产石杉碱甲的方法和应用:中国,CN 201410045031.9[P].2014-05-28
[14]单伟光,应优敏,占扎君.一种蛇足石杉内生真菌及其在制备8α,15α-环氧化石杉碱甲的应用:中国,ZL 201310445192.2[P].2014-03-26
[15]陈启和,范琳琳,董亚晨.撕裂蜡孔菌菌株及其应用:中国,CN 201410520107.9[P].2015-01-14
Optimization of Submerged Fermentation for Mycelium of Ceriporia lacerata and Its Open Fermentation
SHAO Guo-bing1,2,YANG Ping1,*,JIANG Wen-xia1,*
(1.Tianjin Key Laboratory for Industrial Biological Systems and Bioprocessing Engineering,Tianjin Institute of Industrial Biotechnology,Chinese Academy of Sciences,Tianjin 300308,China;2.College of Biotechnology,Tianjin University of Science&Technology,Tianjin 300457,China)
Submerged fermentation of Ceriporia lacerata TIB.BPE.11002 was optimized,the optimal biomass was above 7 g/L.The optimal parameters in submerged fermentation of TIB.BPE.11002 were found as:corn starch 6 g/L,corn steep powder 8 g/L,KH2PO45 g/L,α-amylase 733 U/L,natural pH,culture temperature 25℃,inoculum ratio 5%,loading volume 150 mL/500 mL,shaking speed 150 r/min.In addition,it was discovered and verified that the mycelia of TIB.BPE.11002 could be cultured with open fermentation.
Ceriporia lacerata;optimization of fermentation;open fermentation
10.3969/j.issn.1005-6521.2016.19.043
2015-06-11
天津市科技支撑重点项目(12ZCZDSY12900、14ZCZDSY00063)
邵国兵(1990—),男(汉),硕士研究生,研究方向:发酵工程。
杨萍(1978—),女(汉),高级工程师,研究方向:食品与发酵工程。姜文侠(1964—),男(汉),研究员,研究方向:发酵工程。

