蛇足石杉中的新内生真菌及其代谢产物的分离与鉴定
于飞雪, 杨银河, 赵沛基, 陈 瑶
( 1. 昆明理工大学附属医院, 云南省第一人民医院, 昆明 650500; 2. 中国科学院昆明植物研究所植物化学与西部植物资源持续利用国家重点实验室, 昆明 650201 )
蛇足石杉中的新内生真菌及其代谢产物的分离与鉴定
于飞雪1,2, 杨银河2, 赵沛基2, 陈瑶1*
( 1. 昆明理工大学附属医院, 云南省第一人民医院, 昆明 650500; 2. 中国科学院昆明植物研究所植物化学与西部植物资源持续利用国家重点实验室, 昆明 650201 )
从蛇足石杉内生菌的次级代谢产物中寻找活性成分,为进一步开发利用蛇足石杉药用植物资源提供了新途径,但至今其内生菌代谢产物的系统性研究较为少见。种类丰富的内生真菌普遍存在于各种植物中,但蕨类植物中内生真菌的研究较少。为了寻找蛇足石杉内生菌中的细胞毒活性成分,该研究从蛇足石杉根部分离得到一株球毛壳属 (Chaetomiumsp.) 真菌M336,对其化学成分进行了研究。对蛇足石杉内生真菌M336采用PDA固体培养基扩大发酵,发酵物经提取及乙酸乙酯萃取后,通过正相硅胶柱色谱法、Sephadex LH-20凝胶柱色谱法、薄层制备、高效液相色谱等色谱手段对其发酵物中的化学成分进行分离纯化,利用理化性质、质谱、核磁等波谱分析技术,并结合相关文献数据鉴定化合物的结构。结果表明:从内生真菌M336发酵提取物的乙酸乙酯萃取部分分离并鉴定出8个化合物,分别为chaetoviridines F、chaetoviridines E、5′-epichaetoviridin A、5′-epichaetoviridin A、xanthoquinodins Al、xanthoquinodins A2、xanthoquinodins B1和毛壳菌素。从M336中分离得到8个化合物,化合物3有一定的抑菌作用,其余化合物有一定的细胞毒活性。该研究结果丰富了蛇足石杉内生真菌球毛壳属中的天然细胞毒活性的化合物。
球毛壳属, 内生真菌, 结构鉴定, 细胞毒活性
蛇足石杉(Huperziaserrata)又名千层塔、蛇足草、万年杉等,属蕨类石杉科 (Huperiaceae) 石杉属 (Huperzia) 药用植物 (余红英等,2001)。民间用千层塔的全草治疗痈疖肿毒、跌打损伤等 (程丹华和戴克敏,1992)。由于千层塔野生资源的匮乏及其良好的药理活性,使得大多数研究学者的目光转向了对其内生真菌的研究。植物的内生真菌是一个丰富多样性的生物类群。在植物内生真菌中,有的内生真菌是对植物病原菌产生拮抗而保护宿主植物免受病原菌侵害的卫士,有的内生真菌对宿主体内某些活性成分的形成产生重要影响,也有能产生与宿主相同或相似的生理活性成分的内生真菌,还有一部分内生真菌与宿主只是共生或伴生关系而作用不明等 (谷苏等,2001; Petrini,1991;Tan & Zhou,2001)。自然界中内生真菌普遍存在于各种植物中,其分布广泛,且种类繁多。但蕨类中内生真菌研究较少见 (邹文欣和谭仁祥,2001)。有报道表明蕨类植物内生菌具有多样性及蕨类植物内生真菌产生的次级代谢产物具有丰富的生物学活性 (张君诚等,2010)。Phonkerd et al(2008)研究发现从球毛壳属中分离得到的化合物chaetoviridines F、chaetoviridines E具有抗人表皮样癌 (KB) ,人乳腺癌 (BC1) 和人的小细胞肺癌 (NCI-H187) 作用。Li et al (2013) 报道从罗布斯塔维氏菊的球毛壳属内生真菌中分离得到的化合物chaetoviridines E和5′-epichaetoviridin A对人类癌症细胞株HepG2具有高细胞毒性。从腐质霉属中分离得到的化合物xanthoquinodins Al、xanthoquinodins A2、xanthoquinodins B1具有抗人髓细胞性白血病HL-60,肝细胞癌SMMC-7721,肺癌A-549,乳腺癌MCF-7和结肠癌SW480细胞系作用 (Tabata et al, 1993)。另外,有文献报道毛壳菌素具有明显的细胞毒活性(Kung et al, 2004; Staab et al, 2007; Cook et al, 2009)。蛇足石杉内生真菌次级代谢产物具有细胞毒活性的报道很少见,但以上报道表明,来源于蛇足石杉的球毛壳属内生真菌的次级代谢产物可能具有一定的细胞毒性。因此,具有重要经济价值的蛇足石杉内生真菌将成为筛选新的细胞毒活性物质的重要来源。
本研究从蛇足石杉根部分离并筛选得到1株具细胞毒活性的内生真菌Chaetomiumsp. M336。我们采用了固体发酵形式,对其次级代谢产物进行了研究,从中分离并鉴定了8个化合物,利用化合物各自的理化性质以及质谱、核磁等波谱分析技术,并结合相关文献数据,结构鉴定为chaetoviridines F(1), chaetoviridines E (2),5′-epichaetoviridin A (3),5′-epichaetoviridin A (4),xanthoquinodins Al (5),xanthoquinodins A2 (6),xanthoquinodins B1(7),毛壳菌素 (8)。
1 材料与方法
1.1 仪器与试剂
由VG AutoSpec-3000,Finnigan LCQ-Advantage 型质谱仪测定质谱;通过Bruker AV-400,DRX-600,Avance III 600 核磁共振仪测得NMR谱,内标为TMS;半制备采用Waters996型-高效液相色谱仪完成;正相柱层析硅胶 (100~200目、200~300目、硅胶GF254) 以及GF254薄层硅胶板,均为青岛海洋化工厂生产;Sephadex LH-20由瑞典Amersham Biosciences公司提供;显色方法为待分离样品在GF254薄层硅胶板上用适当展开剂展开后,将其置于荧光灯下波长254 nm和365 nm处观察荧光, 并观察碘蒸气显色以及5%硫酸乙醇溶液处理后加热显色。
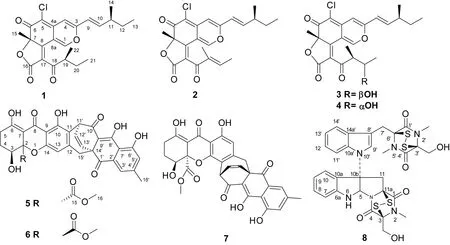
图 1 化合物1-8的结构Fig. 1 Structures of compounds 1-8
Chaetomiumsp. M336来自蛇足石杉 (Huperziaserrata) 的根部,蛇足石杉为本课题组2013年采自云南省文山州西畴县。
1.2 内生真菌的鉴定
Chaetomiumsp. M336的总DNA采用改良的CTAB法提取,使用通用引物ITS4和ITS5扩增ITS序列。
PCR扩增反应程序的热循环参数:95 ℃ 15 min,15 min时加酶; 95 ℃ 40 s,55℃ 40 s,72 ℃ 90 s, 30个循环;72 ℃ 10 min。
PCR结束后,经胶回收获得约700 bp的核酸片段,测序后通过NCBI与GenBank基因库序列进行比对,确定菌株所属类群。
1.3 培养基及培养条件
Chaetomiumsp. M336大批量发酵采用固体PDA培养基,固体PDA培养基配方:马铃薯20%,葡萄糖2%,琼脂2%,蒸馏水1 000 mL,pH 自然。
培养条件:Chaetomiumsp. M336经PDA固体培养基发酵30 L,总共1 250个培养皿,25 ℃培养17 d。
1.4 发酵产物的分离纯化
将划分成小块的固体培养基用乙酸乙酯∶甲醇∶冰醋酸 = (80∶15∶5,V/V/V) 混合有机溶剂浸泡提取4次,合并提取液经46 ℃减压浓缩得到浸膏,将浸膏溶于蒸馏水后加入等体积的乙酸乙酯萃取至乙酸乙酯相颜色较浅,减压浓缩得到提取物40.1 g。粗提物经正相柱层析 (200~300目),分别用石油醚∶乙酸乙酯 (100∶4→6∶4),氯仿∶甲醇 (100∶4→0∶100)进行梯度洗脱,得到11个组分Fr. 1 - Fr. 11。组分Fr. 3 (218 mg) 反复经GF254硅胶正相柱,分别以石油醚-丙酮 (200∶5→0∶100) ,氯仿-甲醇 (100∶0→0∶100) 梯度洗脱,再经Sephadex LH-20 (氯仿∶甲醇 = 1∶1) 和Sephadex LH-20 (甲醇) 凝胶柱得到化合物 1 (1.9 mg)。组分Fr. 4 (1.9 g) 反复经200 ~ 300目硅胶正相柱,以石油醚-乙酸乙酯 (100∶1→6∶4) 梯度洗脱得到5个亚组分,Fr. 4.2 (1.7 g) 经Sephadex LH-20 (氯仿∶甲醇 = 1∶1) 凝胶柱得到化合物 2 (15.0 mg)。组分Fr. 5 (1.8 g) 反复经正相柱、Sephadex LH-20 (氯仿∶甲醇 = 1∶1)及使用半制备柱:Waters 公司产品XterraTMRP-C187 μm 7.8×300 mm (检测波长为210 nm) 经甲醇∶水 (75%∶25%) (水和甲醇均加0.3%的甲酸) 洗脱30 min,分离得到化合物 3 (6.0 mg)。组分Fr. 6 (2.5 g) 反复经200 ~ 300目硅胶,以氯仿-甲醇 (100∶0→6∶4) 梯度洗脱,再经Sephadex LH-20 (氯仿∶甲醇=1∶1)及Sephadex LH-20 (丙酮) 凝胶柱,最后使用半制备柱 (检测波长为210 nm) 经甲醇∶水 (70%∶30%) (水和甲醇均加0.3%的甲酸) 洗脱50 min,分离得到化合物 4 (2.4 mg)。组分Fr. 7 (16.0 g) 反复经200 ~ 300目硅胶色谱柱,以氯仿-甲醇 (100∶0→0∶100) 梯度洗脱,再经Sephadex LH-20 (氯仿∶甲醇 = 1∶1) 及Sephadex LH-20 (丙酮) 凝胶柱得到化合物 5 (6.5 mg)。Fr. 7.5.3 (1.0 g) 经正相硅胶色谱柱及Sephadex LH-20 (丙酮) 得到化合物 6 (32.1 mg)。Fr. 7.5.5 (237.9 mg) 使用半制备柱 (检测波长为210 nm) 经甲醇∶水 (65%∶35%) (水和甲醇均加0.3%的甲酸) 洗脱40 min分离得到化合物7 (6.7 mg)。组分Fr. 8 (1.1 g) 经反复GF254硅胶柱,以氯仿-甲醇 (100∶6→0∶100) 梯度洗脱,再使用半制备柱 (检测波长为210 nm) 经甲醇∶水 (65%∶35%) (水和甲醇均加0.3%的甲酸) 洗脱40 min分离得到化合物 8 (30.8 mg)。
2 结果与分析
2.1 内生真菌的鉴定
利用NCBI里的BLAST,将Chaetomium sp. M336的测序结果与GenBank数据库中的序列进行比对,结果显示该序列与球毛壳属 (Chaetomium) 的同源性达99%,因此Chaetomiumsp. M336鉴定为球毛壳属真菌。
2.2 结构鉴定
化合物1C23H25O5Cl,黄色油状,ESI-MSm/z: 417 [M + H]+;1H-NMR (acetone-d6, 600 MHz),δH: 8.77 (1H, s, H-1), 6.75 (1H, s, H-10), 6.68 (1H, dd,J=15.6, 8.4 Hz, H-4), 6.42 (1H, d,J=12.0, H-9), 3.46 (1H, m, H-19), 2.33 (1H, m, H-11), 1.70 (1H, s, H-15), 1.49 (1H, m, H-20), 1.39 (3H, m, H-12), 1.10 (1H, d,J= 6.4 Hz, H-22), 0.99 (1H, d,J= 6.8 Hz, H-14), 0.91 (3H, q,J= 6.8 Hz, H-13), 0.75 (1H, t,J= 6.0, H-21);13C-NMR (CDCl3, 150 MHz),δC: 201.1 (s,C-18), 183.8 (s, C-6), 168.6 (s, C-16), 164.8 (s, C-8), 158.0 (s, C-3), 152.4 (d, C-1), 147.8 (d, C-10), 140.6 (s, C-4a), 124.6 (s, C-17), 121.2 (d, C-9), 111.2 (s, C-8a), 109.2 (s, C-5), 110.4 (s,C-1), 106.0 (d, C-4), 88.2 (s, C-7), 45.6 (d, C-19), 39.6 (d, C-11), 29.8 (t, C-12), 26.0 (t, C-20), 25.9 (q, C-15), 19.6 (q, C-14), 14.8 (q, C-22), 11.9 (q, C-13), 11.6 (q, C-21)。上述数据与Phonkerd et al (2008) 报道基本一致,故鉴定该化合物为chaetoviridines F。
化合物2C23H23O5Cl,黄色油状,ESI-MSm/z: 415 [M + H]+;1H-NMR (CDCl3, 600 MHz),δH: 8.04 (1H, s, H-1), 6.56 (1H, q,J= 7.6 Hz, H-20), 6.55 (1H, dd,J=15.6, 8.0 Hz, H-4), 6.53 (1H, s, H-10), 6.07 (1H, d,J= 15.6 Hz, H-9), 2.28 (1H, m, H-11), 1.90 (1H, d,J= 7.1 Hz, C-21), 1.86 (1H, s, H-22), 1.71 (1H, s, H-15), 1.43 (1H, q,J= 7.3 Hz, H-12), 1.09 (1H, d,J= 6.7 Hz, H-14), 0.89 (1H, t,J= 7.4);13C-NMR (CDCl3, 150 MHz),δC: 190.3 (s, C-18), 183.7 (s, C-6), 167.4 (s, C-16), 159.2 (s, C-8), 157.2 (s, C-3), 148.3 (d, C-1), 147.9 (d, C-10), 146.8 (d, C-20), 139.4 (s, C-4a), 137.7 (s, C-19), 126.1 (s, C-17), 119.8 (d, C-9), 110.8 (s, C-8a), 109.5 (s, C-5), 105.1 (d, C-4 ), 87.6 (s, C-7), 38.9 (d, C-11), 29.1 (t, C-12), 25.6 (q, C-15), 19.3 (q, C-14), 15.4 (q, C-21), 11.7 (q, C-13), 10.8 (q, C-22)。上述数据与Phonkerd et al(2008) 报道基本一致,故鉴定该化合物为chaetoviridines E。
化合物3C23H25O6Cl,黄色油状,ESI-MSm/z: 433 [M + H]+;1H-NMR (acetone-d6, 600 MHz),δH: 8.66 (1H, s, H-1), 6.73 (s, H-4), 6.80 (1H, dd,J=15.6, 7.8 Hz, H-10), 6.42 (1H, d,J= 9.6 Hz, H-9), 3.73 (1H, m, H-5′), 3.56 (1H, m, H-4′), 2.33 (1H, m, C-11), 1.69 (3H, s, H-7), 1.47 (2H, m, H-12), 1.10 (3H, d,J= 6.7 Hz, H-6′), 1.08 (3H, d,J= 6.8 Hz, H-11), 1.07 (3H, d,J= 6.8 Hz, H-4′), 0.90 (3H, t,J= 7.1 Hz, H- 13);13C-NMR (acetone-d6, 150 MHz),δC: 206.1 (s, C-3′), 183.9 (s, C-6), 168.8 (s, C-1′), 161.6 (s, C-8), 158.1 (s, C-3), 151.6 (d, C-1), 147.8 (d, C-10), 147.8 (d, C-10), 140.7 (s, C-4a), 127.2 (s, C-2′), 121.2 (d, C-9), 111.4 (s, C-8a), 109.0 (s, C-5), 105.9 (d, C-4), 88.2 (s, C-7), 71.2 (d, C-5′), 51.8 (d, C-4′ ), 39.6 (d, C-11), 29.7 (t, C-12), 25.8 (q, 7-CH3), 21.7 (q, C-6′), 19.6 (q, C-11), 13.1 (q, C-4′), 11.9 (q, C-13)。上述数据与Borges et al(2011) 报道基本一致,故鉴定该化合物为5′-epichaetoviridin A。
化合物4C23H25O6Cl,黄色油状,ESI-MSm/z: 433 [M + H]+;1H-NMR (acetone-d6, 600 MHz),δH: 8.66 (1H, s, H-1), 6.73 (1H,s, H-4), 6.80 (1H, dd,J=15.6 , 7.8 Hz, H-10), 6.42 (1H, d,J= 9.6 Hz, H-9), 3.73 (1H, m, H-5′), 3.56 (1H, m, H-4′), 2.33 (1H, m, C-11), 1.69 (3H, s, 7-CH3), 1.47 (2H, m, H-12), 1.10 (3H, d,J= 6.7 Hz, H-6′), 1.08 (3H, d,J= 6.8 Hz, 11-CH3), 1.07 (3H, d,J= 6.8 Hz, 4′-CH3), 0.90 (3H, t,J= 7.1 Hz, H-13);13C-NMR (acetone-d6, 150 MHz),δC: 206.1 (s, C-3′), 183.9 (s, C-6), 168.8 (s, C-1′), 161.6 (s, C-8), 158.1 (s, C-3), 151.6 (d, C-1), 147.8 (d, C-10), 147.8 (d, C-10), 140.7 (s, C-4a), 127.2 (s, C-2′), 121.2 (d, C-9), 111.4 (s, C-8a), 109.0 (s, C-5), 105.9 (d, C-4), 88.2 (s, C-7), 71.2 (d, C-5′), 51.8 (d, C-4′), 39.6 (d, C-11), 29.7 (t, C-12), 25.8 (q, 7-CH3), 21.7 (q, C-6′), 19.6 (q, 11-CH3), 13.1 (q, 4′-CH3), 11.9 (q, C-13)。上述数据与Borges et al(2011) 报道基本一致,,故鉴定该化合物为5′-epichaetoviridin A。
化合物5C23H25O6Cl,黄色油状,ESI-MSm/z: 573 [M + H]+;1H-NMR (CDCl3, 600 MHz),δH: 14.82 (1H, s, OH-8′), 13.94 (1H, s, OH-6), 11.96 (1H, s, OH-10), 11.71 (1H, s, OH-6′), 7.57 (1H, s, H-3′), 7.08 (1H, s, H-5′), 6.67 (1H, d,J= 8.3 Hz, H-13′), 6.48 (1H, t,J= 6.9 Hz, H-12′), 6.08 (1H, s, H-13), 4.79 (1H, d,J= 6.4 Hz, H-11′), 4.27 (1H, s, H-3), 3.69 (1H, s, H-16), 3.04 (1H, d,J= 17.7 Hz, H-15′), 2.88 (1H, d,J= 17.7 Hz, H-15′), 2.81 (1H, ddd,J= 18.7, 11.1, 7.1 Hz, H-5), 2.58 (1H, s, OH-3), 2.45 (3H, s, H-16′), 2.38 (1H, dd,J= 19.3, 6.5 Hz, H-5), 2.12 (1H, m, H-4), 1.92 (1H, m, H-4);13C-NMR (CDCl3, 150 MHz),δC: 195.6 (s, C-1′), 189.0 (s, C-10′), 186.7 (s, C-8′), 182.8 (s, C-8′), 179.8 (s, C-6), 171.0 (s, C-15), 161.4 (s, C-6′), 158.7 (s, C-10), 156.1 (s, C-14), 147.6 (s, C-4′), 146.5 (s, C-12), 132.7 (d, C-13′), 132.2 (s, C-2′), 131.4 (d, C-12′), 124.3 (d, C-5′), 121.0 (d, C-3′), 116.5 (s, C-11), 115.1 (s, C-7′), 110.4 (d, C-13), 106.5 (s, C-9′), 105.1(s,C-9), 100.1 (s, C-7), 83.9 (s, C-2), 66.8 (d, C-3), 53.5 (q, C-16), 37.8 (d, C-11′), 24.4 (t, C-5), 23.0 (t, C-4)。上述数据与Tabata et al(1993) 报道基本一致,故鉴定该化合物为xanthoquinodins A l。
化合物6C31H24O11,黄色油状,ESI-MSm/z: 573 [M + H]+;1H-NMR (CDCl3, 600 MHz),δH: 14.93 (1H, s, OH-8′), 13.95 (1H, s, OH-6), 11.52 (1H, s, OH-6′), 11.09 (1H, s, OH-10), 7.57 (1H, s, H-3′), 7.08 (1H, s, H-5′), 6.69 (1H, d,J=7.6 Hz, H-13′), 6.54 (1H, t,J= 8.4 Hz, H-12′), 4.85 (1H, d,J= 6.0 Hz, H-11′), 4.46 (1H, d,J= 10.6 Hz, H-3), 3.68 (3H, S, H-16), 3.02 (1H, d,J= 16.7 Hz, H-15), 2.96 (1H, d,J= 16.7 Hz, H-15), 2.70 (1H, d,J= 7.8 Hz, H-5), 2.45 (3H, s, H-16′), 2.36 (1H, m, H-5), 2.18 (1H, m, H-4), 2.07 (1H, m, H-4);13C-NMR (CDCl3, 150 MHz),δC: 195.8 (s, C-1′), 190.1 (s, C-10′), 186.9 (s, C-8), 181.8 (s, C-8′), 179.0 (s, C-6), 170.1 (s, C-15), 161.4 (s, C-6′), 160.4 (s, C-10), 155.2 (s, C-14), 147.9 (s, C-4′), 147.0 (d, C-12), 132.5 (s, C-2′), 132.4 (d, C-13′), 131.8 (d, C-12′), 124.6 (d, C-5′), 121.4 (d, C-3′), 115.0 (s, C-7′), 114.2 (s, C-13), 113.9 (d, C-11 ), 107.1 (s, C-9′), 101.8 (s, C-7), 85.7 (s, C-2), 71.9 (d, C-3), 53.6 (q, C-16), 39.5 (t, C-11′), 27.9 (t, C-5), 24.1 (t,C-4)。上述数据与Tabata et al(1993) 报道基本一致,故鉴定该化合物为xanthoquinodins B1。
化合物7 C31H24O11,黄色油状,ESI-MSm/z: 571 [M - H]+;1H-NMR (CDCl3, 600 MHz),δH: 14.84 (1H, s, OH-8′), 13.83 (1H, s, OH-6), 11.82 (1H, s, OH-10), 11.72 (1H, s, OH-6′), 7.57 (1H, s, H-3′), 7.09 (1H, s, H-5′), 6.66 (1H, d,J= 8.2 Hz, H-13′), 6.49 (1H, dd,J= 8.3, 6.8 Hz , H-12′), 4.77 (1H, d,J= 6.6 Hz, H-11′), 4.25 (1H, dd,J= 12.4, 5.0 Hz, H-4), 3.69 (3H, s, H-16), 3.02 (1H, d,J= 18.0 Hz, H-15′), 2.94 (1H, d,J= 18.0 Hz, H-15′), 2.66 (2H, m, H-5), 2.45 (3H, s, H-15′), 2.14 (1H, m, H-4), 2.07 (1H, m, H-4);13C-NMR (CDCl3, 150 MHz),δC: 194.5 (s, 2C, C-6,C-6′), 192.9 (s, 2C, C-8,C-8′), 172.0 (s, 2C, C-15,C-15′), 156.3 (d, 2C, C-1,C-1′), 144.9 (s, 2C, C-4a,C-4a′), 116.7 (s, 2C, C-5,C-5′), 110.7 (s, 2C, C-8,C-8a′), 108.7 (s, 2C, C-3,C-3′), 86.0 (s, 2C, C-7, C-7′), 67.9 (d, 2C, C-4, C-4′), 39.0 (d, 2C, C-11, C-11′), 34.0 (d, 2C, C-9, C-9′), 23.7 (q, 2C, C-14, C-14′), 23.5 (q, 2C, C-12, C-12′), 22.7 (q, 2C, C-16, C-16′), 20.2 (q, 2C, C-10, C-10′)。上述数据与Tabata et al(1993) 报道基本一致,故鉴定该化合物为xanthoquinodins A2。
化合物8C31H30O6N6S4,黄色油状,ESI-MSm/z: 711 [M + H]+;1H-NMR (CDCl3, 600 MHz),δH: 7.66 (1H, d,J= 6.8 Hz, H-14′), 7.34 (1H, d,J= 7.6 Hz, H-7), 7.30 (1H, t,J= 7.6 Hz, H-8), 7.30 (1H, m, H-11′), 7.22 (1H, m, H-12′), 7.22 (1H, m, H-13′), 7.19 (1H, s, H-9′), 6.94 (1H, t,J= 7.4 Hz , H-9), 6.80 (1H, d,J= 7.9 Hz, H-10), 6.21 (1H, s, H-5), 5.39 (1H, s, H-6), 4.42 (1H, d,J= 15.4 Hz, H-11), 4.36 (2H, d,J= 12.2Hz, H-3), 4.33 (2H, d,J= 12.2 Hz, H-3′), 4.29 (1H, d,J= 12.2 Hz, 3-CH2OH), 4.27 (1H, d,J= 12.2 Hz, 3′-CH2OH), 3.88 (1H, d,J= 15.4 Hz, H-7′), 3.71 (1H, d,J= 15.4 Hz, H-7′), 3.19 (3H, s, 2-CH3), 3.16 (3H, s, 2′-CH3), 3.10 (1H, d,J= 15.4 Hz, H-11), 2.96 (3H, s, 5′-CH3);13C-NMR (CDCl3, 150 MHz),δC: 166.8 (s, C-4′), 165.52 (s, C-1), 165.51 (s, C-1′), 163.2 (s, C-4), 148.3 (s, C-6a), 134.0 (s, C-10a′), 131.4 (d, C-8), 130.4 (s, C-14a′), 127.2 (d, C-9′), 126.5 (s, C-10a), 125.0 (d, C-7), 122.8 (d, C-13′), 120.6 (d, C-12′), 120.3 (d, C-9), 119.1 (d, C-14′), 111.4 (d, C-11′), 111.1 (d, C-10), 107.6 (s, C-8′), 80.1 (d, C-5), 76.5 (s, C-6′), 76.1 (s, C-3′), 74.8 (s, C-3), 73.7 (s, C-10b), 73.5 (s, C-11a), 61.2 (t, 3′-CH2OH), 60.5 (t, 3-CH2OH), 42.6 (t, C-11), 28.2 (q, 5′-CH3), 27.5 (q, 2-CH3), 27.4 (q, 2′-CH3), 27.1 (t, C-7′)。上述数据与Fujimoto et al(2004) 报道基本一致,故鉴定该化合物为chetomin。
3 讨论与结论
由于植物内生真菌次生代谢产物具有丰富的结构及其广泛的药理活性和生物学功能,植物内生真菌代谢产物已经成为众多学者的研究热点 (Tan & Zhou, 2001)。近年来,植物内生真菌的次级代谢产物被认为是药理活性分子的重要来源,随着众多研究人员对植物内生真菌进行药物开发,从植物内生真菌的次级代谢产物中发现了大量具有显著生物活性的化合物 (Leslie, 2006)。由于来自于植物各个组织的内生真菌种类繁多,所以内生真菌的研究有待于进一步的挖掘。
本研究从蛇足石衫内生真菌Chaetomiumsp. M336中分离纯化并鉴定出8个化合物,依次为chaetoviridines F (1),chaetoviridines E (2),5′-epichaetoviridin A (3),5′-epichaetoviridin A (4),xanthoquinodins Al (5),xanthoquinodins A2 (6),xanthoquinodins B1 (7),毛壳菌素 (8)。McMullin et al(2013) 发现化合物3具有一定的抗恶臭假单胞菌和枯草芽孢杆菌活性,其他化合物根据相关文献报道均具有一定的细胞毒活性。另外,化合物1、2、4、5、6、7、8具有细胞毒活性,表明它们可能是蛇足石衫内生真菌Chaetomiumsp. M336表现细胞毒的活性物质。本研究丰富了蛇足石杉内生真菌球毛壳属 (Chaetomiumsp.) 的药用价值,并对探索具有细胞毒活性化合物奠定了基础。
BORGES WS,PUPO MT, MANCILLA G, et al, 2011. Azaphilones from the endophyteChaetomiumglobosum[J]. J Nat Prod, 74: 1 182-1 187.
CHENG DH, DAI KM, 1992. Pharmacognosy identification ofHuperziaserrata[J]. Primary J Chin Trad Med, 6(4): 7-9. [程丹华, 戴克敏, 1992. 千层塔的生药学鉴定 [J]. 基层中药杂志, 6(4): 7-9.]
CHEN GD,YAO XS, CHEN Y, et al, 2013. Xanthoquinodins from the endolichenic fungal strainchaetomiumelatum[J]. J Nat Prod, 76: 702-709.
COOK KM,HILTON ST, MECINOVIC J, et al, 2009. Epidithiodiketopiperazines block the interaction between hypoxia-inducible Factor-1 (HIF-1) and p300 by a zinc ejection mechanism [J]. J Biol Chem, 284 (39): 26 831-26 838.
FUJIMOTO H, SUMINO M, OKUYAMA E, et al, 2004. Immunomodulatory constituents from an ascomycete,Chaetomiumseminudum[J]. J Nat Prod, 67: 98-102.
GU S, SHAO H, JIANG XH,et al, 2001. Potential applications of medicinal plants endophytic fungal diversity and its active ingredient [J]. Chin Pharm, 36 (1): 14-15. [谷苏, 邵华, 蒋晓华, 等, 2001. 药用植物内生真菌多样性及其活性成分的潜在应用价值 [J]. 中国药学杂志, 36 (1): 14-15.]
KUNGAL, ZABLUDOFF SD, FANCE DS, et al, 2004. Small molecule blockade of transcriptional coactivation of the hypoxia-inducible factor pathway [J]. Canc Cell, 6: 33-43.
LI X, QIN JC, TIAN Y, et al, 2013. Cytotoxic azaphilone alkaloids fromChaetomiumglobosumTY1 [J]. Bioorg Med Chem Lett, 23: 2 945-29 47.
LESLIE GUNATILAKA AA, 2006. Natural products from plant- associated microorganisms: distribution, structural diversity , bioactivity, and implications of their occurrence [J]. J Nat Prod, 69: 509-526.
MCMULLIN DR, MILLERA JD, SUMARAH MW, et al,2013. New azaphilones fromChaetomiumglobosumisolatedfrom the built environment [J]. Tetrahedron Lett, 54: 568-572.
PETRINI O,1991. Microbial ecology of leaves, Springer-Verlag New York: 179-197.
PHONKERDA N, KANOKMEDHAKULA S, KANOKMEDHAKUL K, et al, 2008. Bis-spiro-azaphilones and azaphilones from the fungiChaetomiumcochliodesVTh01 andC.cochliodesCTh05 [J]. Tetrahedron, 64: 9 636-9 645.
STAAB A, LOEFFLER J, SAID HM, et al, 2007. Effects of HIF-1 inhibition by chetomin on hypoxia-related transcription and radiosensitivity in HT 1080 human fibrosarcoma cells [J] . BMC Cancer, 7: 213-220.
TAN N, LIN YC, SHAO CL, et al, 2009. Identification and bioassay of three anthraquinone secondary metabolites of mangrove endophytic fungus #2240 from south China sea [J]. Chin J Appl Chem, 26 (3): 277-281. [谭倪, 林永成, 邵长伦, 等, 2009. 南海红树林内源真菌#2240的3个蒽醌类次级代谢产物的鉴别和药理活性 [J]. 应用化学, 26 (3): 277-281.]
TAN RX, ZHOU WX, 2001. Endophytes: a rich source of functional metabolites [J]. Nat Prod. Rep, 18: 448-459 .
TABATA N, OMURA S, TOMODA H, et al, 1993. Structure and biosynthesis of xanthoquinodins, anticoccidial antibiotics [J]. J Am Chem Soc, 115: 8 558-8 564.
YU HY, SUN MY, YANG YJ, 2001. Advance in studies onHuperziaserrata[J]. Chin Trad Herb Drugs, 32 (3): 279-281. [余红英, 孙远明, 杨跃进, 2001. 草药蛇足石杉的研究进展 [J]. 中草药, 32 (3): 279-281.]
ZHANG JC, WANG ZM, ZHANG HY, et al, 2010. The summarize about recent research process on fern endophyte [J]. Chin Agric Sci Bull, 26 (20): 70-72. [张君诚, 王铮敏, 张杭颖,等, 2010. 蕨类植物内生菌研究进展 [J]. 中国农学通报,26 (20): 70-72.]ZOU WX, TAN RX, 2001. Recent advances on endophyte research [J]. Chin Bull Bot, 43 (9): 881-892. [邹文欣, 谭仁祥, 等, 2001. 植物内生菌研究新进展 [J]. 植物学报, 43 (9): 881-892.]
Isolation and identification of secondary metabolites from a new endophyteHuperziaserrata
YU Fei-Xue1,2, YANG Yin-He2, ZHAO Pei-Ji2, CHEN Yao1*
( 1.KunmingUniversityofScienceandTechnology, Kunming 650500, China; 2.StateKeyLaboratoryofPhytochemistryandPlantResoursesinWestChina,KunmingInstituteofBotany,ChineseAcademyofScience, Kunming 650201, China )
Many kinds of endophytic fungi are widely associated with various plants and a lot of systemic researches focusing on secondary metabolites of endophytes had been conducted. However, the research on endophyte inHuperziaserratais rare, which is a traditional Chinese medicinal fernQianCengTa, belongs toHuperziaof Huperziaceae. Finding active compounds from endophytes inH.serratacan provide a new way for further exploitation resources of this medicinal plant. The purpose of this study was to search cytotoxic active compounds of endophytes fromH.serrata. We isolated the chemical constitution ofChaetomiumsp. M336 which was an endophytic fungus isolated in the roots ofHuperziaserrata. TheChaetomiumsp. M336 was fermented on solid PDA media. The fungus containing with medium was extracted with ethyl acetate∶methanol∶acetic acid = (80∶15∶5, V/V/V) mixed organic solvent, and the secondary metabolites of endophytic fungi were obtained. The compounds of the fermented extracts were separated and purified by column chromatography involving normal-phase silica gel, Sephadex LH-20 and reversed-phase semi-preparative HPLC. Their structure of the compounds were elucidated by their physical and chemical properties, including nuclear magnetic resonance (NMR) spectroscopy, and electrospray ionization mass spectrometry (ESI-MS) and according to the reported literatures. They results were as follows: eight compounds were isolated and purified from the ethyl acetate extracts of the fungusChaetomiumsp. M336. They were identified as chaetoviridines F, chaetoviridines E, 5′-epichaetoviridin A, 5′-epichaetoviridin A, xanthoquinodins Al, xanthoquinodins A2, xanthoquinodins B1, chetomin. In conclusion, eight compounds were isolated from M336. Compound 3 showed some certain anti-bacterial activity, others exhibit cytotoxicity. This preliminary work will provide information for further search on natural cytotoxic activity products of endophytic fungi fromHuperziaserrata.
Chaetomiumsp., endophytic fungi, structure identification, cytotoxicity
10.11931/guihaia.gxzw201509025
2015-09-28
2015-01-25
国家重点基础研究发展“973”计划项目 (2013CB127505) [Supported by the National Basic Research Program of China “973” Program, (2013CB127505)]。
于飞雪 (1987-),女,吉林长春人,硕士研究生,研究方向为天然药物化学,(E-mail)15025152330@139.com。
陈瑶,教授,研究方向为药物基因组学,(E-mail)Chyhdd@sina.com。
Q946.91
A
1000-3142(2016)09-1112-07
于飞雪, 杨银河, 赵沛基, 等. 蛇足石杉中的新内生真菌及其代谢产物的分离与鉴定 [J]. 广西植物, 2016, 36(9):1112-1118
YU FX, YANG YH, ZHAO PJ, et al. Isolation and identification of secondary metabolites from a new endophyteHuperziaserrata[J]. Guihaia, 2016, 36(9):1112-1118

