枣果霉烂病病原鉴定(二)
——引起新疆枣果霉烂病的几种青霉菌的分离鉴定
沙娜瓦尔·色买提,玉山江·买买提,郭庆元,白剑宇
(1.新疆农业大学农学院,乌鲁木齐 830052;2.新疆农业科学院植物保护研究所,乌鲁木齐 830091)
枣果霉烂病病原鉴定(二)
——引起新疆枣果霉烂病的几种青霉菌的分离鉴定
沙娜瓦尔·色买提1,玉山江·买买提2,郭庆元1,白剑宇1
(1.新疆农业大学农学院,乌鲁木齐830052;2.新疆农业科学院植物保护研究所,乌鲁木齐830091)
【目的】枣果霉烂病是枣干果上的主要病害,青霉菌是引起枣果霉烂病的重要病原之一。明确新疆枣果霉烂病病原种类及优势致病种群,有效防控该病的发生与危害。【方法】通过组织分离、形态鉴定及分子鉴定,对引起枣果霉烂病的几种青霉菌进行准确鉴定,通过人工接种进行致病性比较。【结果】自枣果上分离到的大多数青霉属单孢菌株对枣果具有明显的致病性;50个致病的青霉属单孢菌株分属于5个种,分别为波兰青霉、短密青霉、变幻青霉、产黄青霉、朱黄青霉;其中波兰青霉分离频率最高,为青霉菌中的优势种;变幻青霉在5种青霉菌中致病力最强。【结论】引起新疆枣果霉烂病的青霉属真菌有5种,其中波兰青霉为优势种,变幻青霉为致病力最强的种。
枣;果实霉烂病;青霉;病原鉴定
0 引 言
【研究意义】枣树(ZizyphusjujubeMill)原产于我国黄河流域,至今己有3000多年的栽培历史[l],是重要的特产果品资源之一,是我国第一大干果树种和第七大果品树种[2]。枣果因其味甜、肉质厚、含有丰富的营养物质、较高的营养价值和食疗功能等优良品质而受到消费者的喜爱,是国内外知名的果产品[3]。近年来,新疆的枣果产业蓬勃发展,初步形成了我国最具发展前景的优质枣果产业带。但是,长期以来,果农主要采用传统露天暴晒的方式制干,使枣果极易受到污染,导致吸湿回潮、褐变、酸甜失衡等问题,在枣果储运过程中很容易发生霉变引起枣果霉烂等贮藏期病害,从而造成干果品质下降,市场价格降低。在引起枣果霉烂病的致病菌中,青霉菌和曲霉菌是其主要的病原[4]。因此,明确枣果霉烂病的病原种类及优势致病种群对有效防控该病的发生和危害有重要意义。【前人研究进展】根据已有报道,枣果霉烂病在每年都有大量发生,有的年份甚至造成 90%以上的损失[4]。枣果霉烂病包括轮纹烂果病、红粉病、软腐病、曲霉病、青霉病、木霉病等多种[4,5]。据报道青霉菌侵入枣果后,引起病果变软、果肉变褐、味苦,湿度高时果面长出灰绿色霉层,其病征非常有助于该病的识别[4]。【本研究切入点】目前,国内外对引起枣果霉烂病的青霉菌种类报道甚少,对新疆枣果霉烂病的病原研究未见报道。针对枣果霉烂病危害性,其病原菌种类缺少准确鉴定,防治上没有适当措施的现状,研究拟对引起枣果霉烂病的青霉菌进行大量分离,应用传统真菌形态学鉴定和分子鉴定相结合的方法对引起枣果霉烂的青霉菌进行准确鉴定,并对多种致病青霉菌进行致病性比较。【拟解决的关键问题】通过大量的采样和严格的分离鉴定,明确其致病种类和优势致病种群,为该病的有效防控提供依据。研究在传统的形态鉴定基础上,利用rDNA-ITS将得到的主要病原菌进行鉴定,对引起枣果霉烂病的青霉菌的致病种类和优势致病种群进行分析,为枣果霉烂病害的防治提供理论依据。
1 材料与方法
1.1材 料
1.1.1病 果
2014至2015年,先后于阿克苏地区(市郊、阿克苏阿瓦提县、阿克苏沙雅县)、和田地区(皮山县、策勒县、于田县、洛浦县)、喀什地区(沙车县)等主要枣产区及乌鲁木齐华凌干果批发市场和乌鲁木齐东环路干果批发市场进行病果收集,从中挑选典型病果进行分离。用于分离的主要枣果品种有骏枣、灰枣、哈密大枣等。
1.1.2 培养基
PDA培养基:马铃薯200 g,蔗糖20 g,琼脂15~20 g,用水定容至1L。
查氏琼脂培养基(Czapek):蔗糖30 g,NaNO31 g,K2HPO41 g,KCl 0.5 g,MgSO40.5 g , FeSO40.01 g,琼脂15~20 g,用水定容至1 L,pH 自然。
水琼脂培养基(WA):琼脂15 g、蒸馏水1 000 mL。
1.2方 法
1.2.1 病原菌分离1.2.1.1 组织分离法
将新鲜病果表面清洗干净,用70%酒精棉球擦拭枣果表面,用解剖刀削去大部分病部组织,用镊子夹取病健交界处果肉置于PDA平板培养基上,25℃恒温箱中培养。
1.2.1.2保湿诱发分离法
选取典型病果,置入加滤纸的保湿培养皿内,待菌落长出后,从菌落上选择较为单纯的青霉菌转接到新的查氏平板培养基上,25℃恒温培养5 d后检查菌落。
1.2.2病原真菌的纯化、回接及形态鉴定
对各分离物采用单孢分离法进行纯化[6]。完成所有分离物的单孢分离后,采用离体果针刺接种法将各单孢菌株接种到新鲜、成熟、健康、无伤的红枣果实上,观察其致病与否,由此筛选致病菌株。
将各致病菌株分别接种到查氏平板培养基上,经培养后进行体视显微观察及制作切片镜检,观察描述其产孢方式及分生孢子梗、产孢细胞和分生孢子/的形态特征,结合培养特性,作为鉴定菌种依据。参照《真菌鉴定手册》[7]及《中国真菌志》青霉属分册[8],主要以Pitt和Samson(1993)[9]的资料为依据对各致病菌株进行形态鉴定。
1.2.3病原菌分子鉴定1.2.3.1基因组DNA的提取
从完成形态鉴定的各种青霉菌中选取一个单孢菌株,采用液体静置培养方法收集菌丝体,用液氮充分研磨菌至粉末后装入1.5 mL离心管中,参照试剂盒使用说明,用真菌 DNA 提取试剂盒(北京天根生物科技有限公司)提取其基因组DNA。
1.2.3.2rDNA-ITS的扩增与测序
引物:上游引物ITS1(5′-GTAGTCATATGCTTGTCTC-3′)
下游引物ITS4(5′-TCCTCCGCTTATTGATATGC-3′)
PCR扩增25 μL的反应体系,包括Taq(1U/μL) 0.5 μL,10×PCR Buffer 2.5 μL,Mg2+Plus 2.5 μL,dNTP Mixture 3 μL,ITS1 1 μL,ITS4 1 μL,模板DNA 各2 μL,ddH2O 13 μL。
PCR反应条件为预变性95℃ 3 min;变性,95℃ 1 min,退火52℃ 40 s,延伸72℃ 2 min,35个循环;补平72℃ 10 min。
扩增产物用1%琼脂糖凝胶,在1×TAE电泳缓冲液中电泳,以凝胶成像系统检测并记录扩增产物在琼脂糖凝胶上的图谱。
用PCR产物切胶、PMD18-T载体纯化和连接产物转化方法将扩增产物纯化后送博士德生物公司测序部进行测序。
1.2.3.3BLAST比对与同源性分析
将测得的菌株序列在GenBank中进行BLAST比对,根据待测菌株与已知种的同源性验证形态鉴定结果。
1.2.4病原菌的致病性比较1.2.4.1鲜果接种方法
采集白熟期新鲜健康枣果,用浸泡在70%酒精中的棉球对枣果表面消毒,无菌水冲洗3次,晾干后切成果片并置于保湿培养皿内;将各单孢菌株制成直径4 mm的菌饼作为接种体,贴于枣果片切面上,每果片接种3个位点;每个单孢菌株接种3个果片(3次重复)并置于同一保湿皿中;以果片上放无菌的PDA培养基饼作为对照。接种后在25℃温箱中保湿培养,每天观察记录果实发病情况,10 d后分别统计发病率。
1.2.4.2干果接种方法
选健康干果, 用70%酒精棉球作表面消毒后,用无菌水浸泡吸胀,晾干后切成果片并置于保湿培养皿内;用与鲜果相同的接种和培养方法观察记录果实发病情况。
2 结果与分析
2.1自然发病枣果的典型症状
该病主要为害采收期至储藏期的果实,一般在采后晾晒期(10月中、下旬)大量发生,多从果面虫眼、裂口、病痕及机械伤口处发病。青霉菌侵染枣果后,受害部位果肉变褐、湿度高时果面可长出边缘白色中间灰绿色的霉层。其中灰绿色部分长有大量的分生孢子穗,边缘白色部分主要为新生菌丝。
2.2枣果霉烂病病原菌分离
通过组织分离,从60个典型病果,约300个组织块上获得15个青霉属(Penicilliumspp.)分离物;通过保湿分离,从15个典型病果上获得40个青霉属分离物;合计从75个病果上分离到55个青毒属分离物,经单孢分离得到165个单孢菌株(每分离物2~3个);选取其中117个单孢菌株进行回接,筛选出102个致病的单孢菌株。它们分别来自于50个分离物(有5个分离物的所有菌株无致病表现)。这些致病菌株均能侵染枣果,引起果实表面或内部发病,长出青色或绿色霉层,最后导致烂果,并从发病果实上可重新分离得到与所接菌株的培养性状相同的病原菌,说明分离得到的病原菌是引起枣果霉烂病的致病菌。分离过程中还有大量的曲霉属真菌及少量腐霉属分离物出现。
表150个青霉属菌株所属的种及其出现频率
Table 1Frequency of 50 Penicillium .spp

代表菌株Representativestrain相同特征菌株数Numberofequalcharacteristicstrains出现频率Occurrencefrequency(%)组织分离Tissueisolation(个)保湿分离Moisturizeisolation(个)组织分离Tissueisolation(%)保湿分离Moisturizeisolation(%)合计Total(%)鉴定结果IdentificationresultHMGS1406-1-1RQGS1406-7-4HTGS1406-8-5131326.0026.0052.00波兰青霉(P.polonicum)HMGS1406-2-2YTGS1406-3-2HTGS1406-8-3244.008.0012.00变幻青霉(P.variabile)HTGS1406-4-1HTGS1406-4-2CLGS1406-9-1060.0012.0012.00产黄青霉(P.chrysogenum)RQGS1406-7-1-3RQGS1406-7-2-2RQGS1406-7-3060.0012.0012.00朱黄青霉(P.minioluteum)CLGS1406-5-7YTGS1406-3-5RQGS1406-7-1-1060.0012.0012.00短密青霉(P.brevicompactum)
2.3青霉种的形态鉴定
从50个分离物中各选1个致病单孢菌株,通过对各单孢菌株在查氏培养基上的培养形状及孢子和产孢细胞的形态、大小等特征观察,鉴定出50个青霉属菌株分属于5个种,分别为波兰青霉(P.polonicumThom)、变幻青霉(P.variabileSopp)、产黄青霉(P.chrysogenumThom)、朱黄青霉(P.minioluteumDierckx)和短密青霉(P.brevicompactumDierckx);波兰青霉的出现频率最高为52%,其余四种青霉的出现频率均为12%。此外,从两种分离方法得到的结果来看,经组织分离法得到的青霉菌菌株很少,而经保湿分离法得到的青霉菌菌株数较多;从组织分离法得到的15个菌株中,只鉴定出波兰青霉和变幻青霉两种,且以波兰青霉的菌株占约大多数,而保湿分离得到的35个菌株中鉴定出了上述所有5个种,而仍以波兰青霉的菌株为多。多项分离结果均显示波兰青霉在所有青霉菌株中出现频率最高,为枣果霉烂病的优势病原菌种。表1
2.4各种致病青霉菌的培养性状及形态特征
2.4.1波兰青霉P .polonicum
在查氏培养基上,25℃,培养12 d后,菌落直径36~41 mm,有明显的放射状皱纹,,质地绒状;分生孢子结构大量产生时,菌落通常呈现较深的绿色,近于暗绿橄榄色、橄榄绿色;菌丝体通常白色;菌落反面黄褐色;分生孢子梗发生于基质,孢梗茎(147~300) μm×(3.5~4) μm,壁通常小疣状粗糙;帚状枝三轮生;梗基每轮2~4个分枝,(11~21) μm×(2.8~3) μm;瓶梗每轮3~7个,7~10(11)μm×(2~2.5) μm,瓶状,梗颈较长;分生孢子多球形(3.8)4~3.5 μm,壁平滑。图1A
2.4.2变幻青霉 P . variabile
在查氏培养基上,25℃,培养12 d后,菌落直径30~34 mm,平坦,质地绒状兼有轻微絮状;分生孢子结构较多,菌落通常呈现黄绿色、蓝绿色;菌丝体淡褐色;渗出液通常缺乏;菌落反面黄色;分生孢子梗发生于基质,孢梗茎(128~151)μm×(1.5~3.2) μm, 壁平滑;帚状枝双轮生,紧贴;梗基梗基每轮4~8个,(8~12) μm×(2.5~2.8) μm;瓶梗每轮4~6个,(10 ~12) μm×(1.5~3) μm,披针形;分生孢子呈现椭圆形,(3.5~5) μm×(2~2.5) μm,壁平滑;分生孢子链疏松。图1B
2.4.3产黄青霉P .chrysogenum
在查氏培养基上,25℃,培养12 d后,菌落直径25~30 mm,有大量放射状皱纹;质地通常呈现显著的绒状;分生孢子结构大量产生,菌落通常呈现蓝绿色;菌丝体白色;菌落反面呈现不同程度的黄褐色;分生孢子梗发生于基质,孢梗茎30~80(120)μm×(1.6~3) μm, 壁平滑;梗基每轮2~5个,(9~12) μm×(2.5~2.8) μm;瓶梗每轮4~80个,(7~10) μm×(2~2.7) μm,瓶状,梗劲短;分生孢子呈现椭圆形,(2.8~3.5) μm×(2~2.6) μm,壁平滑;分生孢子链通常呈现不规则的圆柱状。图1C
2.4.4朱黄青霉P .minioluteum
菌落在查氏培养基上,25℃,培养12 d后,直径19~24 mm,平坦,边缘不整齐;质地绒状;分生孢子结构较多,分生孢子面黄绿色;菌丝体白色;菌落反面深红色;分生孢子梗发生于气生菌丝,孢梗茎(40~150) μm×(2.5~3.2) μm,壁平滑;帚状枝双轮生彼此紧贴;梗基每轮5~8个,(8~13) μm×(2.5~3.2) μm;瓶梗每轮6~8个,(8~11) μm×(1.8~2.2) μm,披针形;分生孢子呈现椭圆形,也有近球形,(2.8~3.5) μm×(2.2~2.8) μm,壁平滑;分生孢子疏松而不规则。图1D
2.4.5短密青霉P. brevicompactum
菌落在查氏培养基上,25℃,12 d后,菌落直径17~20 mm,中部有脐状突起,其他部位有放射状皱纹,边缘通常较薄;质地通常绒状;分生孢子结构大量产生,分生孢子面蓝绿色;菌丝体白色;菌落反面暗黄褐色;分生孢子梗发生于基质,孢梗茎(30.5~165) μm×(3~4.5) μm,壁平滑;帚状枝主要是三轮生,通常彼此紧贴;副枝1~3个,(12~18) μm×(2.5~4) μm;梗基每轮4~7个,(7.4~10) μm×(2.5~4) μm,顶端膨大呈现囊状;瓶梗每轮5~8个,(7~9) μm×(2~2.5) μm,瓶状,梗劲短;分生孢子呈现椭圆形或近椭圆形, (2.3~3.32) μm×(2.5~3) μm,壁平滑。图1E
2.5五种青霉菌的rDNA- ITS 序列分析
从几种青霉菌中各选一个致病的单孢菌株,以病原菌的 DNA 作为模板,用通用引物扩增出约 580~600 bp 左右的 rDNA- ITS 序列,并完成测序。将所测得的不同青霉菌株的 rDNA- ITS 序列在GenBank 中与已有的一些青霉菌序列进行比对分析,结果表明,所测病原菌分属于半知菌类青霉属中的确为5个种。图2
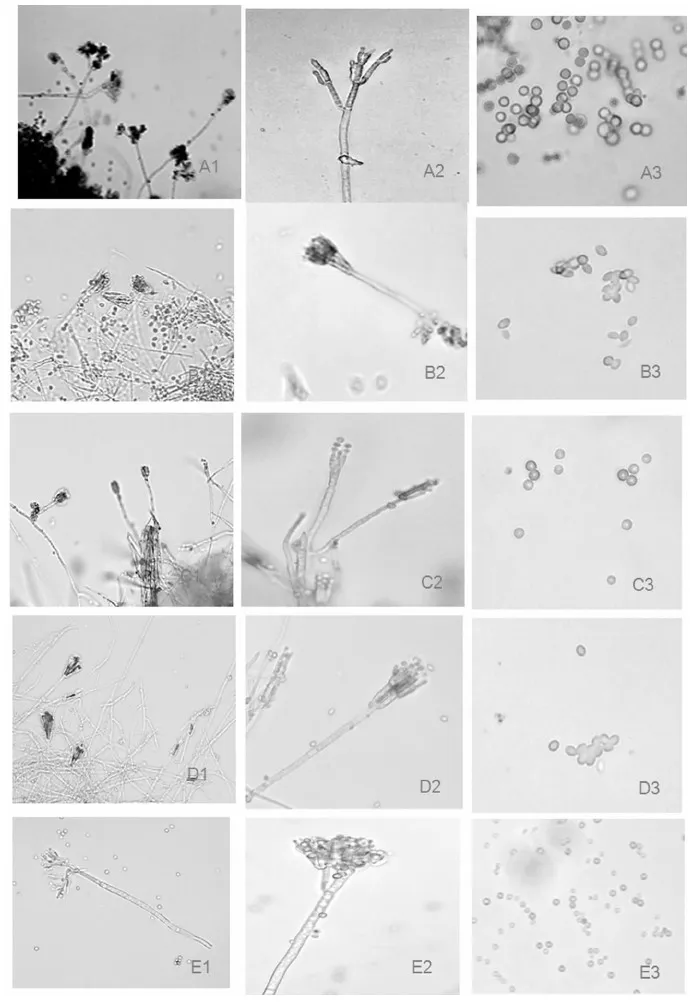
注:A、B、C、D、E分别代表波兰青霉、变幻青霉、产黄青霉、朱黄青霉、短密青霉。1、2、3分别代表五种青霉菌的分生孢子穗、分生孢子梗及分生孢子
Note:A,B,C,D,E respectively representP.polonicum、P.brevicompactum、P.vaeiabile、P.minioluteum、Penicilliumminioluteum;1、2、3 respectively represent the morphology characteristic of 5Penicilliumspp. on conidium fringe、conidiophores、conidia
图1五种青霉的形态特征
Fig. 1Morphological characteristics of 5 species Penicillium fungus
经形态鉴定的各种青霉菌与GenBank 中登录的同种青霉菌的rDNA- ITS 序列进行同源性比对,结果表明:波兰青霉菌株(HMGS1406-1-1)的ITS 序列与P.polonicum(AF033475,KJ741330,KJ589583等)多个菌株的ITS序列同源性达99%~100%;变幻青霉菌株(HTGS1406-8-3)的ITS 序列与P.variabile(HM469398,JF327827,HQ288049等)多个菌株的ITS序列同源性达98%~99%;产黄青霉菌株(HTGS1406-4-1)的ITS 序列与P.chrysogenum(JQ776534,AY373903,KF011475等)多个菌株的ITS序列同源性达99%~100%;朱黄青霉菌株(RQGS1406-7-1-3)的ITS 序列与P.minioluteum(JF910284,FR670332和GU566240等)多个菌株的ITS序列同源性达98%~99%;短密青霉菌株(CLGS1406-5-7)的ITS 序列与P.brevicompactum(AY373897,NR121299和HM469408等)多个菌株的ITS序列同源性达99%~100%;其分析结果与形态鉴定结果一致,表明引起新疆枣果霉烂病的青霉菌确为上述5种。
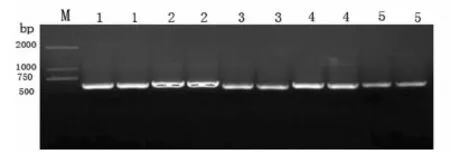
注:M:DNA marker DL2000;1:波兰青霉(HMGS1406-1-1);2:变幻青霉(HTGS1406-8-3);3:产黄青霉(HTGS1406-4-1);4:朱黄青霉(RQGS1406-7-1-3);5:短密青霉(CLGS1406-5-7)
Note:M:DNA marker DL2000;1:P.polonicum(HMGS1406-1-1);2:P.variabile(HTGS1406-8-3);3:P.chrysogenum(HTGS1406-4-1);4:P.minioluteum(RQGS1406-7-1-3);5:P.brevicompactum(CLGS1406-5-7)
图2五种青霉菌株ITS 区域的 PCR 扩增产物
Fig.2rDNA ITS-PCR products of single spore isolates of 5 spcies Penicillium
2.6五种青霉菌的致病性比较
从5种青霉菌中各选3个单孢菌株进行的致病性分析的结果表明:5种青霉菌对枣果的致病力存在明显的差异,同一种青霉菌对鲜果和干果的致病力亦有较大差异,其中有4种青霉对鲜果的致病力明显大于对干果的致病力,仅产黄青霉例外,对鲜果的致病力略小于对干果的致病力;变幻青霉和朱黄青霉对枣鲜果致病能力最强(接种发病率大于81%),对干果的致病力也较强(接种发病率分别为51.84%和33.33%);产黄青霉对枣鲜果致病能力最弱(接种发病率为44.44%),但对干果的致病力最强(接种发病率为66.66%);其他两种青霉(波兰青霉和短密青霉)对枣鲜果致病能力较强,对干果的致病力较弱;同时,同一种青霉菌的不同菌株间的致病力亦有明显差异。表2
表2五种青霉菌对枣鲜果及枣干果的致病性比较
Table 2The results of pathogenicity test of Penicillium fungus to jujube fresh fruit and dried fruit
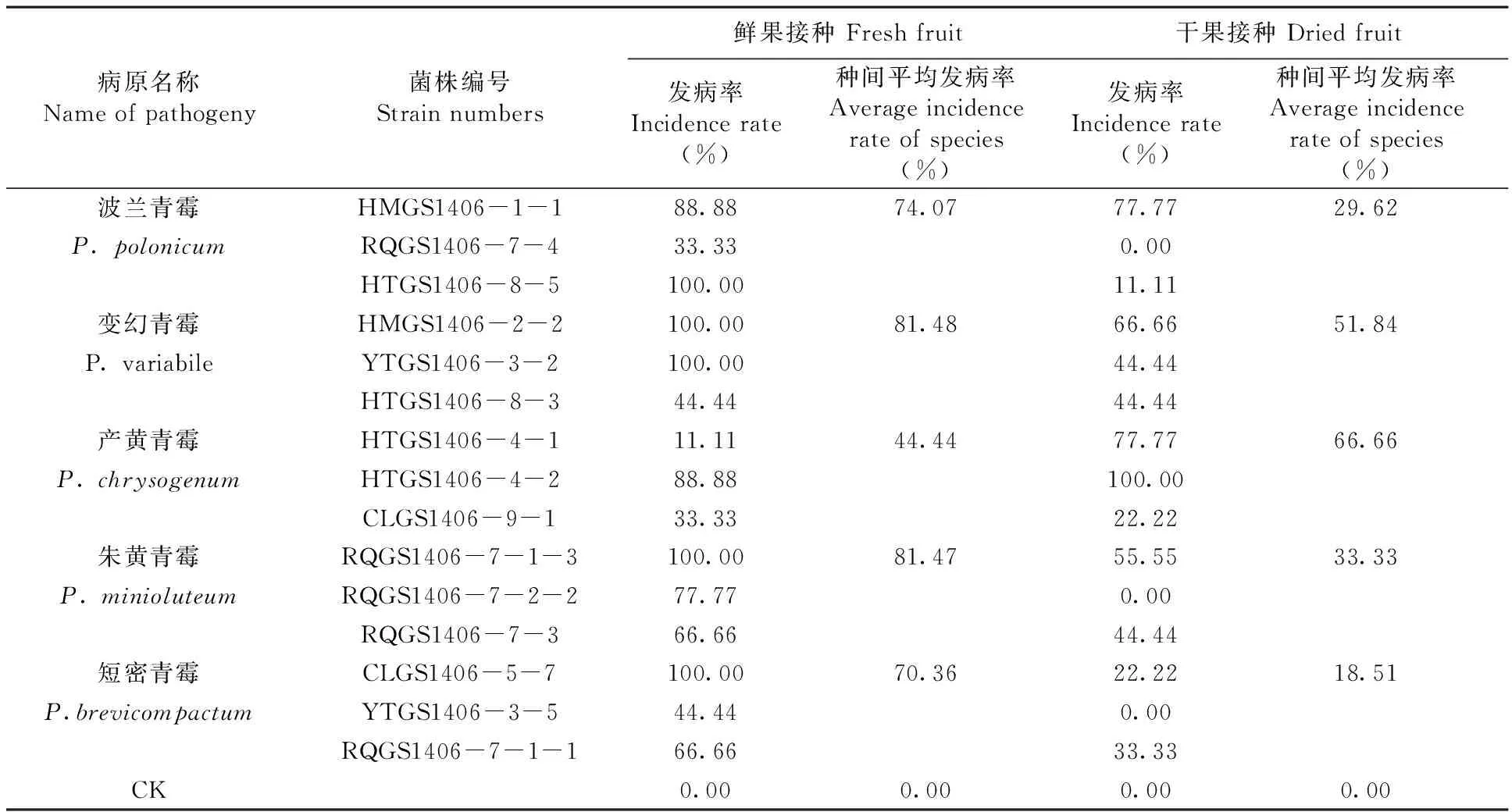
病原名称Nameofpathogeny菌株编号Strainnumbers鲜果接种Freshfruit干果接种Driedfruit发病率Incidencerate(%)种间平均发病率Averageincidencerateofspecies(%)发病率Incidencerate(%)种间平均发病率Averageincidencerateofspecies(%)波兰青霉HMGS1406-1-188.8874.0777.7729.62P.polonicumRQGS1406-7-433.330.00HTGS1406-8-5100.0011.11变幻青霉HMGS1406-2-2100.0081.4866.6651.84P.variabileYTGS1406-3-2100.0044.44HTGS1406-8-344.4444.44产黄青霉HTGS1406-4-111.1144.4477.7766.66P.chrysogenumHTGS1406-4-288.88100.00CLGS1406-9-133.3322.22朱黄青霉RQGS1406-7-1-3100.0081.4755.5533.33P.minioluteumRQGS1406-7-2-277.770.00RQGS1406-7-366.6644.44短密青霉CLGS1406-5-7100.0070.3622.2218.51P.brevicompactumYTGS1406-3-544.440.00RQGS1406-7-1-166.6633.33CK0.000.000.000.00
3 讨 论
青霉属中有多个种是引起枣果霉烂的主要病原菌。在研究中鉴定出的5种青霉菌中,波兰青霉为优势菌种,分离频率最高,致病性较强;变幻青霉为5种青霉菌中致病力最强的种,对鲜果和干果的致病率最大;但需要说明的是,由于每种青霉菌中仅选用了3个代表菌株,且菌株间的致病差异很大,因而5种青霉菌的致病力比较会在一定程度上受到菌株选择的影响,该5种青霉菌对枣果的致病力更为准确的比较,需要选择更多的菌株并设置更多的重复进行比较。
青霉属病原菌的菌落大多呈灰绿色或蓝绿色,通常较难准确描述和仔细区分;根据分生孢子形态、大小、分生孢子梗以及菌落形态来进行种的分类,也存在由于培养性状的可变性及形态特征的交叉带来的疑难,所以,应用病原形态学的方法鉴定植物病原真菌存在需要经验以及用时较长等一系列的问题[ 9]。已有的研究表明ITS在真菌的种间存在着丰富的变异,而在种内不同菌株间却高度保守,可以为真菌的系统发育和分类鉴定提供丰富的遗传信息[10,11]。
根据相关报道,波兰青霉、变幻青霉、产黄青霉、朱黄青霉、短密青霉等多种病菌,也是引起柑橘、苹果、梨等许多果蔬贮藏期病害的病原[12,13]。目前国内外对引起枣果实霉烂病的青霉菌的报道很少,研究结果与以往报道的冬枣霉烂病青霉属病原菌种类有所不同[14],其原因可能是病原菌对不同枣品种的侵染力不同,以及地理环境、管理水平和气候条件等方面的差异,从而导致引起枣霉烂病的青霉属病原菌种类存在一定的差异;此外,不同地区因长期使用不同化学药剂,也可能致使分离所得病原菌种类有所不同。
4 结 论
引起新疆枣果霉烂病的青霉菌有波兰青霉、变幻青霉、产黄青霉、朱黄青霉、短密青霉5种。其中波兰青霉为分离频率最高,致病性较强的优势菌种,变幻青霉为5种青霉菌中致病力最强的种。
References)
[1] 魏天军,魏象廷.中国枣果实病害研究进展[J].西北农业学报,2006,15(1):88-94.
WEI Tian-jun,WEI Xiang-ting.(2006).Advances in Research on Diseases of Chinese Jujube Fruits (ZizyphusjujubeMill.) [J].ActaAgriculturaeBoreali-occidentalisSinica,15(1):88-94.(in Chinese)
[2] 刘孟军.枣属植物分类学研究进展[J].园艺学报,1999,26(5):302-308.
LIU Meng-jun.(1999).Advances in Taxonomy Study on the Genus Ziziphus [J].ActaHorticultureaSinica,26(5):302-308.(in Chinese)
[3] 魏天军.枣果采后生理特性与保鲜贮藏技术研究进展[J].宁夏农业科技,2005,(4):29.
WEI Tian-jun.(2005).Advances of Research on Postharvest Physiology and Storage Technology of JZizyphusjujubeFruits [J].NingxiaAgriculturalSciencesandTechnoligy,(4):29.(in Chinese)
[4] 秦文,柴全喜.枣烂果病的综合防治[J].果农之友,2014,(8):26.
QIN Wen,CHAI Quan-xi.(2006).Zizyphus jujube Fruits mildew pathogen and prevention [J].FruitGrowers`Friend,(8):26.(in Chinese)
[5] 张晓申.枣烂果病的种类和防治措施[J].北京农业,2008,(9):31.
ZHANG Xiao-shen.(2008).The type ofZizyphusjujubeFruits mildew pathogen and prevention measures [J].BeijingAgriculture,(9):31.(in Chinese)
[6] 方中达.植病研究方法[M].(第三版)北京:中国农业出版社,1998.
FANG Zhong-da.(1998).ResearchMethodofPlantPatholigy[M].(3rd Ed.) Beijing:China Agriculture Press.(in Chinese)
[7] 魏景超.真菌鉴定手册[K].上海:上海科学技术出版社,1979:501-512.
WEI Jing-chao.(1979).ManualfortheIdentificationofFungus[K].Shanghai:Shanghai Science Technology Press:501-512.(in Chinese)
[8] 孔华志.中国真菌志(第三十五卷)青霉属及其相关有性型属[M].科学出版社,2007.
KONG Hua-zhi.(2007).FloraFungorumSinicorumPenicilliumetTeleomorphiCognati(vol.35) [M].Science Press.(in Chinese)
[9]J.I. Pitt, R.A. Samson.(1993).Names in current use in the family Trichocomaceae, Cladoniaceae, Pinaceae, and Lemnaceae [J].Koeltz Scientific Books,13-57.
[10]闵晓芳,邓伯勋,陈丽锋,等.柑橘采后致病青霉的鉴定[J].果树学报,2007,24(5):653-656.
MIN Xiao-fang,DENG Bo-xun,CHENG Li-feng, et al.(2007).Molecular identification of Penicillium species causing post- harvest diseases of Citrus fruits[J].JournalofFruitScience,24(5):653-656.(in Chinese)
[11] Bailey, J. A., Nash, C., Morgan, L. W., O'connell, R. J., & TeBeest, D. O. (1996). Molecular taxonomy of Colletotrichum species causing anthracnose on the Malvaceae.Phytopathology, 86(10):1,076-1,083.
[12] Martínez-Culebras, P. V., Barrio, E., García, M. D., & Querol, A. (2000). Identification of Colletotrichum species responsible for anthracnose of strawberry based on the internal transcribed spacers of the ribosomal region.FEMSmicrobiologyletters, 189(1):97-101.
[13] Yu, T., Li, H. Y., & Zheng, X. D. (2007). Synergistic effect of chitosan and Cryptococcus laurentii on inhibition of Penicillium expansum infections.Internationaljournaloffoodmicrobiology, 114(3):261-266.
[14] Zhang, H., Zheng, X., & Yu, T. (2007). Biological control of postharvest diseases of peach with Cryptococcus laurentii.FoodControl, 18(4):287-291.
[15] 吴兴梅,孙蕾,刘元铅,等.冬枣贮藏期主要病害的研究[J].经济林研究,2003,21(2):19-22.
WU Xing-mei,SUN Lei,LIU Yuan-qian,et al.(2003).Research on Main Diseases in Winter Jujube Storage Time[J].NonwoodForestResearch,21(2):19-22.(in Chinese)
Fund project:Supported by science and technology planning projects of Xinjiang Uygur Autonomous Region "Research, integration and demonstration of the key technology of high efficiency and safety production of Xinjiang featured fruit tress" (201130102)
Identification of the Pathogen Causing Jujube Fruit Mildew (Part Ⅱ) -Isolation and Identification ofPenicilliumfungus Causing Jujube Fruit Mildew
Shanawaer Semaiti1,Yushanjiang Maimaiti2,GUO Qing-yuan1,BAI Jian-yu1
(1.CollegeofAgronomy,XinjiangAgriculturalUniversity,Urumqi830052,China;2.ResearchInstituteofPlantProtection,XinjiangAcademyofAgriculturalSciences,Urumqi830091,China)
【Objective】 The Jujube fruit mildew is the major disease of dried jujube fruits,andPenicilliumspp. is one of important pathogenic fungus causing jujube fruits mildew.Clarifying pathogen species and advantaged species of jujube fruits mildew in Xinjiang is significantly important to control the occurrence and damage of this diseases.【Method】Tissue isolation,morphological analysis and molecular analysis were used in accurate identification ofPenicilliumfungus of jujube fruits mildew.At the same time,artificial vaccination was used for pathogenicity comparison.【Result】The results showed that majority of single spore isolates ofPenicilliumspp. fom jujube fruit have got pathogenicity to jujube fruit.The identification result demonstrated that 50 mono-spore fungus ofPenicilliumspp. had pathogenicity belonging to five major species,which wereP.polonicum,P.brevicompactum,P.vaeiabile,P.minioluteumandP.minioluteum.Among them, the highest isolate rate wasP.polonicum,which was the advantage species ofPenicilliumfungus;The pathogenicity comparison displayed that P. vaeiabile was the most virulent species in 5 species ofPenicilliumfungus.【Conclusion】There are five species ofPenicilliumspp. which cause jujube fruits mildew in Xinjiang, among which advantaged pathogenetic fungus isP.polonicum,andP.vaeiabileis the most virulent pathogenic species of jujube fruit mildew in Xinjiang.
jujube;fruits mildew;Penicillium;pathogen identification
10.6048/j.issn.1001-4330.2016.04.015
2015-11-18
新疆维吾尔自治区科技计划项目“新疆特色果树高效安全生产关键技术研究集成与示范”(201130102)
沙娜瓦尔·色买提(1990-),女,新疆和田人,硕士研究生,研究方向为植物病理学,(E-mail)senever352@163.com
郭庆元(1962-),男,四川人,教授,博士生导师,研究方向为植物病理学,(E-mail)guoqingyuan3009@sina.com
S463.65
A
1001-4330(2016)04-0698-08

