响应面法优化酶解猪血制备血红素工艺
张崟,刘文龙,熊伟,宋俊霖,王新惠,王卫
(成都大学/四川省肉类加工重点实验室,四川成都610106)
响应面法优化酶解猪血制备血红素工艺
张崟,刘文龙,熊伟,宋俊霖,王新惠,王卫*
(成都大学/四川省肉类加工重点实验室,四川成都610106)
为了提高从猪血中制备血红素的得率,并获得胰蛋白酶水解猪血制备血红素的最优工艺,本文以猪血为原料,采用胰蛋白酶水解猪血,并对酶解工艺采用响应面法进行优化。结果发现,加酶量、酶解温度、酶解pH均对血红素的得率有显著(P<0.05)影响,水解时间对血红素得率的影响不显著(P>0.05)。拟合模型的显著性分析及可靠性验证结果显示,所得模型能较好地反映各因素与血红素得率的相关性(R2=0.987),得出加酶量412.5 U/mg、酶解温度45℃、pH 5、酶解时间5.5h时,血红素的得率最高,对应的血红素得率为79.45%(质量分数),实测得率为76.3%±1.97%(质量分数)。
血红素;酶解;猪血
猪血是生猪屠宰加工主要的副产物之一。尽管猪血的营养物质含量丰富,但由于其血腥味较重、适口性差等缺点,导致回收利用较少[1]。这不仅造成资源的巨大浪费,而且也带来严重的环境污染问题。因此,开发猪血的综合利用技术是目前畜禽屠宰业急需解决的技术难题。血红素是猪血中具有很高食用和药用价值的物质。血红素可被肠黏膜细胞直接吸收而不会造成损伤,可用于补铁类功能性食品加工[2-3]。血红素还是治疗恶性肿瘤的卟啉类药物和治疗肝炎的原卟啉二钠盐的前体物质[4]。美国FDA早在1983年就批准氯化血红素作为药品使用,我国于1998年正式批准以血红素为基本原料的血卟啉为抗肿瘤新药[5]。血红素也是制备胆红素的前体物质,可作为人工牛黄的间接来源[6]。血红素在肉制品工业中可作为发色剂及人工色素替代品[7]。因此,近年来从畜禽血中提取血红素成为畜禽血回收利用的新亮点。
目前提取血红素的方法主要有酶解法、有机溶剂法、CMC法及表面活性剂法,其中酶解法被认为是最环保的一种提取血红素的方法[6]。In等采用肽链外切和内切酶水解血红蛋白制备血红素肽,酶解液超滤后血红素与肽的比值达25.4%[8];杨锡洪等先用中性蛋白酶酶解血红蛋白,再用风味酶水解,酶解液经10 kDa和3 kDa超滤膜超滤,获得亚铁血红素与肽的比值达9.92%[9]。瞿桂香等采用正交试验法优化中性蛋白酶水解猪血制备亚铁血红素肽工艺,得出加酶量8 000 U/g、反应pH 7.5、温度55℃、底物质量分数8%、水解1 h时,血红素提取效果最好[7]。张亚娟选用不同蛋白酶对猪血红细胞粉进行水解,得出胰蛋白酶和碱性蛋白酶水解对血红素提取效果较好[10]。朱媛媛采用正交试验法对碱性蛋白酶水解牛血红蛋白制取亚铁血红素工艺进行优化,得出当碱性蛋白酶水解时,底物浓度7%、加酶量1%、pH 8、酶解2 h时血红素得率最高为10.87 mg/mL;风味酶水解时,pH 6.5、加酶量2%、酶解2 h血红素得率最高为11.18 mg/mL[11-12]。研究发现在酶解工艺优化时采用响应面法的优化结果优于正交试验法[13],而以往对酶解血红蛋白制备血红素工艺的优化主要采用正交试验法[10-12],而且目前国内外对采用胰蛋白酶水解血红细胞粉制备血红素工艺的研究较少。因此,为了获得更高效的酶解制备血红素工艺,本文探讨了采用胰蛋白酶水解猪血血红细胞粉制备血红素的工艺,并采用响应面法对水解工艺进行优化,以期为工业化提取血红素提供参考。
1 材料与方法
1.1材料、试剂与仪器
新鲜猪血:四川省欣康率食品有限公司;胰蛋白酶(酶活力1 000 U/mg):上海缘聚生物科技有限公司;分析纯柠檬酸、磷酸氢二钠:成都市科龙化工试剂厂;三羟甲基氨基甲烷(Tris)(分析纯):美国Sigma公司。
SHA-CA型水浴恒温振荡器:金坛市金南仪器制造有限公司;ZFD-A5140型鼓风干燥机:上海智成分析仪器制造有限公司;FD-1A-50型真空冷冻干燥机:上海比朗仪器制造有限公司;DR6000紫外可见分光光度计:安庆昌嘉电子产品贸易有限公司;海尔BCD-182STPA冰箱:青岛海尔集团公司。
1.2方法
1.2.1原料处理
新鲜猪血中加入0.314%(质量分数)柠檬酸三钠,充分混匀,然后在2h内将其在3500r/min下离心15min,去除上清液,收集离心管底部的血红细胞。将收集的血红细胞置于海尔BCD-182STPA冰箱于-18℃冻结。冻结的血红细胞采用FD-1A-50型真空冷冻干燥机在-50℃,10 kPa条件下干燥至恒重后备用。
1.2.2血红素制备工艺
冻干血红细胞粉→过100目筛→缓冲溶液溶解→预热至酶解温度→酶解→灭酶→测定血红素浓度
1.2.3缓冲液制备
酶解时酶解液pH的调节采用磷酸氢二钠-柠檬酸缓冲溶液(pH范围2.2~8)和Tris-盐酸(pH范围7.2~9.0)缓冲溶液。
1.2.4单因素酶解试验
1.2.4.1加酶量对血红素得率的影响
取0.2 g冻干的血红细胞,按料液比1∶100(g/mL)溶于20 mL的柠檬酸和磷酸氢二钠缓冲液(pH为7),将其置于已升温至37℃的SHA-CA型水浴振荡器中,以80 r/min振荡30 min,使混合温度升至37℃,然后按0、150、300、450、600、750 U/mg分别加入胰蛋白酶,恒温酶解3 h。酶解后取出锥形瓶,置于DZKW-4电子恒温水浴锅在85℃水浴锅内灭酶15 min。然后测血红素得率。
1.2.4.2反应温度对血红素得率的影响
取0.2 g冻干的血红细胞,按料液比1∶100(g/mL)溶于20 mL pH 7缓冲液,将其置于SHA-CA型水浴振荡器中,分别在30、33、36、39、42、45℃,以80 r/min振荡30 min,使混合液温度升至设定温度,然后按1.2.4.1获得的最高血红素得率对应的胰蛋白酶用量添加胰蛋白酶,恒温酶解3 h。酶解后取出锥形瓶,置于DZKW-4电子恒温水浴锅在85℃水浴锅内灭酶15 min。然后测血红素得率。
1.2.4.3反应pH对血红素得率的影响
取0.2 g冻干的血红细胞,按料液比1∶100(g/mL)溶于20 mL pH分别为5、6、7、8、9的缓冲液,将其置于SHA-CA型水浴振荡器中,在1.2.4.2获得的最高血红素得率对应的水解温度下,以80 r/min振荡30 min,使混合温度升至设定温度,然后按1.2.4.1获得的最高血红素得率添加胰蛋白酶量,恒温酶解3 h。酶解后取出锥形瓶,置于DZKW-4电子恒温水浴锅在85℃水浴锅内灭酶15 min。然后测血红素得率。
1.2.4.4反应时间对血红素得率的影响
取0.2 g冻干的血红细胞,按料液比1∶100(g/mL)溶于20 mL缓冲液,在1.2.4.1、1.2.4.2、1.2.4.3得到的最高血红素得率对应的加酶量、酶解温度和pH下,分别酶解1、2、3、4、5、6 h,酶解前先预热酶解液至酶解温度后再加酶。酶解后取出锥形瓶,置于DZKW-4电子恒温水浴锅在85℃水浴锅内灭酶15 min。然后测血红素得率。
1.2.5血红素含量测定
血红细胞酶解后血红素含量的测定采用张亚娟建立的分光光度法对血红素含量进行定量[10]。通过在波长383 nm处测定血红素的吸光度,利用已建立的血红素吸光度与血红素浓度的关系式,计算血红素含量。
1.2.6血红素得率
根据测得的酶解后血红素含量和原血粉中血红素的含量计算血红素的得率[10]。血红素得率计算式如下:

式中:Y为血红素得率,%;mHeme为提取的血红素质量,g;m血红素总量为所用血红细胞干粉中血红素的总质量,g。
1.2.7响应面设计
采用4因素、5中心、1响应、31次试验的中心旋转设计,对胰蛋白酶水解工艺条件进行分析和优化[14]。因素编码及因素水平见表1。

表1 因素编码及各因素水平Table 1Coded level of experiment factors
1.2.8数据分析
试验中血红素含量测定均做3次平行测定。试验数据采用Excel 2010求平均值、计算标准误差并绘图。采用SAS 9.0软件设计响应面试验方案,并对试验数据进行拟合和优化分析。
2 结果与讨论
2.1单因素试验
2.1.1加酶量对血红素得率的影响
加酶量对血红素得率的影响见图1。
图1中数据显示,随着加酶量的增加,血红素得率呈先增加后减少的趋势。加酶量为600 U/mg时血红素得率显著(P<0.05)高于其他加酶量;加酶量为450 U/mg时血红素的得率显著(P<0.05)高于加酶量为300 U/mg;加酶量为750 U/mg时血红素的得率与加酶量为900 U/mg时的血红素得率无显著差异(P<0.05)。因此,选择加酶量在450 U/mg~750 U/mg之间作为优化试验的加酶量取值范围。

图1 加酶量对血红素得率的影响Fig.1Effect of enzyme amount on extract ratio of heme
猪血血红细胞干物质中血红蛋白含量98.09%[15]。血红蛋白由蛋白质和辅基两部分组成,蛋白质部分为珠蛋白,辅基部分为血红素[7]。当加酶量增加时,酶与底物比增加,更多的珠蛋白被分解,血红素被释放;但是当加酶量过多时,导致血红蛋白的蛋白质过度分解,致使释放的血红素与酶解肽混合而难以分离。这可能是导致血红素得率随着加酶量的增加呈现先增加后减少趋势的主要原因。
2.1.2酶解温度对血红素得率的影响
酶解温度对血红素得率的影响见图2。
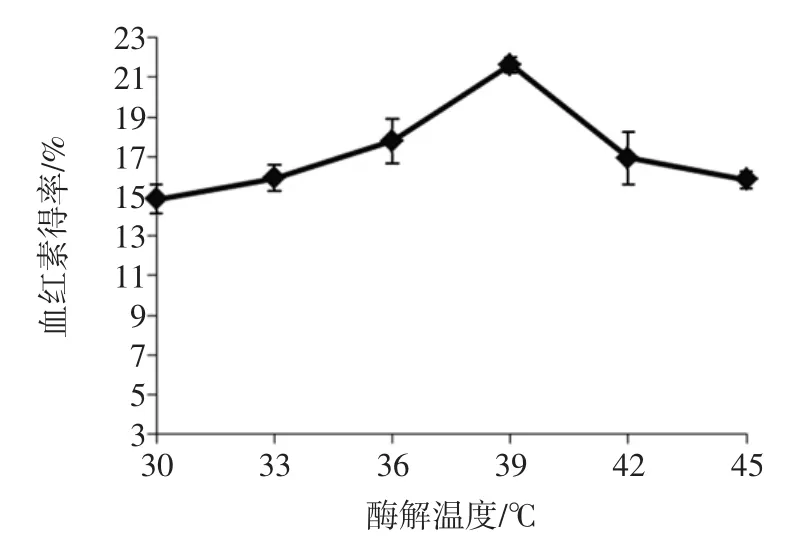
图2 酶解温度对血红素得率的影响Fig.2Effect of hydrolysis temperature on extract ratio of heme
图2中曲线的分布趋势表明,随着酶解温度的增加,血红素得率呈现先增加后降低趋势;当酶解温度为39℃时,血红素的得率显著(P<0.05)高于其他温度。温度为36℃和42℃时血红素的得率均显著(P<0.05)低于39℃时血红素的得率。因此,选择36℃~42℃温度区间为优化试验的温度取值范围。
酶在作用于底物时,有最适的作用温度[16]。这可能是胰酶水解血红细胞提取血红素时,血红素得率随酶解温度增加呈先增加后减小趋势的主要原因。类似现象在碱性蛋白酶水解血红蛋白提取血红素的单因素试验中出现[10,17]。
2.1.3酶解pH对血红素得率的影响
pH对血红素得率的影响见图3。
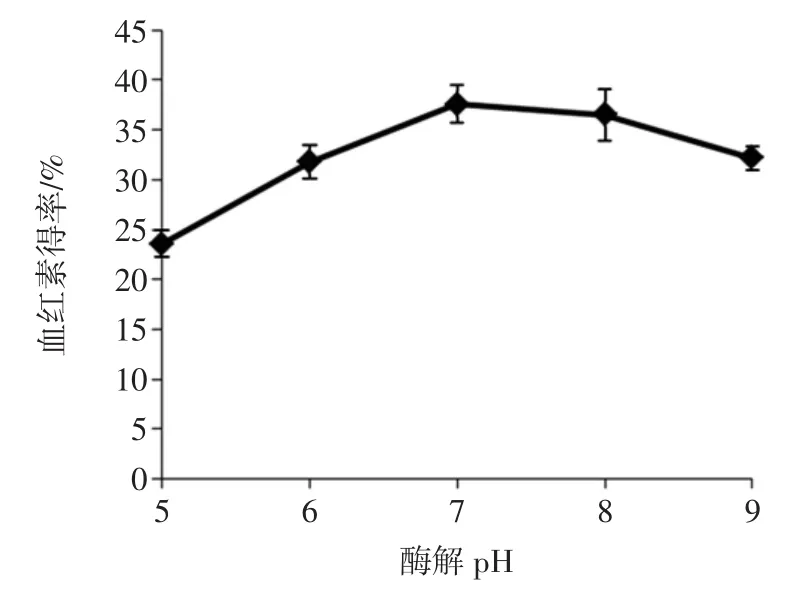
图3 酶解pH对血红素得率的影响Fig.3Effect of hydrolysis pH on extract ratio of heme
图3中数据显示,pH对血红素得率有显著(P< 0.05)影响。当pH为7时,血红素的得率显著(P<0.05)高于pH 6和pH 9时的得率,但与pH 8时的得率无显著差异(P>0.05)。因此,选择pH 6~8作为优化试验的pH取值范围。
胰酶水解蛋白质时有最适的pH,而且该pH受其他酶解条件影响而发生变化,如底物种类、酶解温度、加酶量、酶解时间等。文献报道胰蛋白酶水解海参制备肽时的pH为8[18];胰蛋白酶水解制备蛤蟆油蛋白时的最适pH为4.5[19]。海参与蛤蟆油蛋白的性质不同,前者主要是胰蛋白酶与海参蛋白质间的相互作用,而后者在酶解的同时还要利用低酸性条件使脂肪酸与蛋白质分离再酶解。由此可见,底物的性质对酶解pH的影响很大。
2.1.4酶解时间对血红素得率的影响
酶解时间对血红素得率的影响见图4。
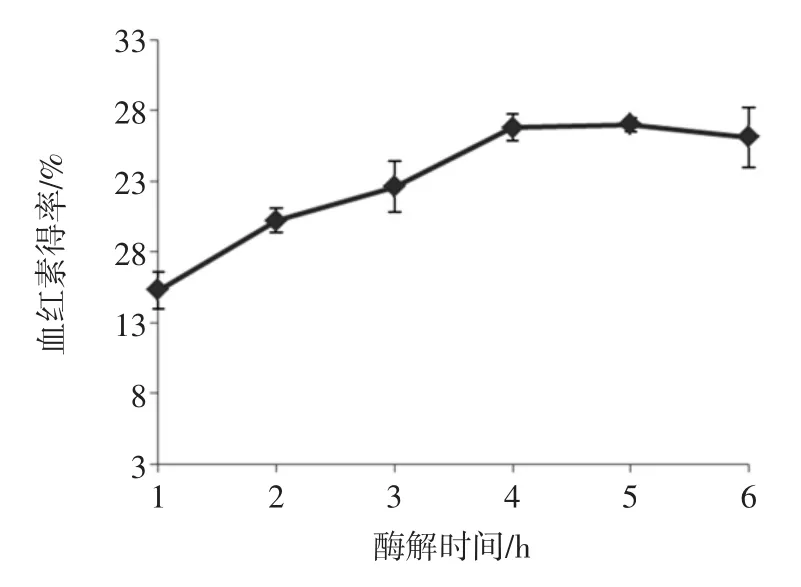
图4 酶解时间对血红素得率的影响Fig.4Effect of hydrolysis time on extract ratio of heme
图4中数据显示,随着酶解时间增加,血红素得率呈现逐渐增加趋势,当酶解时间达4 h以后,血红素的得率提高不显著(P>0.05),趋于恒定。水解3 h时血红素的得率显著(P<0.05)低于4、5 h和6 h时的得率。因此,在响应面优化水解工艺时,选择提取时间范围为4 h~5 h。
随着酶解时间的增加,酶作用于底物的时间也增加。因而会使血红蛋白更多地被分解,进而释放出辅基血红素。但是在加酶量和底物浓度一定的条件下,随着水解时间增加,水解产生的血红素量会趋于恒定,加之水解产生多肽使血红素的分离纯化难度增加。因而导致血红素的得率增长缓慢。这可能是随着酶解时间的增加,血红素得率趋于稳定的主要原因。类似现象在碱性蛋白酶水解猪血红蛋白提取血红素的单因素试验中出现[10]。
2.2酶解工艺的响应面法优化
2.2.1优化试验方案及试验结果
为了进一步获得最优的胰蛋白酶水解提取血红素工艺,在单因素试验确定的加酶量、酶解温度、pH和酶解时间取值范围基础上,采用中心旋转设计法对响应面试验方案进行了设计。所得试验方案及试验结果见表2。

表2 响应面试验方案及试验结果Table 2Response surface plan and experiment results
对表2中各因素与血红素得率进行拟合,所得拟合方程见式1。

式中:Y表示血红素得率,%;X1表示加酶量,U/mg;X2表示酶解温度,℃;X3表示酶解pH;X4表示酶解时间,h。
2.2.2拟合显著性分析
对拟合模型(式1)及拟合模型中各因素对血红素得率影响的显著性进行分析,结果见表3。

表3 数学模型的显著性分析Table 3Significant analysis of relativity model
由表3所得显著性分析结果显示,P主模型=0.000 1<0.05,P失拟项=0.142 412>0.05,且拟合相关性系数的平方(R2)=0.987。由此可知,所得模型具有较高的显著性,能够有效反映各因素与血红素得率的关系。PX1(加酶量)= PX2(酶解温度)=PX3(pH)=0.000 1<0.05,由此可知,酶解温度、pH及加酶量均对血红素得率有显著影响,而且影响程度相近。PX4(酶解时间)=0.395 041>0.05,因此酶解时间对血红素得率的影响不显著。
2.2.3拟合模型的可靠性验证
为了进一步验证拟合模型(式1)的可靠性,以获得可靠的最优酶解工艺,对拟合模型的计算结果与实测结果进行对比,所得结果见表4。

表4 拟合模型在预测血红素得率时的有效性验证Table 4Effectiveness of relativity model in predicting the extract ratio of hemoglobin
表4中的实测血红素得率(Y实)与计算血红素得率(Y计)相对误差显示,相对误差值均小于10%。由此可见,所得模型具有较好的可靠性,可用于试验优化以获得最优的酶解工艺条件。
2.3酶解工艺优化
以式1拟合模型为依据,对最优的酶解工艺条件进行优化,得出加酶量412.5 U/mg、酶解温度45℃、pH 5、酶解时间5.5 h时,血红素的得率最高,对应的血红素得率为79.45%(质量分数)。通过再次对优化工艺进行试验验证,得出实测血红素得率为76.3%±1.97%(质量分数)。与优化得到的最优值79.45%比较,相对误差为3.96%。因此,加酶量412.5 U/mg、酶解温度45℃、pH 5、酶解时间5.5 h为制备血红素的最优酶解工艺。
加酶量、酶解温度及pH,酶解时间对血红素得率的影响也可以通过响应面图看出(图5)。图中血红素得率的变化趋势显示,随着加酶量、酶解温度及pH的变化,血红素得率的变化程度均较随酶解时间变化大。由此可见,在用胰蛋白酶水解血红细胞粉制备血红素时,应严格控制加酶量、酶解温度及pH,以获得理想的酶解效果。
3 结论

图5 酶解因素与血红素得率的响应面图Fig.5Response Surface of the optimized extract ratio of serum protein
采用响应面法优化胰蛋白酶水解血红细胞提取血红素工艺的结果显示,加酶量、酶解温度、酶解pH均对血红素的得率有显著(P<0.05)影响;酶解时间对血红素得率的影响不显著(P>0.05)。拟合模型的显著性分析及可靠性验证结果显示,所得模型能较好地反映酶解各因素与血红素得率的相互关系(R2=0.987)。根据所得的拟合模型,对胰蛋白酶水解血红细胞粉提取血红素的工艺进行优化,得出加酶量412.5 U/mg、酶解温度45℃、pH 5、酶解时间5.5 h时血红素的得率最高,对应的优化血红素得率为79.45%,实测得率为76.3%±1.97%。
[1]王洪江,谢跻,柳婷,等.猪血的综合开发与应用研究进展[J].肉类研究,2009(12):81-83
[2]李美良,蒲彪,赵广华.铁蛋白:一种新型矿质元素营养强化剂载体[J].食品科学,2014,35(13):326-328
[3]MIQUEL E,FARRÉ R.Effects and future trends of casein phosphopeptides on zinc bioavailability[J].Trends in Food Science&Technology,2007,18(3):139-143
[4]周淡宜,徐水祥,江月仙.血红素纯化技术研究[J].药物生物技术,2004,11(3):181-183
[5]张爱华.高纯度血红素的制备[J].中国医药工业杂志,1993,24(1):4-5
[6]宋照军,张延生,刘玺,等.猪血中血红素提取纯化新技术研究[J].肉类工业,2004(8):23-25
[7]瞿桂香,黄耀江,董明盛.血红素制备工艺研究进展[J].中央民族大学学报(自然科学版),2007,16(1):19-22
[8]IN M J,CHAE H J,OH N S.Process development for heme-enrichedpeptideby enzymatic hydrolysis of hemoglobin[J].Bioresource Technology,2002,84:63-68
[9]杨锡洪,夏文水.酶法水解血红蛋白制备亚铁血红素肽[J].食品与机械,2005,21(3):14-18
[10]张亚娟.从猪血中酶法制取血红素的研究[D].无锡:江南大学,2007
[11]朱媛媛.亚铁血红素的酶法制备及功能特性研究[D].长春:吉林大学,2011
[12]GUO Y X,PAN D D,TANOKUR M.Optimisation of hydrolysis conditions for the production of the angiotensin-I converting enzyme(ACE inhibitory peptides from whey protein using response surface methodology[J].Food Chemistry,2009,114:328-330
[13]张崟,王卫,张佳敏,等.响应面法和正交试验对骨素酶解工艺优化的比较[J].食品研究与开发,2012,33(7):53-56
[14]JOHN A R.Mathematical Statistics and Data Analysis[M].3rd Edition.Belmont:Thomson Higher Education,1994:240-253
[15]TOLDRÀ M,DÀVILA E,SAGUER E,et al.Functional and quality characteristics of the red blood cell fraction from bio-preserved porcine blood as influenced by high pressure processing[J].Meat Science,2008,80(2):380-388
[16]郑宝东.食品酶学[M].南京:东南大学出版社,2006:88-89
[17]李斌,章梁,黄泽元.酶解猪血制备血红素工艺的研究[J].食品与机械,2009,25(6):153-156
[18]刘程惠,董秀萍,赵露露,等.胰蛋白酶酶解法制备海参肽的工艺条件[J].大连轻工业学院学报,2006,25(2):83-85
[19]周光新,张鹤,董颖,等.胰蛋白酶酶解法制备蛤蟆油蛋白工艺的研究[J].食品科技,2013,38(10):236-239
Process Optimization of Preparing Heme from Pig Blood by Enzymatic Hydrolysis with Response Surface Method
ZHANG Yin,LIU Wen-long,XIONG Wei,SONG Jun-lin,WANG Xin-hui,WANG Wei*
(Chengdu University,Key Laboratory of Meat Processing of Sichuan,Chengdu 610106,Sichuan,China)
In order to improve extracting ratio of heme from pig blood,and obtain an optimal process of heme preparation by trypsin hydrolysis,the pig blood was taken as raw material,trypsin was adopted to hydrolyze the red blood cell,and the hydrolysis process was optimized using response surface method.Results showed that the extraction ratio of the heme was significantly(P<0.05)affected by the amount of trypsin,hydrolysis temperature,and hydrolysis pH,the extraction ratio of the heme was not significantly(P>0.05)influenced by hydrolysis time.The significance analysis of the fitting model and the results of reliability confirmation indicated that the obtained fitting model correlated the factors and the extraction ratio of heme well(R2=0.987).Results showed that the heme extraction ratio was the highest with the amount of trypsin of 412.5 U/mg,enzyme temperature of 45℃,pH of 5,hydrolysis time of 5.5 h.The corresponding heme extraction ratio was 79.45%(mass fraction),the confirmed heme extraction ratio was 76.3%±1.97%(mass fraction).
heme;enzymolysis;pig blood
10.3969/j.issn.1005-6521.2016.20.024
四川省教育厅重点项目(14ZA0320);自然科学基金青年基金(31501505)
张崟(1981—),男(汉),副教授,博士,从事肉品加工及副产物利用方面的研究。
王卫(1958—),男(汉),教授,硕士,从事肉品加工方面的研究。
2015-12-11

