干细胞在软骨再生中的应用
王明杰 ,刘舒云 ,郭维民,张雨,彭江,卢世璧,郭全义
干细胞在软骨再生中的应用
王明杰 ,刘舒云 ,郭维民,张雨,彭江,卢世璧,郭全义
软骨损伤是最常见的膝关节疾病之一。由于软骨无血管、神经、淋巴组织,营养成分主要来自膝关节的滑液,这些组织学的特点使得软骨损伤的自我修复能力极为有限。创伤性的软骨损伤和早期的骨性关节炎(OA)会引起患者关节的疼痛和肿胀,若损伤不予处理则会加速关节的退变,引起更严重的功能障碍。软骨损伤以及后续的关节退变给患者生活带来极大的不便,同时软骨损伤作为长期和慢性的疾病也消耗着大量的医疗资源。然而,随着组织工程相关再生医学的发展,使得软骨损伤的修复得以实现[1]。
组织工程技术主要包括种子细胞、支架材料和细胞因子等,其中种子细胞是影响修复效果的重要因素之一。自体软骨细胞移植(ACI)技术在修复软骨损伤中应用广泛且临床效果肯定,因此自体的软骨细胞被认为是组织工程软骨种子细胞的“金标准”。但自体软骨细胞在临床中的应用存在着许多待解决的问题:①由于自体软骨细胞的供区面积有限,为了满足修复所需的细胞数量,在移植之前需要将细胞在体外单层扩增培养,然而在培养过程中会出现软骨细胞的去分化,导致软骨细胞表型丢失。去分化的软骨细胞在再生修复过程中易生成质量较差的纤维软骨,而非透明软骨。纤维软骨生物力学特性差,无法达到经久耐用的效果。②自体软骨细胞移植需要二次手术,患者难以接受复杂的治疗过程。③获取自体软骨细胞的健康供区虽然是膝关节非负重区的位置,但也存在供区破坏所导致的一系列风险。虽然“3D”或添加细胞因子的体外培养条件,能够减少软骨细胞表型的丢失,但损伤供区健康软骨和二次手术的问题仍然使得自体软骨细胞修复软骨损伤的临床应用受到很多限制[2-3]。
干细胞根据发育潜能可分为全能干细胞(totipotent stem cells,TSCs)、多能干细胞(induced pluripotent stem cells,iPSs)和单能干细胞(unipotent stem cells,USCs)。由于干细胞的自我更新复制和多项分化的潜能,使得干细胞在组织再生领域得到了广泛关注。同时由于软骨组织不可自我修复的特性,也使得干细胞在软骨组织再生领域的研究越来越多,且间充质干细胞(mesenchymal stem cells,MSCs)相关的研究已经在临床中得到了应用[4]。关注干细胞在软骨再生领域的发展,利于提供一些软骨再生的修复策略。
1 软骨祖细胞与软骨细胞的特点
基于软骨细胞表面存在不断损伤修复的理论[5],软骨祖细胞(cartilage derived progenitor cells,CDPCs)最先由Dowthwaite 等在 2007 年提出,并在研究中发现该细胞群对于纤维连接蛋白具有较高的亲和性,集落形成能力较强,同时表达细胞命运选择基因 Notch 1。另有研究报道,在晚期骨性关节炎患者的软骨中发现软骨祖细胞的存在[6],该研究结果展示了软骨祖细胞具有较好的成软骨能力、具有向损伤区的软骨组织趋化的特性、具有下调成骨转录因子 Run-2和上调成软骨转录因子 Sox-9 的特性以及增加细胞外基质合成的特性。先前的研究结果证明软骨干细胞仅存在于软骨组织的表层[5,7],2014 年,Yu 等[8]发现软骨组织的深层同样有软骨祖细胞的存在。在软骨祖细胞数量方面,表层 1/3区域多于深层 2/3 的区域,但不同区域的软骨祖细胞具有向不同组织系分化的不同基因表达特性,这种特性对于维持关节软骨内在的稳态具有重要的意义。近年来有研究表明:软骨祖细胞与软骨细胞相比较,过度表达白介素趋化因子-8(IL-8)和 C-C 基配体-2(CCL-2)。软骨祖细胞过度表达的趋化因子使得免疫细胞集聚,从而在软骨的损伤与修复过程中起到调节炎症反应的作用。软骨祖细胞具有干细胞的表面标志物,如 STRO-1、CD90 和 CD166 等,也同样具有多项分化潜能。软骨祖细胞成软骨诱导后可检测到大量的 II 型胶原和蛋白多糖且不含有与软骨退变老化相关的X 型胶原,与骨髓间充质干细胞(BMSCs)的成软骨诱导相比有着明显的不同[9]。同时 BMSCs 与软骨祖细胞体外成软骨诱导相比更容易引起细胞肥大。另外也有文献报道软骨祖细胞的体外诱导成软骨效果明显优于滑膜间充质干细胞(synovium-derived mesenchymal stem cells,SMSCs)[10]。这些研究结果显示软骨祖细胞用于软骨再生的效果很可能要优于 MSCs。
2016 年,Jiang 等[11]进一步探讨了人源性的软骨祖细胞以及该细胞在临床软骨组织损伤修复中的应用潜能。该研究在体内和体外试验中对比了软骨祖细胞的成软骨能力,发现在低密度、低糖的“2D”培养模式中,不经诱导的软骨祖细胞可以自发进入软骨分化程序,为该细胞的临床应用提供理论基础。为了进一步检验该细胞修复软骨的效果,15 名年轻患者接受了应用软骨祖细胞修复 6 ~ 13 cm2大小软骨缺损的治疗,修复效果显著,患者的疼痛感消失,日常活动自如。虽然经过诱导后的软骨祖细胞和正常的关节软骨细胞相比在细胞表型和再生软骨的质量上还有一定的差距,但是软骨干细胞和其他大多数的干细胞相比,具有更好的软骨再生能力。关于软骨祖细胞的相关研究还停留在比较早期的阶段,需要进一步的研究来阐释其在软骨再生中的作用。因为应用自体软骨祖细胞修复软骨缺损同样面临损伤健康软骨区域和二次手术等一系列问题,因此在克服细胞免疫排斥问题或者证明该细胞本身具有较低的免疫原性的基础之上,应用同种异体软骨祖细胞修复关节软骨缺损可能是未来较为有希望的方法之一。
2 干细胞成软骨分化
干细胞的多项分化潜能和自我复制能力是其成为良好组织工程软骨种子细胞的基础,将干细胞诱导成为软骨细胞样的细胞是构建组织工程软骨的重要因素。干细胞根据其发育阶段,可分为胚胎干细胞(embryonic stem cells,ESCs)和成体干细胞(adult stem cells,ASCs)。胚胎干细胞的优势在于无限制的自我更新能力和多能性,通过对其成软骨诱导可以产生足量的软骨细胞。未经处理的胚胎干细胞存在致瘤性和较高发生畸胎瘤的风险,因此应用稳定和有效的培养条件来扩增和诱导其向特定的软骨系分化至关重要。许多不同的策略被单一或联合应用于诱导胚胎干细胞向软骨系分化:①通过胚胎小体的形成。这种策略模仿胚胎发育的早期,即上胚层、中胚层和下胚层的形成;②通过胚胎干细胞生成间充质干细胞。基于间充质干细胞所具有的免疫豁免特性和更高的安全性考虑,有学者已经研究出了从胚胎干细胞派生出间充质干细胞,并向软骨分化和应用到软骨组织工程修复的技术;③生长因子和细胞活素。应用最多的是 TGFβ 家族,主要是 TGFβ-1 和 TGFβ-2。另外还有 BMP 家族,主要是BMP-2、BMP-4 和 BMP-6。其他的还有 PDGF-bb、IGF-1和 SHH(Sonic Hedgehog Protein);④与成体干细胞类似的策略,如与软骨细胞或纤维细胞共培养以及改变细胞微环境的 3D 培养、低氧诱导、力学刺激等[12]。
iPSs 可以通过基因改造任何体细胞而获得。iPSs 与ESCs 相比较,其优势在于兼具无限自我复制和多能性,且不存在伦理学问题。iPSs 最早是通过改变小鼠成纤维细胞4 个相关因子(Oct3/4、Klf-4、c-Myc、Sox-2)获得[13]。这是一项在干细胞领域中具有突破性的研究成果,也为基因治疗和组织工程相关的研究提供了新的工具。体细胞、成纤维细胞和软骨细胞都已经被改造重新编程为 iPSs 且能够诱导分化成软骨系。通过皮肤成纤维细胞产生的 iPSs 诱导成为软骨细胞,同时根据 HLA 表型,建立一个 iPSs 库,该细胞库能够提供同种异体 iPSs 应用于软骨组织再生研究。该细胞库的应用和传统组织工程软骨再生相比,能够减少花费同时也能够覆盖大量患病人群[14]。已有相关研究表明软骨细胞来源的 iPSs 系与其他细胞来源的 iPSs 系相比能够更高地表达蛋白多糖基因,同时软骨细胞来源 iPSs 系的软骨相关基因的表达与软骨形成相关基因无差别。通过进一步探究其生物学特性,建立分化策略,优化生产程序,最终实现生产足够的、有功能的 iPSs 源性软骨细胞样细胞种群。未来,iPSs 有希望成为一种新颖的、较安全的组织工程软骨种子细胞[14]。
MSCs 目前被认为是最有希望实现软骨再生的细胞,已经被应用到临床中并取得良好的效果。MSCs 向软骨细胞分化是通过某些分子和细胞活素(其中起主要作用的是生长因子)、细胞所处的微环境所诱导。不同的生长因子在 MSCs向软骨分化的不同阶段起到了不同的作用[15-16]:①起始阶段,起作用的因子包括 TGFβ、FGF-2、FGF-4、FGF-8、FGF-10、Wnt-3a、Wnt-4a、Wnt-7a、SHH、BMP-2、BMP-4、BMP-7。所起的作用主要是募集和凝聚 MSCs 以及促进MSCs 的增殖。②早期成软骨阶段,起作用的因子包括IGF-1、BMP-2、BMP-4、BMP-7、FGF-2/FGFR-2、GDF-5。所起作用是成软骨细胞到软骨细胞的分化过程以及软骨祖细胞的增殖。③中后期成软骨阶段,起作用的因子包括FGF-18、FGFR-3、BMP-2、BMP-7、Ihh、PTHrP-R。所起的作用是向成熟的软骨细胞分化。MSCs 最先是从骨髓组织中分离出来,也可以从其他组织中提取,包括脂肪组织、胎盘组织、脐带组织、脐带血、外周血、羊膜等。这些细胞的成软骨特性均已研究证实。通过 MSCs 黏附和大规模培养的特性,可以将其分离出来,尽管没有特定的表面标记来分选该群细胞,国际细胞治疗协会(International Society of Cellular Therapy)定义了 MSCs 需阳性表达 CD105、CD73、CD90,阴性表达 CD45、CD34、CD14、CD19、CD11b 和HLA-DR。由于缺乏特定的标志物来识别 MSCs 细胞群,因此想要明确地比较不同组织来源的 MSCs 在成软骨的相似性和区别性较为困难[17]。成熟的软骨细胞定居于软骨组织中,软骨细胞之所以能够维持其细胞表型与定居的微环境密切相关[18],包括特殊的细胞外基质、低氧的环境[19]、力学刺激[15]以及特殊的形态学结构。因此,MSCs 所处的微环境对其向软骨分化起到了特定的作用,包括“3D”培养模式、ECM 支架培养、低氧环境、力学刺激等。另外共培养[20]作为一种较为新颖的培养模式,目的在于利用软骨细胞和 MSCs 各自优势,实现软骨细胞对 MSCs 的诱导作用,同时实现 MSCs 促进软骨细胞增殖作用。
MSCs 一直被认为是软骨修复的“万能药”,但许多结果却不及预期。相关研究发现,MSCs 自身存在着软骨内成骨的分化程序,软骨内成骨伴随着软骨细胞的肥大,肥大的软骨细胞不适合作为组织工程软骨的种子细胞[21],因此,MSCs 向软骨细胞诱导分化成软骨过程中,软骨细胞肥大问题是影响诱导效果的关键因素之一,同时也是制约诱导后的干细胞在临床应用的限制性因素之一。许多用来抑制软骨细胞肥大策略都被证明是有效的,例如蛋白或基因水平的干预(PTHrP、TGFβ、Sox-9),细胞共培养(软骨细胞和干细胞),培养膜的应用(硫酸软骨素和软骨细胞外基质),低氧环境,生物力学刺激等[22]。然而,通过干细胞的诱导还不能产生像透明软骨一样的完全正常的软骨组织。因此,应用基于干细胞的组织工程软骨修复技术达到完美的软骨修复还将面临着巨大的挑战。
3 干细胞软骨修复的临床应用
成体干细胞(ASCs)最先应用于临床治疗,与 ESCs和 iPSs 细胞相比具有更高的安全性。MSCs 作为 ASCs中最具代表性的干细胞被广泛应用于临床软骨再生之中。MSCs 可来源于各种组织,如骨髓、脂肪、胎盘、脐带血、滑膜、外周血、肌腱、软骨等。如表 1 所示,到目前为止,用于软骨损伤临床治疗的干细胞有 BMSCs、脂肪间充质干细胞(ADSCs)、SMSCs、外周血干细胞(PBMSCs)和hCDPCs 等,均取得了较为满意的修复效果。BMSCs 修复软骨损伤的临床应用较早,且取得了满意的修复效果。近年来也有应用同种异体的 BMSCs 来治疗骨性关节炎的相关研究。ADSCs 相比较 BMSCs 在治疗软骨损伤方面有一定的优势,如避免骨质疏松所导致的 BMSCs 数量和质量的下降,血管基质片段细胞(stromal vascular fraction,SVF)不经体外培养治疗软骨伤安全性更高,吸脂术后的脂肪组织作为医疗废弃物得到重新利用等。PBMSCs 易于获取,且可以通过一次手术完成修复,这也是该细胞应用于临床的一大优势所在。应用 SMSCs 和 CDPCs 修复软骨损伤的报道较少,与其他 MSCs 相比较,其优势和劣势需要更多的临床试验来验证。但由于 CDPCs 起源于软骨组织本身,具有更好的向软骨分化的能力,可能是一种比较有潜力的细胞。用干细胞修复软骨损伤,修复的部位主要包括膝关节的软骨、半月板以及踝关节距骨的软骨。损伤的类型主要是单纯局限性的软骨损伤或者骨性关节炎的早期。细胞到达损伤部位的方式主要有单纯干细胞的直接注射、细胞混合透明质酸(HA)、细胞混合富集血小板(PRP)、细胞混合纤维蛋白胶和细胞复合胶原支架材料。目前应用各种干细胞治疗软骨损伤还仅仅局限于应用未经处理或单纯体外扩增培养的干细胞,虽然实验室中已经证实了干细胞诱导成软骨的可行性和安全性,但尚未有体外诱导干细胞成软骨应用于临床的报道。其中最主要的限制在于诱导后细胞的不稳定性[49](易退变和成瘤),以及更进一步的安全性得不到有效的证明。因此,需要更多的研究证据来证明诱导干细胞成软骨后的安全性。
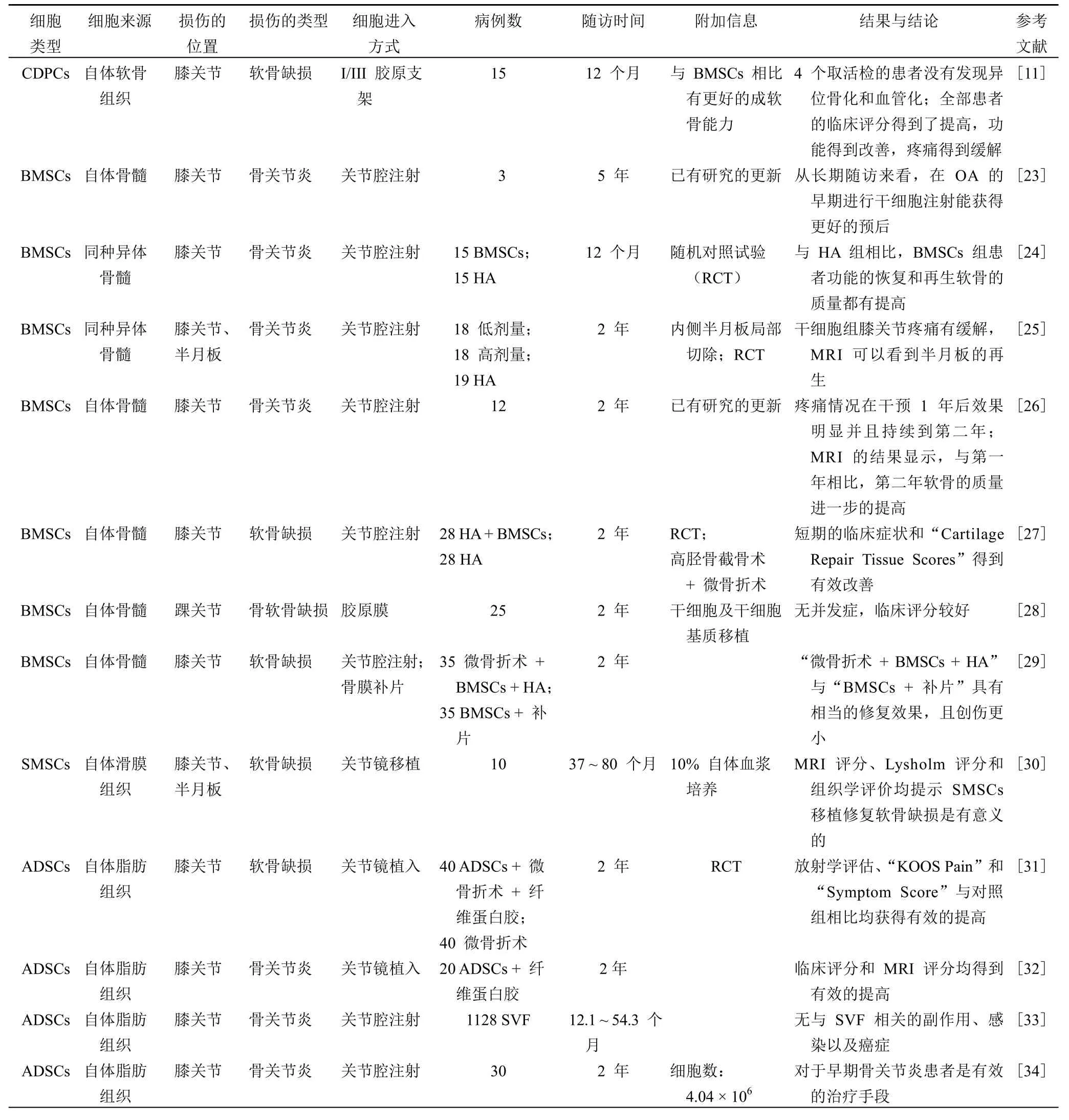
表 1 近年来干细胞在软骨再生方面的临床试验研究
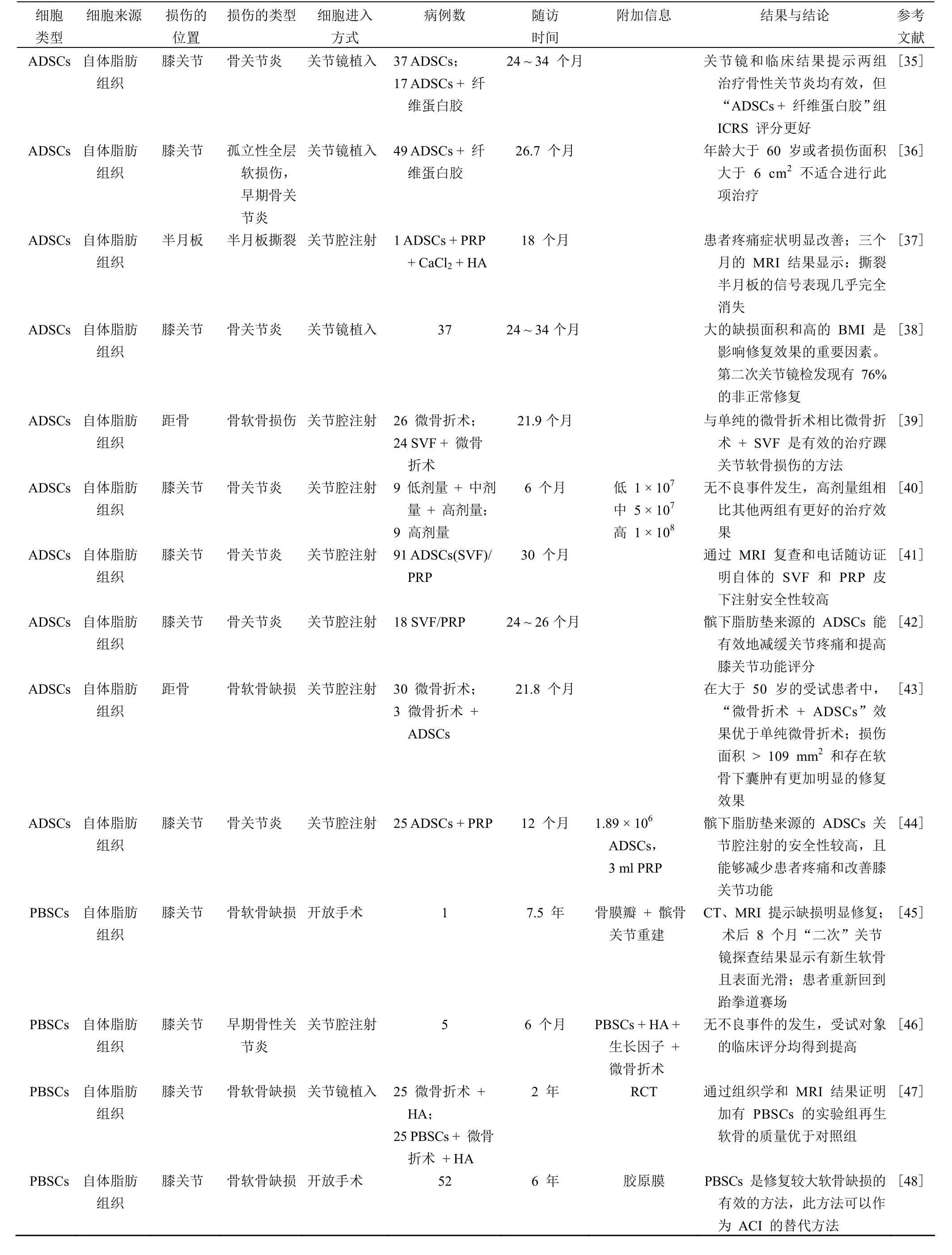
续表 1
4 结论与展望
干细胞的相关研究是软骨再生中的重要基础性研究之一。尽管目前干细胞在软骨修复过程中所起到的作用以及具体起作用的机制并不是很清楚,且不同种类的干细胞在临床上得到应用的可能性和限制性尚存在很大争议,但干细胞在该领域的许多优势是显而易见的。MSCs 作为干细胞软骨再生领域应用最为广泛的种子细胞,其安全性和有效性在基础研究和临床研究中都得到了较可靠的证据。虽然许多应用干细胞修复软骨损伤临床试验的相关研究取得了令人满意的疗效,但仍需更大样本量和更长随访时间的临床研究来进一步证明干细胞在软骨修复中的安全性和有效性。
[1] Goldring MB, Goldring SR. Articular cartilage and subchondral bone in the pathogenesis of osteoarthritis. Ann N Y Acad Sci, 2010, 1192:230-237.
[2] Welch T, Mandelbaum B, Tom M. Autologous chondrocyte implantation: past, present, and future. Sports Med Arthrosc, 2016,24(2):85-91.
[3] Brittberg M, Lindahl A, Nilsson A, et al. Treatment of deep cartilage defects in the knee with autologous chondrocyte transplantation. N Engl J Med, 1994, 331(14):889-895.
[4] Richardson SM, Kalamegam G, Pushparaj PN, et al. Mesenchymal stem cells in regenerative medicine: Focus on articular cartilage and intervertebral disc regeneration. Methods, 2016, 99:69-80.
[5] Dowthwaite GP, Bishop JC, Redman SN, et al. The surface of articular cartilage contains a progenitor cell population. J Cell Sci,2004, 117(Pt 6):889-897.
[6] Koelling S, Kruegel J, Irmer M, et al. Migratory chondrogenic progenitor cells from repair tissue during the later stages of human osteoarthritis. Cell Stem Cell, 2009, 4(4):324-335.
[7] Williams R, Khan IM, Richardson K, et al. Identification and clonal characterisation of a progenitor cell sub-population in normal human articular cartilage. PLoS One, 2010, 5(10):e13246.
[8] Yu Y, Zheng H, Buckwalter JA, et al. Single cell sorting identifies progenitor cell population from full thickness bovine articular cartilage. Osteoarthritis Cartilage, 2014, 22(9):1318-1326.
[9] McCarthy HE, Bara JJ, Brakspear K, et al. The comparison of equine articular cartilage progenitor cells and bone marrow-derived stromal cells as potential cell sources for cartilage repair in the horse. Vet J,2012, 192(3):345-351.
[10] Zhou C, Zheng H, Seol D, et al. Gene expression profiles reveal that chondrogenic progenitor cells and synovial cells are closely related. J Orthop Res, 2014, 32(8):981-988.
[11] Jiang Y, Cai Y, Zhang W, et al. Human cartilage-derived progenitor cells from committed chondrocytes for efficient cartilage repair and regeneration. Stem Cells Transl Med, 2016, 5(6):733-744.
[12] Fu C, Yan Z, Xu H, et al. Isolation, identification and differentiation of human embryonic cartilage stem cells. Cell Biol Int, 2015, 39(7):777-787.
[13] Takahashi K, Yamanaka S. Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors. Cell,2006, 126(4):663-676.
[14] Tsumaki N, Okada M, Yamashita A. iPS cell technologies and cartilage regeneration. Bone, 2015, 70:48-54.
[15] Panadero JA, Lanceros-Mendez S, Ribelles JL. Differentiation of mesenchymal stem cells for cartilage tissue engineering: Individual and synergetic effects of three-dimensional environment and mechanical loading. Acta Biomater, 2016, 33:1-12.
[16] Augustyniak E, Trzeciak T, Richter M, et al. The role of growth factors in stem cell-directed chondrogenesis: a real hope for damaged cartilage regeneration. Int Orthop, 2015, 39(5):995-1003.
[17] Seo S, Na K. Mesenchymal stem cell-based tissue engineering for chondrogenesis. J Biomed Biotechnol, 2011, 2011:806891.
[18] Zhou M, Yuan X, Yin H, et al. Restoration of chondrocytic phenotype on a two-dimensional micropatterned surface. Biointerphases, 2015,10(1):011003.
[19] Shang J, Liu H, Li J, et al. Roles of hypoxia during the chondrogenic differentiation of mesenchymal stem cells. Curr Stem Cell Res Ther,2014, 9(2):141-147.
[20] Hubka KM, Dahlin RL, Meretoja VV, et al. Enhancing chondrogenic phenotype for cartilage tissue engineering: monoculture and coculture of articular chondrocytes and mesenchymal stem cells. Tissue Eng Part B Rev, 2014, 20(6):641-654.
[21] Chen S, Fu P, Cong R, et al. Strategies to minimize hypertrophy in cartilage engineering and regeneration. Genes Dis, 2015, 2(1):76-95.
[22] Sun MM, Beier F. Chondrocyte hypertrophy in skeletal development,growth, and disease. Birth Defects Res C Embryo Today, 2014, 102(1):74-82.
[23] Davatchi F, Sadeghi Abdollahi B, Mohyeddin M, et al. Mesenchymal stem cell therapy for knee osteoarthritis: 5 years follow-up of three patients. Int J Rheum Dis, 2016, 19(3):219-225.
[24] Vega A, Martín-Ferrero MA, Del Canto F, et al. Treatment of knee osteoarthritis with allogeneic bone marrow mesenchymal stem cells: A Randomized Controlled Trial. Transplantation, 2015, 99(8):1681-1690.
[25] Vangsness CT Jr, Farr J 2nd, Boyd J, et al. Adult human mesenchymal stem cells delivered via intra-articular injection to the knee following partial medial meniscectomy: a randomized, double-blind, controlled study. J Bone Joint Surg Am, 2014, 96(2):90-98.
[26] Orozco L, Munar A, Soler R, et al. Treatment of knee osteoarthritiswith autologous mesenchymal stem cells: two-year follow-up results. Transplantation, 2014, 97(11):e66-e68.
[27] Wong KL, Lee KB, Tai BC, et al. Injectable cultured bone marrow-derived mesenchymal stem cells in varus knees with cartilage defects undergoing high tibial osteotomy: a prospective, randomized controlled clinical trial with 2 years' follow-up. Arthroscopy, 2013,29(12):2020-2028.
[28] Richter M, Zech S. Matrix-associated stem cell transplantation(MAST) in chondral defects of foot and ankle is effective. Foot Ankle Surg, 2013, 19(2):84-90.
[29] Lee KB, Wang VT, Chan YH, et al. A novel, minimally-invasive technique of cartilage repair in the human knee using arthroscopic microfracture and injections of mesenchymal stem cells and hyaluronic acid--a prospective comparative study on safety and short-term efficacy. Ann Acad Med Singapore, 2012, 41(11):511-517.
[30] Sekiya I, Muneta T, Horie M, et al. Arthroscopic transplantation of synovial stem cells improves clinical outcomes in knees with cartilage defects. Clin Orthop Relat Res, 2015, 473(7):2316-2326.
[31] Koh YG, Kwon OR, Kim YS, et al. Adipose-derived mesenchymal stem cells with microfracture versus microfracture alone: 2-Year Follow-up of a Prospective Randomized Trial. Arthroscopy, 2016,32(1):97-109.
[32] Kim YS, Choi YJ, Lee SW, et al. Assessment of clinical and MRI outcomes after mesenchymal stem cell implantation in patients with knee osteoarthritis: a prospective study. Osteoarthritis Cartilage, 2016,24(2):237-245.
[33] Michalek J, Moster R, Lukac L, et al. Autologous adipose tissue-derived stromal vascular fraction cells application in patients with osteoarthritis. Cell Transplant, 2015. [Epub ahead of print]
[34] Koh YG, Choi YJ, Kwon SK, et al. Clinical results and second-look arthroscopic findings after treatment with adipose-derived stem cells for knee osteoarthritis. Knee Surg Sports Traumatol Arthrosc, 2015,23(5):1308-1316.
[35] Kim YS, Choi YJ, Suh DS, et al. Mesenchymal stem cell implantation in osteoarthritic knees: is fibrin glue effective as a scaffold? Am J Sports Med, 2015, 43(1):176-185.
[36] Kim YS, Choi YJ, Koh YG. Mesenchymal stem cell implantation in knee osteoarthritis: an assessment of the factors influencing clinical outcomes. Am J Sports Med, 2015, 43(9):2293-2301.
[37] Pak J, Lee JH, Lee SH. Regenerative repair of damaged meniscus with autologous adipose tissue-derived stem cells. Biomed Res Int,2014, 2014:436029.
[38] Koh YG, Choi YJ, Kwon OR, et al. Second-look arthroscopic evaluation of cartilage lesions after mesenchymal stem cell implantation in osteoarthritic knees. Am J Sports Med, 2014, 42(7):1628-1637.
[39] Kim YS, Lee HJ, Choi YJ, et al. Does an injection of a stromal vascular fraction containing adipose-derived mesenchymal stem cells influence the outcomes of marrow stimulation in osteochondral lesions of the talus? A clinical and magnetic resonance imaging study. Am J Sports Med, 2014, 42(10):2424-2434.
[40] Jo CH, Lee YG, Shin WH, et al. Intra-articular injection of mesenchymal stem cells for the treatment of osteoarthritis of the knee:a proof-of-concept clinical trial. Stem Cells, 2014, 32(5):1254-1266.
[41] Pak J, Chang JJ, Lee JH, et al. Safety reporting on implantation of autologous adipose tissue-derived stem cells with platelet-rich plasma into human articular joints. BMC Musculoskelet Disord, 2013,14:337.
[42] Koh YG, Jo SB, Kwon OR, et al. Mesenchymal stem cell injections improve symptoms of knee osteoarthritis. Arthroscopy, 2013, 29(4):748-755.
[43] Kim YS, Park EH, Kim YC, et al. Clinical outcomes of mesenchymal stem cell injection with arthroscopic treatment in older patients with osteochondral lesions of the talus. Am J Sports Med, 2013, 41(5):1090-1099.
[44] Koh YG, Choi YJ. Infrapatellar fat pad-derived mesenchymal stem cell therapy for knee osteoarthritis. Knee, 2012, 19(6):902-907.
[45] Fu WL, Ao YF, Ke XY, et al. Repair of large full-thickness cartilage defect by activating endogenous peripheral blood stem cells and autologous periosteum flap transplantation combined with patellofemoral realignment. Knee, 2014, 21(2):609-612.
[46] Turajane T, Chaweewannakorn U, Larbpaiboonpong V, et al. Combination of intra-articular autologous activated peripheral blood stem cells with growth factor addition/preservation and hyaluronic acid in conjunction with arthroscopic microdrilling mesenchymal cell stimulation Improves quality of life and regenerates articular cartilage in early osteoarthritic knee disease. J Med Assoc Thai, 2013, 96(5):580-588.
[47] Saw KY, Anz A, Siew-Yoke Jee C, et al. Articular cartilage regeneration with autologous peripheral blood stem cells versus hyaluronic acid: a randomized controlled trial. Arthroscopy, 2013,29(4):684-694.
[48] Skowroński J, Skowroński R, Rutka M. Cartilage lesions of the knee treated with blood mesenchymal stem cells - results. Ortop Traumatol Rehabil, 2012, 14(6):569-577.
[49] Somoza RA, Welter JF, Correa D, et al. Chondrogenic differentiation of mesenchymal stem cells: challenges and unfulfilled expectations. Tissue Eng Part B Rev, 2014, 20(6):596-608.
10.3969/j.issn.1673-713X.2016.05.013
国家自然科学基金重点项目(2113404);国家自然科学基金面上项目(81472092)
100853 北京,解放军总医院骨科研究所北京市再生医学重点实验室/全军战创伤重点实验室
郭全义,Email:doctorguo_301@163.com
2016-07-27
同为第一作者

