温度对裙带菜幼孢子体抗氧化系统的影响*
宫庆礼, 王 鹏, 王晓艳, 刘 岩
(中国海洋大学水产学院,山东 青岛 266003)
温度对裙带菜幼孢子体抗氧化系统的影响*
宫庆礼, 王 鹏, 王晓艳, 刘 岩**
(中国海洋大学水产学院,山东 青岛 266003)
以裙带菜(Undariapinnatifida)幼孢子体为材料,测定了不同温度(12、20、24和28 ℃)培养下,藻体抗氧化系统变化情况。与对照组(12 ℃)相比,高温会导致活性氧含量上升,并伴随藻体抗氧化酶活性和抗氧化物含量的变化。当裙带菜处于12 ℃时,机体总抗氧化能力保持恒定。当遭受较轻程度高温环境时(20 ℃),藻体ROS平衡被打破,机体内O2-、H2O2等活性氧物质迅速积累,36 h达到峰值,同时抗氧化系统中的SOD活性上升,将O2-转化为H2O2。由于损伤较轻,藻体仅依靠原有的抗氧化力及9 h内大量合成的AsA缓慢清除H2O2。CAT和POD活性以及GSH含量未见上升。当温度损伤增加时(24 ℃),为了尽快修复藻体,POD活性3 h内急剧上升,同时GSH和AsA迅速合成,在较短时间内控制H2O2含量。随后CAT活性逐渐上升,完成后期修复工作。若温度超过藻体耐受限度(28 ℃),将造成多种抗氧化酶失活。36 h内MDA大量积累,质膜通透性降低,细胞内ROS与抗氧化物外流,最终导致藻体死亡。结果表明,抗氧化系统调节对于裙带菜幼孢子体适应不同环境温度起到了重要作用。这种依机体损伤程度而改变的抗氧化机制,可以更快速、更节能、更有效地修复藻体所受损伤。本结果为进一步解释裙带菜广泛分布原因、研究裙带菜应对不适环境条件机制及培育耐高温品系裙带菜提供一定科学依据。
裙带菜; 幼孢子体; 温度; 抗氧化系统
温度是影响微藻与大型海藻生长分布及生理功能的重要环境因素之一。随着全球气候变暖,温室效应导致的海水温度升高对海藻生活状况的影响成为研究的热点。已有研究报道了温度对海带(Saccharinajaponica)[1-3]、羊栖菜(Sargassumfusiforme)[4]、鼠尾藻(S.thnnbergi)[5]、龙须菜(Gracilarialemaneiformis)[6]的生长、发育以及繁殖过程造成不同程度的影响。
先前的研究认为,抗氧化系统在应对不适环境对海藻造成的损伤中起重要作用。海藻在遭受自然环境变化影响时会产生超出正常范围的活性氧(ROS),Apel等发现,每次短暂的热刺激都能增加ROS的产生,其中超氧阴离子(O2-)、过氧化氢(H2O2)被认为是ROS中最为重要的组成部分[7],这些ROS会对机体及细胞造成损伤。膜脂过氧化产物丙二醛(MDA)可以作为细胞膜损伤的标志物。不利的环境条件下海藻会启用抗氧化系统清除过多的氧自由基,保护机体免受损伤。抗氧化系统包括抗氧化酶和抗氧化物,抗氧化酶主要有超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)等;抗氧化物包括抗坏血酸(AsA)、还原型谷胱甘肽(GSH)等。整个抗氧化系统的抗氧化能力用总抗氧化能力(T-AOC)表示,T-AOC可以直观全面的展示植物体对环境的抗逆性[8]。已有报道研究了温度对不同海藻的抗氧化系统影响,如温度升高会引起海带配子体MDA上升[9];高温胁迫使龙须菜体内抗坏血酸等抗氧化物含量升高,并引起多种抗氧化酶活性的变化[6];温度升高造成条斑紫菜(Prophyrayezoensis)丝状体的POD活性下降[10]。
裙带菜(Undariapinnatifida),是西北太平洋特有的暖温带海藻,广泛分布于中国、日本和朝鲜半岛[11-12]。目前裙带菜是中国、日本和韩国的重要经济养殖海藻之一[12]。除了食用之外,裙带菜还广泛应用于工业[11]、食品[13]、医药[14]等领域,并且在海洋环境修复方面也起着重要的作用[15]。王萌等研究了高温对裙带菜配子体叶绿素a、脯氨酸及丙二醛含量和POD活性的生理影响[16]。
目前裙带菜已经入侵欧洲和大洋洲,这种广泛分布的特点一定与很多适应环境的机制有关,本文主要研究抗氧化系统在藻体适应温度中的作用。裙带菜以配子体的形式度夏,与配子体和成体相比,幼孢子体时期裙带菜对环境最为敏感,对不适环境抵抗能力最弱。孢子体出库下海初期,环境由室内转为室外,海区水温波动较大,会对幼孢子体的存活、生长产生重要影响。根据“短板”效应,裙带菜幼孢子体对温度的耐受性很大程度上决定了该物种的分布。因此研究幼孢子体时期裙带菜抗氧化系统对不同温度的响应,可以进一步解释裙带菜广泛分布的原因。
本文以养殖裙带菜幼孢子体为材料,研究了不同温度处理条件下裙带菜幼孢子体活性氧、抗氧化酶和抗氧化物在168h内的变化情况,为进一步研究裙带菜应对不适环境条件机制及培育耐高温品系裙带菜提供一定科学依据。
1 实验材料与方法
1.1 样品采集
于2013年11月自青岛胶州湾(36°06′53.58′′N;120°18′42.06′′E) 采集养殖裙带菜苗绳,于低温、阴暗条件下将裙带菜幼孢子体迅速带回实验室。将裙带菜幼孢子体沿附着基切下,置于海水循环系统(500 L的1/4PESI培养液)中充气暂养3 d,以便藻体切口处愈合。暂养水温为12 ℃(同采集地水温),光照强度90 μmol·m-2·s-1,光周期12L∶12D。
1.2 温度实验
选取状态良好且长势均一的裙带菜幼孢子体(全长(4.0±1.0)cm),分散放置于实验水槽中,水槽中添加18L 1/4PESI培养液,培养密度约为0.2 g/L。将水槽放置于光照培养箱(GXZ-280D,宁波江南仪器厂)中,充气培养7 d,每3 d更换培养液。以采集地水温12 ℃作为对照,另外设置3个温度处理(20、24和28 ℃),培养条件为光照90 μmol·m-2s-1,光周期12L∶12D,每个处理3个平行。分别于不同温度下培养3、6、9、12、24、36、48、60、72、96、120、144和168 h时从各处理组水槽中取样,液氮速冻后于-80 ℃保存,用于各项抗氧化活性指标的测定。
1.3 抗氧化分析
以超氧阴离子(O2-)、过氧化氢(H2O2),以及丙二醛(MDA)作为活性氧损伤指标,以超氧化物歧化酶(SOD)、过氧化物酶(POD)以及过氧化氢酶(CAT)作为抗氧化酶指标,以还原型谷胱甘肽(GSH)和抗坏血酸(AsA)作为抗氧化物指标。
MDA含量用硫代巴比妥酸法(TBA)[19]测定;抑制与产生超氧阴离子自由基测试盒用于测定O2-含量;过氧化氢测试盒用于测定H2O2含量;植物铜锌超氧化物歧化酶测试盒用于测定SOD活性;过氧化物酶测定试剂盒(测组织)用于测定POD活性;过氧化氢酶测试盒(可见光)用于测定CAT活性;还原型谷胱甘肽测试盒用于测定GSH含量;维生素C测试盒用于测定AsA含量;总抗氧化能力测试盒用于测定T-AOC。
以上植物组织试剂盒均购自南京建成生物工程研究所,使用紫外分光光度计(U-2900,Hitachi High-Technologies)测定吸光值并计算其含量或活力。
1.4 数据处理
用统计软件SPSS 17.0分析不同温度及不同时间藻体的活性氧含量、抗氧化酶活性以及抗氧化物含量间差异是否显著。以Schffe’s多重比较分析不同温度处理与对照组的差异性,当P<0.01时认为差异显著。
2 结果
本实验中,不同温度组藻体生长状况明显不同:对照组(12 ℃)藻体叶片健康完整,始终保持茶褐色;20 ℃组和24 ℃组,叶片颜色从顶端开始发生不同程度变浅;28 ℃组藻体随培养时间延长叶片色泽逐渐变浅,尖端衰退,培养48 h时全部死亡。
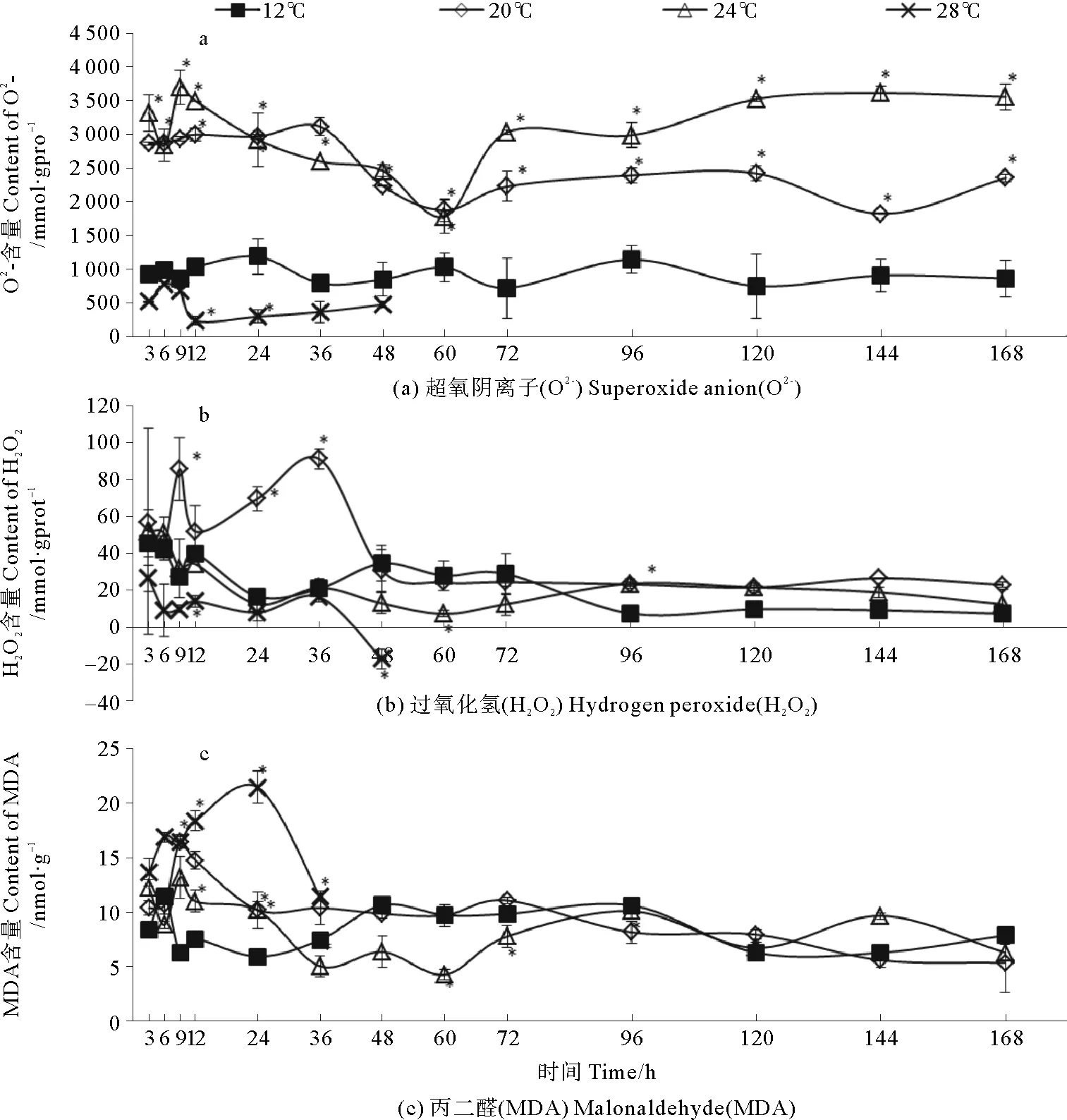
图1表示在不同温度下培养168h期间,藻体中O2-、H2O2及MDA含量的变化。12 ℃下藻体中O2-、H2O2及MDA含量基本保持稳定。20 ℃与24 ℃时,处理3 h,藻体中O2-含量分别高达对照组的3.15和3.65倍,20 ℃组在36 h时达到最高值而24 ℃组在9 h便达到峰值,分别为对照组的4倍与4.35倍,之后逐渐下降,60 h时均出现最小值,培养168 h后两处理组均显著高于对照组。28 ℃组O2-含量始终低于对照组。20 ℃下,H2O2含量在9~36 h间显著高于对照组,36 h出现最高值,为对照组4.4倍,之后逐渐下降并保持平稳。24 ℃下H2O2含量与对照组间没有显著差异。28 ℃组的H2O2含量始终低于对照组。20 ℃组与24 ℃组中MDA含量均在9 h达到最高值,分别为对照组的2.62倍和2.1倍,之后逐渐下降,168 h后与对照组无显著差异。28 ℃下,MDA含量在24 h内迅速上升且显著高于对照组,24 h时达到峰值,为对照组3.62倍,之后开始下降。
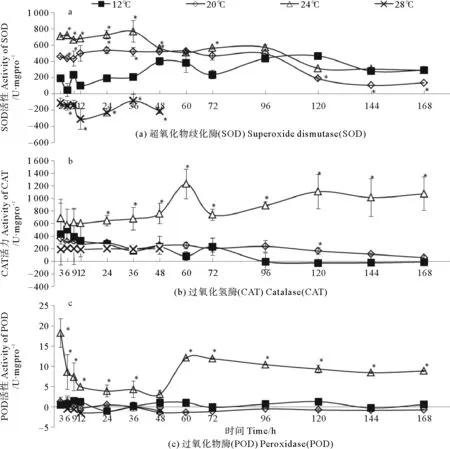
图2表示藻体抗氧化酶活性在不同温度下的变化情况。12 ℃下SOD活性有逐渐上升的趋势,168 h时为3 h的1.53倍。20与24 ℃下,藻体SOD活性在36 h内显著高于对照组,之后逐渐下降。28 ℃下SOD活性显著下降,甚至出现负值。12 ℃下CAT活性逐渐降低,96 h后接近零水平。20与28 ℃下CAT活性变化不大,与对照组无显著差异。24 ℃下CAT活力与12 h后显著高于对照组,并呈上升趋势,60 h时达到峰值。12、20及28 ℃下POD活性很低,接近零水平。而24 ℃下仅在处理3 h后POD活性便显著高于对照组,为对照组的39.8倍,之后逐渐下降,于60 h时突然上升,并始终显著高于对照组。
(表示与对照组(12 ℃)差异显著(P<0.01)。means significant difference between treatment groups (20, 24, 28 ℃) and control group (12 ℃).)
图1 不同温度处理下裙带菜幼孢子体活性氧和MDA含量随时间的变化
Fig.1 Contents of ROS and MDA for Undaria pinnatifida at different temperature. Asterisk
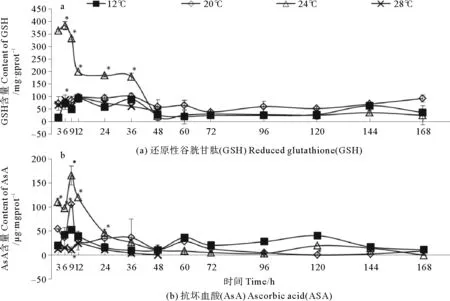
图3表示抗氧化物含量在不同温度下的变化情况。12 ℃中藻体GSH和AsA含量基本稳定。20与28 ℃下藻体GSH含量与对照组无显著差异。当培养温度为24 ℃时,藻体GSH含量迅速上升,6 h达到峰值,为对照组的5.35倍,之后逐渐下降,36 h内显著高于对照组,48 h后与对照组无显著差异。12 ℃下,藻体中AsA含量波动较大,于9、60及120 h出现3个峰值,但相互之间差异不大。20和24 ℃下,AsA含量在短时间内急剧上升,于9h达到峰值,分别为对照组的2.02和3.16倍,之后迅速下降,20 ℃组于12 h时恢复,而24 ℃组于36 h时恢复。28 ℃组AsA含量始终低于对照组。
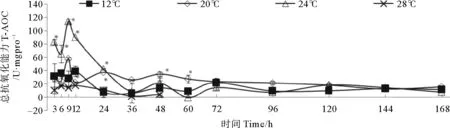
图4表示总抗氧化能力在不同温度中的变化。对照组T-AOC水平在前12 h较高,之后基本稳定,低于20 U·mgpro-1。20 ℃组中,T-AOC水平在9 h达到峰值,为对照组2.08倍,之后逐渐下降至正常水平。24 ℃组的T-AOC水平在培养9h内迅速增加,达到峰值(约为对照组的4.15倍)后逐渐下降,36 h后与正常水平相近。28 ℃组的T-AOC水平持续下降,36 h接近零水平。
3 讨论
在正常条件下,生物体内活性氧的产生与其清除保持平衡,此时活性氧不仅不会损伤机体,还能发挥其独特的生理作用。当植物处于不适的环境条件下,会发生氧化还原循环,产生大量活性氧,若超出了活性氧清除系统的能力会引起活性氧累积,导致脂质过氧化、代谢功能丧失、DNA损伤甚至细胞死亡等损伤[17]。
裙带菜是一年生大型海藻,主要生长于潮下带海区。温度对裙带菜的生长、发育及繁殖有很大的影响。胡敦清等研究发现不同生长阶段的裙带菜对温度的要求不同:裙带菜发育初期,温度在10~24 ℃之间,有利于胚孢子和配子体的形成,可以正常形成卵囊并排出卵子;配子体发育的最适温度范围为20~24 ℃,在此温度内配子体成熟早、排卵率高;幼孢子体形成的适温范围为15~21 ℃,而生长最适温度为14~18 ℃[18]。
(表示与对照组(12 ℃)差异显著(P<0.01)。means significant difference between treatment groups(20, 24, 28 ℃) and control group(12 ℃).)
图2 不同温度处理下裙带菜幼孢子体抗氧化酶活性随时间的变化
Fig.2 Activity of antioxidant enzymes for Undaria pinnatifida at different temperature. Asterisk
(表示与对照组(12 ℃)差异显著(P<0.01)。means significant difference between treatment groups(20, 24, 28 ℃) and control group(12 ℃).)
图3 不同温度处理下裙带菜幼孢子体抗氧化物含量随时间的变化
Fig.3 Contents of antioxidants for Undaria pinnatifida at different temperature. Asterisk
(表示与对照组(12 ℃)差异显著(P<0.01)。means significant difference between treatment groups(20, 24, 28 ℃) and control group(12 ℃).)
图4 不同温度处理下裙带菜幼孢子体总抗氧化能力随时间的变化
Fig.4 Total antioxidant capacity for Undaria pinnatifida at different temperature. Asterisk
宋洪元等认为植物在高温胁迫下细胞膜损伤与质膜透性增加是高温伤害的本质之一[19]。本实验中,除了24 ℃处理组的H2O2,20与24 ℃下,藻体活性氧含量均显著高于对照组,说明此温度已经加剧藻体中活性氧产生。24 ℃处理组H2O2含量较低与抗氧化酶协同作用及抗氧化物含量短时间急剧增加有关。藻体在28 ℃下培养48 h后全部死亡,质膜过氧化产物MDA含量最高,而O2-与H2O2含量较低可能与细胞质膜通透性完全丧失有关。王萌等人的研究结果显示在30 ℃高温胁迫下,裙带菜配子体MDA含量随时间逐渐上升,48 h仍有活性[16]。这是因为与孢子体相比,配子体作为裙带菜的度夏形式具有更好的高温耐受性[20]。
本实验中,除28 ℃外,96 h内,SOD活性与温度呈正相关,在藻体的温度应答过程中迅速应激且保持较高活性水平,之后各处理组SOD活性均出现不同程度下降。20与24 ℃对藻体形成不同程度的高温环境,促使活性氧大量生成。SOD通常作为抗氧化系统的第一道防线,其作用是将细胞内过多的超氧阴离子催化分解为基态氧和H2O2。在20与24 ℃中培养36 h内,SOD活性比对照组分别提高大约2.5和3.5倍。CAT的作用是把多种生理过程产生的H2O2分解成水和氧气[21]而POD能有效避免H2O2与有机过氧化物在藻类体内的积累。20 ℃时,高温程度较低,未刺激机体提高CAT与POD活性,仅依靠机体本身抗氧化底物清除H2O2,因此H2O2含量在36 h仍高于对照组。24 ℃时,高温程度增加,CAT与POD活性均有不同程度上升。CAT活性缓慢上升,显著高于对照组和20 ℃处理组,在60 h达到峰值,之后虽有所下降,但仍保持较高活性水平。与CAT的激活方式不同,POD在处理后迅速发挥抗氧化作用,3 h即达到峰值,其活性可以达到对照组近40倍,表现出对不适环境应答的快速性和高效性,且实验60 h后POD活性再次升高。CAT与POD共同作用,有效的清除了机体中由SOD歧化产生的H2O2。由此可知,在裙带菜幼孢子体对高温诱导刺激的应答过程中,各个酶组分参与抗氧化反应的速度和持续效果存在差异。3种抗氧化酶活性在28 ℃均较低,是因为温度超出了藻体耐受力,抗氧化酶失活,无法正常代谢。
与本文结果相似,鹿宁等人研究发现,高温胁迫3个品系龙须菜72 h期间,初期(24 h)CAT活性增强,随后POD和GSH-PX活性增强,参与到抗氧化作用中,SOD活性则在整个过程中持续起作用,消除自由基对龙须菜的伤害[6]。但其并未对24 h内其他时间点进行取样测定,未观察到抗氧化酶短时间活性骤增的现象。龙须菜属红藻纲,其耐受温度更高,32 ℃仍能积极响应。同属红藻纲的条斑紫菜,其抗氧化酶活性在28和30 ℃活性始终较低,藻体受高温损害较大[10]。海藻对温度胁迫的应答机制决定了其温度的耐受性,进而影响其自然分布。与裙带菜和条斑紫菜相比,龙须菜表现出了较高的温度耐受性,故其自然种群的地理分布也更为广泛。
还原型抗坏血酸AsA和还原型谷胱甘肽GSH,是AsA-GSH循环清除活性氧的主要底物,通过NADPH将H2O2转化为H2O[21]。24 ℃下GSH含量在短时间内快速上升,然后缓慢下降到对照水平,起到了阶段性的抵抗作用,这与Yogesh等的结果一致[22]。张容芳等认为GSH可以为细胞膜上巯基蛋白和酶提供保护,避免活性物质的侵害,保证呼吸作用中电子传递链和氧化磷酸化的正常进行,降低脱氧核糖核酸DNA突变和受损的几率[21]。在本研究测定指标中,AsA含量的变化趋势与T-AOC最为相近,说明AsA对藻体抗氧化能力有直接贡献,大量合成AsA有助于藻体应对不适环境。研究表明,高温会导致PSⅡ放氧复合体失活,抗坏血酸(AsA)通过传递电子给PSⅡ,保持电子的持续传递,以减轻反应中心受热胁迫损伤的程度[23]。AsA作为植物极重要的抗氧化剂,在清除活性氧之外,还可以调控蛋白质翻译和基因转录[24]。研究发现添加外源AsA后,可以降低水稻叶绿体中H2O2的含量[25]。已有研究发现高温胁迫龙须菜72 h内, GSH-PX(谷胱甘肽过氧化物酶)、维生素C(抗坏血酸)含量升高,T-AOC均先升高后降低抗,养殖品系抗氧化性能高于野生型[6];不同品系海带热胁迫研究表明,受胁迫后海带体内AsA的含量上升显著[10]。
4 结语
裙带菜抗氧化系统对温度响应方式随温度改变而不同。当裙带菜处于适宜温度时,机体总抗氧化能力保持恒定。当遭受较轻程度高温环境时,藻体活性氧平衡被打破,机体内积累大量O2-等ROS,此时SOD最先发挥作用,将O2-转化为H2O2。但由于不适环境造成的损伤较轻,CAT和POD活性没有增强且GSH含量未见上升,藻体仅依靠细胞本底存在的抗氧化能力及短时间大量合成的AsA缓慢清除H2O2。当温度继续升高时,为了尽快修复高温对藻体的损伤,POD活性短时间内急剧上升,同时机体迅速合成GSH和AsA等抗氧化物,在较短时间内控制H2O2含量。之后CAT活性逐渐上升,完成后期机体修复工作。当温度继续上升并超过藻体耐受限度后,多种抗氧化酶失活,MDA大量积累,质膜通透性降低,细胞内ROS与抗氧化物外流,最终导致细胞死亡。这种依机体损伤程度而改变的抗氧化机制,可以更快速、更节能、更有效地修复藻体所受损伤。
此外,不能因为AsA对抗氧化能力有直接贡献就认为其是抗氧化系统中最重要的部分,同样的,虽然诸如POD、CAT等抗氧化酶在提供还原力方面起间接作用,但也是构成机体总抗氧化能力的重要组成部分。需要进行更多实验,以进一步判定各种抗氧化成分在抗氧化系统中的地位。
裙带菜自然群体分布于东亚地区的日本、中国与韩国沿海,然而,近年来已发现裙带菜通过远洋货轮压舱水等途径被引入新西兰[26]、澳洲[27]、阿根廷[28]和法国[29]等地。本实验结果说明在不适温度环境条件下,抗氧化系统对维持藻体正常生理功能与结构起关键作用,为裙带菜扩大种群分布范围提供保障。
[1] 朱明远, 吴荣军, 李瑞香, 等. 温度对海带幼孢子体生长和光合作用的影响[J]. 生态学报, 2004, 24(1): 23-29.
Zhu M, Wu R, Li R, et al. The impacts of temperature on growth and photosynthesis ofLaminariajaponicajuvenile sporophytes[J]. Acta Ecologica Sinica, 2004, 24(1): 23-29.
[2] 王悠. 海带对高温胁迫的生理生化响应和耐高温机理的初步研究[D]. 青岛: 中国海洋大学, 2003.
Wang Y. The Physiological and Biochemical Responses to Heat Stress and the Preliminary Study on Heat-Resistant Mechanisms inLaminariajaponica[D]. Qingdao: Ocean University of China, 2003.
[3] 凌晶宇, 梁洲瑞, 王飞久, 等. 高温对海带(Saccharinajaponica)抗氧化酶及叶绿素荧光参数的影响[J]. 渔业科学进展,2016(3):120-125.
Ling J, Liang Zi, Wang F, et al. Effects of high temperature on the antioxidant enzymes and chlorophyll fluorescence parameters ofSaccharinajaponica[J]. Progress In Fishery Sciences, 2016(3):120-125.
[4] 孙圆圆, 孙庆海, 孙建璋. 温度对羊栖菜生长的影响[J]. 浙江海洋学院学报(自然科学版), 2009, 28(3): 342-347.
Sun Y, Sun Q, Sun J. The effect temperature on the growth ofSargassumfusiforme[J]. Journal of Zhejiang Ocean University(Natural Science), 2009, 28(3): 342-347.
[5] 梁洲瑞, 孙修涛, 王飞久, 等. 光, 温对鼠尾藻卵子排放和幼孢子体生长的影响[J]. 渔业科学进展, 2012, 33(1): 109-113.
Liang Z, Sun X, Wang F, et al. Effects of light and temperature on egg releasing and young sporophyte growth ofSargassumthunbergi[J]. Progress in Fishery Sciences, 2012, 33(1): 109-113.
[6] 鹿宁, 臧晓南, 张学成, 等. 高温胁迫下不同龙须菜品系抗氧化能力的比较[J]. 武汉大学学报: 理学版, 2010(5): 570-577.
Lu N, Zang X, Zhang X, et al. Comparison of antioxidant activities of different strains ofGracilarialemaneiformisunder high-temperature stress[J]. Journal of Wuhan University (Natural Science Edition), 2010(5): 570-577.
[7] Apel K, Hirt H. Reactive oxygen species: metabolism, oxidative stress, and signal transduction[J]. Annu Rev Plant Biol, 2004, 55: 373-399.
[8] 刘泳. 高温胁迫对海带生长的影响及其作用机理的初步探讨[D]. 青岛: 中国海洋大学, 2004.
Liu Y. The Effeets of Heat Stress on the Growth ofLaminariajaponicaand the Preliminary Study on the Effective Meehanism[D]. Qingdao: Ocean University of China, 2004.
[9] 宣慧, 佟少明, 侯和胜. 高温胁迫对海带配子体生长和生理的影响[J]. 天津农业科学, 2011, 17(2): 5-8.
Xuan H, Tong S, Hou H. Effects of high temperature stress on growth and physiology of gametophytes ofLaminariajaponica[J]. Tianjin Agricultural Science, 2011, 17(2): 5-8.
[10] 侯和胜, 何文君, 李洪艳, 等. 高温胁迫对条斑紫菜丝状体的生长和生理影响[J]. 辽宁师范大学学报(自然科学版), 2008, 31(4): 487-490.
Hou H, He W, Li H, et al. Effects of high temperature stress on growth and physiology of conchocelis ofPorphyrayezoensis[J]. Journal of Liao ning Normal University (Natural Science Edition), 2008, 31(4): 487-490.
[11] 韩晓弟, 王刚. 裙带菜的植物学特性及利用[J]. 特种经济动植物, 2003(9): 30-31.
Han X, Wang G. The botanical characteristics and utilization ofUndariapinnatifida[J]. Special Economic Animal and Plant, 2003(9): 30-31.
[12] 张定民, 缪国荣,裴鲁青. 裙带菜的研究[J]. 浙江水产学院学报, 1983, 2(2): 115-124.
Zhang D, Miao G, Pei L. Study onUndariapinnatifida[J]. Journal of Zhejiang College of Fisheries, 1983, 2(2): 115-124.
[13] 苏秀榕, 李太武, 丁明进. 裙带菜孢子叶营养成分分析[J]. 营养学报, 1994, 16(2): 236-239.
Su X, Li T, Ding M. Analysis of the nutrients in sporophyll ofUndariapinnatifida(Harv.) Suri[J]. Acta Untrimenta Sinica, 1994, 16(2): 236-239.
[14] 付小梅, 高淑清, 孙侠. 裙带菜的生理药理作用研究进展[J]. 癌变·畸变·突变, 2004, 16(4): 254-256.
Fu X, Gao S, Sun X. Progross on physiological and pharmacological effects ofUndariapinnatifida[J]. Carcinogenesis,Teratogenesis and Mutagenesis, 2004, 16(4): 254-256.
[15] 李宏基, 李庆扬. 裙带菜孢子体的生长发育与温度的关系[J]. 海洋与湖沼, 1966(2): 140-152.
Li H, Li Q, Li H. The relation of growth, development ofUndariapinnatifida(Harv.)Sur. with temperature[J]. Oceanologia et Limnologia Sinica, 1966(2): 140-152.
[16] 王萌, 佟少明, 侯和胜. 高温胁迫对裙带菜配子体的生长和生理影响[J]. 天津农业科学, 2010, 16(3): 24-26.
Wang M, Tong S, Hou H. Effects of high temperature stress on growth and physiology of gametophytes ofUndariapinnatifida[J]. Tianjin Agricultural Science, 2010, 16(3): 24-26.
[17] 杜秀敏,殷文璇,赵彦修,等. 植物中活性氧的产生及清除机制[J]. 生物工程学报, 2001(2): 121-125.
Du X, Yin W, Zhao Y, et al. The production and scavenging of reactive oxygen species in plants[J]. Chinese Journal of Biotechnology, 2001(2): 121-125.
[18] 胡敦清, 索如瑛, 刘绪炎, 等. 温度与裙带菜育苗的关系[J]. 海洋水产研究, 1989(10): 13.
Hu D, Suo R, Liu X, et al. The relationship between temperature and sporeling breeding ofUndaria[J]. Marine Fisheries Research, 1989(10): 13.
[19] 宋洪元,雷建军,李成琼. 植物热胁迫反应及抗热性鉴定与评价[J]. 中国蔬菜,1998(1): 50-52.
Song H, Lei J, Li C. Identification and evaluation of plant heat stress response and heat resistance [J]. China Vegetables, 1998(1): 50-52.
[20] 李耕. 裙带菜低温水育苗[J]. 科学养鱼, 2003(6): 23.
Li G. Low-temperature water breeding ofUndariapinnatifida[J]. Scientific Fish Farmin, 2003(6): 23.
[21] 张容芳, 唐东山, 刘飞. 藻类抗氧化系统及其对逆境胁迫的响应[J]. 环境科学与管理, 2011, 36(12): 21-25.
Zhang R, Tang D, Liu F. Alage antioxidant system and its influence on stress[J].Environmental Science And Management, 2011, 36(12): 21-25.
[22] Yogesh Mishra, Poonam Bhargava, Lal Chand Rai. Differential induction of enzymes and antioxidants of the antioxidative defense system in Anabaena doliolum exposed to heat stress[J]. Journal of Thermal Biology, 2005, 30(7): 524-531.
[23] Tóth S Z, Nagy V, Puthur J T, et al. The physiological role of ascorbate as photosystem II electron donor: protection against photoinactivation in heat-stressed leaves[J]. Plant Physiology, 2011, 156(1): 382-392.
[24] Mano J, Ushimaru T, Asada K. Ascorbate in thylakoid lumen as an endogenous electron donor to photosystem II: protection of thylakoids from photoinhibition and regeneration of ascorbate in stroma by dehydroascorbate reductase[J]. Photosynthesis Research, 1997, 53(2-3): 197-204.
[25] 华春, 王仁雷, 刘友良. 外源 AsA 对盐胁迫下水稻叶绿体活性氧清除系统的影响[J]. 作物学报, 2004, 30(7): 692-696.
Hua C, Wang R, Liu Y. Effect of exogenous ascorbic acid on active oxygen scavenging system in chloroplasts of rice under salt stress[J]. Acta Agronomica Sinica, 2004, 30(7): 692-696.
[26] Hay C H, Luckens P A. The Asian kelpUndariapinnatifida(Phaeophyta: Laminariales) found in a New Zealand harbour[J]. New Zealand Journal of Botany, 1987, 25(2): 329-332.
[27] Sanderson J C. A preliminary survey of the distribution of the introduced macroalga,Undariapinnatifida(Harvey) Suringer on the east coast of Tasmania, Australia[J]. Botanica Marina, 1990, 33(2): 153-158.
[28] Casas G N, Piriz M L. Surveys ofUndariapinnatifida(Laminariales, Phaeophyta) in Golfo Nuevo, Argentina[J]. Hydrobiologia, 1996, 326(1): 213-215.
[29] Silva P C, Woodfield R A, Cohen A N, et al. First report of the Asian kelpUndariapinnatifidain the northeastern Pacific Ocean[J]. Biological Invasions, 2002, 4(3): 333-338.
责任编辑 朱宝象
Effect of Temperature on the Antioxidation System of JuvenileUndariapinnatifidaSporophyte
GONG Qing-Li, WANG Peng, WANG Xiao-Yan, LIU Yan
(College Of Fisheries, Ocean University of China, Qingdao 266003, China)
To determine the effect of temperature on the capacity of antioxidation of Undaria pinnatifida, content of ROS, activity of antioxidant enzymes and content of antioxidants were measured in juvenile sporophyte of U. pinnatifida at different temperatures (12, 20, 24 and 28 ℃). The results showed that, high temperatures (20, 24 and 28 ℃) increased ROS and changed the activity of diverse antioxidant enzymes and content of antioxidants in comparison with the control temperature (12 ℃). The total antioxidant capacity of U. pinnatifida remained constant at appropriate temperature (12 ℃). When exposured at a slighter degree of high temperature (20 ℃), the content of O2-and H2O2 in organism increased rapidly and reached the maximum at 36h, while the activity of SOD raised at the same time, to transform O2-into H2O2. Although activity of CAT and POD and content of GSH kept almost constant, H2O2was eliminated slowly by the increased AsA and the basic antioxidant capacity of organism. When temperature rose to 24 ℃, the damage was increased. Besides SOD, the activity of POD rose dramatically in a short period of time, accompanying with the accumulation of GSH and AsA. Therefore the content of H2O2was kept in a normal level. If the temperature exceeded the tolerance limit of U. pinnatifida(28 ℃), all of activity of studied antioxidant enzymes decreased. MDA accumulated in 36 h, which can destruct the plasma membrane permeability and lead to alga death eventually. The results of this study illustrated the important role of antioxidation system regulation in the adaptation to different ambient temperatures of young U. pinnatfida sporophyte. Consequently, the study provided some
to explain why this specie is widely distributed, investigate the adaptive mechanism of U. pinnatfida to adverse environmental conditions and breed high temperature tolerant strains.
Undariapinnatifida; juvenile sporophyte; temperature; antioxidation system
国家海洋局公益性项目(201405040-4)资助
2016-07-29;
2016-09-23
宫庆礼(1965-),男,教授,主要从事大型海藻生理生态研究。E-mail:qingli@vip.sina.com
** 通讯作者:E-mail:qd_liuyan@ouc.edu.cn
S917.3
A
1672-5174(2016)11-091-08
10.16441/j.cnki.hdxb.20160273
宫庆礼, 王鹏, 王晓艳, 等. 温度对裙带菜幼孢子体抗氧化系统的影响[J]. 中国海洋大学学报(自然科学版), 2016, 46(11): 91-98.
GONG Qing-Li, WANG Peng, WANG Xiao-Yan, et al. Effect of temperature on the antioxidation system of juvenileUndariapinnatifidasporophyte [J]. Periodical of Ocean University of China, 2016, 46(11): 91-98.
Supported by Public Science and Technology Research Funds Projects of Ocean(201405040-4)

