禽致病性大肠杆菌Ⅵ型分泌系统2 evfC基因缺失株的构建及其生物学特性分析
王 栋,王少辉,孟庆美,刘 新,许 漩,杨登辉,韩先干,丁 铲,张焕荣,于圣青
(1. 西南民族大学生命科学与技术学院,成都610041;2. 中国农业科学院上海兽医研究所,上海 200241)
禽致病性大肠杆菌Ⅵ型分泌系统2 evfC基因缺失株的构建及其生物学特性分析
王栋1,2,王少辉2,孟庆美2,刘新2,许漩2,杨登辉2,韩先干2,丁铲2,张焕荣1,于圣青2
(1. 西南民族大学生命科学与技术学院,成都610041;2. 中国农业科学院上海兽医研究所,上海 200241)
为了分析VI型分泌系统2(Type VI secretion system2,T6SS2)核心组分EvfC对禽致病性大肠杆菌(Avian pathogenic Escherichia coli,APEC)生物学特性及致病性的影响,本研究采用Red同源重组系统构建APEC evfC基因缺失株,并利用低拷贝质粒pSTV28构建互补株。然后比较分析野生株、缺失株与互补株的生长曲线、运动性、生物被膜形成能力、黏附侵袭能力、胞内存活能力、动物致病力等生物学特性差异。结果表明,evfC基因缺失不影响APEC的生长速度、运动性、生物被膜形成能力、黏附侵袭能力。然而,缺失evfC可导致APEC在HD-11胞内存活能力及对雏鸭的致病力降低。本研究为阐述APEC T6SS2的致病作用提供了参考依据。
禽致病性大肠杆菌;Ⅵ型分泌系统2;evfC基因;缺失
禽致病大肠杆菌(Avian pathogenic E. coli,APEC)属于肠道外致病性大肠杆菌(Extraintestinal pathogenic E. coli,ExPEC),能够引起鸡、鸭和其他禽类局部或全身感染,造成家禽较高的死亡率和发病率,严重危害我国养禽业的健康发展[1]。另外,APEC与人ExPEC具有共同的毒力因子和致病机制,能够引起人和哺乳动物发病[2,3],对人类具有潜在威胁。
病原菌的毒力往往与毒力因子有关,毒力因子的转运需要分泌系统的参与。Ⅵ型分泌系统(typeⅥ secretion system,T6SS)是仅存于革兰阴性菌中一种蛋白转运系统,属于接触依赖性分泌系统,能够一步将效应蛋白分泌到胞外或者靶细胞内。研究表明T6SS与APEC的毒力有关[4],然而T6SS在不同的细菌、不同的环境下具有不同甚至相反的功能,比如增强细菌毒力[5]、调节菌间关系[6]、以及抑制细菌的复制和毒力等[7]。T6SS由20多种蛋白组成,其中细胞器运输蛋白质(DotU)、溶血素共调节蛋白质(Hcp)、缬氨酸谷氨酸重复蛋白(VgrG)、ATP水解酶(ClpB)和胞内增殖蛋白(intracellular multiplication factor,IcmF)是其核心蛋白。DotU具有稳定蛋白分泌装置的作用,与细菌毒力密切相关[8,9]。Hcp是六形环长管道结构,VgrG具有类似于T4噬菌体的针尖样结构,Hcp能够和VgrG连接,利用VgrG穿刺包细胞膜将效应蛋白注入靶细胞[10]。Hcp和VgrG不仅是T6SS结构蛋白,而且还是T6SS的效应蛋白。ClpB是AAA+ATP超家族的成员,具有ATP酶区域,普遍认为其为分泌系统提供能量[11]。IcmF有3个跨膜螺旋结构,参与稳定分泌系统,IcmF(SciS)在沙门菌致病过程中发挥重要作用[12]。然而,但IcmF(EvfC)对APEC毒力的影响尚不清楚。因此,我们构建了APEC DE719菌株T6SS2分泌系统evfC基因的缺失株及其互补株,对其生物特性进行分析,为进一步研究APEC的致病力提供参考。
1 材料与方法
1.1菌株、质粒、细胞和实验动物APEC菌株DE719由本实验室自病鸭体内分离,经鉴定为O2血清型,对鸡、鸭具有致病性[8];大肠杆菌DH5α购自天根(北京)生化科技有限公司;质粒pKD46、pKD3、pCP20、pSTV28由本实验室保存;鸡成纤维细胞DF-1和禽巨噬细胞HD-11由本实验室保存;1日龄樱桃谷鸭购自江苏省江阴市某种鸭场。
1.2主要试剂和仪器质粒提取试剂盒购自天根(北京)生化科技有限公司;2×PCR Mix、DNA Marker购自北京康为世纪生物科技有限公司;L-阿拉伯糖购自Sigma公司;限制性内切酶购自大连TaKaRa公司;DMEM培养基、胎牛血清购自Gibco公司;PCR仪购自ABI公司;电转化仪购自Bio-Rad公司。
1.3引物设计根据APEC DE719菌株T6SS2基因序列(GenBank登录号:KM251715.1),设计evfC基因缺失引物、缺失鉴定引物及互补引物(表1),由英潍捷基(上海)贸易有限公司合成。

表1 本研究中使用的引物Table 1 Primers used in this study
1.4缺失株及互补株构建利用Red同源重组系统[13]构建evfC基因缺失株。首先以引物evfC缺失-F/evfC缺失-R扩增含有evfC上下游基因同源臂的氯霉素抗性片段,将其电转化入表达Red同源重组酶的DE719感受态细胞中,涂布氯霉素抗性平板。挑取单克隆,采用PCR及测序鉴定evfC基因缺失株。以DE719基因组为模板,以引物evfC互补-F/evfC互补-R扩增evfC基因,经双酶切后克隆至pSTV28质粒,构建互补质粒pSTV28-evfC。测序正确后电转化入缺失株DE719ΔevfC中,构建互补株DE719CΔevfC。
1.5生长曲线及运动性测定测定不同菌株的生长速度及运动性,分析T6SS核心组分EvfC是否影响APEC的生长及运动特性。取新鲜培养的菌液,按1:100接种于LB培养基,37℃、200 r/m振荡培养,每小时取样并测定菌液的OD600,记录并绘制生长曲线图。培养至OD600=1时,将1 μL新鲜菌液分别点样于0.3%琼脂LB平板上,37℃静置培养12 h,测定细菌运动直径。
1.6生物被膜形成能力测定采用96孔微孔板法测定不同菌株的生物被膜形成能力。将野生株DE719、evfC基因缺失株、evfC基因互补株新鲜菌液按每孔200 μL加入96孔聚苯乙烯微孔板,37℃培养24 h。弃去培养液,用无菌PBS洗涤3次后加入200 μL结晶紫溶液染色30 min。然后用无菌PBS洗涤5次,自然风干后加入200 μL 95%乙醇,作用5~10 min,测定OD595,以无菌培养基作为阴性对照。
1.7细胞黏附与侵袭试验将新鲜培养菌液用DMEM洗涤后,按MOI=100感染鸡成纤维细胞DF-1,于37℃、5% CO2的细胞培养箱中感染2 h,以DMEM作为阴性对照。然后以无菌PBS洗涤后,用Triton-X 100裂解细胞并倍比稀释,涂平板,进行菌落计数。细胞侵袭试验与细胞黏附试验的感染方式相同,感染2 h后以无菌PBS洗涤3次,用含有庆大霉素的DMEM作用1 h杀死胞外细菌。然后用Triton-X 100裂解细胞并倍比稀释,涂平板,进行菌落计数。
1.8胞内存活试验检测不同菌株在禽吞噬细胞HD-11内存活能力,细菌及细胞的准备同黏附及侵袭试验。细菌感染HD-11细胞1 h后,用PBS洗涤3次,再用含庆大霉素(100 μg/mL)的DMEM作用1 h杀死胞外细菌,此时计为侵袭始点(0 h),然后用含庆大霉素的DMEM继续培养细胞6、12、24 h,分别裂解细胞,倍比稀释涂平板,进行菌落计数,绘制胞内存活曲线。
1.9LD50测定将处于对数生长期细菌用无菌PBS洗涤、重悬,调整OD600=1,10倍梯度稀释后,以腿部肌肉注射攻毒7日龄樱桃谷鸭(0.2 mL/只),每个稀释度注射8只,连续观察7 d,记录发病死亡情况,按照改良寇氏法计算半数致死量(LD50)。
2 结果
2.1基因缺失株、互补株的构建及鉴定挑取疑似基因缺失株进行PCR鉴定,结果显示缺失株DE719ΔevfC内侧鉴定引物无法扩增出evfC基因(图1A);外侧鉴定引物可以扩增出替换evfC基因的氯霉素抗性片段(1623 bp)(图1B)。PCR产物测序结果表明缺失株DE719ΔevfC构建成功。以DE719基因组为模板,利用互补引物扩增evfC基因互补片段,构建pSTV28-evfC互补质粒,测序正确后,电转化入缺失株DE719ΔevfC中,获得互补株DE719CΔevfC(结果未展示)。

图1 内外侧引物鉴定基因缺失株DE719ΔevfCFig. 1 Identifi cation of mutant strain DE719ΔevfC with different primers
2.2生长曲线和运动性检测生长曲线结果显示DE719、DE719ΔevfC和DE719CΔevfC的生长速度无显著差异,表明evfC基因不影响DE719的生长速度(图2A)。基因缺失株及互补株的运动性与野生株相比差异不具备显著统计学意义(P>0.05)(图2B),表明T6SS2核心组分EvfC不影响APEC的运动性。

图2 野生株DE719、缺失株DE719ΔevfC和互补株DE719 CΔevfC的生长曲线和运动性Fig. 2 Growth kinetics and motility assays of DE719, DE719ΔevfC and DE719CΔevfC
2.3生物被膜形成能力测定生物被膜形成能力测定结果显示,DE719ΔevfC的生物被膜形成能力与野生株相同,表明T6SS2核心组分EvfC不影响APEC DE719生物被膜的形成(图3)。

图3 野生株DE719、缺失株DE719ΔevfC和互补株DE719 CΔevfC的生物被膜生成能力测定Fig. 3 Determination of the bacterial biofi lm formation for DE719, DE719ΔevfC and DE719CΔevfC
2.4黏附侵袭试验黏附侵袭结果显示,缺失株DE719ΔevfC对DF-1细胞的黏附侵袭能力高于野生株DE719,然而差异不具备显著统计学意义(P>0.05)(图4),表明evfC基因不影响APEC对DF-1细胞的黏附及侵袭。

图4 野生株DE719、缺失株DE719ΔevfC和互补株DE719 CΔevfC对DF-1细胞黏附侵袭能力Fig. 4 Adhesion and invasion capacity of DE719, DE719ΔevfC and DE719 CΔevfC to DF-1 cells
2.5胞内存活能力检测胞内存活试验结果显示,缺失株DE719ΔevfC对禽巨噬细胞HD-11的侵袭能力高于野生株DE719,但差异不具备显著统计学意义(P>0.05)。然而,缺失株DE719ΔevfC在HD-11细胞内的存活能力显著低于野生株(P<0.05),但互补株DE719CΔevfC的胞内存活能力没有回复到野生株水平(图5)。

图5 野生株DE719、缺失株DE719ΔevfC和互补株DE719ΔevfC的胞内存活能力检测Fig. 5 Invasion and intracellular survival capacity of DE719, DE719ΔevfC and DE719CΔevfC
2.6致病力测定分别以DE719、缺失株DE719ΔevfC和互补株DE719CΔevfC感染雏鸭,结果显示缺失株DE719ΔevfC的致病力下降了1.5倍,但是互补株的致病力没有回复到野生株水平。
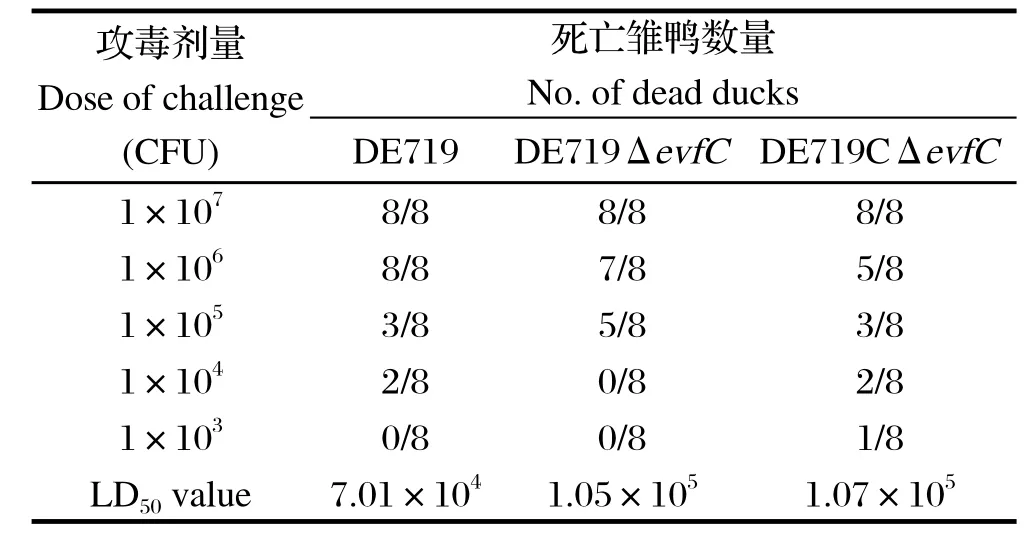
表2 野生株DE719、缺失株DE719ΔevfC和互补株DE719ΔevfC的半数致死量结果Table 2 Calculations of LD50for DE719, DE719ΔevfC and DE719CΔevfC
3 讨论
T6SS普遍存在于革兰阴性菌中,超过四分之一的不同菌种的已测序革兰阴性菌中都存在T6SS基因簇,其属于Sec依赖性分泌系统。T6SS的功能具有多样性,大部分位于细菌的毒力基因岛上[14],提示其与致病菌的致病力密切相关。但是T6SS并非只与致病力有关,共生菌的T6SS具有抑制自身毒力的作用,条件性致病菌的T6SS则可能涉及细菌间相互竞争[10]。同一细菌可以拥有多套T6SS,在致病过程中发挥不同作用。在APEC基因组发现了3个不同T6SS(T6SS1、T6SS2、T6SS3),其中T6SS1与肠黏附性大肠杆菌的T6SS相似,其核心组件ClpV和Hcp参与肌动蛋白在上皮细胞重排。T6SS3由于缺少核心组分Hcp和FHA,不具备分泌功能。T6SS2与新生儿脑膜炎大肠杆菌(newborn meningitis E. coli,NMEC)具有很高的同源性。NMEC菌株RS218的T6SS2核心组件Hcps在黏附和侵袭人脑血管内皮细胞、细胞因子和趋化因子的释放、细胞凋亡等过程中发挥重要作用[15]。我们前期已经证实T6SS2核心组分Hcp、VgrG、DotU和ClpB与APEC致病性密切相关,本研究通过构建evfC基因缺失株和互补株,分析EvfC对APEC生物学特性和致病性的影响。
本研究采用Red同源重组系统构建APEC DE719菌株evfC基因缺失株,可获得无耐药性基因缺失株,不会存在生物安全隐患。Red同源重组系统的另外一个优点是不会对缺失基因的下游基因产生极性效应,因此广泛用于大肠杆菌、沙门菌等细菌的基因缺失株构建[13]。生物学特性分析结果表明T6SS2核心组分EvfC不影响APEC的生长速度、运动性、生物被膜的形成。细胞试验结果显示evfC缺失株与野生株对DF-1细胞和HD-11细胞的黏附侵袭能力无明显差异,表明T6SS2核心组分EvfC在 APEC黏附及侵袭细胞过程中不发挥作用。然而,de Pace等[16]证明APEC T6SS中的icmF基因缺失株与野生株相比对上皮细胞的黏附侵袭能力、胞内增殖能力、生物被膜生成能力、运动性均降低。绿脓假单胞菌中T6SS(H1-T6SS、H2-T6SS和H3-T6SS)分别发挥不同作用,其中H1-T6SS针对原核生物发挥毒性作用,H2-T6SS和H3-T6SS主要参与细菌和宿主相互作用[17]。APEC也拥有三套T6SS,其作用亦不相同[18],因此在APEC T6SS1和T6SS2的 IcmF(EvfC)缺失株表现出不同的生物学特性。
胞内存活试验结果表明缺失株DE719ΔevfC在HD-11胞内的存活能力显著低于野生株,因此导致DE719ΔevfC对雏鸭的致病力下降。然而,互补株的胞内存活能力及致病力均未回复至野生株水平,有可能因为质粒互补不能使EvfC发挥稳定T6SS系统作用。研究表明沙门菌T6SS IcmF(SciS)及嗜肺性军团菌T4SS IcmF(EvfC)具有维持分泌系统稳定的作用,从而有利于细菌在细胞内的增殖[12,19]。本研究与其他研究结果一致,表明EvfC对细菌在胞内的生存繁殖发挥重要作用。本研究分析了T6SS2核心组分EvfC对APEC生物学特性和致病性的影响,为深入研究T6SS2的功能及防控禽大肠杆菌病提供参考。
[1] Ewers C, Janssen T, Wieler L H. Avian pathogenic Escherichia coli (APEC)[J]. Berl Munch Tierarztl Wochenschr, 2003, 116(9-10): 381-395.
[2] Ron E Z. Host specificity of septicemic Escherichia coli: human and avian pathogens[J]. Curr Opin Microbiol, 2006, 9(1): 28-32.
[3] Tivendale K A, Logue C M, Kariyawasam S, et al. Avianpathogenic Escherichia coli strains are similar to neonatal meningitis E. coli strains and are able to cause meningitis in the rat model of human disease[J]. Infect Immun, 2010, 78(8): 3412-3419.
[4] Filloux A, Hachani A, Bleves S. The bacterial type VI secretion machine: yet another player for protein transport across membranes[J]. Microbiology, 2008, 154(6): 1570-1583.
[5] English G, Trunk K, Rao V A, et al. New secreted toxins and immunity proteins encoded within the Type VI secretion system gene cluster of Serratia marcescens[J]. Mol Microbiol, 2012, 86(4): 921-936.
[6] Konovalova A, Petters T, Sogaard-Andersen L. Extracellular biology of Myxococcus xanthus[J]. FEMS Microbiol Rev, 2010, 34(2): 89-106.
[7] Chow J, Mazmanian S K. A pathobiont of the microbiota balances host colonization and intestinal inflammation [J]. Cell Host Microbe, 2010, 7(4): 265-276.
[8] Wang S, Dai J, Meng Q, et al. DotU expression is highly induced during in vivo infection and responsible for virulence and Hcp1 secretion in avian pathogenic Escherichia coli[J]. Front Microbiol, 2014, 5: 588.
[9] Silverman J M, Brunet Y R, Cascales E, et al. Structure and regulation of the type VI secretion system[J]. Annu Rev Microbiol, 2012, 66: 453-472.
[10] Bartonickova L, Sterzenbach T, Nell S, et al. Hcp and VgrG1 are secreted components of the Helicobacter hepaticus type VI secretion system and VgrG1 increases the bacterial colitogenic potential[J]. Cell Microbiol, 2013, 15(6): 992-1011.
[11] Suarez G, Sierra J C, Sha J, et al. Molecular characterization of a functional type VI secretion system from a clinical isolate of Aeromonas hydrophila[J]. Microb Pathog, 2008, 44(4): 344-361.
[12] Parsons D A, Heffron F. sciS, an icmF homolog in Salmonella enterica serovar Typhimurium, limits intracellular replication and decreases virulence[J]. Infect Immun, 2005, 73(7): 4338-4345.
[13] Datsenko K A, Wanner B L. One-step inactivation of chromosomal genes in Escherichia coli K-12 using PCR products[J]. Proc Natl Acad Sci U S A, 2000, 97(12): 6640-6645.
[14] Jani A J, Cotter P A. Type VI secretion: not just for pathogenesis anymore[J]. Cell Host Microbe, 2010, 8(1): 2-6.
[15] Zhou Y, Tao J, Yu H, et al. Hcp family proteins secreted via the type VI secretion system coordinately regulate Escherichia coli K1 interaction with human brain microvascular endothelial cells[J]. Infect Immun, 2012, 80(3): 1243-1251.
[16] de Pace F, Boldrin de Paiva J, Nakazato G, et al. Characterization of IcmF of the type VI secretion system in an avian pathogenic Escherichia coli (APEC) strain [J]. Microbiology, 2011, 157(10): 2954-2962.
[17] Lin J, Cheng J, Chen K, et al. The icmF3 locus is involved in multiple adaptation- and virulence-related characteristics in Pseudomonas aeruginosa PAO1[J]. Front Cell Infect Microbiol, 2015, 5: 70.
[18] Ma J, Bao Y, Sun M, et al. Two functional type VI secretion systems in avian pathogenic Escherichia coli are involved in different pathogenic pathways [J]. Infect Immun, 2014, 82(9): 3867-3879.
[19] Sexton J A, Miller J L, Yoneda A, et al. Legionella pneumophila DotU and IcmF are required for stability of the Dot/Icm complex [J]. Infect Immun, 2004, 72(10): 5983-5992.
CONSTRUTION AND BIOLOGICAL CHARACTERISTICS ANALYSIS OF TYPE VI SECRETION SYSTEM 2 CORE COMPONENT EVFC MUTANT IN AVIAN PATHOGENIC ESCHERICHIA COLI
WANG Dong1,2, WANG Shao-hui2, MENG Qing-mei2, LIU Xin2, XU Xuan2, YANG Deng-hui2, HAN Xian-gan2, DING Chan2, ZHANG Huan-rong1, YU Sheng-qing2
(1. College of Life Science and Technology, University of Southwest Nationalities, Chengdu 610041, China; 2. Shanghai Veterinary Research Institute, CAAS, Shanghai 200241, China)
To determine the roles of type VI secretion system 2 core component EvfC in Avian pathogenic Escherichia coli (APEC), we constructed the evfC gene mutant strain and complementary strain of APEC DE719 by the Red recombination system and low-copy plasmid pSTV28. Then the growth curve, motility, biofilm formation, adhesion and invasion capacity, intracellular survival capacity and virulence to duck of wild-type strain, mutant strain and complementary strain were compared and analyzed. The results showed that inactivation of evfC gene did not affect the growth, motility capacities, biofi lm formation, nor the adhesion and invasion capacities of APEC. However, the evfC gene mutant showed signifi cantly decreased survival capacity and attenuated virulence in ducks. These study would help us to understand the pathogenicity T6SS 2 in APEC.
Avian pathogenic Escherichia coli; type VI secretion system 2; evfC gene; mutant
S852.612
A
1674-6422(2016)03-0021-06
2016-03-16
国家自然科学基金项目(31572523、31370045);公益性农业(科研)专项项目(201303044);上海市科技兴农重点攻关项目(沪农科攻字(2015)第1-9号)
王栋,男,硕士研究生,预防兽医学专业
于圣青,E-mail:yus@shvri.ac.cn;张焕容,E-mail:zhrong05@163.com;王少辉,E-mail:shwang0827@126.com

