HEp-2-NS1改良细胞分离6种常见呼吸道病毒的敏感性分析
秦 笙 王玉涛 孟少伟 许振杰 关文达 陈 茶 杨子峰 江海明
1.广东省中医院检验医学部,广东广州510006;2.广州医科大学附属第一医院广州呼吸疾病研究所呼吸疾病国家重点实验室呼吸疾病国家临床医学研究中心,广东广州510230;3.广州呼研所医药科技有限公司,广东广州510663
HEp-2-NS1改良细胞分离6种常见呼吸道病毒的敏感性分析
秦 笙1王玉涛2孟少伟1许振杰1关文达2陈 茶1杨子峰2江海明3
1.广东省中医院检验医学部,广东广州510006;2.广州医科大学附属第一医院广州呼吸疾病研究所呼吸疾病国家重点实验室呼吸疾病国家临床医学研究中心,广东广州510230;3.广州呼研所医药科技有限公司,广东广州510663
目的评价HEp-2-NS1改良细胞分离培养6种常见呼吸道病毒的效果。方法以HEp-2细胞为对照,HEp-2-NS1改良细胞分别接种6种常见呼吸道病毒,包括甲型流感病毒(IFA),乙型流感病毒(IFB),腺病毒(ADV),呼吸道合胞病毒(RSV),副流感病毒1、3型(PIV1/3),通过血凝试验、细胞病变法分别进行病毒滴度检测和观察细胞病变(CPE);使用533份急性上呼吸道感染诊断的患儿咽拭子,对HEp-2-NS1细胞分离RSV的阳性率和出现CPE时间进行评价分析。结果①病毒滴度:血凝试验结果显示HEp-2和HEp-2-NS1两种细胞中IFA、IFB滴度均为1∶8,PIV1、PIV3滴度均为1∶4;CPE结果显示,RSV在HEp-2和HEp-2-NS1培养2 d后病毒滴度分别为(2.67±0.16)和(3.67±0.20),差异有统计学意义(P<0.05);ADV在两种细胞中培养3 d后病毒滴度分别为(2.67±0.18)和(3.33±0.49),差异无统计学意义(P>0.05)。②CPE检测:相比HEp-2细胞,感染RSV的HEp-2-NS1细胞培养2 d后即可出现局部范围的细胞融合病变,病变范围占全视野的30%;4 d后可在镜下清楚观察到大范围的细胞融合病变,病变范围占全视野的95%。③临床标本评价:HEp-2-NS1和HEp-2两种细胞对临床患儿咽拭子RSV的初筛分离率分别为7.50%和3.75%,差异有统计学意义(P<0.05);CPE出现时间HEp-2-NS1为(3.77±0.90)d,而HEp-2为(4.66±0.80)d,差异有统计学意义(P<0.05)。结论HEp-2-NS1细胞是一种新型的RSV鉴定细胞,为临床实验室快速分离培养RSV提供了合适的工具。
病毒培养;HEp-2-NS1细胞;呼吸道合胞病毒
目前临床实验室对病毒分离鉴定技术的认识仍较为薄弱,但另一方面临床需求却很大,两者之间反差明显。2009年4月人猪流感病毒流行,由于当时为新现病毒,PCR等方法均无能为力,WHO指出病毒分离培养是最可靠的方法之一[1]。利用呼吸道合胞病毒(RSV)非结构蛋白NS1对干扰素负调节特性[2-3],笔者构建了一株稳定表达RSV病毒NS1蛋白的HEp-2-NS1细胞[4],从细胞增殖、干扰素应答和病毒敏感性等不同方面对该细胞株进行评价,并进一步应用到实际分离鉴定工作中,务求使基础研究的成果转化为临床研究的有力武器,实践“临床与基础有机结合”的研究模式。
1 材料与方法
1.1 材料
1.1.1 细胞尧病毒
改良的HEp-2-NS1细胞由广州呼吸疾病研究所呼吸疾病国家重点实验室杨子峰教授提供,细胞对照HEp-2购自上海细胞库。甲型流感病毒(IFA,A/PR/8/ 34,1ot:7389612),腺病毒(ADV,G.B,1ot:7512088),呼吸道合胞病毒(RSV,B/Wash/18537/'62,1ot:5271356)购自ATCC;副流感病毒1、3型(PIV1、3),乙型流感病毒(IFB)为临床分离株。
1.1.2 临床标本
2010年6月~2011年2月采集深圳儿童医院533份符合急性上呼吸道感染诊断患儿咽拭子。采集后的拭子置于病毒运送培养基内,以冰盒运送至实验室后分装存放于-80℃。
1.1.3 主要试剂
细胞培养板购自CORNING公司;DMEM和胎牛血清购自Gibco公司,DMEM完全培养基补加终浓度为10%的胎牛血清;甲苯磺酰基-L-氨基联苯氯甲基酮(TPCK)-胰酶购自上海国源生物技术有限公司;0.75%的新鲜豚鼠血为自配。
1.2 方法
1.2.1 HEp-2-NS1细胞对6种常见呼吸道病毒的敏感性
1.2.1.1 接种病毒以1×105个/mL的接种浓度将HEp-2和HEp-2-NS1接种于96孔板,置37℃,5%CO2培养24 h。吸弃培养基加入10倍梯度稀释的多种常见呼吸道病毒,包括IFA、IFB、RSV、ADV、PIV1、PIV3,室温3000 r/min离心60 min。RSV、ADV补加含4%胎牛血清DMEM培养基100 μL/孔;IFA、IFB、PIV1/3补加含4 μg/mL TPCK DMEM培养基100 μL/孔;置于5%CO2、36℃培养箱培养6~8 d。
1.2.1.2 血凝试验在透明尖底板每孔加50 μL 0.75%新鲜豚鼠血,加入50 μL含IFA、IFB、PIV1/3病毒培养液,混匀,放入4℃冰箱30~60 min后观察结果。细胞凝集孔底于一点为阴性,扩散于孔面则为阳性。
1.2.1.3 细胞病变效应法检测RSV、ADV病毒滴度每天观察RSV、ADV细胞病变效应(CPE),当与细胞对照相比,感染RSV病毒的单层细胞出现局部大而形态不规则的细胞融合,形成多核巨细胞时则判断为CPE阳性。感染ADV病毒的单层细胞出现局部大而圆的固缩或致密的细胞,呈“葡萄样”或“串珠状”判断为CPE阳性。根据CPE结果,用Reed-Muench法[5]计算病毒滴度,以50%细胞感染量(TCID50)表示。
1.2.2 HEp-2-NS1细胞分离培养RSV的临床评价
使用深圳儿童医院533份符合急性上呼吸道感染诊断的患儿咽拭子。96孔细胞板准备HEp-2-NS1和HEp-2细胞,置36℃、5%CO2培养箱培养2 d即长满。咽拭子标本室温解冻后震荡20~30 s,弃去拭子,4℃3000 r/min离心5 min,取上清液接种细胞。每份标本接种上清液0.2 mL/孔,做复孔,以RSV标准株为阳性对照,同时设立阴性对照。经室温3000 r/min离心1 h后加入细胞维持培养基0.2 mL/孔,置36℃、5%CO2培养箱培养4~6 d。每天观察CPE,当与阴性对照相比,培养物的单层细胞出现局部大而形态不规则的细胞融合,形成多核巨细胞时则判断为RSV CPE阳性。登记CPE出现时间并拍照记录。
1.3 统计学方法
采用SPSS 18.0统计学软件进行数据分析,计量资料数据用均数±标准差()表示,两组间比较采用t检验;计数资料用率表示,组间比较采用χ2检验;以P<0.05为差异有统计学意义。
2 结果
2.1 HEp-2-NS1细胞对多种常见呼吸道病毒的敏感性
2.1.1 血凝试验检测HEp-2-NS1细胞对IFA尧IFB尧PIV1尧PIV3的敏感性
实验结果显示,IFA、IFB和PIV1、PIV3经HEp-2细胞和HEp-2-NS1细胞扩增后,IFA、IFB滴度均为1∶8,PIV1和PIV3滴度均为1∶4。见图1。 2.1.2细胞病变效应法检测HEp-2-NS1细胞对RSV和ADV的敏感性
2.1.2.1 病毒滴度RSV在HEp-2和HEp-2-NS1两种细胞中培养第2天TCID50为(2.67±0.16)和(3.67± 0.20),差异有统计学意义(P<0.05);第3天TCID50为(2.67±0.25)和(3.77±0.35),差异有统计学意义(P<0.05);第4天TCID50为(4.50±0.16)和(4.67±0.26),差异无统计学意义(P>0.05);第5天病毒TCID50均为(5.30±0.21)。见图2。
ADV在HEP-2和HEP-2-NS1两种细胞中培养第2天TCID50为(2.67±0.18)和(3.00±0.49);第3天TCID50为(2.67±0.18)和(3.30±0.49);第4天TCID50为(3.00±0.24)和(3.33±0.33);第5天TCID50为(3.00±0.13)和(3.33± 0.23);差异均无统计学意义(均P>0.05)。见图2。
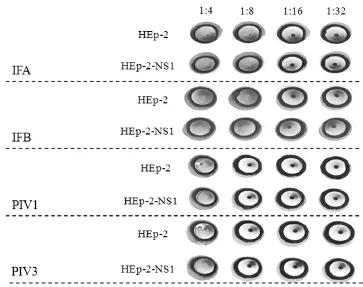
图1 HEp-2-NS1细胞对4种呼吸道病毒的血凝试验结果
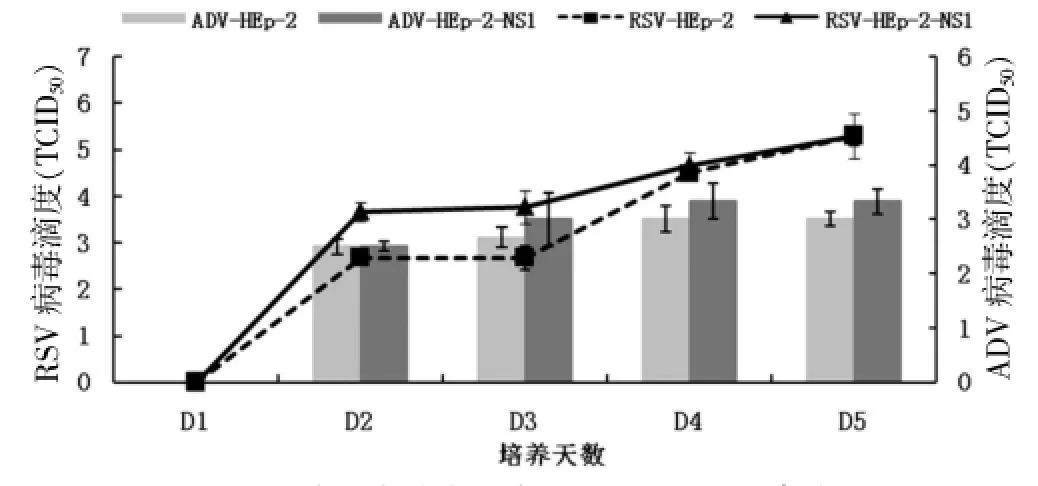
图2 细胞病变效应法检测RSV、ADV病毒滴度

图3 HEp-2和HEp-2-NS1细胞对RSV、ADV病毒敏感性比较
2.1.2.2 细胞病变效应结果感染RSV的HEp-2-NS1细胞培养2 d后出现局部范围的细胞融合病变,病变范围占全视野的30%,4 d后可在镜下清楚观察到大范围的细胞融合病变,出现多个多核巨细胞,病变范围约占全视野的95%。同时对比感染RSV的HEp-2细胞,培养2 d未发现CPE,培养4 d后出现多个小范围细胞融合病变,病变范围占全视野的45%。见图3a~d。
感染ADV的HEp-2-NS1细胞培养2 d后出现局部肿胀的细胞,细胞间隙增大;培养4 d后可见大范围细胞呈典型的葡萄串状脱落,部分细胞溶解为碎片,病变范围达全视野的95%。同时对比感染ADV的HEp-2细胞,培养2 d未发现CPE,培养4 d出现聚集、肿胀等细胞病变,病变范围约占全视野的50%。感染ADV的HEp-2和HEp-2-NS1细胞培养4天,结果如图3e~h。
2.2 HEp-2-NS1细胞分离培养RSV的临床评价
利用533份上呼吸道感染患儿标本对HEp-2-NS1细胞进行临床评价,结果发现,HEp-2-NS1和HEp-2两种细胞对RSV的CPE初筛分离率分别为7.50%(39/533)和3.75%(20/533),差异有统计学意义(P<0.05);CPE出现时间HEp-2-NS1为(3.77±0.90)d,而HEp-2为(4.66±0.80)d,差异有统计学意义(P<0.05);HEp-2-NS1细胞感染临床标本后产生RSV CPE的最早时间为48 h,比HEp-2提前24 h。
3 讨论
转基因技术早已用于科学研究,随着病毒复制分子机制不断地被揭示,发现了一些在病毒复制中起重要作用的基因调节因素,由此开发出一些基因工程细胞株。早于1988年研究人员已用改造过的CD4阳性淋巴细胞[6]和HeLa细胞[7]用于检测人类免疫缺陷病毒,并将此技术成功应用于临床检测单纯疱疹1型和2型病毒(HSV1、HSV2)[8]。Lutz等[9]建立了一株293T转基因细胞,最短能在感染病毒6 h后检出甲型流感病毒,用于甲型流感病毒的鉴定以及判断抗病毒药物治疗效果。目前国外已有商品化的MIX系列混合共培养细胞,用于检测所有已知的可培养肠道病毒属病毒[10-11]和呼吸道病毒[12-14]。Zhu等[15]成功构建Vero-ICP0-Luc细胞株,用于抗疱疹病毒药物的筛选和耐药情况的评价[16]。这些转基因细胞不但扩大了对病毒的易感谱,而且使检测敏感性有所提高[17]。
本研究使用的HEp-2-NS1细胞由HEp-2细胞经基因工程改造而成,既保留了原细胞对病毒敏感的基本特性[18-19],又具有独特的胞内自发抗干扰素等性质[4]。为了进一步考核其潜在的临床应用价值,本研究利用6种常见的呼吸道病毒株评价HEp-2-NS1细胞对不同病毒的敏感性。在实验过程中发现,虽然HEp-2-NS1细胞不能提高对病毒株的敏感性或扩展病毒谱,但在同样的感染滴度下,HEp-2-NS1对RSV和ADV的CPE产生范围和数量均有提高,出现典型CPE的时间也显著缩短。实验证明,在病毒分离鉴定过程中使用HEp-2-NS1细胞可以有效地降低RSV、ADV的结果判读难度和提高分离效率。
经过系列的实验室评价后,本研究使用533份儿科标本作临床应用评价。对于533份临床标本,HEp-2-NS1细胞同样表现出CPE典型、快速、容易判断等特点。在相同的环境下由同一经验丰富实验人员使用统一的操作步骤,HEp-2-NS1细胞的总体分离率比HEp-2细胞提高一倍,而且结果判断时间提前24 h。从初筛结果可以看出HEp-2-NS1细胞大大提高了RSV病毒的分离效率,有望成为临床RSV检测的另一个实用工具。
综上所述,新构建的HEp-2-NS1细胞是一种新型的RSV鉴定细胞,解决了部分病毒分离工作中病毒敏感性不强、报告时间慢等理论和技术问题[20],为临床实验室分离RSV提供了较为合适的细胞。
[1]WHO.Guidance to inf1uenza 1aboratories:diagnosing swine inf1uenza A/H1N1 infections of current concern[EB/OL].[2009-05-03].http://www.who.int/csr/disease/swinef1u/swinef1u_guidance_1abs_20090425.pdf.
[2]Spann KM,Tran KC,Chi B,et a1.Suppression of the Induction of A1pha,Beta,and Gamma Interferons by the NS1 and NS2 Proteins of Human Respiratory Syncytia1 Virus in Human Epithe1ia1 Ce11s and Macrophages[J]. Journa1 of Viro1ogy,2004,78(8):4363-4369.
[3]Jean FV,Ju1ie F,Sara W.Ro1e of A1pha/Beta Interferons in the Attenuation and Immunogenicity of Recombinant BovineRespiratorySyncytia1VirusesLackingNSProteins[J]. Journa1 of Viro1ogy,2003,77(15):8426-8439.
[4]秦笙,王玉涛,杨子峰,等.稳定表达呼吸道合胞病毒非结构蛋白NS1细胞的构建及其生物特性研究[J].病毒学报,2011,27(6):590-596.
[5]Reed LJ,Muench H.A simp1e method of estimating fifty percent endpoints[J].Am J Hyg,1938,27(3):493-497.
[6]Fe1ber BK,Pav1akis GN.A quantitative bioassay for HIV-1based on trans-activation[J].Science,1988,239(4836):184-187.
[7]Chesebro B,Wehr1y K.Deve1opment of a sensitive quantitativefoca1 assay for human immunodeficiency virus infectivity[J].J Viro1,1988,62(10):3779-3788.
[8]Stabe11 EC,O1ivo PD.Iso1ation of a ce11 1ine for rapid andsensitive histochemica1 assay for the detection of herpes simp1ex virus[J].J Viro1 Methods,1992,38(38):195-204.
[9]Lutz A,Dya11 J,O1ivo PD,et a1.Virus-inducib1e reporter genes as a too1 for detecting and quantifying inf1uenza A virus rep1ication[J].J Viro1 Methods,2005,126(1-2):13-20.[10]Huang YT,Yam P,Yan H.Engineered BGMK ce11s for sensitive and rapid detection of enteroviruses[J].J C1in Microbio1,2002,40(2):366-371.
[11]Buck GE,Wiesemann M,Stewart L.Comparison of mixed ce11 cu1ture containing genetica11y engineered BGMK and CaCo-2 ce11s(Super E-Mix)with RT-PCR and conventiona1 ce11 cu1ture for the diagnosis of enterovirus meningitis[J].J C1in Viro1,2002,25(Supp1 1):S13-18.
[12]Lim G,Park TS,Suh JT,et a1.Comparison of R-mix virus cu1ture and mu1tip1ex reverse transcriptase-PCR for the rapid detection of respiratory viruses[J].Korean J Lab Med,2010,30(3):289-294.
[13]Taggart EW,Crist G,Bi11etdeaux E,et a1.Uti1ity of termina1 hemadsorption for detection of hemadsorbing respiratory viruses from conventiona1 she11 via1 cu1tures for 1aboratories using R-Mix cu1tures[J].J C1in Viro1,2009,44(1):86-87.
[14]Kim JS,Kim SH,Bae SY,et a1.Enhanced detection of respiratory viruses using cryopreserved R-Mix Ready Ce11s[J].J C1in Viro1,2008,42(3):264-267.
[15]Zhu QC,Wang Y,Peng T.Herpes simp1ex virus(HSV)immediate-ear1y(IE)promoter-directed reporter system for the screening of antiherpetics targeting the ear1y stage of HSVinfection[J].JBiomo1Screen,2010,15(8):1016-1020.
[16]Wang Y,Wang Q,Zhu Q.Identification and characterization of acyc1ovir-resistant c1inica1 HSV-1 iso1ates from chi1dren[J].J C1in Viro1,2011,52(2):107-112.
[17]O1ivo PD.Transgenic ce11 1ines for detection of anima1 viruses[J].C1inMicrobio1 Rev,1996,9(3):321-334.
[18]Knipe DM,How1ey PM.Fie1ds viro1ogy[M].5th Edition. USA:Lippincott,Wi11iams&Wi1kins,2007:1615.
[19]A1ice EM,Li11ian S,He1ene WT.Cu1ture Characteristics of four permanent 1ines of human cancer ce11s[J].Cancer Res,1955,15(9):598-602.
[20]EnquistL.Viro1ogy in the 21st century[J].Journa1 of viro1ogy,2009,83(11):5296-5308.
Sensitivity analysis of 6 kinds of common resPiratory virus isolated from HEP-2-NS1 modified cell
QIN Sheng1WANG Yutao2MENG Shaowei1XU Zhenjie1GUAN Wenda2CHEN Cha1YANG Zifeng2JIANG Haiming3
1.Department of Laboratory Medicine,Guangdong Province Traditiona1 Chinese Medica1 Hospita1,Guangdong Province,Guangzhou510006,China;2.The First Affi1iated Hospita1 of Guangzhou Medica1 University State Key Laboratory of Respiratory Disease,Guangzhou Institute of Respiratory DiseaseNationa1 C1inica1 Research Center for Respiratory Disease,Guangdong Province,Guangzhou510230,China;3.Guangzhou Institute of Respiratory Disease Co.,Ltd.,Guangdong Province,Guangzhou510663,China
Objective To eva1uation of the effect of 6 common respiratory viruses iso1ated from HEp-2-NS1 modified ce11s.Methods HEp-2-NS1 modified ce11s were inocu1ated with 6 kinds of common respiratory virus,with the HEp-2 ce11s as the comparison,inc1uding inf1uenza A virus(IFA),inf1uenza B virus(IFB),adenovirus(ADV),respiratory syncytia1 virus(RSV)and parainf1uenza virus type 1 and 3(PIV1/3).The vira1 titer and cytopathogenic effect(CPE)were detected by hemagg1utination test and CPE method.533 pharyngea1 swabs from chi1dren with acute upper respiratory tract infection were detected in HEp-2 and HEp-2-NS1 ce11 1ine.The RSV positive rate iso1ated from HEp-2-NS1 ce11s and CPE time were eva1uated.Results①Vira1 titer:hemagg1utination test showed that IFA and IFB vira1 titers in HEp-2-NS1 and HEp-2 ce11 1ines were both 1∶8 and PIV1,PIV3 vira1 titers were both 1∶4.CPE resu1ts showed the vira1 titers of RSV in HEp-2 andHEp-2-NS1 were(2.67±0.16)and(3.67±0.20)after 2 days cu1tured,with statistica11y significant difference(P<0.05);whi1e the vira1 titer of ADV after 3 days cu1tured were(2.67±0.18)and(3.33±0.49),there was no statistica11y significant difference(P>0.05).②CPE detection:compared to HEp-2 ce11,the RSV ce11 fusion in HEp-2-NS1 cou1d be observed after 2 days cu1tured,the extent of disease accounted for 30%of fu11 fie1d of vision;as we11 as 95%1esions in a wide range of RSV ce11 fusion cou1d be observed c1ear1y after 4 days cu1tured.③Eva1uation of c1inica1 specimen:the separation rate of RSV in c1inica1 pharyngea1 swab with HEp-2-NS1 and HEp-2 ce11s were 7.50%and 3.75%respective1y(P<0.05).The time of RSV CPE appeared in HEp-2-NS1 was(3.77±0.90)d,whereas HEp-2 was(4.66±0.80)d,with statistica11y significant difference(P<0.05).Conclusion HEp-2-NS1 ce11 is a new kind of too1 for RSV identification,which can quick1y iso1ated cu1ture RSV in c1inica1 1aboratory.
Virus cu1ture;HEp-2-NS1 ce11;Respiratory syncytia1 virus
R373.1
A
1673-7210(2016)07(c)-0029-05
2016-04-21本文编辑:程铭)
广东省中医药局建设中医药强省科研课题(20152126);广东省省级科技项目(2013B020224006);广东省广州市科技惠民项目(2014Y2-00031)。
秦笙(1983-),男,医学硕士,主要从事临床病毒学诊断研究。
关文达(1982-),男,医学硕士,研究员,主要从事临床病毒学研究。

