日本鳗鲡肝脏表达抗菌肽2基因的克隆与表达
段明珠黄 贝梁 英张芳芳聂 品黄文树,
(1. 集美大学水产学院, 厦门 361021; 2. 鳗鲡现代产业技术教育部工程研究中心, 厦门 361021; 3. 中国科学院水生生物研究所, 武汉 430072; 4. 福建省海洋生物资源开发利用协同创新中心, 厦门 361021)
日本鳗鲡肝脏表达抗菌肽2基因的克隆与表达
段明珠1,2黄 贝1,2*梁 英1,2张芳芳1,2聂 品3黄文树1,2,4
(1. 集美大学水产学院, 厦门 361021; 2. 鳗鲡现代产业技术教育部工程研究中心, 厦门 361021; 3. 中国科学院水生生物研究所, 武汉 430072; 4. 福建省海洋生物资源开发利用协同创新中心, 厦门 361021)
为探讨鱼类抗菌肽基因的生物学功能, 研究应用RACE方法克隆获得了日本鳗鲡 (Anguilla japonica) 肝脏表达抗菌肽2基因 (Liver-Expressed Antimicrobial Peptide 2, LEAP-2), 即AJLEAP-2的cDNA序列, 全长为450 bp, 开放阅读框编码89个氨基酸。其成熟肽含有LEAP-2保守基序“C-X5-C-X4-C-X4-C”。AJLEAP-2基因组结构与其他脊椎动物LEAP-2相同, 都包含有三个外显子。利用荧光定量PCR检测了AJLEAP-2在日本鳗鲡不同组织/器官中的表达, 发现其转录子在肝脏中表达量最高, 是内参基因 (β-actin) 的6倍; 其次是肠道, 但其表达量仅为肝脏的1/130。此外, 还检测了AJLEAP-2在日本鳗鲡玻璃鳗(Glass eel)阶段的转录表达水平, 结果显示, 玻璃鳗中AJLEAP-2的转录表达量仅低于黑仔期的肝脏, 为黑仔鳗肠道表达量的2倍。LPS和迟缓爱德华菌 (Edwardsiella tarda) 刺激能显著上调鳗鲡血液中AJLEAP-2的转录表达, 刺激16h后上调倍数最高, 分别为对照组的86倍和12倍。此外, LPS刺激72h和E. tarda 刺激8h后, 肠道中AJLEAP-2显著上调表达(P<0.05), 为对照组的8倍。Poly I:C刺激24h后, 血液中AJLEAP-2转录表达显著下调。结果表明, AJLEAP-2在日本鳗鲡抗细菌感染过程中起重要的作用。
抗菌肽; LEAP-2; 日本鳗鲡; 迟缓爱德华氏菌
抗菌肽 (Antimicrobial peptides) 是一类广谱抗微生物多肽, 可抑制或杀死细菌、真菌、寄生虫和病毒等。同时, 它也是生物体非特异性免疫系统的重要组成部分, 也称宿主防御肽, 广泛存在于动、植物和细菌等生物体[1]。其主要杀菌机理是通过破坏细菌细胞膜的完整性, 使细菌内容物泄漏, 进而杀死细菌[2]。与传统抗生素相比, 抗菌肽具有不易产生耐药性和无环境污染的特性, 被视为现有抗生素的潜在替代品, 近年来已成为研究与开发的热点[3]。
肝脏表达抗菌肽2 ( Liver-Expressed Antimicrobial Peptide-2, LEAP-2 ) 是2003年Krause等[4]从人类血液中分离的一种新抗菌肽, 在中性pH时, 带 +4电荷, pI9.2。其羧基端有4个半胱氨酸残基,C1与C3、C2与C4各自形成二硫键, 因其是第二个在肝脏中发现的大量转录表达的抗菌肽, 故命名为LEAP-2。人类LEAP-2的cDNA全长为512 bp, 包含3个外显子, 2个内含子, 基因编码77个氨基酸, 包含信号肽, Prodomain域和成熟肽三部分。在血液中,LEAP-2被加工成几种不同长度的多肽, 参与抗菌活动[4,5]。抗菌活性研究发现, 巨大芽孢杆菌(Bacillus megaterium)等对重组表达和化学合成的LEAP-2都具有敏感性, 其抗菌活性与膜的亲和性相关[6]。
在鱼类中, Zhang等[7]首先从虹鳟 (Oncorhynchus mykiss) 克隆获得两个LEAP-2, 即LEAP-2A和LEAP-2B,分析发现LEPA-2存在RXXR切割位点, 酶切后形成成熟肽, 并且LEAP-2A和LEAP-2B在肝脏中均高水平转录表达, 经细菌刺激后, 肠和皮肤的转录表达量增加[7]。迄今, 已有包括斑点叉尾(Ictalurus punctatus)[8]、黄颡鱼 (Pelteobagrus fulvidraco)、牙鲆 (Paralichthys olivaceous)[9]、斑马鱼 (Danio rerio)[10]、蓝鲶 (Ictalurus furcatus)[8]、草鱼 (Ctenopharynodon idellus)[11]、团头鲂 (Megalobrama amblycephala)[12]、鲤 (Cyprinus carpio )[13]、(Miichthys miiuy)[14]、大西洋鲑 (Salmo salar)、鲫 (Carassius auratus)[15]和大黄鱼 (Larimichthys crocea)[16]等13种鱼的LEAP-2基因被克隆鉴定。与哺乳动物LEAP-2主要表达于肝脏组织中不同, 鱼类LEAP-2的组织表达模式差异较大。例如, 斑点叉尾LEAP-2在肝脏中的转录表达量远低于其他组织/器官[8],而团头鲂LEAP-2 在中肠中转录表达水平最高, 其次是脑垂体[12]。此外, 硬骨鱼类LEAP-2受外源刺激物诱导后, 转录表达模式具有一定的种属特异性[12]。如灭活的嗜水气单胞菌(Aeromonas hydrophila)刺激4h后, 草鱼肝脏中LEAP-2转录表达量上调倍数最高[11]。而灭活嗜水气单胞菌刺激72h后,团头鲂肝脏中LEAP-2的转录表达才达到高峰。
鳗鲡是中国重要的养殖鱼类, 近十年来, 鳗鲡养殖业稳定发展, 2013年, 中国鳗鲡产量达到20.6万吨, 主要集中在福建、广东和江西三省[17]。在鳗鲡养殖所发生的各种疾病中, 细菌性疾病危害最严重[18]。据调查测算, 2006年福建省养殖鳗鲡发生的疾病中, 细菌性疾病所占比例最高, 约为43%[19]。自2006年日本实施“肯定列表制度”, 对中国输日鳗鲡的药物残留进行严格控制, 给中国养鳗业造成了巨大压力。因此, 针对鳗鲡细菌性疾病的抗菌肽的研究开发显得尤为迫切。本研究克隆鉴定了日本鳗鲡抗菌肽LEAP-2基因, 并利用荧光定量PCR技术研究了该基因在日本鳗鲡各组织/器官中的表达模式, 及外源刺激后基因表达的变化, 研究结果将有助于深入了解日本鳗鲡的抗菌机制, 丰富鱼类先天免疫的理论。
1 材料与方法
1.1 实验材料
日本鳗鲡[体质量(203±53) g] 购于福建省集美大学水产养殖基地, 养殖水温 (28±2)℃;玻璃鳗[20][体长(6±2) cm]购于福建省莆田市。对日本鳗鲡(黑仔鳗)采集血液、鳃、心脏、肝脏、肠、胃、脾脏、头肾、中肾、鳔和皮肤组织/器官, 玻璃鳗采集整条。黑仔鳗样品采集及处理方法:用肝素钠预处理的无菌注射器抽取鳗鲡血液2 mL, 800×g离心20min, 去上层溶液, 收集下层细胞, 加入1 mL Trizol®reagent (Invitrogen, 美国) 和6—7颗直径3 mm玻璃珠, 组织匀浆(3000 r/min, 20s/次, 匀浆3次, Retsch MS100, 日本); 其他组织取约100 mg,同上加入玻璃珠及1 mL Trizol后, 匀浆。取整条玻璃鳗剪碎后, 同上加入玻璃珠及1 mL Trizol后, 匀浆。上述样品于-80℃保存, 备用。
免疫刺激试验: 设PBS对照组, LPS刺激组(1 mg/ 100 g鱼, Sigma), Poly I:C刺激组(1 mg/100 g鱼,Sigma), 迟缓爱德华氏菌刺激组(2×107cfu/100 g鱼),免疫方法是腹腔注射。分别在注射后8h、16h、24h和72h采样, 每组每个时间点随机取鳗鲡8尾, 每尾鱼分别采集上述11个组织/器官。
1.2 基因组DNA和总RNA的提取
DNA提取: 取日本鳗鲡肌肉100 mg, 参照 Mini-BEST Universal Genomic DNA Extraction Kit Ver.4.0 (TaKaRa, 日本)试剂盒提取基因组DNA。RNA提取: 取解冻后的组织样品200 μL, 根据Trizol®reagent试剂盒说明书提取总RNA, 每尾鱼的不同组织/器官作为独立样品提取RNA。琼脂糖凝胶电泳法检测总RNA/DNA的完整性, 利用分光光度计(Thermo, NanoDrop 2000, 美国)检测RNA或DNA的浓度及纯度。
1.3 cDNA第一链的合成
基因克隆: 取肝脏总RNA, 经RNase-free DNase I (New England Biolabs Inc, 美国) 处理后, 反转录(SMARTerTMRACE cDNA Amplification Kit,Clontech, 美国)合成第一链, 制备肝脏3′和5′RACE模板。
Real-time PCR扩增模板制备: 取4 μg总RNA用GoScripTMReverse Transcription System (Promega,美国) 反转录试剂盒反转录, 产物用TE buffer稀释,于-20℃保存, 备用。
1.4 AJLEAP-2全长cDNA的克隆和序列测定
通过分析日本鳗鲡肝脏和肾脏cDNA文库, 获得一条与鲤LEAP-2相似性为65%的EST序列, 根据EST序列设计引物(Primer Premier 6.0 软件) (表1),按照SMARTer试剂盒的说明书进行巢式PCR, 获得5′和3′末端基因片段。利用所获得的5′和3′末端序列, 设计引物AJLEAP-2_FL_F和AJLEAP-2_FL_R(表 1) 进行PCR扩增和全长cDNA验证[21]。PCR产物于1.2%琼脂糖胶上电泳, 回收 (E.Z.N.A®Gel Extraction Kit, OMEGA, 美国), 连接到pMD19-T载体(TaKaRa, 日本), 并热激转化至大肠杆菌Escherich coliDH5α中。经PCR检测阳性克隆后测序验证。

表 1 所用引物序列Tab. 1 Primers used in the present study
1.5 AJLEAP-2基因组序列扩增
用扩增cDNA全长的引物(AJLEAP-2_FL_F和AJLEAP-2_FL_R, 表1), 以肌肉基因组DNA为模板,进行PCR扩增 (LA试剂盒, TaKaRa, 日本), 反应体系25 μL: 基因组DNA 1 μL, 上下游引物(10 μmol/L)各1 μL, LA Taq DNA 聚合酶(5 U/μL) 0.25 μL,10×LA PCR Buffer II (Mg2+Plus) (TaKaRa, 日本)2.5 μL, dNTP Mixture (2.5 mmol/L) 4 μL, 反应条件为: 94℃预变性3min; 94℃变性30s, 64℃退火30s,72℃延伸2min, 35个循环; 72℃ 10min。
1.6 AJLEAP-2在日本鳗鲡不同组织器官表达量分析
荧光定量PCR采用Lightcycler 480 SYBR Green I 试剂盒 (Roche, 德国) 在Ligthcycler 480 II PCR仪 (Roche, 德国) 上进行。PCR反应体系: cDNA模板4 μL, 正向引物 (qAJLEAP-2F, 跨内含子, 10 μmol/L 0.5 μL),反向引物 (qAJLEAP-2R,10 μmol/L) 0.5 μL, LightCycler 480 SYSR Green I Master (2×) 10 μL, 补充水至20 μL。反应条件:95℃变性20s, 58℃退火20s, 72℃延伸25s, 40个循环。荧光信号采集温度为81℃。反应结束后分析扩增产物的溶解曲线, 以判定扩增产物的特异性。以β-actin作为内参比基因。梯度稀释已知拷贝数AJLEAP-2和β-actin质粒样品, 与组织/器官样品同时进行PCR扩增, 绘制标准曲线, 计算各自基因的扩增效率。
不同组织/器官中AJLEAP-2的转录表达谱, 是以不同组织/器官中(AJLEAP-2表达量)/(β-actin表达量)的1000倍来表示。不同免疫源刺激实验组的AJLEAP-2相对表达量的倍数变化, 是以相应时间点的相同组织的PBS对照组靶基因表达量为基准计算所得。
1.7 序列生物信息学分析
利用NCBI网站中的Blast (http://blast.ncbi. nlm.nih.gov/Blast.cgi) 进行序列比对; 利用ExPASy的翻译工具(http://web.expasy.org/translate/) 获得LEAP-2的氨基酸序列; ExPASy (http://web.expasy. org/compute_pi/)预测分子量和pI值; 用SignalP 4.1 Server程序 (http://www.cbs.dtu.dk/services/SignalP/)分析信号肽; 用Pfam程序(http://pfam.xfam.org/)分析结构域; SWISS-MODEL程序(http://swissmodel. expasy.org/) 预测LEAP-2基因的三级结构。利用ClustalX-2.1软件进行氨基酸序列的多重比对; 应用MEAG5.0软件, 采用邻位相接法 (NJ法) 构建了系统发育树。基因组数据来源于Ensembl网站(http:// asia.ensembl.org/index.html)。
1.8 数据统计分析
数据结果用Excel软件进行计算, 用单因素变量方差分析法 (ANOVA) 分析免疫原刺激样品间AJLEAP-2表达量差异, 利用 Dunnettt-Test (2-sided)进行多重比对。所有数据均用平均值±标准误差(SEM) 的方式表示, P<0.05 表示差异显著, P<0.01表示差异极显著。利用GraphPad.Prism.v5.0软件进行作图。
2 结果
2.1 日本鳗鲡AJLEAP-2基因序列分析
通过RACE 和PCR的方法克隆获得日本鳗鲡LEAP-2 (AJLEAP-2) 的全长cDNA 序列(GenBank登录号: KP893812)。AJLEAP-2 cDNA全长450 bp,包括5′ UTR 60 bp、开放阅读框(ORF) 270 bp和3′UTR 120 bp, 其中3′ UTR中有保守的终止信号(AATAAA)。推导的AJLEAP-2前体肽分子量为9.66 kD, pI为9.33。该前体肽包括三个部分: N-端26氨基酸残基为信号肽部分; 随后22个氨基酸残基为原结构域 (Prodomain),该结构域的C-末端含有成熟肽切割位点(RXXR); C-末端的41个氨基酸残基为成熟肽 (其分子量为4.78 kD, pI 8.86), 含有哺乳动物和鱼类LEAP2高度保守的4个半胱氨酸残基,其基序为-C-X5-C-X4-C-X4-C-,其中C65与C76、 C71与C81可能形成二硫键。
高等脊椎动物 (哺乳类和鸟类) LEAP-2原前体肽 (Proprepeptide) 为76—77肽, 其中信号肽部分含22个氨基酸残基, 成熟肽为40肽, pI为9.37; 两栖类LEAP-2的前体肽为80肽, 信号肽为24肽, 成熟肽为40肽, pI为9.58; 而鱼类LEAP-2的前体肽较为多样,总长度为78—102个氨基酸残基, 成熟肽包含37—46个氨基酸残基, 成熟肽的pI 6.79—9.2。根据信号肽、Prodomain及成熟肽的长度和等电点不同,鱼类的LEAP-2可以区分为三型, 即A、B、C型: 高等脊椎动物和硬骨鱼C型LEAP-2成熟肽的长度小于或等于40个氨基酸残基, 而硬骨鱼A、B型的均大于40个氨基酸残基(表 2); 高等脊椎动物和硬骨鱼的C型LEAP-2的Prodomain区长度小于18个氨基酸, 而硬骨鱼的A和B型的较大, 一般大于22个氨基酸 (表 2); 哺乳类、鸟类、两栖类和大多数的硬骨鱼C型的成熟肽pI大于9, 硬骨鱼A型的pI为7—9, 而硬骨鱼B型的pI (除虹鳟为8.94) 均小于7 (表 2)。

表 2 各物种LEAP-2基因的GenBank登录号及序列信息Tab. 2 GenBank accession number and sequence information for LEAP-2 genes in vertebrates
利用AJLEAP-2_FL_F和AJLEAP-2_FL_R引物对日本鳗鲡基因组进行LA-PCR扩增, 获得AJLEAP-2基因组序列, GenBank登录号为: KR013137。用Spidey软件对基因组序列与cDNA序列进行比对,结果显示, AJLEAP-2的开放阅读框包含三个外显子 (69、161和40 bp)和两个内含子(868和110 bp),内含子1属于0相位, 内含子2属于2相位, 内含子剪切符合GT-AG规则。信号肽部分由外显子1及外显子2的部分序列共同编码, 成熟肽部分由外显子2的部分序列和外显子3共同编码。基因组结构比对分析结果显示, 脊椎动物LEAP-2基因的基因结构保守, 外显子大小相近。哺乳类和大多数硬骨鱼类的内含子相位相同, 内含子1均是为0相位(除鸡为1),内含子2均为2相位(除石首科的大黄鱼和鮸为0)(表 3)。脊椎动物LEAP-2的四个保守半胱氨酸的编码高度保守, 前3个半胱氨酸由外显子2编码, 第4个半胱氨酸由外显子3编码, 除爪蟾为前2个半胱氨酸由外显子2编码, 后2个半胱氨酸由外显子3编码。
2.2 LEAP-2的多重比对及系统发育树构建分析
选取哺乳类、鸟类、两栖类和硬骨鱼类等17个代表性物种的21条LEAP-2的全长氨基酸序列进行多重比对。结果显示, 所有脊椎动物LEAP-2的原前体肽包括信号肽、Prodomain区和成熟肽三个部分。哺乳类、鸟类、两栖类和硬骨鱼C型LEAP-2氨基酸全长、信号肽、Prodomain区和成熟肽长度均小于硬骨鱼A、B亚型。Prodomain区内都有保守基序为“RXXR”, 它是成熟肽的切割位点, 硬骨鱼类LEAP-2A (包括AJLEAP-2基因) 的蛋白酶水解位点基序均为“RXAR”, LEAP-2B (除虹鳟LEAP-2B为RRTR) 为“RKXR”, LEAP-2C型为“RATKR”序列(表 2)。在成熟肽的N端包含有6个高度保守的氨基酸序列: 高等脊椎动物为“M/ITPFWR”, 硬骨鱼类LEAP-2A(包括AJLEAP-2)为“MTPLWR”, LEAP-2B(除虹鳟LEAP-2B为MTPLWR)为“MSPLWR”, 而LEAP-2C少一个氨基酸“M”为“SLLWR”。
相似性分析结果显示日本鳗鲡AJLEAP-2的氨基酸序列与哺乳动物、鸟类、两栖类及其他鱼类的相似度12%—57.2%,其中与虹鳟的相似度最高为57.2%。
用MEAG 5.0软件对9个物种的15条LEAP-2成熟肽序列构建进化树。结果显示, 哺乳类、鸟类和两栖类的LEAP-2聚为一支, 硬骨鱼聚成另一支。其中硬骨鱼LEAP-2的A、B、C型又分别聚在不同的小分支中, 其中本研究的AJLEAP-2与虹鳟、斑马鱼、鲤和大黄鱼LEAP-2A亚型聚为一支, 鱼类LEAP-2B亚型与LEAP-2A型进化关系接近, 2B先聚为一小支 (虹鳟LEAP-2B与鱼类LEAP-2A聚为一支)后与LEAP-2A聚为一支, 鱼类LEAP-2C亚型聚为一支, 三种亚型最后聚为一大支后, 而高等脊椎动物LEAP-2聚为另一大支 (图 1)。
2.3 日本鳗鲡LEAP-2三级结构预测
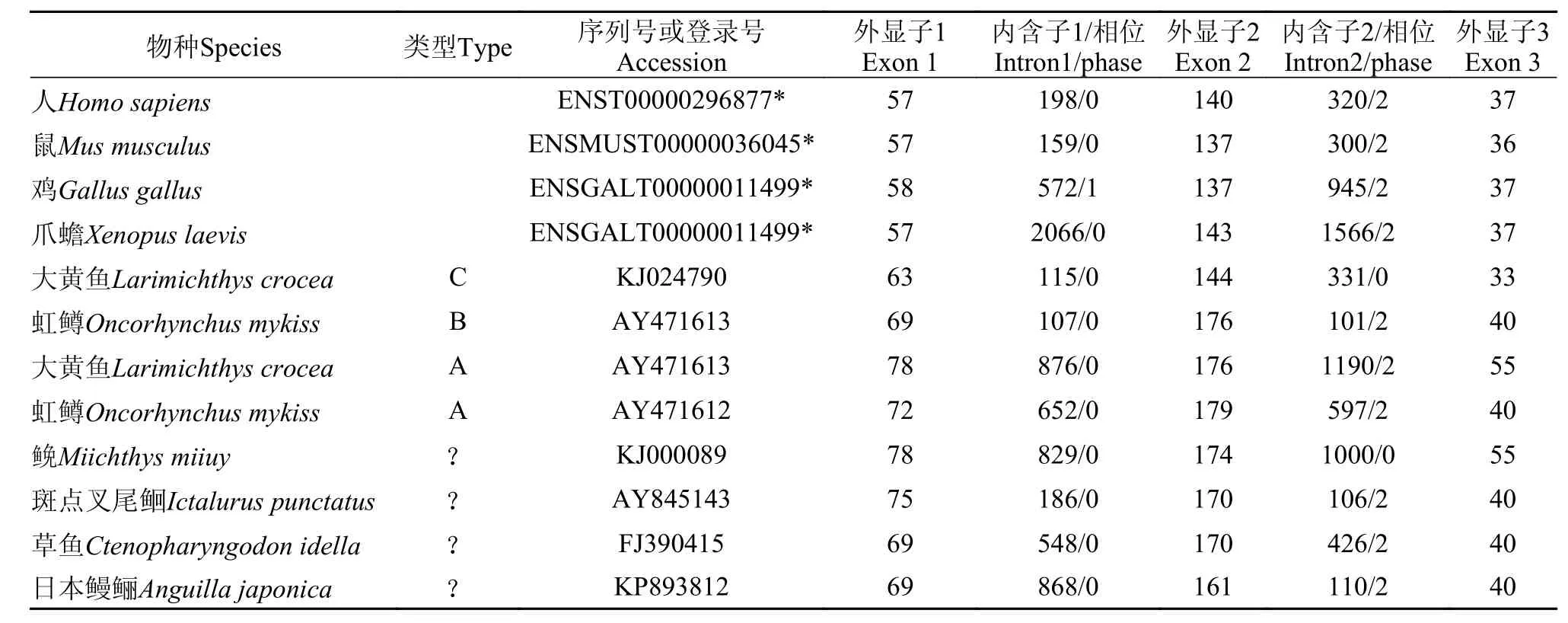
表 3 日本鳗鲡LEAP-2与其他脊椎动物LEAP-2基因组结构比较Tab. 3 Comparison of the genomic organization of AJLEAP-2 gene with its counterparts from other vertebrates
通过最佳模型的搜索发现,AJLEAP-2蛋白序列最匹配的模板是人类LEAP-2 (PDB 2l1q.1.A), 用SWISS-MODEL预测日本鳗鲡LEAP-2蛋白的三级结构(图 2)。结果显示, 日本鳗鲡LEAP-2与人类LEAP-2蛋白结构相似, 包括由两对二硫键组成的紧密中心和无序的N端、C端组成一个稳定的结构。
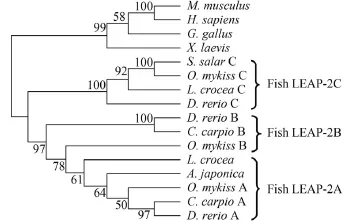
图 1 脊椎动物AJLEAP-2基因系统发育分析Fig. 1 Phylogenetic analysis of AJLEAP-2 mature peptide amino acid sequences from vertebrate
2.4 AJLEAP-2基因的组织特异性表达
利用Real-time PCR检测日本鳗鲡(黑仔鳗)的肝脏、肠、皮肤、心脏、血液、胃、头肾、中肾、鳔、脾脏、鳃等11个组织/ 器官AJLEAP-2的转录表达水平, 结果显示, AJLEAP-2在所检测的不同组织/器官中均有转录表达; 其中肝脏中的表达量最高,其平均表达量是β-actin的6倍; 其次是肠, 但其表达量仅为肝脏的1/130, 在血液, 皮肤等中表达量也相对较高。此外, 我们还检测了玻璃鳗的AJLEAP-2基因的转录表达水平。结果显示, AJLEAP-2在玻璃鳗中的表达量虽然不及黑仔鳗期的肝脏表达量,但比黑仔鳗期的其他组织/器官表达量都高, 约为肠道表达量的2倍 (图 3)。
2.5 免疫刺激后AJLEAP-2的基因表达变化
与对照组相比, LPS刺激后16h, 血液中AJLEAP-2转录表达量上调了86倍 (P<0.05), 在肠中, 刺激后72h显著性上调8倍 (P<0.05), 而肝脏则在24h显著性下调 (P<0.05)(图 4A)。Poly I:C刺激后, 血液中AJLEAP-2基因早期无显著变化, 到24h和72h显著性下调 (P<0.05), 而肠和肝脏中的AJLEAP-2无显著性差异 (P>0.05)(图 4B)。迟缓爱德华氏菌刺激后,血液中的AJLEAP-2在16h显著性上调12倍 (P<0.05), 而在24h和72h均显著下调 (P<0.05)。肠中的AJLEAP-2在被检测的时间点均上调, 在8h具有显著性差异 (P<0.05), 上调8倍。肝脏中的AJLEAP-2在被检测的时间点均无显著性差异(P>0.05)(图4C)。
3 讨论
LEAP-2是一种富含半胱氨酸的阳离子抗菌肽,首次从人类血液的超滤液中纯化获得, 后被发现在肝脏中大量表达[4],在脊椎动物抗细菌免疫应答的过程中起十分重要的作用[11,19,23]。本研究克隆了日本鳗鲡的LEAP-2基因全长cDNA序列, 在解析其基因结构的基础上, 对其表达模式进行了研究。
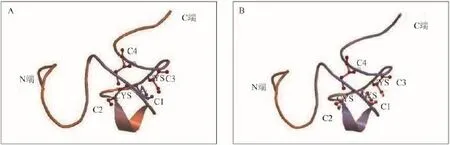
图 2 日本鳗鲡LEAP-2蛋白三级结构预测Fig. 2 Predicted tertiary structure of Anguilla japonica LEAP-2
虽然氨基酸序列相似性分析结果显示AJLEAP-2与高等脊椎动物LEAP-2基因的相似性较低(12%—23%), 但是, 其与其他硬骨鱼类LEAP-2基因的相似性较高 (54.6%—57.2%)。此外, 基因结构分析结果显示, 日本鳗鲡LEAP-2基因结构与已报道脊椎动物LEAP-2的结构类似, 由3个外显子和2个内含子组成, 且硬骨鱼类LEAP-2基因的外显子大小相近, 表明其在鱼类的进化中保持较高的保守性。
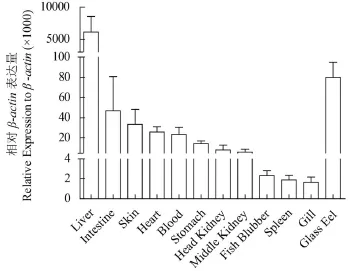
图 3 AJLEAP-2基因在健康黑仔鳗期不同组织/器官和玻璃鳗中相对表达量Fig. 3 Tissue expression of AJLEAP-2 in glass eels and different tissues/organs from Japanese eel elver
Li等[16]通过系统进化分析, 将鱼类LEAP-2分为三个亚型, 即LEAP-2A、LEAP-2B和LEAP-2C。本研究对A、B、C三型进行分析, 结果发现三种类型在基因长度, 特征序列, 成熟肽等电点等方面具有差别, 其中A型和B型除成熟肽等电点外, 其他特征较为接近, 而C型基因长度, 特征序列, 成熟肽等电点等都与高等脊椎动物的LEAP-2特征相近, 进化系统进化分析结果显示A型和B型同源关系较近, C型与两者关系较远。因此, 结合系统进化分析、氨基酸序列比对及等电点分析, 我们认为本研究所克隆获得的AJLEAP-2为A型, Zhang等[7]所报道的虹鳟LEAP-2B成熟肽的特征序列和等电点等特征更接近于其他硬骨鱼类的LEAP-2A。
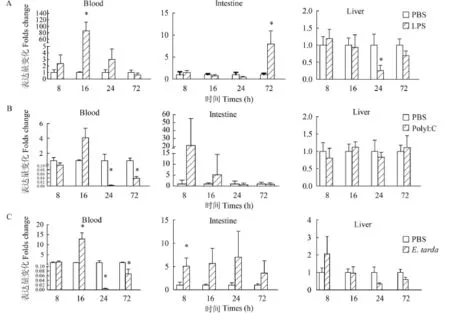
图 4 LPS(A)、PolyI:C(B)和爱德华氏菌(C)刺激后AJLEAP-2表达量变化分析Fig. 4 Differential expression of AJLEAP-2 in Anguilla japonica after being intraperitoneal injected with LPS(A), Poly I:C (B) or Edwardsiella tarda (C)
脊椎动物的LEAP-2基因在各组织/器官中广泛表达, 且主要表达于肝脏中[16]。人类LEAP-2在肝、肾、十二指肠、空肠等组织/器官中表达[4]。猪LEAP-2主要表达于肝脏, 在肾和肠也有表达[24]。鸡LEAP-2表达于肝、小肠、肺、和肾脏[22]。多数硬骨鱼LEAP-2也是在肝脏中表达量最高[7,11,13,14]。但也有例外, 如斑点叉尾LEAP-2A在肝脏中的表达量远远低于其他组织/器官[8], 鲤LEAP-2A在脾脏中表达量最高[13], 大黄鱼LEAP-2A和LEAP-2C亚型均在肠中表达量最高, 其次才为肝脏[16]。在本研究中,AJLEAP-2主要表达于肝脏, 其次在肠、心脏、皮肤、血液、胃、头肾、中肾、鳔、脾脏和鳃。这些结果表明鱼类LEAP-2基因的表达模式具有种属特异性[12]。有研究表明, LEAP-2参与了鱼类早期发育过程中的免疫应答。如草鱼LEAP-2在16细胞期和团头鲂LEAP-2受精卵发育开始高表达, 随后表达量开始降低, 孵化后LEAP-2又重新高表达[11,12]。本研究发现在日本鳗鲡玻璃鳗时期, AJLEAP-2高表达, 说明LEAP-2参与了日本鳗鲡幼体时期的先天免疫反应。
已有的研究表明, 细菌或其成分(如LPS)刺激能够显著诱导LEAP-2的表达。灭活嗜水气单胞菌刺激可显著上调草鱼肝脏、脾脏、脑和鳃组织中LEAP-2基因的表达[11]。腹腔注射鳗弧菌6h后, 鲤肝脏、脾脏、头肾、皮肤、鳃和前肠组织中LEAP-2基因显著上调表达[13]。大黄鱼感染溶藻弧菌后,其肝脏组织中LEAP-2A基因快速上调表达[16]。本研究发现, LPS和迟缓爱德华菌刺激能显著上调日本鳗鲡血液中AJLEAP-2基因的表达, 刺激16h上调倍数最高, 分别为对照组的86倍和12倍。此外LPS刺激72h和E. tarda 刺激8h后, 肠AJLEAP-2显著上调表达, 为对照组的5—8倍。而Poly I:C刺激后,AJLEAP-2在肝脏和肠中表达无显著变化, 且在刺激24h后血液中AJLEAP-2表达量显著下调, 表明AJLEAP-2基因主要参与鱼类抗细菌免疫应答。
综上所述, 本研究克隆获得了日本鳗鲡LEAP-2基因。结合其基因结构、分子特性和系统进化分析, 推断该分子为硬骨鱼类LEAP-2A亚型。此外,本研究检测了LPS、迟缓爱德华菌和Poly I:C刺激后, 日本鳗鲡LEAP-2基因的表达模式, 结果进一步证实了该基因主要参与鱼类的抗细菌免疫应答。
[1]Reddy K V, Yedery R D, Aranha C. Antimicrobial peptides: premises and promises [J]. International Journal of Antimicrobial Agents, 2004, 24(6): 536—547
[2]Leonard T N, Evan F H, Hans J V. The expanding scope of antimicrobial peptide structures and their modes of action [J]. Trends in Biotechnology, 2011, 29(9): 464—472
[3]Venugopal R, Jyh Y C. Applications of antimicrobial peptides from fish and perspectives for the future [J]. Peptides, 2011, 32(2): 415—420
[4]Krause A, Sillard R, Kleemeier B, et al. Isolation and biochemical characterization of LEAP-2, a novel blood peptide expressed in the liver [J]. Protein Science, 2003,12(1): 143—152
[5]Howard A, Townes C. Expression and functional analyses of liver expressed antimicrobial peptide-2 (LEAP-2)variant forms in human tissues [J]. Cellular Immunology,2010, 261(2): 128—133
[6]Hocquellet A, Odaert B, Cabanne C, et al. Structure activity relationship of human liver-expressed antimicrobial peptide 2 [J]. Peptides, 2010, 31(1): 58—66
[7]Zhang Y A, Zou J, Chang C I, et al. Discovery and characterization of two types of liver-expressed antimicrobial peptide 2 (LEAP-2) genes in rainbow trout [J]. Veterinary Immunology and Immunopathology, 2004, 101(3): 259—269
[8]Bao B, Peatman E. The catfish liver-expressed antimicrobial peptide 2 (LEAP-2) gene is expressed in a wide range of tissues and developmentally regulated [J]. Molecular Immunology, 2005, 43(4): 367—77
[9]Chen X W, Shi Z Y, Li Q, et al. Sequence and expression analysis of LEAP-2 gene from Paralichthys olivaceus [J]. Acta Agriculturae Boreali-sinica, 2012, 27(S1): 12—17[陈晓武, 施志仪, 李倩, 等. 牙鲆肝脏抗菌肽-2基因序列和表达分析. 华北农学报, 2012, 27(S1): 12—17]
[10]Mammalian Gene Collection (MGC) Program Team. Generation and initial analysis of more than 15,000 fulllength human and mouse cDNA sequences [J]. Proceedings of the National Academy of Sciences, 2002, 99(26): 16899—16903
[11]Liu F, Li J L, Yue G H, et al. Molecular cloning and expression analysis of the liver-expressed antimicrobial peptide 2 (LEAP-2) gene in grass carp [J]. Veterinary Immunology and Immunopathology, 2010, 133(2): 133—143
[12]Liang T, Ji W, Zhang G R, et al. Molecular cloning and expression analysis of liver-expressed antimicrobial peptide 1 (LEAP-1) and LEAP-2 genes in the blunt snout bream (Megalobrama amblycephala) [J]. Fish & Shellfish Immunology, 2013, 35(2): 553—563
[13]Gui W Y, Hong Y G. Molecular characterization of LEAP-2 cDNA in common carp (Cyprinus carpio L.) and the differential expression upon a Vibrio anguillarum stimulus; indications for a significant immune role in skin[J]. Fish & Shellfish Immunology, 2014, 37(1): 22—29
[14]Liu T X, Gao Y H, Wang R X, et al. Characterization,evolution and functional analysis of the liver-expressed antimicrobial peptide 2 (LEAP-2) gene in miiuy croaker[J]. Fish & Shellfish Immunology, 2014, 41(2): 191—199
[15]Jae S R, Chang B J, Duck H K, et al. Immune gene discovery in the crucian carp, Carassius auratus [J]. Fish &Shellfish Immunology, 2014, 36(1): 240—251
[16]Li H X, Lu X J, Li C H, et al. Molecular characterization and functional analysis of two distinct liver-expressed antimicrobial peptide 2 (LEAP-2) genes in large yellow croaker (Larimichthys crocea) [J]. Fish & Shellfish Immunology, 2014, 38(2): 330—339
[17]Fishery Department of the Ministry of Agriculture, the People’s Republic of China. China Fisheries Yearbook in 2014 [Z]. Beijing: China Agricultural Press. 2014 [农业部渔业局. 2014年中国渔业统计年鉴. 北京: 中国农业出版社. 2014]
[18]Seong J J, Eun H A, Hye J L. Bacterial pathogens and flora isolated from farm-cultured eels (Anguilla japonica)and their environmental waters in Korean eel farms [J]. Veterinary Microbiology, 2013, 163(1): 190—195
[19]Fan H P, Zhong Q F. Overview and trends of cultured eel diseases in the first half of this year [J]. Scientific Fish Aquaculture, 2006, (8): 50—51 [樊海平, 钟全福. 今年上半年养殖鳗鲡病害发生概况与流行趋势. 科学养鱼,2006, (8): 50—51]
[20]Guo H Y, Zhang Y, Tang W Q, et al. Pigmentation stages and body proportions of Anguilla japonica glass eels at the Yangtze river estuary [J]. Acta Hydrobiologica Sinica,2015, 39(1): 197—202 [郭弘艺, 张亚, 唐文乔, 等. 长江口日本鳗鲡幼体色素发育时相及其体型变化. 水生生物学报, 2015, 39(1): 197—202]
[21]Duan L P, Huang B, Zhou L H, et al. Molecular cloning,characterization and expression of two novel lectins in mud crab, Scylla paramamosain [J]. Acta Hydrobiologica Sinica, 2015, 39(2): 315—324 [段利朋, 黄贝, 周立红, 等. 拟穴青蟹两种新C-型凝集素基因的克隆与表达分析. 水生生物学报, 2015, 39(2): 315—324]
[22]Townes C L, Michailidis G, Nile C J, et al. Induction of cationic chicken liver expressed antimicrobial peptide 2 in response to Salmonella enterica infection [J]. Infection and Immunity, 2004, 72(12): 6987—6993
[23]Hocquellet A, Odaert B, Cabanne C, et al. Structure activity relationship of human liver-expressed antimicrobial peptide 2 [J]. Peptides, 2010, 31(1): 58—66
[24]Sang Y, Ramanathan B, Minton J E, et al. Porcine liverexpressed antimicrobial peptides, hepcidin and LEAP-2: cloning and induction by bacterial infection [J]. Developmental and Comparative Immunology, 2006, 30(4): 357—366
MOLECULAR CLONING AND EXPRESSION ANALYSIS OF A LIVER
EXPRESSED ANTIMICROBIAL PEPTIDE-2 IN JAPANESE EEL, ANGUILLA JAPONICA
DUAN Ming-Zhu1,2, HUANG Bei1,2, LIANG Ying1,2, ZHANG Fang-Fang1,2, NIE Pin3and HUANG Wen-Shu1,2,4
(1. Fishery College, Jimei University, Xiamen 361021, China; 2. Engineering Research Center of the Modern Technology for Eel Industry, Ministry of Education PRC, Xiamen 361021, China; 3. Institute of Hydrobiology, Chinese Academy of Sciences, Wuhan 430072, China; 4. Fujian Collaborative Innovation Center for Exploitation and Utilization of Marine Biological Resources,Xiamen 361021, China)
Liver Expressed Antimicrobial Peptide 2 (LEAP-2), a cysteine-rich cationic antimicrobial peptide, plays a vital role in the host innate immune system. In the present study, the AJLEAP-2 gene was cloned from Japanese eel (Anguilla japonica) by RACE. The length of AJLEAP-2 cDNA was 450 bp including a 270 bp ORF that encodes a putative 89-peptide. The peptide contained the conserved motif MTPFWR and the characteristic motif C-X5-C-X4-C-X4-C of LEAP-2. AJLEAP-2 has three exons similar to the counterpart from other vertebrates. The expression of AJLEAP-2 from tissue/organs of Japanese eel elver indicated the highest expression in liver that was five times higher than that of β-actin, and then in intestine that was only 1/130 the amount in liver. Additionally, AJLEAP-2 was highly expressed in glass eel, which was almost twice the amount in elver intestine. LPS and Edwardsiella tarda increased the expression of AJLEAP-2 in blood and reached the peak level at 16h post challenge increasing 86 folds and 12 folds, respectively. Both LPS and E. tarda significantly up-regulated the expression of AJLEAP-2 in intestine. Meanwhile, the transcript level of AJLEAP-2 in blood was significantly down-regulated at 24h challenged with Poly I:C. These results suggest that AJLEAP-2 may play an important role in innate immunity of Japanese eel against bacterial infection.
Anguilla japonica; LEAP-2; Antimicrobial peptide; Edwardsiella tarda
10.7541/2016.35
Q344+.1
A
1000-3207(2016)02-0252-09
2015-06-07;
2015-08-18
国家自然科学基金(31172438和U1205123); 福建省自然科学基金(2012J06008, 201311180002和2014J05042); 教育部留学回国人员科研启动金资助 [Supported by the National Natural Science Foundation of China (Nos. 31172438 and U1205123), the Natural Science Foundation of Fujian Province (Nos. 2012J06008, 201311180002 and 2014J05042) and the Projects-sponsored by SRF,for ROCS, SEM]
段明珠(1989-), 女, 湖北黄冈人; 硕士; 主要研究方向为鱼类免疫学。E-mail: dmzstiver@sina.cn; 黄贝(1982—), 男, 江西萍乡人; 博士; 主要研究方向为鱼类免疫学。E-mail: huangbei@jmu.edu.cn *共同第一作者
黄文树, 男, 博士; E-mail: wshuang@jmu.edu.cn

