脑血疏口服液对大鼠脑出血后神经功能及血肿周围半暗带细胞凋亡的影响
胡 勇,张亚红,刘重霄 ,周 任 ,师 蔚,郭振宇
脑血疏口服液对大鼠脑出血后神经功能及血肿周围半暗带细胞凋亡的影响
胡 勇1,张亚红2,刘重霄2,周 任2,师 蔚2,郭振宇2
目的 在建立大鼠脑出血(ICH)模型基础上,早期应用药物进行干预,观察大鼠神经功能缺失及脑出血血肿周围半暗带中细胞凋亡情况。方法 选用SD大鼠78只,随机分为实验组、治疗组和对照组,各组又随机分为1 h、6 h、1 d、3 d、7 d和14 d亚组。实验组注射Ⅳ型胶原酶建立ICH模型,治疗组予以药物干预,后各组分别进行神经功能测定及TUNEL法统计检测细胞。结果 脑出血模型建立后各组动物均出现不同的神经功能缺失症状,脑出血组神经功能缺失症状明显重于治疗组和对照组;对照组脑组织几乎未见TUNEL阳性细胞,实验组于6 h可见脑出血灶周围TUNEL阳性细胞最多,并随时间的延长逐渐减少,于3 d再次出现TUNEL阳性细胞高峰后下降;治疗组仅在脑出血后6 h观察到脑出血灶周围TUNEL阳性细胞数高峰,但其高峰时数量少于脑出血组,之后渐下降。结论 脑血疏口服液可以通过抑制神经元凋亡,改善神经功能缺失及减轻脑出血后继发脑损害。
脑出血;脑血疏口服液;细胞凋亡;神经功能缺失;大鼠;中风
脑出血(ICH)是严重危害人类健康的常见病和多发病,ICH后继发性脑损伤是导致ICH病人致残率和死亡率极高的重要原因之一。既使近年来神经影像诊断、神经外科微创手术和神经康复研究等方面均有较大进展,但ICH病人的疗效和预后并未有根本改观,仍然是目前神经科学研究领域的重要课题[1]。研究证实,ICH后血液成分及其降解产物和炎性细胞大量渗入脑组织中,可通过细胞凋亡造成脑组织进一步损伤[2]。脑血疏口服液(国药准字Z20070059,国家中药保护品种)具有益气、活血、化瘀之功效,临床应用发现其确实对ICH病人颅内血肿吸收及减轻脑损害起到一定作用,但其确切治疗机制仍未完全明了[3]。那么脑血疏口服液是否通过抑制ICH后血肿周围半暗带中细胞凋亡来改善神经功能及减轻继发脑损伤,目前缺乏相关研究证实。本实验拟在建立大鼠ICH模型基础上,应用脑血疏口服液进行干预,观察大鼠神经功能缺失及脑出血血肿周围半暗带中细胞凋亡,为今后阐明ICH后脑损伤的致病机制及治疗方案打下一定的基础。
1 材料与方法
1.1 动物分组 健康清洁SD大鼠78只,体重250 g~300 g,雄性,由西安交通大学动物实验中心提供。实验动物使用随机数字表法分组:实验组、治疗组和对照组。实验组和治疗组再随机分为1 h、6 h、1 d、3 d、7 d和14 d亚组,每亚组6只大鼠,对照组共6只大鼠,各组间大鼠体重无明显差异。
1.2 ICH动物模型建立 用Ⅳ型胶原酶建立ICH模型,大鼠术前12 h禁饮食4 h禁水,0.4%戊巴比妥钠腹腔麻醉(40 mg/kg),必要时水合氯醛补充麻醉,保证手术操作期间大鼠有自主呼吸,俯卧位固定于动物头颅立体定向仪上,头皮“钉子型”剪开,取前囟为原点,向右3 mm,向后1 mm,深度5 mm为注射点(尾状核),磨钻磨开颅骨,进针后缓慢注射Ⅳ型胶原酶、肝素和生理盐水混合溶液(每1 mL含Ⅳ型胶原酶0.2 U及肝素2 U),留针10 min,缓慢退针,骨蜡封闭颅骨钻孔,缝合头皮。术中注意大鼠呼吸情况并保持呼吸道通畅,大鼠体温控制在36.5℃~37.5℃,术毕动物送入有空调的动物房饲养。对照组按Ⅳ型胶原酶法注入相同剂量生理盐水;治疗组按上述造模方法每8 h灌服脑血疏口服液1 mL/kg,实验组及对照组灌服生理盐水。
1.3 观察指标 采用SPSS 20.0软件包分析。参照Longa FZ五级评分法,对造模后大鼠进行神经功能评分。取脑出血动物模型脑组织标本备用,TUNEL法染色。

2 结 果
2.1 ICH后各组神经功能缺损症状 造模后6 h将实验组大鼠尾部提起,可见大鼠左侧前肢略回收于腹下,而部分大鼠表现为追尾现象,Longa评分1分~2分;术后2 d~3 d神经功能缺失最重,表现为不能站立或有意识障碍,Longa评分3分~4分。治疗组动物神经功能缺失症状与实验组相比较轻,对照组无明显神经功能缺失表现。
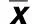
表1 ICH后各时相点神经功能评分比较(±s) 分
2.2 出血灶周围TUNEL阳性细胞 正常脑组织内极少见TUNEL阳性细胞,在实验组中TUNEL阳性细胞核染成蓝紫色,对照组脑组织几乎未见TUNEL阳性细胞;6 h时实验组出血灶周围脑组织TUNEL阳性细胞最多,明显高于治疗组(P<0.05);1 d时实验组TUNEL阳性细胞较6 h时有所下降,但仍高于治疗组(P<0.05);3 d时实验组TUNEL阳性细胞较其1 d时又有所增加,而此时治疗组TUNEL阳性细胞随时间的延长逐渐减少,并且治疗组与实验组同时段相比TUNEL阳性细胞数减少明显(P<0.05)。详见表2。
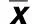
表2 各组血肿周围缺血半暗带TUNEL阳性细胞的变化(±s)
3 讨 论
有关ICH后继发性脑损伤的研究,目前观点认为ICH后继发性脑损伤的可能机制主要两大类[4-6]:一是血肿直接作用,引发神经细胞凋亡。其发病机制可能与下述几方面因素有关:①血红蛋白的作用。血红蛋白是一种含铁蛋白,出血后该物质被释放到蛛网膜下腔或脑组织内,并在其代谢过程中产生脂质过氧化反应,导致细胞膜损伤、DNA片段化,最终导致细胞坏死或凋亡。②血液其他成分的刺激。研究证实,血液中凝血酶和纤溶酶可直接导致神经组织细胞凋亡。③出血后继发的炎性反应。大量动物实验证实ICH后存在炎性细胞增生、释放炎性因子,并导致正常神经元凋亡。二是除了血肿的直接作用外,ICH后血肿对周围脑组织的压迫、脑水肿形成、局部脑组织缺血、并发蛛网膜下腔出血后脑血管痉挛等也可导致神经细胞损伤、凋亡。
细胞凋亡是一个形态学上的概念,自1972年来病理学家Kerr等提出“凋亡”概念后,引起人们对这一生物学现象的广泛兴趣。细胞凋亡与坏死是有本质区别的[7-8]。凋亡被描述成细胞的程序性崩解,细胞皱缩,胞核裂解,染色质浓缩,凋亡小体形成。而严重缺血、高温及机械性损伤等主要环境变化引起的细胞坏死现象是一种变性现象,坏死的特征是细胞质和细胞器膨胀、胞膜及胞体破裂。细胞坏死是不可逆过程,细胞结构和功能的损伤是不可逆转的,是被动的过程。而凋亡在一定条件下可被调控的。既然ICH后神经元凋亡是造成继发脑损伤的关键因素同时又是可控因素,那么临床中探寻一种行之有效的治疗ICH的方法就成为可能。
本研究提示,实验组及治疗组大鼠均出现了神经系统症状,具体表现为反应淡漠、食欲差,活动减少,肢体瘫痪,对照组大鼠正常。1 h时神经功能评分3组间差别无统计学意义,说明1 h时神经功能障碍可能由麻醉引起,没有实际意义;6 h后神经功能评分结果显示实验组明显高于其余两组,由于此时麻醉药物已代谢,故考虑与这一阶段血肿的形成、进展、压迫脑组织、脑水肿产生及局部炎症介质的毒性反应等继发性脑损伤的严重程度有关。使用脑血疏口服液的治疗组大鼠也出现神经系统症状,但症状较未使用药物实验组为轻,并且恢复快。对照组均于造模后6 h恢复进食和活动,其后未见神经系统症状出现。ICH后神经元细胞凋亡发生存在并有一定规律性,实验组凋亡发生的时间较早,且出现两次神经元凋亡高峰:早期约6 h时,晚期在3 d左右。而治疗组出现一次神经元凋亡高峰,约在6 h左右。
脑血疏口服液具有益气、活血、化瘀的作用,其主要成分为黄芪、水蛭、 石菖蒲、牛膝及川芎,主要用于“气虚血瘀”所致中风病人。近期关于脑血疏口服液的研究表明[9-13]:ICH血肿周围及血肿内部发生炎症反应,并且有中性粒细胞、巨噬细胞移行至血管外,小胶质细胞激活;ICH后1 d~7 d,有大量的多形核白细胞、单核细胞在血肿周围浸润;ICH后48 h中性粒细胞黏附于血管壁或从毛细血管和小静脉内游出。渗出的中性粒白细胞能够释放各种细胞因子,以肿瘤坏死因子-α(TNF-α)为主的多种致炎因子,破坏血脑屏障(BBB)、加重脑水肿和脑损伤。TNF-α对毛细血管有直接毒性作用,导致微小血管痉挛,增加毛细血管通透性,开放血脑屏障,加重外周白细胞浸润及脑水肿。脑血疏口服液可以减轻血肿周围多种细胞因子的参与和表达,如TNF-α、IL-1、IL-6等。
脑血疏口服液可以通过抑制神经元凋亡,改善神经功能缺失及减轻脑出血后继发脑损害,对大鼠脑出血后神经功能及血肿周围半暗带细胞凋亡调控,可能是通过抑制炎性因子产生,但该方式是否为唯一渠道,还需进一步研究证实。
[1] 王忠诚.王忠诚神经外科学[M].武汉:武汉科学技术出版社, 2005:867.
[2] Morgenstern LB, Hemphill JC, Anderson C, et al.Guidelines for the management of spontaneous intracerebral hemorrhage[J].Stroke, 2015, 5(9):2108-2129.
[3] 谢道珍, 李静, 罗林, 等.脑血疏通口服液治疗出血性中风的实验研究[J].中国中西医结合杂志, 1995,15(1): 354-357.
[4] Torfs CF.Prenatal and perinatal factors in the etiologyor cerebral palsy[J].J Pediatr, 2002, 116: 615-616.
[5] Robertson C, CMT,Finer NN, et al.School performance of surviors of neonatal encephalopathy associated with birth asphyxia at term[J].J Pediatr, 2001, 114: 753-760.
[6] Michael R,Hoane, Shelby A, et al.The effects of nicotimamide on apoptosis and blood-brain barrier breakdown following traumatic brain injury[J].Brain Research, 2006,1125:189-193.
[7] Maiese K.Neuronal survival: cellular and molecular pathways of protection[J].NY Acad Sci, 1997, 835:255-273.
[8] Leist M,Single B, Castoldi, et al.Intracellular ATP concentration: a switch deciding between apoptosis and necrosis[J].J Exp Med, 1997, 185(8): 1481-1486 .
[9] 张汝洋,季东.依达拉奉联合脑血疏口服液治疗高血压脑出血临床研究[J].中外医学研究,2011(7):125-127.
[10] 苗文才,闫睿.脑血疏口服液治疗高血压脑出血疗效观察[J].中国实用神经疾病杂志, 2014,14:12-16.
[11] 宋艳玲,原向军,尚慧娟.高压臭氧联合脑血疏口服液治疗脑梗死临床观察[J].中西医结合心脑血管病杂志, 2015,13(7):371-372.
[12] 陈尚军,王海燕,左毅, 等.脑血疏口服液治疗脑出血后继发神经功能损害的疗效观察[J].中西医结合心脑血管病杂志, 2016,14(2):199-202.
[13] 张选国,王凌.脑血疏口服液对气虚血瘀型急性脑梗死疗效及炎性指标的影响[J].中西医结合心脑血管病杂志,2016,14(3):299-300.
(本文编辑王雅洁)
1.陕西省黄陵县医院(西安交通大学第二附属医院协管医院 陕西黄陵727300);2.西安交通大学第二附属医院
郭振宇,E-mail:guozhenyu18@sina.com
R743.3 R285.5
A
10.3969/j.issn.1672-1349.2016.15.012
1672-1349(2016)15-1735-03
2016-04-16)

