pIRES-EGFP-GRK2-S670A突变质粒真核表达载体的构建与表达
马 旸,韩陈陈,李亦凡,汪 扬,魏 伟
◇技术与方法◇
pIRES-EGFP-GRK2-S670A突变质粒真核表达载体的构建与表达
马 旸,韩陈陈,李亦凡,汪 扬,魏 伟
GRK2-S670A突变体导入pIRES-EGFP真核表达载体,为寻找GRK2 磷酸化GPCR的位点提供研究基础。利用PCR定点突变试剂盒,获得pGEM-T-GRK2-S670A,用SalI/ApaI分别对pGEM-T-GRK2-S670A和EGFP-C3双酶切,构建EGFP-C3-GRK2-S670A,SalI/BamHI双酶切EGFP-C3-GRK2-S670A和pIRES-EGFP,得到pIRES-EGFP-GRK2-
pIRES-EGFP-GRK2-S670A突变质粒;重组质粒;细胞转染
G蛋白偶联受体激酶2(Gprotein-coupledreceptorkinase2,GRK2)在G蛋白偶联受体(G-protein-coupledreceptors,GPCRs)信号转导中起着重要作用[1]。GRK2结构域中不同的磷酸化位点影响GRK2的活性和功能[2-3]。MAPK磷酸化GRK2的Ser670,抑制GRK2 活性[4],调节GPCR的脱敏和内化,在心力衰竭、高血压、类风湿关节炎等疾病的发生发展过程中起着重要作用[5-7]。研究[8]表明,GRK2在类风湿关节炎的免疫细胞和滑膜细胞中高表达,芍药苷(Paeoniflorin,Pae)可以下调GRK2的活性。因此GRK2作为心衰、高血压、类风湿关节炎等疾病的治疗靶点,为靶向药物的研发提供了新的方向。为了探讨药物作用GRK2的活性位点,该研究构建了pIRES-EGFP-GRK2-S670A突变质粒真核表达载体,并使其在HEK293细胞中成功表达。
1 材料与方法
1.1 材料
1.1.1 菌种和质粒 E.coliDH5α菌株为安徽医科大学临床药理所保存;pIRES-EGFP载体、pEGFP-C3载体购自上海北诺生物科技有限公司;pGEM-T-GRK2-wt质粒为本课题组前期构建。
1.1.2 试剂和仪器 定点突变试剂盒、PrimerStarDNA聚合酶、SalI、BamHI、DNAMarkerDL10 000(美国Takara公司);ApaI(美国ThermoScientific公司);T4DNA连接酶(美国Promega公司);Lipofectamine3000Reagent(美国Invitrogen公司);胶回收试剂盒(中国TIANGEN公司); 质粒小提试剂盒(美国OmegaBio-Tek公司);小鼠抗人GRK2 抗体(美国Abcam公司);PCR扩增仪(美国BIO-RAD公司);Tanon1600全自动数码凝胶成像系统(上海天能科技有限公司);IX-70荧光倒置显微镜(日本OLYMPUS公司);2306-2型CO2培养箱(美国SHELLAB公司)。
1.2 方法
1.2.2pGEM-T-GRK2-S670A质粒的获取 以pGEM-T-GRK2-wt为模板,利用导入变异点的引物进行PCR反应后,对PCR产物进行末端平滑化及5′磷酸(P)化处理,再用高效连接试剂LigationSolutionI进行自身连接(环化反应),然后转化、提取突变体DNA,即pGEM-T-GRK2-S670A。
1.2.3 重组真核表达质粒pIRES-EGFP-GRK2-S670A的构建EGFP-C3载体和pGEM-T-GRK2-S670A质粒经SalI、ApaI双酶切,凝胶回收,在T4DNA连接酶作用下,连接EGFP-C3与GRK2-S670A,4 ℃连接过夜。经过转化、筛选、扩增,质粒提取,酶切鉴定,获得EGFP-C3-GRK2-S670A突变质粒。再将pIRES-EGFP载体和EGFP-C3-GRK2-S670A突变质粒经SalI、BamHI双酶切,连接、转化、筛选、扩增,质粒提取,酶切鉴定,获得pIRES-EGFP-GRK2-S670A突变质粒。
1.2.4HEK293细胞培养和转染HEK293细胞培养于含 10%胎牛血清的DMEM培养液中,置于37 ℃、5%CO2孵箱中培养 。消化细胞后,于6孔板内接种2×105个细胞,待细胞长至80%~90%进行转染 。转染方法根据转染试剂说明书提供的操作步骤进行。
1.2.5 蛋白提取与Westernblot检测 细胞转染48h后,收集并清洗细胞,加入含蛋白酶抑制剂的细胞裂解液,冰上裂解30min,4 ℃、13 200r/min离心15min,吸取上清液加入上样缓冲液,混匀后沸水浴中煮10min,经过上样、电泳、转膜、封闭等操作后,用GRK2抗体,4 ℃孵育过夜,第2天经过洗膜和二抗敷育后置于ImageQuantLAS4000荧光及化学发光成像系统中曝光成像。
2 结果
2.1pGEM-T-GRK-S670A的扩增 以pGEM-T-GRK2-wt质粒为模板,以GRK2-670上游引物、GRK2-670下游引物PCR扩增后,1%琼脂糖电泳结果表明,产物条带均与预期的大小一致,即线性pGEM-T-GRK-S670A目的片段(约5 000bp),见图1A。将PCR扩增产物切胶的回收产物(图1B)进行末端平滑化及5′磷酸化处理,再用高效连接试剂LigationSolutionI进行自身连接(环化反应),经双酶切初步鉴定,得到线性GRK-S670A片段(2 067bp)和线性pGEM-T片段(3 015bp),见图1C。
2.2pEGFP-C3-GRK2-S670A突变质粒的构建和鉴定 将pGEM-T-GRK2-S670A突变质粒和pEGFP-C3载体用SalI和ApaI行双酶切,1%的琼脂糖凝胶电泳上检测,切胶回收,得到线性GRK-S670A片段(2 067bp)和线性pEGFP-C3 片段(4 700bp)。将构建的pEGFP-C3-GRK2-S670A突变质粒,经酶切鉴定,得到2 067bp的GRK-S670A片段和4 700bp的线性pEGFP-C3 片段,见图2。

图1 PCR扩增产物及酶切鉴定
M:Marker;A:pGEM-T-GRK-S670APCR扩增产物;1:PCR扩增的线性pGEM-T-GRK-S670A;B:PCR产物(pGEM-T-GRK-S670A)切胶回收;1:PCR扩增产物切胶回收得到的线性pGEM-T-GRK-S670A;C:PCR产物(pGEM-T-GRK-S670A)双酶切鉴定;1:SalI和ApaI双酶切pGEM-T-GRK-S670A质粒
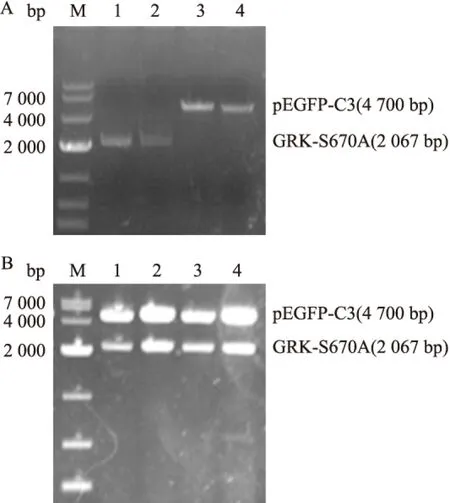
图2 pEGFP-C3-GRK2-S670A重组突变质粒的酶切及鉴定
M:Marker;A:pGEM-T-GRK-S670A质粒和pEGFP-C3质粒双酶切回收产物;1、2:SalI和ApaI双酶切pGEM-T-GRK-S670A突变质粒,切胶回收;3、4:SalI和ApaI双酶切pEGFP-C3载体,切胶回收;B:pEGFP-C3-GRK2-S670A重组突变质粒双酶切鉴定;1、2、3、4:SalI和ApaI双酶切pEGFP-C3-GRK2-S670A突变质粒
2.3pIRES-EGFP-GRK2-S670A突变质粒的构建和鉴定 将EGFP-C3-GRK2-S670A突变质粒和pIRES-EGFP载体用SalI和BamHI进行双酶切后,得到线性GRK-S670A片段(2 067bp)和pIRES-EGFP片段(5 200bp),见图3A。将构建的pIRES-EGFP-GRK2-S670A突变质粒,经SalI/BamHI双酶切鉴定,得到线性GRK-S670A片段(2 067bp的)和线性pIRES-EGFP片段(5 200bp),见图3B,基因测序结果经过序列比对正确,表明载体构建成功。
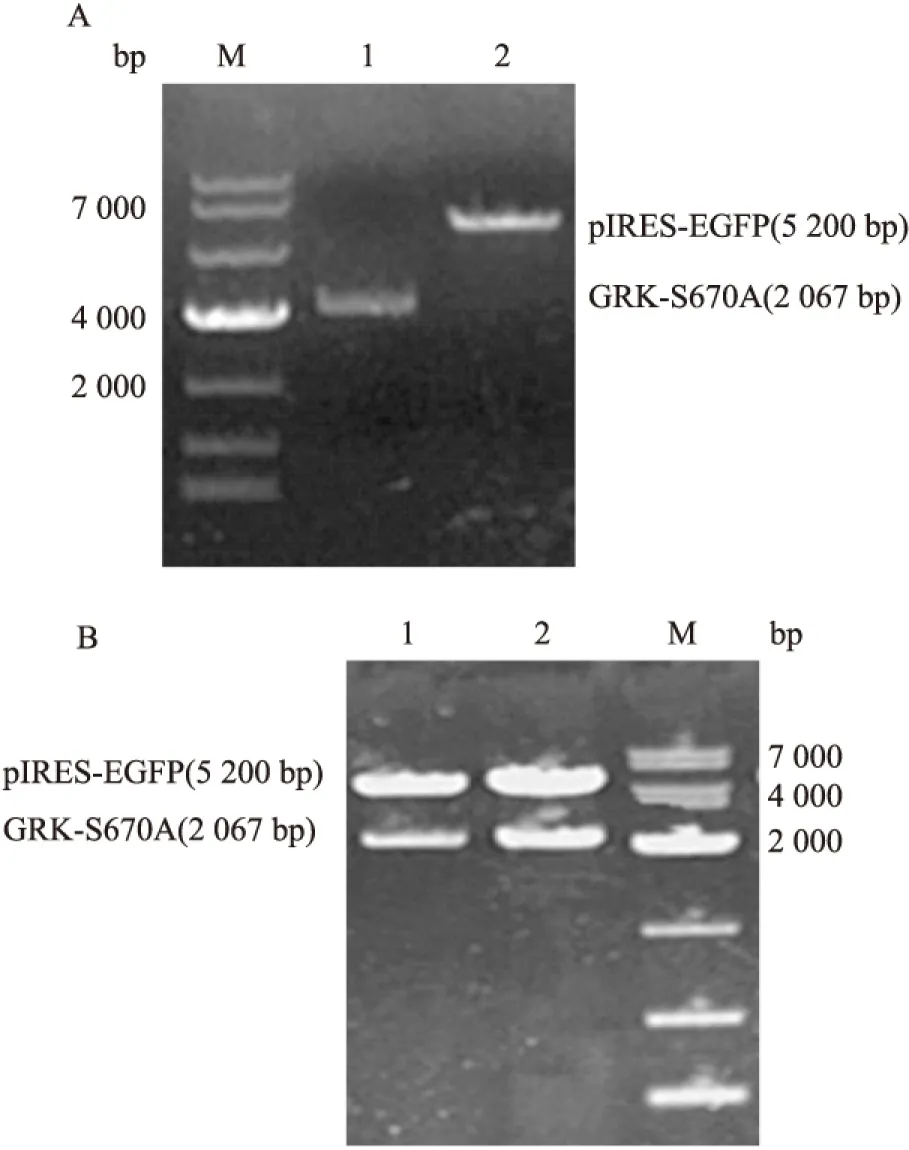
图3 pIRES-EGFP-GRK2-S670A重组突变质粒的酶切及鉴定
M:Marker;A:pEGFP-C3-GRK2-S670A质粒和pIRES-EGFP质粒双酶切回收产物;1:SalI和BamHI双酶切pEGFP-C3-GRK2-S670A,切胶回收;2:SalI和BamHI双酶切pIRES-EGFP,切胶回收;B:pIRES-EGFP-GRK2-S670A重组突变质粒酶切鉴定;1、2:SalI和BamHI双酶切pIRES-EGFP-GRK2-S670A突变质粒
2.4 荧光显微镜观察pIRES-EGFP-GRK2-S670A重组蛋白表达 在6孔板中接种人源HEK293细胞,转染pIRES-EGFP-GRK2-wt和pIRES-EGFP-GRK2-S670A重组突变质粒,培养48h后,在荧光显微镜下观察可见绿色荧光蛋白的表达,见图4。
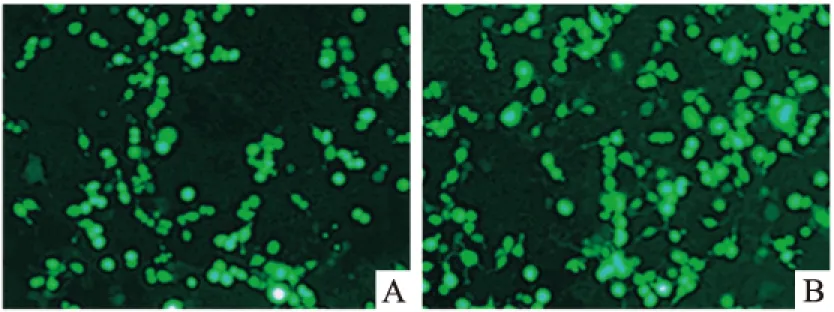
图4 荧光显微镜下观察重组质粒的表达 ×40
A:重组质粒pIRES-EGFP-GRK2-wt转染HEK293细胞48h;B:pIRES-EGFP-GRK2-S670A突变质粒转染HEK293细胞48h
2.5Westernblot法检测pIRES-EGFP-GRK2-S670A重组蛋白表达 转染空载体pIRES-EGFP-ctr、pIRES-EGFP-GRK2-wt和pIRES-EGFP-GRK2-S670A到HEK293细胞48h后,Westernblot结果表明转染GRK2-wt和GRK2-S670A的质粒可见EGFP-GRK2重组蛋白表达,同时由于使用GRK2的抗体进行检测,结果中也同时可见内源GRK2的表达。见图5。
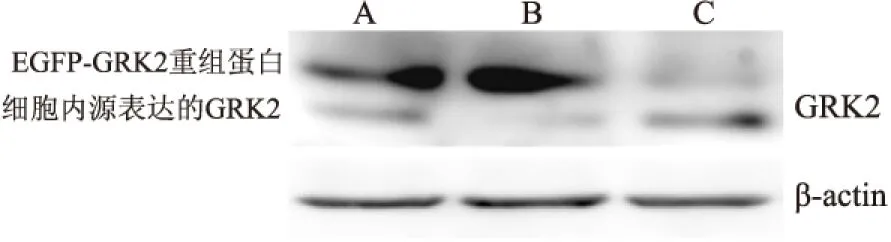
图5 Western blot法检测GRK2的重组蛋白在HEK293细胞中的表达
A:pIRES-EGFP-GRK2-wt;B:pIRES-EGFP-GRK2-S670A;C:pIRES-EGFP-ctr
3 讨论
人源GRK2由689个氨基酸残基组成,有3个重要的结构域:N末端、催化结构域、C末端[9]。N末端约有185个氨基酸组成的结构域,可以结合Gα/11、Gβγ、小窝蛋白、钙调蛋白等,含有蛋白激酶C(PKC)的磷酸化位点(Ser29)[10]及c-Src的磷酸化位点(Tyr19、86、92)[11];催化结构域约有270个氨基酸组成,有S-亚硝基化位点(Cys340)以及决定GRK2催化活性的重要位点(Lys220)[12];C末端约有230个氨基酸组成,可以结合PI3K、AKT、PIP2、钙调蛋白等,含有细胞外信号调节激酶(ERK)的磷酸化位点(Ser670)及蛋白激酶A(PKA)的磷酸化位点(Ser685)。GRK2 的Cys340发生S-亚硝基化可抑制GRK2的活性[13],ERK磷酸化GRK2的Ser670也可抑制GRK2的活性[4],而PKA磷酸化GRK2的Ser685可促进GRK2的活化[14]。对参与GRK2活性的主要位点进行点突变,构建相应的突变质粒并在真核细胞中稳定表达,对于探讨小分子化合物影响GRK2活性的机制有主要实验价值。
定点突变技术是分子生物学和蛋白质工程中常用的重要技术之一,是体外特异性取代、插入或缺失DNA序列中任何一个特定碱基的技术。通过定点突变技术可以有目的地改变DNA序列中的碱基,使之符合应用需求。常用方法有盒式取代诱导、常寡核苷酸引物诱变及PCR定点诱变等。PCR定点诱变因具有突变效率高、简便快捷、成本低及可在任何位点引入突变的优点,是DNA靶片段产生突变的首选方法。根据PCR定点诱变的技术原理,本课题组针对GRK2,分别设计带有突变碱基的诱变引物,以pGEM-T-GRK-wt为模板,通过双酶切成功获得了GRK2-S670A突变体的cDNA片段,再将这些突变的cDNA片段分别连pIRES-EGFP中,其中重组突变质粒pIRES-EGFP-GRK2-S670A转染入真核细胞以表达带有绿色荧光蛋白标记的GRK2 突变体。本实验将pIRES-EGFP-GRK2-wt和pIRES-EGFP-GRK2-S670A突变质粒分别转染入HEK293细胞后培养48h,荧光显微镜观察显示野生型与突变型在细胞定位方面并无明显差异,两者均为全细胞分布。Westernblot检测显示,重组蛋白与内源蛋白比较,条带位置略有升高,这是因为重组蛋白的分子量多出一个EGFP的分子量。
综上所述,pIRES-EGFP-GRK2-S670A突变质粒真核表达载体的成功构建及其在HEK293细胞中成功表达,将为探讨药物作用GRK2的活性位点奠定基础。
[1]WatariK,NakayaM,KuroseH.MultiplefunctionsofGprotein-coupledreceptorkinases[J].JMolSignal, 2014, 9(1):1.
[2]MushegianA,GurevichVV,GurevichEV.TheoriginandevolutionofGprotein-coupledreceptorkinases[J].PLoSOne, 2012, 7(3):e33806.
[3]PenelaP,MurgaC,RibasC,etal.ThecomplexGprotein-coupledreceptorkinase2 (GRK2)interactomeunveilsnewphysiopathologicaltargets[J].BrJPharmacol, 2010, 160(4): 821-32.
[4]NoguésL,SalcedoA,MayorFJr,etal.Multiplescaffoldingfunctionsof{beta}-arrestinsinthedegradationofGprotein-coupledreceptorkinase2[J].JBiolChem, 2011, 286(2):1165-73.
[5]HuangZM,GaoE,ChuprunJK,etal.GRK2intheheart:aGPCRkinaseandbeyond[J].AntioxidRedoxSignal, 2014, 21(14):2032-43.
[6]SantulliG,TrimarcoB,IaccarinoG.G-protein-coupledreceptorkinase2andhypertension:molecularinsightsandpathophysiologicalmechanisms[J].HighBloodPressCardiovascPrev, 2013, 20(1):5-12.
[7]StevensonNL,Martin-MartinB,FreemanJ,etal.Gprotein-coupledreceptorkinase2moderatesrecruitmentofTHP-1cellstotheendotheliumbylimitinghistamine-invokedWeibel-Paladebodyexocytosis[J].JThrombHaemost, 2014, 12(2):261-72.
[8]ChenJY,WuHX,WeiW,etal.Paeoniflorininhibitsproliferationoffibroblast-likesynoviocytesthroughsuppressingG-protein-coupledreceptorkinase2[J].PlantaMed, 2012, 78(7):665-71.
[9]EvronT,DaigleTL,CaronMG.GRK2:multiplerolesbeyondGprotein-coupledreceptordesensitization[J].TrendsPharmacolSci, 2012, 33(3):154-64.
[10]MalhotraR,D′SouzaKM,StaronML,etal.Galpha(q)-mediatedactivationofGRK2bymechanicalstretchincardiacmyocytes:theroleofproteinkinaseC[J].JBiolChem, 2010, 285(18):13748-60.
[11]HuangJ,NalliAD,MahavadiS,etal.InhibitionofGαiactivitybyGβγismediatedbyPI3-kinase-γ-andcSrc-dependenttyrosinephosphorylationofGαiandrecruitmentofRGS12[J].AmJPhysiolGastrointestLiverPhysiol, 2014, 306(9):G802-10.
[12]BeautraitA,MichalskiKR,LopezTS,etal.MappingtheputativeGprotein-coupledreceptor(GPCR)dockingsiteonGPCRkinase2:insightsfromintactcellphosphorylationandrecruitmentassays[J].JBiolChem, 2014, 289(36):25262-75.
[13]HuangZM,GaoE,FonsecaFV,etal.ConvergenceofGprotein-coupledreceptorandS-nitrosylationsignalingdeterminestheoutcometocardiacischemicinjury[J].SciSignal, 2013, 6(299):ra95.
[14]MurthyKS,MahavadiS,HuangJ,etal.PhosphorylationofGRK2byPKAaugmentsGRK2-mediatedphosphorylation,internalization,anddesensitizationofVPAC2receptorsinsmoothmuscle[J].AmJPhysiolCellPhysiol, 2008, 294(2):C477-87.
Construction and expression of the eukaryotic expressing vector of pIRES- EGFP- GRK2- S670 A mutants recombinant plasmids
MaYang,HanChenchen,LiYifan,etal
(Institute of Clinical Pharmacology, Anhui Medical University,Key Laboratory of Anti-inflammatory and Immune Medicine, Ministry of Education, Anhui Collaborative Innovation Center of Anti-inflammatory and Immune Medicine, Hefei 230032)
TheS670AmutationofGRK2wasimportedtothepIRES-EGFPeukaryoticexpressionvector,providingresearchfoundationofGRK2phosphorylationGPCRsite(s).TaKaRamutanBESTKitwasadoptedtoobtainpGEM-T-GRK2-S670A.pGEM-T-GRK2-S670AandEGFP-C3plasmidsweredouble-digestedbySalI/ApaI,toconstructEGFP-C3-GRK2-S670Aplasmid.ThenEGFP-C3-GRK2-S670AandpIRES-EGFPweredouble-digestedbySalI/BamHI,inordertobuildacompleteeukaryoticexpressionplasmidpIRES-EGFP-GRK2-S670A.TheplasmidwastransfectedinHEK293cellsandrecombinantproteinwasdetectedwithfluorescencemicroscopeandWesternblotassays.TheresultsofdigestionandDNAsequencingoftheplasmidwerecorrect,eukaryoticexpressedvectorpIRES-EGFP-GRK2-S670Amutantrecombinantplasmidwassuccessfullyconstructed,andtherecombinantproteinwasexpressedinHEK293celllinesaftercelltransfection,whichmaybethefoundationofthefollowingresearch.
IRES-EGFP-GRK2-S670Amutantsplasmids;recombinantplasmids;celltransfection
http://www.cnki.net/kcms/detail/34.1065.R.20160810.1104.034.html
2016-05-30接收
国家自然科学基金(编号:81502123、81330081);安徽省自然科学基金(编号:1308085QH130);安徽省高等学校省级自然科学研究项目(编号:KJ2014A119)
安徽医科大学临床药理研究所、抗炎免疫药物教育部重点实验室、抗炎免疫药物安徽省协同创新中心,合肥 230032
马 旸,女,博士,讲师;
魏 伟,男,博士,教授,博士生导师,责任作者,E-mail:wwei@ahmu.edu.cn
S670A。将构建的质粒转染HEK293细胞,荧光显微镜下观察和Westernblot法检测融合蛋白的表达。酶切鉴定显示pIRES-EGFP-GRK2-S670A质粒条带大小符合,测序结果正确,成功构建pIRES-EGFP-GRK2-S670A真核表达质粒,转染HEK293 细胞后可见融合蛋白表达,为后续研究奠定基础。
R394.112;R394.34
A
10.19405/j.cnki.issn1000-1492.2016.10.034

