深圳市儿童医院儿童粪便分离的459株沙门菌分布特征及耐药性
王红梅,王和平,雷 旻,周高枫,张交生,彭宝玲,张锐沐,邓继岿
(深圳市儿童医院,广东 深圳 518038)
·论著·
深圳市儿童医院儿童粪便分离的459株沙门菌分布特征及耐药性
王红梅,王和平,雷 旻,周高枫,张交生,彭宝玲,张锐沐,邓继岿
(深圳市儿童医院,广东 深圳 518038)
目的 了解儿童粪便分离沙门菌的分布特征及耐药情况。 方法 分析2012年1月—2015年10月某院患儿粪便标本分离的沙门菌检出情况,以及沙门菌血清型和对常用抗菌药物的敏感性。 结果 7 047例患儿送检粪便标本,459例患儿检出沙门菌,总检出率为6.51%。沙门菌肠炎患儿男女比为2.4︰1,其中3岁以下儿童352例(占76.69%);459株沙门菌中5—10月份检出374株(占81.48%),7、8、9月检出数量最多,分别为72、84、78株。沙门菌血清型主要为B群(69.06%)和D群(19.39%),分别以鼠伤寒沙门菌和肠炎沙门菌血清型为主。未检出耐亚胺培南和厄他培南的菌株,沙门菌属对哌拉西林/他唑巴坦、头孢吡肟、头孢他啶、氨曲南和头孢曲松的敏感率均>70%,肠炎沙门菌对头孢类抗生素的敏感率低于鼠伤寒沙门菌,但对复方磺胺甲口恶唑的敏感率高于鼠伤寒沙门菌。结论 该院儿童粪便检出的沙门菌主要分离自3岁以下婴幼儿,夏秋季节高发,血清型以鼠伤寒和肠炎沙门菌为主,抗菌药物治疗要结合血清型及药敏结果慎重选择。
沙门菌; 血清型; 儿童; 粪便; 抗药性,微生物;耐药性; 流行病学特征
[Chin J Infect Control,2016,15(11):817-820]
沙门菌是一类重要的人畜共患病原菌,是细胞内寄生的革兰阴性肠杆菌,在自然界广泛存在,除可感染人外,还可感染很多动物,受污染的动物肉类、蛋类和奶制品等食品是沙门菌的主要感染源。儿童免疫力相对低下,是沙门菌的易感人群,学龄前儿童多见,主要表现为肠炎。文献[1]报道,沙门菌血清型分布具有明显的地区差异。本研究对深圳市儿童医院2012年1月—2015年10月粪便分离的459株沙门菌进行回顾性分析,现报告如下。
1 对象与方法
1.1 菌株来源 2012年1月—2015年10月从7 047例患儿送检粪便标本中培养的沙门菌,同一患儿分离的相同菌株只收集第一株菌。
1.2 仪器及试剂 血平皿、营养琼脂、麦康凯和SS平皿购自郑州安图绿科生物工程有限公司,亚硒酸盐胱氨酸增菌培养基(SC培养基)购自江门市凯林贸易有限公司,菌株的鉴定及药敏试验为法国生物梅里埃公司VITEK 2 Compact全自动细菌鉴定药敏系统,诊断血清(60种)为宁波天润生物药业有限公司产品。
1.3 菌株分离培养 粪便标本接种SC培养基、血平板、麦康凯和SS平皿,根据《全国临床检验操作规程》(第三版)对可疑菌落进行分离、纯化,应用VITEK 2 Compact全自动细菌鉴定药敏系统进行生化鉴定和药敏试验,按照美国临床实验室标准化协会(CLSI)2014年标准判定细菌的药敏结果。
1.4 血清学分型 经生化鉴定为沙门菌属后,用沙门菌诊断血清确定血清型,生理盐水作为阴性对照,伤寒沙门菌ATCC 14028为阳性对照。
1.5 质控菌株 肺炎链球菌ATCC 49619、大肠埃希菌ATCC 25922、铜绿假单胞菌ATCC 27853和肺炎克雷伯菌ATCC 700603,均购自卫生部临床检验中心。
1.6 统计分析 应用WHONET 5.6软件对沙门菌的药敏结果进行分析。
2 结果
2.1 沙门菌检出情况及患儿临床资料 7 047例患儿送检粪便标本,共检出沙门菌459株,总检出率为6.51%,2015年检出率最高(10.37%),见表1。5—10月份检出沙门菌374株(占81.48%),7、8、9月检出数量最多,分别为72、84和78株,见表2。男性患儿检出324株,女性患儿检出135株,男女比例为2.4︰1,年龄分布1月~13岁,平均年龄(1.83±3.60)岁,其中<1岁年龄组最多,占35.95%,其次是1~2岁年龄组(占30.28%),见表3。
表1 2012年1月—2015年10月某儿童医院粪便标本中沙门菌检出情况
Table 1 Detection ofSalmonellafrom fecal specimens in a children’s hospital between January 2012 and October 2015

项目2012年2013年2014年2015年合计送检标本数10621273238823247047检出菌株数5146121241459检出率(%)4.803.615.0710.376.51
表2 2012年1月—2015年10月某儿童医院各月粪便标本中沙门菌检出情况(株)
Table 2 Detection ofSalmonellafrom fecal specimens in a children’s hospital in each month between January 2012 and October 2015 (No. of isolates)

年份1月2月3月4月5月6月7月8月9月10月11月12月2012123331086752120130113147551054201426167121523815161020156264173042505826--合计91111162856728478562315
表3 粪便标本检出沙门菌的患儿年龄分布
Table 3 Age distribution of children who were isolatedSalmonellafrom feces

年龄(岁)株数构成比(%)<116535.951~13930.282~4810.463~316.754~286.105~163.496~13326.97合计459100.00
2.2 血清型分布 沙门菌血清型主要为B群和D群,分别占69.06%和19.39%,分别以鼠伤寒沙门菌和肠炎沙门菌血清型为主。见表4。
表4 2012—2015年某儿童医院粪便标本中459株沙门菌血清型分布
Table 4 Serotype distribution of 459 strains ofSalmonellafrom fecal specimens in a children’s hospital in 2012-2015
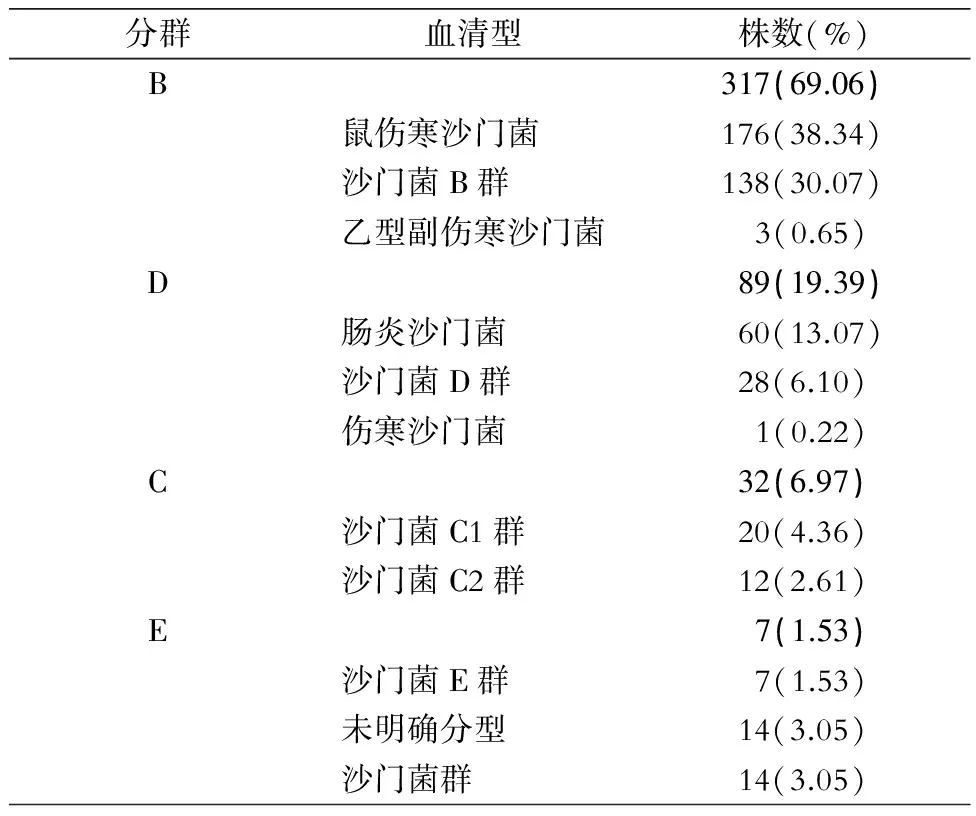
分群血清型株数(%)B317(69.06)鼠伤寒沙门菌176(38.34)沙门菌B群138(30.07)乙型副伤寒沙门菌 3(0.65)D89(19.39)肠炎沙门菌60(13.07)沙门菌D群28(6.10)伤寒沙门菌 1(0.22)C32(6.97)沙门菌C1群20(4.36)沙门菌C2群12(2.61)E 7(1.53)沙门菌E群 7(1.53)未明确分型14(3.05)沙门菌群14(3.05)
2.3 药敏结果 检测446株沙门菌对常用抗菌药物的敏感率,未检出耐亚胺培南和厄他培南菌株,沙门菌属对哌拉西林/他唑巴坦、头孢吡肟、头孢他啶、氨曲南和头孢曲松的敏感率均>70%,肠炎沙门菌对头孢类抗生素的敏感性低于鼠伤寒沙门菌,但对复方磺胺甲口恶唑的敏感率高于鼠伤寒沙门菌。见表5。
表5 2012—2015年某儿童医院粪便标本中沙门菌对抗菌药物的敏感情况(%,株)
Table 5 Antimicrobial susceptibility ofSalmonellafrom fecal specimens in a children’s hospital in 2012 - 2015(%, No. of isolates)

抗菌药物鼠伤寒沙门菌(n=174)肠炎沙门菌(n=58)沙门菌属(n=446)氨苄西林11.49(20)31.03(18)29.82(133)氨苄西林/舒巴坦11.49(20)36.21(21)33.63(150)哌拉西林/他唑巴坦90.23(157)100.00(58)95.74(427)头孢他啶83.33(145)63.79(37)84.30(376)头孢曲松71.84(125)63.79(37)78.70(351)头孢吡肟85.63(149)68.97(40)87.00(388)氨曲南78.74(137)63.79(37)82.06(366)厄他培南100.00(174)100.00(58)100.00(446)亚胺培南100.00(174)100.00(58)100.00(446)复方磺胺甲口恶唑59.20(103)94.83(55)62.78(280)
3 讨论
沙门菌是最常见的细菌食源性疾病的病原菌,在世界范围内引起许多成人和儿童发病及死亡。沙门菌的血清型超过2 600种,且不断出现新的致病性血清型,沙门菌感染已成为一个重大的公共卫生问题[1]。大部分沙门菌感染是食源性感染,也可通过接触感染的动物或直接的人际传播获得。沙门菌属感染在临床上可分为胃肠炎型或食物中毒型、败血症(伤寒型)和局部感染型,沙门菌肠炎是沙门菌感染的主要临床表现,以儿童多见[2]。本研究中<3岁患儿占76.69%,6岁以上患儿检出数明显减少,提示3岁以下婴幼儿胃肠功能尚未发育成熟,机体抵抗力差,为易感人群。发病季节以5—10月份多见,7、8、9月检出最多,与文献报道[2-4]相符。根据患儿发病年龄、病史和主要临床表现,结合沙门菌感染的流行病学特征,考虑患儿发病可能是食品污染,主要集中在奶制品和冰箱内储存食品。沙门菌喜湿、耐寒、不耐热,在水、乳类和肉制品中能生存数月,故在婴幼儿喂养中应尽量避免食用冰箱存储食品,进食煮透的肉制品。
本研究显示2012—2015年腹泻患儿粪便沙门菌检出率由4.80%逐年增高至10.37%,与李桦等[3]研究相似;男性患儿多见,临床表现主要为腹泻、腹痛和发热,部分患儿合并有呼吸道感染,有14例合并轮状病毒感染,提示沙门菌肠炎存在与轮状病毒混合感染的情况。
沙门菌血清型分布有地区差异。法国Montpellier大学一项为期4年的回顾性研究[4]显示Languedoc-Roussillon地区儿童粪便分析和实验室检测提示有2种主要的沙门菌血清型:鼠伤寒沙门菌和肠炎沙门菌,与本研究结果一致,与珠海地区李桦等[3]研究也一致,但与中山地区杨晓华等[5]、浙江地区张建群等[6]的研究结果不同,提示沙门菌血清型分布可能有典型的地区差异,深圳与珠海地区湿润温暖,与Languedoc-Roussillon地区皆为临海地区。气候特点可能是沙门菌血清型在各地区分布不同的原因之一。
由于实验室检测试剂的限制,2014年7月前本院仅能对沙门菌鉴定到群,不能鉴定到具体血清型,限制了统计数据的完整性,之后采用的60种血清分型试剂检测显示大部分B群和D群沙门菌为鼠伤寒沙门菌和肠炎沙门菌。
小儿沙门菌肠炎的治疗主要是对症处理,欧洲儿科传染病学会推荐高危儿童使用抗菌药物,以减少菌血症和肠道外感染的风险,其中高危儿童包括新生儿、小婴儿(<3个月)、免疫缺陷、解剖性或功能性无脾、糖皮质激素或免疫抑制剂治疗、炎症性肠病或胃酸缺乏儿童;而抗菌药物使用次数及剂量增加,导致病原菌耐药性的增强则是目前沙门菌治疗中的主要问题[7-12]。本组沙门菌对哌拉西林/他唑巴坦、头孢吡肟、头孢他啶和头孢曲松的敏感率较高,可经验性用药,未检出对亚胺培南或厄他培南耐药的菌株,但复方磺胺甲口恶唑的敏感率仅62.78%,需明确血清型和具体菌株的药敏结果再决定是否使用;对氨苄西林/舒巴坦的敏感率已低至33.63%,不适于临床治疗。鼠伤寒沙门菌和肠炎沙门菌血清型对药物敏感性略有区别,肠炎沙门菌对头孢类抗生素的敏感性低于鼠伤寒沙门菌,但对复方磺胺甲口恶唑的敏感率高于鼠伤寒沙门菌,与潘惠芳等[11]研究一致,提示临床对沙门菌肠炎患儿的抗菌药物治疗需结合血清型及药敏结果慎重选择。
[1] Switt AI, Soyer Y, Warnick LD, et al. Emergence, distribution, and molecular and phenotypic characteristics ofSalmonellaentericaserotype 4,5,12:i:-[J] Foodborne Pathog Dis, 2009, 6(4) : 407-415.
[2] 江载芳,申昆玲,沈颖.诸福棠实用儿科学[M]. 8版.北京:人民卫生出版社,2015.
[3] 李桦,汪伟山,周玉球.2009—2014年珠海市腹泻儿童沙门菌感染的流行病学特征[J].国际检验医学杂志,2015,36(18):2640-2642.
[4] Lalande M, Guyon G, Morin C,et al.Salmonellainfections in children: A retrospective study over a four-year period[J]. Arch Pediatr, 2005,12(1):23-27.
[5] 杨晓华,谭南,林爱心.小儿沙门菌肠炎344例病原菌分布及药敏试验结果[J].中国感染与化疗杂志, 2014,14(2):149-152.
[6] 张建群,罗学辉,黄绍军.浙江省余姚市腹泻儿童沙门菌感染流行病学特征和耐药分析[J].疾病监测,2015,30 (9):776-779.
[7] Srinivasaraghavan R, Narayanan P, Kanimozhi T. Culture provenSalmonellatyphico-infection in a child with Dengue fever: a case report[J]. J Infect Dev Ctries, 2015, 9(9):1033-1035.
[8] Ifeanyi CI, Bassey BE, Ikeneche NF, et al. Molecular characterization and antibiotic resistance ofSalmonellain children with acute gastroenteritis in Abuja, Nigeria[J]. J Infect Dev Ctries, 2014, 8(6):712-719.
[9] Chinnasami B, Sadasivam K, Vivekanandhan A, et al. A study on longevity of immune response after vaccination withSalmonellatyphiVi conjugate vaccine (pedatyphTM) in children[J]. J Clin Diagn Res, 2015, 9(5):SC 01-03.
[10] Bula-Rudas FJ, Rathore MH, Maraqa NF.Salmonellainfections in childhood[J]. Adv Pediatr, 2015, 62(1):29-58.
[11] 潘慧芳,李艳红,刘艳梅.儿童感染沙门菌血清型分布和耐药性分析[J].中国妇幼保健,2015,30(8):1196-1197.
[12] Guarino A, Ashkenazi S, Gendrel D, et al. European Society for Pediatric Gastroenterology, Hepatology, and Nutrition/European Society for Pediatric Infectious Diseases evidence-based guidelines for the management of acute gastroenteritis in children in Europe: Update 2014[J]. J Pediatr Gastroenterol Nutr, 2014,59(1):132-152.
(本文编辑:豆清娅)
Distribution characteristics and antimicrobial resistance of 459 strains of Salmonella isolated from feces of children in Shenzhen Children’s Hospital
WANG Hong-mei, WANG He-ping, LEI Min,ZHOU Gao-feng, ZHANG Jiao-sheng, PENG Bao-ling, ZHANG Rui-mu, DENG Ji-kui
(ShenzhenChildren’sHospital,Shenzhen518038,China)
Objective To understand the distribution characteristics and antimicrobial resistance ofSalmonellaisolated from feces of children. MethodsSalmonellawere isolated from fecal specimens of children in a hospital between January 2012 and October 2015, serotypes and susceptibility ofSalmonellato commonly used antimicrobial agents were analyzed. Results A total of 7 047 children’s fecal specimens were detected, 459 (6.51%) children were isolatedSalmonella, the ratio of male to female was 2.4∶1, 352 (76.69%) children were less than 3 years old; 374 strains (81.48%) were isolated from May to October, the numbers of stains isolated in July, August, and September were 72, 84, and 78 respectively.Salmonellagroup B and group D were the most common serotypes, accounting for 69.06% and 19.39% respectively, most were serotypes ofSalmonellatyphimurium(S.typhimurium) andSalmonellaenteritidis(S.enteritidis). No imipenem- or ertapenem-resistant strains were found, susceptibility ofSalmonellato piperacillin/tazobactam, cefepime, ceftazidime, aztreonam, and ceftriaxone were all>70%, susceptibility rate ofS.enteritidisto cephalosporins was lower thanS.typhimurium, but to compound sulfamethoxazole was higher thanS.typhimurium. ConclusionSalmonellaare mainly isolated from children less than 3 years old in this hospital, summer and autumn are peak seasons, the main serotypes wereS.typhimuriumandS.enteritidis, antimicrobial therapy should be carefully selected in combination with serotypes and antimicrobial susceptibility testing result.
Salmonella; serotype; child; feces; drug resistance,microbial; drug resistance; epidemiological characteristic
2015-12-22
深圳市科技研发资金(JCYJ20160429175723608);深圳市儿童医院重点专科资助项目(szetyy-zdzk-2015-gr)
王红梅(1979-),女(汉族),陕西省宝鸡市人,副主任技师,主要从事临床微生物学感染与诊断研究。
邓继岿 E-mail: djikui20212@sina.com
10.3969/j.issn.1671-9638.2016.11.003
R378.2+2
A
1671-9638(2016)11-0817-04

