猪O型口蹄疫病毒抗体化学发光酶联免疫检测方法的建立
崔辰,黄立纲,李晶,邹兴启,朱元源,谢磊,赵启祖,杨利敏,刘文军
1 中国科学院微生物研究所 病原微生物与免疫学重点实验室,北京 100101 2 中国科学院大学,北京 100049 3 中国兽医药品监察所,北京 100081 4 清华大学第一附属医院检验科,北京 100016 5 北京市动物卫生监督所,北京 100044
Chen Cui1,2*, Ligang Huang4*, Jing Li1, Xingqi Zou3, Yuanyuan Zhu3, Lei Xie5, Qizu Zhao3, Limin Yang1, and Wenjun Liu1
1 CAS Key Laboratory of Pathogenic Microbiology and Immunology, Institute of Microbiology, Chinese Academy of Sciences, Beijing 100101, China 2 University of Chinese Academy of Sciences, Beijing 100049, China 3 China Institute of Veterinary Drug Control, Beijing 100081, China 4 Department of Clinical Laboratory, First Hospital of Tsinghua University, Beijing 100016, China 5 Beijing Animal Health Inspection Institute, Beijing 100044, China
动物及兽医生物技术
猪O型口蹄疫病毒抗体化学发光酶联免疫检测方法的建立
崔辰1,2*,黄立纲4*,李晶1,邹兴启3,朱元源3,谢磊5,赵启祖3,杨利敏1,刘文军1
1 中国科学院微生物研究所 病原微生物与免疫学重点实验室,北京 100101 2 中国科学院大学,北京 100049 3 中国兽医药品监察所,北京 100081 4 清华大学第一附属医院检验科,北京 100016 5 北京市动物卫生监督所,北京 100044
崔辰, 黄立纲, 李晶, 等. 猪O型口蹄疫病毒抗体化学发光酶联免疫检测方法的建立. 生物工程学报, 2016, 32(11): 1519-1530.
Cui C, Huang LG, Li J, et al. Establishment of chemiluminescent enzyme immunoassay for detecting antibodies against foot-and-mouth disease virus serotype O in swine. Chin J Biotech, 2016, 32(11): 1519-1530.
表达并纯化猪O型口蹄疫病毒 (FMDV) VP1重组蛋白作为检测抗原,建立了一种快速检测猪O型口蹄疫病毒抗体的化学发光酶联免疫 (CLEIA) 检测方法。建立的VP1-CLEIA方法特异性为100%,板内变异系数在1.10%-6.70%之间,板间变异系数在0.66%-4.80%之间,具有较好的特异性和重复性,且灵敏度高于ELISA方法。通过对山东、辽宁、河北地区采集的250份临床血清的检测表明,该方法与间接ELISA试剂盒的符合率为93.50%,与液相阻断ELISA试剂盒的符合率为94.00%,表明本次建立的VP1-CLEIA检测方法可以用于猪O型FMDV感染或疫苗免疫后抗体水平检测。
O型口蹄疫病毒,VP1蛋白,化学发光酶联免疫
Chen Cui1,2*, Ligang Huang4*, Jing Li1, Xingqi Zou3, Yuanyuan Zhu3, Lei Xie5, Qizu Zhao3, Limin Yang1, and Wenjun Liu1
1 CAS Key Laboratory of Pathogenic Microbiology and Immunology, Institute of Microbiology, Chinese Academy of Sciences, Beijing 100101, China 2 University of Chinese Academy of Sciences, Beijing 100049, China 3 China Institute of Veterinary Drug Control, Beijing 100081, China 4 Department of Clinical Laboratory, First Hospital of Tsinghua University, Beijing 100016, China 5 Beijing Animal Health Inspection Institute, Beijing 100044, China
口蹄疫 (Foot-and-mouth disease,FMD) 是由口蹄疫病毒 (Foot-and-mouth disease virus,FMDV) 引起的偶蹄动物急性、热性、高度接触性传染病,传播迅速、感染率高[1]。FMDV主要通过呼吸道和消化道传播,仅数个感染性病毒粒子便可引起易感动物发病,甚至造成世界性的大流行,给畜牧业带来极其严重的经济损失,因此FMDV是世界各国检疫和防疫的重点对象[2]。FMDV有7个血清型,分别为O、A、C、Asia1、SAT1、SAT2和SAT3型,其中O型、A型和Asia1型在中国交替流行,且涉及面广、疫情复杂、破坏性强[3]。目前我国预防和控制口蹄疫主要以疫苗免疫为主,但FMDV的血清型众多,不同亚型的疫苗之间无交叉保护作用,且国内外口蹄疫疫苗质量参差不齐,因此建立一种简便、快速、灵敏度高的FMDV感染和/或免疫后抗体检测方法对预防和控制口蹄疫的发生和流行具有十分重要的意义。
目前FMDV的检测方法主要分为3类,包括血清学诊断技术、生物学试验和分子生物学诊断技术。在血清学诊断技术中,世界动物卫生组织 (World animal health organization,OIE)推荐的检测FMDV抗体的标准方法为中和试验以及液相阻断ELISA (LPBE),其中血清中和试验需要使用活病毒,在普通实验室难以完成[4]。液相阻断ELISA可以用于替代中和试验检测血清中产生的相应的保护性抗体[5],但同样操作费时。以灭活病毒作为抗原建立的间接ELISA方法与上述两种方法相比,具有灵敏、快速、操作简便等优点[6],但此方法存在病毒灭活不全的风险以及病毒纯化较为困难的问题[7]。为降低病毒传播风险且不影响病毒的抗原性,使用原核表达系统或杆状病毒系统表达病毒的重组结构蛋白,并将其作为检测抗原是目前的主要研究方向[8]。宋妮等[9]采用原核表达的重组结构蛋白作为包被抗原建立的猪O型FMDV间接ELISA检测方法,通过对200份田间血清样品的检测表明,此方法与液相阻断ELISA的符合率为97%,具有较好的特异性和敏感性。
化学发光酶联免疫检测 (Chemiluminescent enzyme immunoassay,CLEIA) 是将化学发光体系与ELISA技术相结合,用于检测微量抗原或抗体的一种新型标记免疫测定技术,其基本原理是化学发光底物分子在酶的催化下,吸收氧化反应中的能量跃迁到激发态,处于激发态的分子以光辐射的形式返回基态时会产生光,称为化学发光[10]。化学发光的强度与反应物或产物的浓度成正比,因此可以通过测量发光强度,绘制标准曲线来测量待测物的浓度,实现定量分析[11]。与普通间接ELISA检测方法相比,CLEIA同样具有操作简便、特异性高的优势,且其灵敏度和精确度均优于普通ELISA,并且由于CLEIA最后测定的是光子的量,对检测者无害、检测范围广,还能够定量检测,是理想的标记免疫测定方法[12-13]。CLEIA已被欧盟列为牛海绵样脑病的快速检测方法之一。Buschmann等[14]于2004年使用间接ELISA、夹心ELISA、Eastern blotting及CLEIA四种方法检测312份绵羊海绵样脑病标准阳性血清样本,其中CLEIA的检出率几乎可达100%,而其他3种方法的检出率只有80%左右。CLEIA由于较ELISA方法灵敏度和精确度更高,因此已被广泛应用于肿瘤标记物检测、糖尿病、心脏病、高血压、艾滋病以及食品安全检测,但是在动物疫病检测领域,国内尚未见报道。
FMDV为单股正链RNA病毒,基因组全长约8.5 kb,编码组成病毒衣壳的蛋白为4种结构蛋白VP1、VP2、VP3和VP4以及10种成熟的非结构蛋白 (L、2A、2B、2C、3A、3B、3C、3D及3AB和3ABC复合体)[15]。在FMDV的4种结构蛋白中,VP1携带引发宿主细胞对FMDV免疫反应的关键性抗原表位,暴露于病毒粒子表面,单独的VP1蛋白即可刺激机体产生中和抗体,是ELISA中有效的目标抗原[16]。我国农业部规定,O型FMDV的VP1结构蛋白ELISA检测方法不仅可以用来检测病毒感染后动物体内抗体水平,还可以用于疫苗免疫后抗体水平的监测。我国现有的口蹄疫疫苗大部分为灭活疫苗,其经过一系列的制备过程后,最终的纯化浓缩抗原中只包含病毒部分结构蛋白,而除3D之外的大部分非结构蛋白已被去除[17]。动物经口蹄疫疫苗免疫后,体内会产生大量针对结构蛋白的抗体。因此为建立一种快速、安全的猪O型FMDV抗体检测方法,本试验以原核表达的VP1重组蛋白作为抗原,初步建立了猪O型FMDV抗体CLEIA检测方法,其灵敏度优于目前的ELISA检测方法。
1 材料与方法
1.1 材料
1.1.1 重组质粒、菌株
包含猪O型FMDV VP1基因的重组质粒pET-28a-VP1由本实验室构建并保存;大肠杆菌Rosetta (DE3) 由本实验室保存。
1.1.2 主要仪器和试剂
化学发光免疫分析仪购自北京泰格科信有限公司;HRP-羊抗猪IgG酶标二抗购自Earthox公司;SuperSignal ELISA Femto Luminol/Enhancer Solution购自Thermo Scientific公司;O型口蹄疫间接血凝抗体检测试剂盒、O型口蹄疫病毒抗体液相阻断ELISA试剂盒购自中国农业科学院兰州兽医研究所;猪O型口蹄疫ELISA抗体检测试剂盒购自武汉科前动物生物制品有限责任公司;其他常规试剂均为国产分析纯。
1.1.3 血清
猪O型FMDV标准阳性血清由中国兰州兽医研究所惠赠;猪A型FMDV阳性血清、猪Asia 1型FMDV阳性血清、猪O型FMDV阴性血清、猪伪狂犬病毒阳性血清、猪瘟病毒阳性血清、猪细小病毒阳性血清和猪圆环病毒阳性血清由本实验室保存;250份临床猪血清采集自山东、辽宁和河北等地。
1.2 方法
1.2.1 pET-28a-VP1重组蛋白的纯化、表达和复性
将pET-28a-VP1重组质粒转化大肠杆菌Rosetta(DE3)感受态细胞,挑取单菌落转接至含终浓度为30 μg/mL卡那霉素LB液体培养基中,37 ℃、200 r/min培养至菌液OD600在0.6−0.8之间,取出少量诱导前全菌作为对照,在剩余培养物中加入终浓度为1 mmol/L的异丙基硫代半乳糖苷 (Isopropyl-beta-D-thiogalactopyranoside, IPTG),37 ℃诱导过夜。超声破碎菌体后分别收集上清及沉淀进行SDS-PAGE电泳分析,鉴定目的蛋白的表达。收集超声后沉淀,使用Ni-NTA树脂亲和层析纯化重组蛋白。SDS-PAGE电泳检测纯化效果。纯化后蛋白透析复性,复性产物使用Bradford法[18]测定蛋白含量,500 μL/管分装,-20 ℃冻存备用。
1.2.2 蛋白最佳包被浓度的确定
纯化后蛋白用碳酸盐包被缓冲液 (pH 9.6)从1∶10开始倍比稀释至1∶160,100 μL/孔加入化学发光板,4 ℃包被20 h。PBST洗涤,200 μL/孔,洗4次,每次3 min,拍干。加入3%酪蛋白(Casein)+1%蔗糖-PBST混合封闭液300 μL/孔,37 ℃封闭1 h。PBST洗涤,300 μL/孔,洗4次,每次3 min,拍干。猪O型FMDV标准阳性、阴性血清用封闭液1∶32稀释后加入酶标板,100 μL/孔,37 ℃反应30 min。PBST洗涤,300 μL/孔,洗5次,每次3 min,拍干。HRP-羊抗猪IgG酶标二抗用封闭液1∶50 000稀释后加入酶标板,100 μL/孔,37 ℃反应30 min。PBST洗涤,300 μL/孔,洗5次,每次3 min,拍干。加化学发光底物 (鲁米诺),100 μL/孔,避光显色5 min。用化学发光免疫分析仪进行检测,将P/N值最大时的抗原浓度作为最佳蛋白包被浓度。
1.2.3 最佳封闭条件的确定
以抗原最佳包被浓度包被酶标板,分别以3% BSA-PBST,1%明胶-PBST,10%新生牛血清-PBST,3%酪蛋白+1%蔗糖-PBST混合液封闭,并选用37 ℃封闭60、90和120 min三个时间梯度进行比较,使用化学发光底物显色后,比较阳性血清和阴性血清的发光值,根据P/N比值确定最适合的封闭条件。操作过程同前。
1.2.4 酶标二抗工作浓度的确定
按已确定的最佳抗原包被浓度包被化学发光板,使用最佳封闭条件进行封闭,将HRP-羊抗猪IgG酶标二抗用封闭液稀释为1∶5 000、1∶10 000、1∶20 000和1∶40 000四个梯度,使用化学发光底物显色,观察显色结果,确定最佳酶标二抗工作浓度。
1.2.5 判定标准的确定
取10份猪O型FMDV阴性血清进行CLEIA检测,每份血清重复两孔取平均值,操作过程同前,计算10份标准阴性血清化学发光值的平均值 (x1) 和标准差 (s1)。由于武汉科前生物生产的ELISA检测试剂盒只制定了免疫合格的判定标准,未界定感染与否的阴阳血清判定标准,因此本实验同时对该商品试剂盒的阴阳血清判定标准进行了界定。取10份猪O型FMDV阴性血清进行ELISA检测,每份血清重复两孔取平均值,按照试剂盒说明书进行操作,计算10份标准阴性血清的OD630平均值 (x2) 和标准差(s2)。根据统计学原则,待检血清的化学发光值≥x1+2s1或OD630值≥x2+2s2时,则可以在99.9%的水平上判为阳性。因此将x1+2s1所得的值定为VP1-CLEIA方法阴阳性血清的界限,将x2+2s2的值确定为ELISA商品试剂盒的阴阳血清判定标准。
根据《2016年国家动物疫病监测与流行病学调查计划》的规定,猪只在接受O型FMDV灭活疫苗免疫后28 d,使用正向间接血凝试验检测血清中的抗体效价≥32,即可判定为免疫合格。本次建立的CLEIA检测方法中,同时确定了是否免疫合格的判定标准。取10份经正向间接血凝试验判定抗体效价为1∶32的猪O型FMDV阳性血清进行CLEIA检测,每份血清重复两孔取其平均值,操作过程同前。计算10份标准血清化学发光值的平均值 (x3) 和标准差(s3),将x3+2s3所得的值确定为是否免疫合格的界限。
1.2.6 特异性试验
用建立好的CLEIA方法分别检测猪伪狂犬病毒阳性血清、猪瘟病毒阳性血清、猪细小病毒阳性血清、猪圆环病毒阳性血清、猪A型FMDV阳性血清以及猪Asia 1型FMDV阳性血清,同时设猪O型FMDV阳性、阴性血清对照,观察CLEIA方法的特异性以及交叉反应性。
1.2.7 灵敏度试验
将已经用正向间接血凝试验标定好抗体效价的标准阳性血清 (1∶512) 用封闭液按1∶32、1∶64、1∶128、1∶256、1∶512、1∶1 024、1∶2 048、1∶4 096的稀释度进行稀释,其余按最适反应条件进行检测,判定标准采用1.2.5确定的阴阳性血清界定标准,观察建立的CLEIA方法的敏感性。同时,用武汉科前生物生产的猪O型口蹄疫ELISA抗体检测试剂盒进行平行检测,操作方法按试剂盒说明书进行。
1.2.8 重复性试验
将重组蛋白以最佳浓度包被化学发光板,选取4份血清,每份血清重复4孔,按已建立的最适反应条件检测,进行板内重复性试验,对结果进行统计学分析,计算变异系数。将重组蛋白以最佳浓度包被4块化学发光板,使用相同的4份血清进行板间重复性试验,对结果进行统计学分析,计算变异系数。
1.2.9 对比试验
用建立好的VP1-CLEIA方法检测采集自山东多个猪场的血清样本200份,用1.2.5确定的是否免疫合格的标准判定结果,检测结果与武汉科前生物生产的猪O型口蹄疫ELISA抗体检测试剂盒进行对比。
对近3年采集自山东、辽宁、河北等地接种过猪O型FMDV灭活疫苗猪场的50份血清样本用建立好的VP1-CLEIA方法进行检测,用1.2.5确定的阴阳性血清的标准判定结果,并同国标试剂盒O型口蹄疫病毒液相阻断ELISA试剂盒的检测结果进行对比。

图1 诱导表达Rosettta-pET-28a-VP1重组菌株的SDS-PAGE分析Fig. 1 Expression of VP1 as identified by SDS-PAGE. M: protein molecular weight marker 1: un-induced Rosettta-pET-28a-VP1; 2: the pellet of the post-induced bacterial lysates from ultrasonic disruption; 3: the supernatant of the bacterial lysates from ultrasonic disruption.

图2 表达产物纯化后SDS-PAGE分析Fig. 2 Purification of VP1 analyzed by SDS-PAGE. M: protein molecular weight marker; 1: flow through; 2-8: purification sample of VP1.

表1 VP1-CLEIA抗原最佳包被浓度的选择Table 1 Determination of coating concentration for VP1-CLEIA
2 结果与分析
2.1 pET-28a-VP1重组蛋白的表达和纯化
将重组质粒pET-28a-VP1转化Rosetta (DE3)宿主菌后进行培养诱导表达,分别取诱导前菌液,诱导后菌液超声破碎的菌体沉淀和上清进行SDS-PAGE电泳分析,结果如图1所示。诱导后产物有重组蛋白表达,分子量约为27 kDa,与预期大小一致,以包涵体的形式存在,上清未观察到重组蛋白条带。诱导表达产物的包涵体经Ni-NTA树脂亲和层析纯化后进行SDS-PAGE电泳分析,得到分子量在27 kDa左右的高纯度重组蛋白,结果如图2所示。
2.2 蛋白最佳包被浓度的确定
随着VP1蛋白包被量的减少,测得FMDV阴性血清及阳性血清的化学发光值均不断降低,当包被抗原为1∶40 (20 μg/mL) 稀释时,P/N值较大,且阴性血清的化学发光值较小,结果见表1。因此可以确定在VP1-CLEIA方法中VP1蛋白的最佳包被浓度为20 μg/mL。
2.3 最佳封闭条件的确定
以抗原最佳包被浓度包被酶标板,选用3% BSA-PBST,1%明胶-PBST,10%新生牛血清-PBST,3% Casein+1%蔗糖-PBST混合液4种封闭液进行比较,分别在37 ℃条件下封闭60、90、120 min,比较P/N值。结果显示,3% Casein+1%蔗糖-PBST混合液的封闭效果最好。37 ℃条件下封闭60 min阴性本底较高,封闭90和120 min的结果差异不大。因此选用3%酪蛋白+1%蔗糖-PBST混合液作为封闭液,最佳封闭时间为37 ℃封闭90 min,结果见表2。
2.4 酶标二抗工作浓度的确定
当HRP-羊抗猪IgG酶标二抗稀释度为1∶40 000时,P/N值最大,因此将该稀释度作为最佳酶标二抗稀释度,结果见表3。
2.5 判定标准的确定
对10份猪O型FMDV阴性血清按以上确定的最适条件进行VP1-CLEIA检测以及ELISA检测 (武汉科前),每份血清重复两孔。10份血清化学发光值的平均值 (x1) 和标准差 (s1) 分别为28 033.25和1 553.87。因此初步确定VP1-CLEIA阴阳血清临界值为x1+2s1,即31 141。10份血清经ELISA检测后 OD630的平均值 (x2) 和标准差 (s2) 分别为0.12和0.03。因此初步确定ELISA试剂盒阴阳血清临界值为x1+2s1,即0.18。

表2 VP1-CLEIA最佳封闭条件的确定Table 2 Determination of blocking condition for VP1-CLEIA

表3 VP1-CLEIA HRP-羊抗猪IgG酶标二抗最佳稀释度的确定Table 3 Determination of HRP conjugated IgG dilution for VP1-CLEIA
对10份经正向间接血凝试验判定抗体效价为1∶32的猪O型FMDV标准血清按以上确定的最适条件进行VP1-CLEIA检测,每份血清重复两孔。10份血清化学发光值的平均值 (x3) 和标准差(s3)分别为108 322.80和9 532.36。因此初步确定是否免疫合格的临界值为x3+2s3,即127 388。
2.6 VP1-CLEIA的特异性
使用VP1-CLEIA检测了其他4种常见的猪传染病免疫后阳性血清以及2种其他亚型猪FMDV免疫后阳性血清,结果均为阴性,同时猪O型FMDV阳性对照及阴性对照分别检出为阳性和阴性,证明建立的VP1-CLEIA方法具有良好的特异性 (表4)。
2.7 VP1-CLEIA的灵敏度
将已标定抗体效价为1∶512的猪O型FMDV阳性标准血清用封闭液从1∶32开始做倍比稀释,分别用建立的VP1-CLEIA方法和武汉科前生物的ELSIA试剂盒进行检测。结果显示VP1-CLEIA方法检测血清样本在1∶2 048稀释时仍可判为阳性,ELSIA试剂盒在1∶1 024稀释时可判为阳性。提示建立的VP1-CLEIA方法灵敏度优于ELSIA方法 (表5)。
2.8 VP1-CLEIA的重复性
结果显示,板内重复性试验的变异系数在1.10%-6.70%之间,板间重复性试验的变异系数在0.66%-4.80%之间,均小于7%。表明同一份血清样本在同一批次制备抗原包被的化学发光板内变异系数较小,具有良好的重复性。结果见表6、表7。
2.9 VP1-CLEIA与ELISA方法的符合率
用本次建立的VP1-CLEIA方法检测采集自山东猪场的血清样本200份,用2.5确定的免疫合格标准判定结果,检测结果与武汉科前生物生产的猪O型口蹄疫ELISA抗体检测试剂盒进行对比,两者符合率为93.50%。用本次建立的VP1-CLEIA方法检测采集自山东、辽宁、河北等地接种过灭活疫苗猪场的血清样本50份,用2.5确定的阴阳性血清标准判定结果,检测结果与国标试剂盒O型口蹄疫病毒液相阻断ELISA试剂盒的检测结果进行对比,两者符合率为94.00% (表8)。

表4 VP1-CLEIA的特异性Table 4 Specificity of VP1-CLEIA

表5 VP1-CLEIA的灵敏度Table 5 Sensitivity of VP1-CLEIA and ELISA

表6 VP1-CLEIA的板内重复性Table 6 Intro-batch reproducibility for VP1-CLEIA
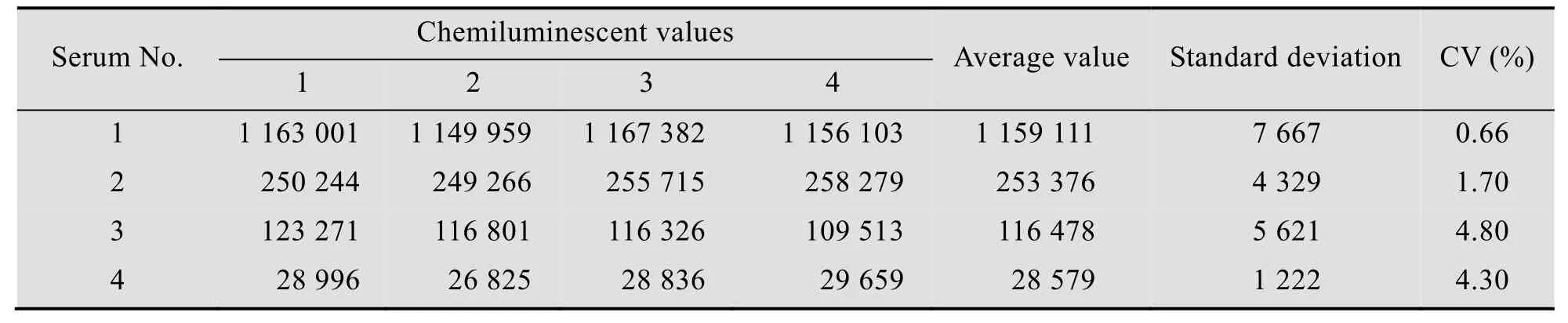
表7 VP1-CLEIA的板间重复性Table 7 Inter-batch reproducibility for VP1-CLEIA

表8 VP1-CLEIA与间接ELISA以及液相阻断ELISA的符合率Table 8 Agreement between VP1-CLEIA and indirect ELISA or liquid phase block ELISA
3 讨论
本试验选择大肠杆菌系统表达的VP1重组结构蛋白代替病毒颗粒作为包被抗原,初步建立了猪O型FMDV感染后和疫苗免疫后血清中针对VP1结构蛋白抗体的CLEIA检测方法。VP1结构蛋白是O型FMDV产生中和抗体的主要蛋白,检测针对VP1蛋白的抗体水平可用于评价FMDV疫苗的免疫效果,而且VP1蛋白也是检测FMDV抗体应用最广的检测抗原[19]。传统的ELISA方法主要是使用BHK细胞培养的FMDV作为抗原包被,虽然特异性和灵敏度均较高,但在生产的过程中存在病毒扩散的风险,且成本较高[20],因此为降低安全隐患和生产成本,并使操作更为简便,本试验选用大肠杆菌系统表达的VP1重组蛋白作为包被抗原。
动物感染FMDV或经口蹄疫灭活疫苗免疫后,体内均会出现针对VP1结构蛋白的抗体,因此O型FMDV的VP1结构蛋白CLEIA检测方法既可以用于检测病毒感染后动物体内抗体水平,还可以用于疫苗免疫后动物体内抗体水平的监测。因此本试验在确定判定标准时,考虑到检测者的不同需求,制定了是否存在病毒感染及是否免疫合格两个判定标准。鉴别诊断FMDV疫苗免疫动物和自然感染动物的关键在于动物体内是否产生针对非结构蛋白的抗体,因此在实际应用过程中,可以配合使用FMDV非结构蛋白检测试剂盒。
ELISA检测方法敏感性高、操作简便,微量的样品即能引起高效的抗原抗体反应,但目前只能实现定性检测或半定量检测,且重复性有待提高[21]。CLEIA检测方法将免疫反应的特异性与化学发光分析的高灵敏性相结合,敏感性比普通ELISA高出一个数量级,灵敏度可与放射免疫分析法相媲美,且不存在放射污染等问题[22],另外CLEIA检测方法的重复性好,批间及批内变异系数均明显低于ELISA方法,能够精确地进行定性及定量检测[23]。今后可以通过建立标准曲线,实现抗体水平的定量检测。尽管CLEIA检测方法已被越来越多地应用于食品中药物残留以及人类疾病的检测[24-26],但对于动物疫病的检测及疫苗免疫评价鲜有报道,本研究首次将该技术用于猪O型FMDV抗体的检测,通过对临床血清样本的检测可以看出,本次建立的CLEIA方法较ELISA方法具有更好的敏感性和精密度,与市售的间接ELISA试剂盒符合率达到93.50%以上,与液相阻断ELISA的检测符合率为94.00%,为更灵敏、精确的检测猪O型FMDV抗体水平的研究奠定了基础。
REFERENCES
[1] Xie QG. Foot and Mouth Disease. Beijing: China Agricultural University Press, 2004: 1-2 (in Chinese).谢庆阁. 口蹄疫. 北京: 中国农业出版社, 2004: 1-2.
[2] Kitching P, Hammond J, Jeggo M, et al. Global FMD control-is it an option? Vaccine, 2007, 25(30): 5660-5664.
[3] Animal husbandry and Veterinary Department of the Ministry of agriculture of the People's Republic of China. The Prevention and Treatment for Foot and Mouth Disease. Beijing: China Agricultural Science and Technology Press, 1994: 5-6 (in Chinese).中华人民共和国农业部畜牧兽医司. 家畜口蹄疫及其防治. 北京: 中国农业科技出版社, 1994: 5-6.
[4] Mackay DKJ, Bulut AN, Rendle T, et al. A solid-phase competition ELISA for measuring antibody to foot-and-mouth disease virus. J Virol Methods, 2001, 97(1/2): 33-48.
[5] Van Maanen C, Terpstra C. Comparison of a liquid-phase blocking sandwich ELISA and a serum neutralization test to evaluate immunity in potency tests of foot-and-mouth disease vaccines. J Immunol Methods, 1989, 124(1): 111-119.
[6] Hamblin C, Barnett IT, Crowther JR. A new enzyme-linked immunosorbent assay (ELISA) for the detection of antibodies against foot-and-mouth disease virus. J Immunol Methods, 1986, 93(1): 115-121.
[7] Robiolo B, La Torre J, Maradei E, et al. Confidence in indirect assessment of foot-and-mouth disease vaccine potency and vaccine matching carried out by liquid phase ELISA and virus neutralization tests. Vaccine, 2010, 28(38): 6235-6241.
[8] Lu QX, Liu C, Guo GP, et al. Establishment of indirect ELISA diagnose based on the VP1 protein of foot-and-mouth disease virus serotype A. Acta Agri Boreali-Occidentalis Sin, 2014, 23(1): 30-35 (in Chinese).卢清侠, 刘畅, 郭官鹏, 等. A型口蹄疫病毒VP1蛋白间接ELISA检测方法的建立. 西北农业学报, 2014, 23(1): 30-35.
[9] Song N, Wang FX, Sun N, et al. Purification of the recombinant structural protein of foot-and-mouthdisease virus serotype O in swine and establishment of the indirect ELISA. China Ani Husbandry Vet Med, 2013, 40(12): 20-26 (in Chinese).宋妮, 王凤雪, 孙娜, 等. 猪O型口蹄疫病毒重组结构蛋白的纯化及间接ELISA检测方法的建立. 中国畜牧兽医, 2013, 40(12): 20-26.
[10] Lin JM. Chemiluminescence-basic Principles and Applications. Beijing: Chemical Press, 2004: 14 (in Chinese).林金明. 化学发光基础理论与应用. 北京: 化学出版社, 2004: 14.
[11] Wang C, Wu J, Zong C, et al. Chemiluminescence immunoassay and its application progress. Chin J Anal Chem, 2012, 1(40): 3-10 (in Chinese).汪晨, 吴洁, 宗晨, 等. 化学发光免疫分析方法及其应用进展. 分析化学, 2012, 1(40): 3-10.
[12] Creton R, Jaffe LF. Chemiluminescence microscopy as a tool in biomedical research. Biotechniques, 2001, 31(5): 1098-1105.
[13] He FY, Feng YJ, Wu P, et al. Establishment to chemiluminescent enzyme immunoassay for chloramphenicol. Chin J Vet Drug, 2012, 46(3): 25-29 (in Chinese).何方洋, 冯月君, 吴鹏, 等. 氯霉素化学发光酶联免疫检测方法的建立. 中国兽药杂志, 2012, 46(3): 25-29.
[14] Buschmann A, Biacabe AG, Ziegler U, et al. Atypical scrapie cases in Germany and France are identified by discrepant reaction patterns in BSE rapid tests. J Virol Methods, 2004, 117(1): 27-36.
[15] Zhang XS, Liu ZX, Zhao QZ, et al. Progress in the structure and function of RNA gene in the genome of foot and mouth disease virus. Chin J Virol, 2001, 17(4): 375-380 (in Chinese).张显升, 刘在新, 赵启祖, 等. 口蹄疫病毒基因组RNA结构与功能研究进展. 病毒学报, 2001, 17 (4): 375-380.
[16] Lu ZJ, Liu ZX. Research conditions of foot-and-mouth disease virus. Chin J Vet Sci Tech 2003, 33(2): 69-74 (in Chinese).卢曾军, 刘在新. 口蹄疫病毒研究概况. 中国兽医科技, 2003, 33(2): 69-74.
[17] Zhang RX. Development of an indirect VP2-ELISA to detect antibodies of infected foot-and-mouth disease virus and a 8BF-ELISA kit using tandem epitopes of 3B to differentiate infected from vaccinated cattle [D]. Harbin: Northeast Agricultural University, 2010 (in Chinese).张润祥. 牛口蹄疫病毒VP2-ELISA和3B表位串联肽间接ELISA试剂盒的研制 [D]. 哈尔滨: 东北农业大学, 2010.
[18] Ye WM, Han HX, Fan LY, et al. Simple and rapid determination of trace proteins by Bradford colorimetric method. Lab Med, 1996, 4(1): 207-208 (in Chinese).叶伟民, 韩焕兴, 范列英, 等. Bradford比色法简便快速测定微量蛋白. 检验医学, 1996, 4(1): 207-208.
[19] Wang JH, Liang CM, Peng IM, et al. Induction of immunity in swine by purified recombinant VP1 of foot-and-mouth disease virus. Vaccine, 2003, 21: 3721-3729.
[20] Wang GH, Du JZ, Cong GZ, et al. Establishment of indirect ELISA diagnose based on the VP1 structural protein of foot-and-mouth disease virus in pigs. Chin J Biotech, 2007, 9(23): 961-966 (in Chinese).王光华, 独军政, 丛国正, 等. 猪口蹄疫病毒VP1结构蛋白抗体间接ELISA方法的建立. 生物工程学报, 2007, 9(23): 961-966.
[21] Zhu HX. Comparison of the effect of chemical luminescence method and enzyme linked immunosorbent assay in the serum of hepatitis B virus. Contemp Med, 2010, 6(16): 89-90 (in Chinese).朱火星. 化学发光法和酶联免疫法应用于乙肝病毒血清学效果比较. 当代医学, 2010, 6(16): 89-90.
[22] Xu CL, Peng CF, Hao K, et al. Determination of clenbuterol residual by chemiluminescent enzyme immunoassay. Chin J Anal Chem, 2005, 33(5): 699-702 (in Chinese).胥传来, 彭池方, 郝凯, 等. 化学发光酶免疫方法检测克伦特罗残留. 分析化学, 2005, 33(5):699-702.
[23] Zhang SS, Jiang SF, Bai JH. Progress of chemiluminescence immunoassay. J Qingdao Inst Chem Technol, 1992, 13(1): 98-103 (in Chinese).张书圣, 江淑芙, 白洁洪. 化学发光酶联免疫分析的进展. 青岛化工学院学报, 1992, 13(1): 98-103.
[24] Zheng JF, Zhang F, Lü L. Preparation of an AOZ chemiluminescence-ELISA kit. J Univ Jinan: Sci Tech, 2012, 10(26): 366-369 (in Chinese).郑俊峰, 张峰, 吕丽. AOZ化学发光酶联免疫检测试剂盒的研制. 济南大学学报:自然科学版, 2012, 10(26): 366-369.
[25] Zhou QY, Zhang NN. Application of double antigen sandwich chemiluminescence detection for hepatitis C virus antibody. Labeled Immunoassay Clin Med, 2016, 23(3): 324-326 (in Chinese).周齐洋, 张娜娜. 丙型肝炎病毒抗体双抗原夹心法化学发光检测的应用. 标记免疫分析与临床, 2016, 23(3): 324-326.
[26] Wei GW, Yu YP, Wei WK, et al. Progress on chemiluminescence immunoassay technique and its application. Prog Vet Med, 2010, 31(3): 97-102 (in Chinese).魏光伟, 余永鹏, 魏文康, 等. 化学发光免疫分析技术及其应用研究进展. 动物医学进展, 2010, 31(3): 97-102.
(本文责编 陈宏宇)
March 10, 2016; Accepted: May 13, 2016
Limin Yang. Tel/Fax: +86-10-64807503; E-mail: lmyang@im.ac.cn
Establishment of chemiluminescent enzyme immunoassay for detecting antibodies against foot-and-mouth disease virus serotype O in swine
Recombinant structural protein VP1 of foot-and-mouth disease virus serotype O was expressed in Escherichia coli and then purified using Nickel affinity chromatography. A chemiluminescent enzyme immunoassay (CLEIA) method was established using the purified recombinant protein as coating antigen to detect antibody of foot-and-mouth disease virus serotype O in swine. The specificity of VP1-CLEIA method is 100%. The coefficients of variation in the plate and between plates are 1.10%-6.70% and 0.66%-4.80%, respectively. Comparing with the commercial indirect ELISA kit or liquid phase block ELISA kit, the calculated coincidence rate is 93.50% or 94.00%. The high specificity and stability suggested this detection method can be used to monitor the antibody level of foot-and-mouth disease virus serotype O in swine.
foot-and-mouth disease virus serotype O, VP1 protein, chemiluminescent enzyme immunoassay
Supported by: Key Research Program of the Chinese Academy of Sciences (No. KSZD-EW-Z-005-001).*These authors contributed equally to this study.
中国科学院重点部署项目 (No. KSZD-EW-Z-005-001) 资助。

