大菱鲆家系选育二代7种免疫因子的分析
田岳强, 郭建丽, 黄智慧, 3, 马爱军, 3, 王新安, 3, 杨 志, 曲江波
大菱鲆家系选育二代7种免疫因子的分析
田岳强1, 2, 郭建丽1, 黄智慧1, 3, 马爱军1, 3, 王新安1, 3, 杨 志4, 曲江波4
(1. 中国水产科学研究院黄海水产研究所农业部海洋渔业可持续发展重点实验室青岛市海水鱼类种子工程与生物技术重点实验室山东青岛266071; 2. 上海海洋大学, 上海201306; 3. 青岛海洋科学与技术国家实验室海洋生物学与生物技术功能实验室, 山东青岛 266071; 4. 烟台开发区天源水产有限公司, 山东烟台 264003)
为选育高成活率的大菱鲆()抗鳗弧菌()群体, 对30个大菱鲆选育二代家系(F2)和1个普通养殖群体进行鳗弧菌攻毒实验(周期为14 d), 统计分析死亡率。选取死亡率不同的6个选育家系和普通养殖群体构成7个实验组, 采用半定量-聚合酶链反应(semi-quantitative polymerase Chain reaction , RT-PCR) 技术对它们肝脏、脾脏、头肾的相关免疫因子——溶菌酶(Lysozyme)、抗菌肽(Hepcidin)、热激蛋白70(HSP70)、热激蛋白90(HSP90)、免疫球蛋白(IgM)、C-型凝集素(C-type lectin)、Lily-型凝集素(Lily-type lectin) 的表达量开展研究, 并应用SPSS 16.0软件对攻毒前后各免疫因子的表达量与攻毒后存活率之间的相关性进行分析。研究结果表明: 攻毒前后选育家系幼鱼肝脏、脾脏、头肾中7个免疫因子的表达量普遍高于普通养殖幼鱼, 且在7个实验组中, 攻毒后的表达量相较攻毒前均呈现下降趋势; 攻毒前, 肝脏中lysozyme、IgM的表达量与存活率为极显著性正相关(<0.01), HSP70、HSP90、C-type lectin、Lily-type lectin的表达量与存活率为显著性正相关(<0.05); 脾脏中, Hepcidin、HSP70和HSP90的表达量与存活率为极显著性正相关(<0.01); 头肾中, HSP70的表达量与存活率为显著正相关(<0.05)。综上, 可以推断选育家系相对于普通养殖群体大菱鲆抗鳗弧菌性能更强, 且7种免疫因子在鳗弧菌感染鱼体的过程中发挥重要的抗感染作用; 从F2中获得一个抗鳗弧菌性能较强的家系(23号), 可用于今后大菱鲆抗鳗弧菌品系的选育指导工作, 为大菱鲆高成活率群体的选育提供参考资料和理论依据。
大菱鲆(); 鳗弧菌(); 选育家系; 免疫因子; RT-PCR
大菱鲆(), 隶属于鲽形目(Pleuronectiformes)、菱鲆科(Bothidae)、菱鲽属(), 为原产于北欧的底栖冷水性鱼类[1]。1992年中国水产科学院黄海水产研究所率先将其引进中国, 目前大菱鲆养殖已发展为年产量超过60 000t的海水养殖支柱产业[2]。但是中国进口大菱鲆群体种质较单一, 加之累代养殖和近亲交配, 其种质退化日趋明显, 并且伴随着大菱鲆养殖业的迅猛发展和集约化程度的不断提高, 病害问题日渐突出[3-5], 严重制约了大菱鲆养殖产业的可持续发展。
自“十一五”开始, 中国陆续立项支持大菱鲆良种选育的相关研究, 旨在选育出生长快、抗逆性强的新品种[2]。从2007年起, 本课题组采用电子标记辅助的大规模家系选育技术和分子辅助育种技术, 开始了大菱鲆的良种选育工作[6-10]。目前已成功选育出生长快、成活率高的新品种“多宝一号”以及耐高温[9-10]的新品系。然而, 大菱鲆高成活率品系的选育及相关抗病的详细机制国内鲜有报道, 为了指导本课题组高成活率品系的选育, 开展此研究。众所周知, 溶菌酶、抗菌肽、热激蛋白、免疫球蛋白和凝集素等均是鱼类重要的免疫因子,国内外许多专家对它们在抵抗感染性致病菌的防御机制中起到的作用进行研究。如周丽等[11]对引起牙鲆体表溃烂的病原纤毛虫——指状拟舟虫()诱导牙鲆免疫反应产生的免疫球蛋白进行分析, 发现病原纤毛虫免疫注射牙鲆, 可诱导牙鲆发生特异性免疫反应, 产生抗体; Shike等[12-13]报道抗菌肽mRNA表达量变化受外界病原微生物的正调控; 林天势等[14]用病原菌感染大黄鱼(), 感染48 h后, 各组织HSP90表达量明显上升等。
本研究对以高成活率为选育目标的大菱鲆家系选育二代和普通养殖群体幼鱼进行鳗弧菌()攻毒实验, 检验选育家系抗鳗弧菌性能, 并分析了肝脏、脾脏和肾脏中的多种免疫因子的表达水平及其与存活率的关系, 为大菱鲆高成活率性状选育提供参考资料和理论依据。
1 材料与方法
1.1 实验材料
1.1.1 实验用鱼
实验家系用鱼来源于本课题组于2010年5月在烟台天源水产国家级良种场所构建的同批次选育家系[8]。于2011年5月开展攻毒实验, 即从30个家系中分别挑取40尾幼鱼, 从购自日照养殖场的普通群体中挑取40尾幼鱼, 同时从选育家系与普通养殖群体中共挑选40尾组成1个混合组, 共计32组, 分别养殖于32个直径110 cm、高68 cm的圆柱形玻璃钢桶内。养殖海水为过滤深井海水, 循环流水, 桶内海水高度控制在50 cm, 水温为(13±1)℃, 氧气泵连续通氧, DO≥7.3 mg/L, 盐度为28‰, 早晚各喂1次, 暂养14 d。为保证后续攻毒实验用菌量在各组之间无显著差异, 挑选的所有用鱼规格均匀[体长均值为(17.79±2.8) cm, 体质量均值为(275.98±21.36)g, 均值±标准差]。后期免疫分析所用的6个家系是根据攻毒后死亡率的高低, 从30个家系中挑选获得。
1.1.2 鳗弧菌
攻毒实验所用的鳗弧菌为本实验室保存并经过鉴定的鳗弧菌菌株。菌株接种于灭菌的TSB培养基(TSB 30g, NaCl 15g, 蒸馏水1 000 mL溶解), 28℃, 200 r /min培养约24 h, 测定OD600值, 并用0.9%生理盐水稀释至已测定的半致死浓度106cfu/mL。
1.2 实验方法
1.2.1 攻毒实验
暂养结束后, 参照文献[15-16]的方法, 对选育家系及普通养殖群体幼鱼腹腔注射1μL/g[17]经过稀释的鳗弧菌菌液, 同时对混合组腹腔注射1 μL/g 0.9%生理盐水作为对照。感染期间水温控制在(14±1)℃,实验持续14 d, 统计死亡情况并及时捞出死鱼。对每组死鱼随机抽取3尾进行涂片镜检, 均发现鳗弧菌。
1.2.2 样品采集
在注射前和注射后第15天分别从各组随机取5尾大菱鲆幼鱼, 剪取幼鱼肝脏、脾脏、头肾, 置于加入组织保护液的无RNA酶离心管中, 即为肝脏、脾脏、头肾的样品。样品放入液氮中保存备用。
1.2.3 免疫因子的测定和分析
1.2.3.1 RNA提取
利用TIANGEN动物组织总RNA提取试剂盒提取肝脏、脾脏和头肾样品的RNA。将5个样本按照等同的RNA含量进行混合, 分装并用封口膜封存, –80℃储存。
1.2.3.2 RNA反转录成cDNA
在RNase-free离心管中加入1 μg混匀后的RNA以及1 μL random hexamer primer(随机引物), 加入RNase-free ddH2O至12 ++μL, 65℃反应5 min。向上述反应体系中加入4 μL 5×Reaction Buffer、1 μL (20 U/μL)RIboLock RNase Inhibitor、2 μL 10 mmol/L dNTP Mix以及1 μL(200 U/μL)RevertAid M-MuLV R反转录酶, 反应体系总体积为20 μL。PCR扩增, 反应条件为: 25℃ 5min, 42℃ 60 min, 75℃ 5 min。
1.2.3.3 免疫因子的PCR扩增与分析
对7种免疫因子的特异引物(表1), 在Taq polymerase的作用下进行特异性扩增, 并用β-actin作为内参对RT-PCR产物进行分析。PCR反应体系20 μL: cDNA 1 μL, 10×buffer 1.5 μL, 上、下游引物各0.5 μL, 2.5 mmol/L dNTPs 1.3 μL, Taq DNA聚合酶0.2 μL, 无RNA水15 μL。PCR反应条件: 94℃预变性5 min; 94℃变性30 s, 退火45 s, 72℃延伸45 s, 按表1设置循环数; 72℃延伸5 min, 反应结束。利用1.7%琼脂糖凝胶电泳系统对PCR产物进行检测, 利用凝胶成像软件(UV-systems)对条带强度进行分析。每个样品的凝胶电泳进行3次重复, 灰度值以[均值±标准差]表示。

表1 PCR反应中特异性引物的核苷酸序列
1.3 数据处理
采用SPSS16.0统计软件进行单因素方差分析, 用Duncan法进行多重比较,<0.05为差异显著。
进行皮尔逊检验(Pearson correlation), 对攻毒前各免疫因子的相对表达量与大菱鲆攻毒后的死亡率进行相关性分析。Pearson相关系数公式为:
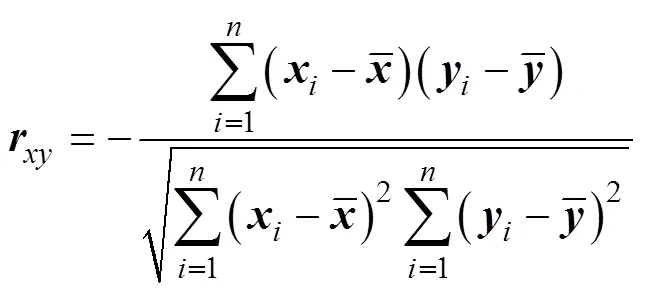
2 结果
2.1 攻毒后大菱鲆的累积死亡情况
注射生理盐水的混合组在实验期间未出现死亡, 可排除养殖环境和注射对实验的干扰。攻毒后, 30个家系的累积死亡率在(23.34±4.72)%~(75.00±2.36)%, 普通养殖群体的累积死亡率为(81.67±2.35)%, 各家系的死亡率均低于普通养殖群体(编号31)(图1); Duncan多重比较结果表明, 30个家系中有27个的累积死亡率显著低于普通养殖群体(<0.05)。选取死亡率由低到高具有代表性的6个家系作为家系组, 分别命名为家系组1~6, 死亡率平均值分别为25.00%、33.33%、41.65%、56.66%、66.66%、75.00%, 对应家系号为23号、6号、8号、7号、15号、5号, 普通选育群体命名为普通组, 共7个实验组用于免疫因子分析。
2.2 肝脏攻毒前后各免疫因子的表达分析
应用7种免疫因子的特异性引物对肝脏cDNA进行PCR扩增, PCR产物利用1.7%琼脂糖凝胶电泳系统进行检测, 利用凝胶成像软件(UV-systems)分析条带强度, 由此得出攻毒实验对大菱鲆肝脏7种免疫因子表达水平的影响, 如图2。应用SPSS16.0分别对各实验组肝脏之间免疫因子的表达量进行方差分析及多重比较, 并用检验分析7种免疫因子攻毒前后的差异性, 结果见表2。肝脏中各免疫因子的表达量在攻毒后普遍呈现下降趋势; 攻毒前, 6个家系组的各免疫因子表达量全部高于普通组(<0.05), 7个实验组的免疫因子表达量的高低与其存活率呈一定的正相关关系; 攻毒后, 大多数家系组的免疫因子表达量高于普通组(<0.05)。
2.3 脾脏攻毒前后各免疫因子的表达分析
应用7种免疫因子的特异性引物对脾脏cDNA进行PCR扩增, 结果见图3。应用SPSS16.0分别对各实验组脾脏之间免疫因子的表达量进行方差分析及多重比较, 并用检验分析免疫因子攻毒前后的差异性, 结果见表3。脾脏中各免疫因子的表达量在攻毒后普遍呈现下降趋势; 无论攻毒前后, 6个家系组的各免疫因子表达量普遍高于普通组(<0.05); 攻毒前, 7个实验组的免疫因子表达量的高低与其存活率呈一定的正相关关系。
B. 攻毒前; A. 攻毒后(图3、图4同)
B. before the challenge; A. after the challenge (same as in Fig. 3 and Fig. 4)
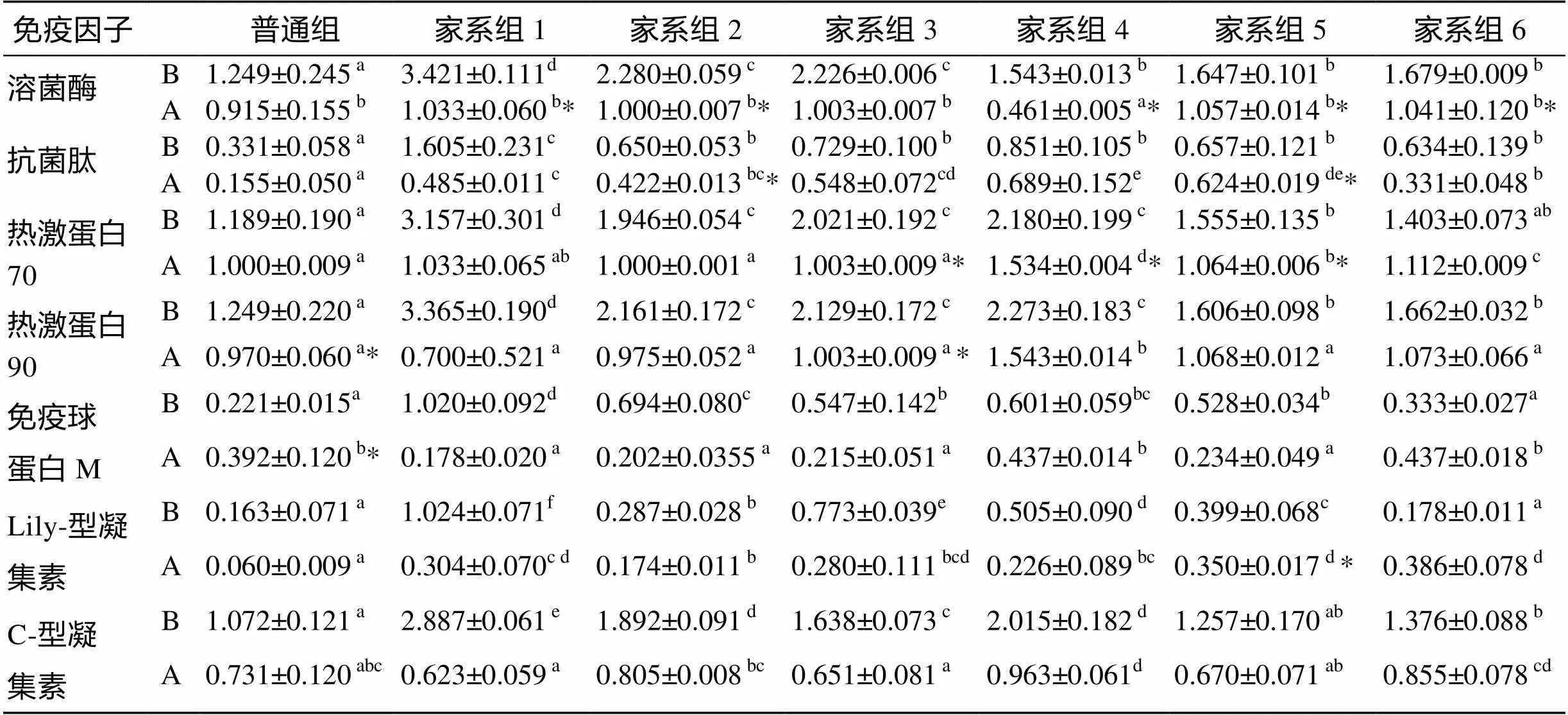
表2 大菱鲆肝脏7种免疫因子灰度值测定结果
注: B. 攻毒前, A. 攻毒后。同行中, 标有不同小写字母者表示同种免疫因子相同实验阶段下不同组间差异显著(<0.05), 标有相同小写字母者表示组间差异不显著(>0.05); 标有“*”者表示该组在不同实验阶段下差异显著(<0.05), 没标“*”者表示该组在不同实验阶段下差异不显著(>0.05)(表3, 表4同)

表3 大菱鲆幼鱼脾脏7种免疫因子灰度值测定结果
2.4 头肾攻毒前后各免疫因子的表达分析
应用7种免疫因子的特异性引物对头肾cDNA进行PCR扩增, 结果见图4。应用SPSS16.0分别对各实验组头肾免疫因子攻毒前后的表达量进行方差分析及多重比较, 并用检验分析免疫因子攻毒前后的差异性, 结果见表4。头肾中各免疫因子的表达量在攻毒后普遍呈现下降趋势; 无论攻毒前后, 6个家系组的免疫因子表达量普遍高于普通组(<0.05); 攻毒前, 7个实验组免疫因子的表达量与其存活率相关关系不如肝脏与脾脏中明显。

表4 大菱鲆幼鱼头肾7种免疫因子灰度值测定结果
2.5 攻毒前7种免疫因子表达量与存活率的相关性分析
将各实验组肝脏、脾脏和头肾中7种免疫因子攻毒前的表达量与攻毒后的存活率(存活率=1–死亡率)进行相关性分析, 如表5所示。肝脏中, 溶菌酶(Lysozyme)、免疫球蛋白M(IgM)的表达量与存活率为极显著性正相关(<0.01), 热休克蛋白70(HSP70)、热休克蛋白90(HSP90)、C-型凝集素(C-type lectin)、Lily-型凝集素(Lily-type lectin)的表达量与其为显著性正相关(<0.05); 脾脏中, 抗菌肽(Hepcidin)、热激蛋白70(HSP70)和热激蛋白90(HSP90) 的表达量与存活率为极显著正相关(<0.01); 头肾中热休克蛋白70(HSP90)的表达量与存活率为显著正相关(<0.05)。

表5 大菱鲆肝脏、脾脏和头肾的7种免疫因子攻毒前的表达量与存活率的相关性分析
注: 显著相关(<0.05); **. 极显著相关(<0.01)
3 讨论与小结
非特异性免疫系统是动物抵御外界病原体侵染的重要防线, 鱼类作为较低等的脊椎动物, 相对于哺乳动物而言, 其特异性免疫系统机制还处于较原始的状态, 因此在抵抗入侵病原微生物生理反应中, 鱼类的非特异性免疫防御系统所承担的角色显得更为关键[18-19]。鱼类的肝脏、脾脏和头肾都是合成免疫因子的重要器官, 加之溶菌酶、抗菌肽、热激蛋白70、热激蛋白90、IgM、C-型凝集素、Lily-型凝集素7种重要的免疫因子在鱼体抵抗感染性致病菌的最前沿防御机制中起着至关重要的作用。因此, 分析各重要免疫因子在肝脏、脾脏和头肾组织中的表达情况, 可以在一定程度上对机体的抗病力进行判断。
本研究立足于前人经验, 应用Duncan多重比较死亡率, 选取6个F2家系和1个普通群体, 采用RT-PCR手段对它们肝脏、脾脏和头肾的7种免疫因子展开研究, 分析攻毒前肝脏、脾脏和头肾中相关免疫因子的表达量与攻毒后存活率之间的相关性, 分析结果讨论如下:
攻毒后, 各家系的死亡率均低于普通养殖群体, 30个家系中有27个家系的累积死亡率显著低于非选育群体(<0.05)。说明F2选育家系在抗鳗弧菌方面优于普通养殖群体。
肝脏、脾脏与头肾中, 无论攻毒前后, 6个家系组肝脏、脾脏、头肾中7个免疫因子的表达量普遍高于普通组, 见表2、表3、表4。这表明, 免疫因子在家系组的重要免疫器官中的表达能力优于普通组, 初步判定选育家系F2的抗鳗弧菌性能优于普通养殖群体。
在肝脏、脾脏和头肾中, 对比攻毒前后多组免疫因子的表达量出现了显著差异, 作者推测这些免疫因子在鳗弧菌感染鱼体的过程中, 发挥了重要的抗感染作用。然而, 各免疫因子在攻毒后, 表达量出现下降趋势, 与之前部分学者得出的上升趋势的结论不完全一致[20-24]。如强俊等[20]对“吉富”、“新吉富”、“埃及尼罗”3种不同品系的尼罗罗非鱼()进行高密度胁迫发现, 应激48 h内, 吉富罗非鱼(Jifu)与新吉富罗非鱼(New Jifu)溶菌酶活力水平以及肝脏HSP70 mRNA水平呈先上升后下降的变化, 埃及尼罗罗非鱼(Egypt)血清溶菌酶活力与肝脏HSP70 mRNA水平在应激后48 h内始终高于应激前(<0.05)。作者认为是由于取样时间不同造成的。之前的研究均在攻毒实验后的第24、48小时等时间点取样, 本实验目的是对各家系的抗性性能进行分析, 筛选出抗鳗弧菌性能较强的家系, 为今后的抗性选育工作提供理论依据, 因此在实验设计中, 模拟养殖环境, 避免取样后鱼缸中密度变化造成实验误差, 在实验结束即攻毒后第15天取样, 该时间点可能不在各免疫因子表达量增加的阶段, 而正好处于免疫因子表达下降阶段。
对比表2、表3、表4, 肝脏、脾脏和头肾中, 相同实验组在攻毒前后, 表达量出现显著性差异的免疫因子并不一致。作者推测, 这3种不同的免疫器官, 在抗鳗弧菌时, 其免疫应答机理不同, 当外源病毒侵染鱼体时, 3个器官起免疫主导作用的免疫因子不同。
分析免疫因子攻毒前表达量与存活率之间的相关性发现, 肝脏中, Lysozyme、IgM的表达量与存活率为极显著性正相关(<0.01), HSP70、HSP90、C-type lectin、Lily-type lectin的表达量与其为显著性正相关(<0.05); 脾脏中, Hepcidin、HSP70和HSP90 的表达量与存活率为极显著正相关(<0.01); 头肾中HSP70的表达量与存活率为显著正相关(<0.05)。作者将得出的与存活率成显著或者极显著正相关的免疫因子作为可靠的免疫指标, 对今后大菱鲆高成活率育种工作提供指导。以这些指标为依据, 作者对6个家系组攻毒前各免疫因子的表达量进行分析, 如表2、表3、表4。攻毒前, 家系组1的肝脏、脾脏、头肾中, 与存活率显著相关的免疫因子表达量均最高, 其对应的存活率为75.00%, 从而可以判断该家系组在抗鳗弧菌方面相对于其他选育家系有较强的优势, 其对应的家系号为23。今后在抗鳗弧菌品种的选育过程中, 可以选取此家系为亲本继续构建, 也可取其存活个体进行抗鳗弧菌分子标记的筛选工作等。
通过本实验, 可以推测F2相对于普通养殖群体大菱鲆, 在抗鳗弧菌方面具有一定的优势, 得到一个抗鳗弧菌性能较好的家系23号, 而且以上7种非特异免疫因子在鳗弧菌感染鱼体的过程中, 发挥重要的抗感染作用。得出了一些与存活率成显著或者极显著正相关的免疫因子, 可作为可靠的免疫指标, 指导大菱鲆高成活率育种工作。
参考文献:
[1] Blanquer A, Alayse J P. Allozyme variation in turbot() and brill() (Osteichthyes, Pleuronectiformes, ScoPhthalmidae) throughout their range in Europe[J]. Fish Biology, 1992, 41(5): 725-736.
[2] 雷霁霖, 刘新富, 关长涛. 中国大菱鲆养殖20年成就和展望——庆祝大菱鲆引进中国20周年[J]. 渔业科学进展, 2012, 33(4): 123-130.Lei Jilin, Liu Xinfu, Guan Changtao. Turbot culture in China for two decades: Achievements and prospect[J]. Progress in Fishery Sciences, 2012, 33(4): 123-130.
[3] 申雪艳, 宫庆礼, 雷霁霖, 等.进口大菱鲆L苗种的遗传结构分析[J]. 海洋与湖沼, 2004, 35(4): 332-341. Shen Xueyan, Gong Qingli, Lei Jilin, et al. Population genetic structure analysis of the imported turbot seedlingsL. using RAPD and microsatellite technique[J]. Oceanologia Et Limnologia Sinica, 2004, 35(4): 332-341.
[4] 雷霁霖, 马爱军, 陈超, 等. 大菱鲆(L.)养殖现状与可持续发展[J]. 中国工程科学, 2005, 7(5): 30-34. Lei Jilin, Ma Aijun, Chen Chao, et al. The present status and sustainable development of turbot (L.) culture in China[J]. Engineering Science, 2005, 7(5): 30-34.
[5] 秦蕾, 王印庚, 阎斌伦. 大菱鲆微生物性疾病研究进展[J]. 水产科学, 2008, 27(11): 598-602. Qin Lei, Wang Yingeng, Yan Binlun. Advances in research on diseases of turbotaffected by microorganisms[J]. Fisheries Science, 2008, 27(11): 598-602.
[6] 马爱军, 王新安, 雷霁霖. 大菱鲆()不同生长阶段体重的遗传参数和育种值估计[J]. 海洋与湖沼, 2010, 40(2): 187-194. Ma Aijun, Wang Xin’an, Lei Jilin. Genetic parameterization for turbot: implication to breeding strategy[J]. Oceanologia Et Limnologia Sinica, 2009, 40(2): 187-194.
[7] 马爱军, 王新安, 薛宝贵, 等. 大菱鲆()选育家系的构建和培育技术研究[J]. 海洋与湖沼, 2010, 41(3): 301-306. Ma Aijun, Wang Xin′an, Xue Baogui, et al. Investigation on family construction and rearing techniques for turbot (l.) family selection[J]. Oceanologia Et Limnologia Sinica, 2010, 41(3): 301-306.
[8] 马爱军, 王新安, 黄智慧, 等. 大菱鲆()家系选育F2早期选择反应和现实遗传力估计[J]. 海洋与湖沼, 2012, 43(1): 57-61. Ma Aijun, Wang Xin′an, Huang Zhihui, et al. Response to selection and realized heritability for early growth in the second-generation breeded line of turbot (L)[J]. Oceanologia Et Limnologia Sinica, 2012, 43(1): 57-61.
[9] Liang X M, Ma A J, Wang X A, et al.Morphological comparison between a selected fast-growing strain and the common cultured strain of turbot[J]. Chinese Journal of Oceanology and Limnology, 2012, 30(4): 563-568.
[10] 马爱军, 黄智慧, 王新安, 等. 大菱鲆耐高温品系选育及耐温性能评估[J]. 海洋与湖沼, 2012, 43(4): 797-804. Ma Aijun, Huang Zhihui, Wang Xin'an, et al. The selective breeding of thermal tolerance family and appraisal of performance in turbot[J]. Oceanologia Et Limnologia Sinica, 2012, 43(4): 797-804.
[11] 周丽, 战文斌, 宋微波, 等. 指状拟舟虫诱导牙鲆抗血清免疫球蛋白分析[J]. 中国水产科学, 2000, 7(2): 28-31. Zhou Li, Zhan Wenbin, Song Weibo, et al. Analysis of immunogloblin M (IgM) in serum of Japanese flounder,[J]. Journal of Fisheryences of China, 2000, 7(2): 28-31.
[12] Shike H, Lauth X, Westerman M E, et al. Bass hepcidin is a novel antimicrobial peptide induced by bacterial challenge[J]. European Journal of Biochemistry, 2002, 269(8): 2232-2237.
[13] Shike H, Shimizu C, Lauth X, et al. Organization and expression analysis of the zebrafish hepcidin gene, an antimicrobial peptide gene conserved among vertebrates[J]. Developmental & Comparative Immunology, 2004, 28(7-8): 747-754.
[14] 林天势, 薛良义, 孙爱飞, 等. 温度和病原菌感染对大黄鱼热激蛋白90基因表达的影响[J]. 中国细胞生物学学报, 2012, 34(6): 555-564. Lin Tianshi, Xue Liangyi, Sun Aifei, et al. Effect of temperature and pathogen on HSP90 expression in[J]. Chinese Journal of Cell Biology, 2012, 34(6): 555-564.
[15] 陈松林, 田永胜, 徐田军, 等. 牙鲆抗病群体和家系的建立及其生长和抗病性能初步测定[J]. 水产学报, 2008, 32(5): 665-673. Chen Songlin, Tian Yongsheng, Xu Tianjun, et al. Development and characterization for growth rate and disease resistance of disease-resistance population and family in Japanese flounder()[J]. Journal of Fisheries of China, 2008, 32(5): 665-673.
[16] 莫照兰, 徐永立, 张培军. 养殖牙鲆鳗弧菌疫苗的研究[J]. 海洋科学, 2002, 26(4): 63-66. Mo Zhaolan, Xu Yongli, Zhang Peijun. Vaccination againston cultured flounder,[J]. Marine Sciences, 2002, 26(4): 63-66.
[17] 马爱军, 郭建丽, 王新安, 等. 大菱鲆选育家系抗鳗弧菌性能[J]. 中国水产科学, 2014, 21(3): 484-493. Ma Aijun, Guo Jianli, Wang Xin'an, et al. Family selection and estimation of disease resistance in turbot,[J]. Journal of Fishery Sciences of China, 2014, 21(3): 484-493.
[18] Bergljót M. Innate immunity of fish (overview)[J]. Fish & Shellfish Immunology, 2006, 20(2): 137-151.
[19] 佟雪红, 徐世宏, 刘清华, 等. 大菱鲆早期发育过程中免疫器官的发生[J]. 海洋科学, 2011, 35(6): 62-67. Tong Xuehong, Xu Shihong, Liu Qinghua, et al. Ontogeny of immune organs during early developmental stages of turbot[J]. Marine Sciences, 2011, 35(6): 62-67.
[20] 强俊, 杨弘, 何杰, 等. 3种品系尼罗罗非鱼生长及高密度胁迫后生理响应变化的比较[J]. 中国水产科学, 2014, 21(1): 142-152. Qiang Jun, Yang Hong, He Jie, et al. Comparison on growth performance in three different strains ofand physiological responses after short-term high stocking density stress[J]. Journal of Fishery Sciences of China, 2014, 21(1): 142-152.
[21] 万文菊, 王纪亭, 石存斌, 等. 溶藻弧菌感染对剑尾鱼HSP70基因表达的影响[J]. 大连水产学院学报, 2007, 22(5): 330-334. Wan Wenju, Wang Jiting, Shi Cunbin, et al. Gene expression of HSP70 in green swordtailexposed to[J]. Journal of Dalian Fisheries University, 2007, 22(5): 330-334.
[22] 魏然, 张士璀, 王长法, 等. 盐度多牙鲆非特异性免疫功能的影响[J]. 海洋科学进展, 2003, 21(2): 209-213. Wei Ran, Zhang Shicui, Wang Changfa, et al. Effects of changes in salinity on nonspecific immune function of Japanese flounder[J]. Advances in Marine Science, 2003, 21(2): 209-213.
[23] 刘波, 王美垚, 谢骏, 等. 低温应激对吉富罗非鱼血清生化指标及肝脏HSP70基因表达的影响[J]. 生态学报, 2011, 31(17): 4866-4873. Liu Bo, Wang Meiyao, Xie Jun, et al. Effects of acute cold stress onserum biochemical and immune parameters and liver HSP70 gene expression in GIFT strain of Nile tilapia()[J]. Acta Ecologica Sinica, 2011, 31(17): 4866-4873.
[24] 刘洪展, 郑风荣, 孙修勤, 等. 氨氮胁迫对刺参几种免疫酶活性的影响[J]. 海洋科学, 2012, 36(8): 47-52. Liu Hongzhan, Zheng Fengrong, Sun Xiuqin, et al. Effect of exposure to ammonia nitrogen stress on immune enzyme of holothurian[J]. Marine Sciences, 2012, 36(8): 47-52.
(本文编辑: 谭雪静)
Analysis of seven immune-related genes in selective second filial families (F2) of turbot ()
TIAN Yue-qiang1, 2, GUO Jian-li1, HUANG Zhi-hui1, 3, MA Ai-jun1, 3, WANG Xin-an1, 3, YANG Zhi4, QU Jiang-bo4
(1. Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences; Key Laboratory of Sustainable Development of Marine Fisheries, Ministry of Agriculture; Qingdao Key Laboratory for Marine Fish Breeding and Biotechnology, Qingdao 266071, China; 2. Shanghai Ocean University, Shanghai 201306, China; 3. Laboratory for Marine Biology and Biotechnology, Qingdao National Laboratory for Marine Science and Technology, Qingdao 266071, China; 4. Yantai Tianyuan Aquatic Limited Corporation, Yantai 264003, China)
For breeding turbot group with high survival rates and resistance to, 30 selective second filial families (F2) with a high survival rate and one common culture group of turbot (L.) were infected with. Six F2and one control groups were picked out as samples for detecting the following immune responses. Gene expressions of seven immune-related factors (lysozyme, HSP90, HSP70, IgM, hepcidin, C-type lectin, and lily-type lectin) were analyzed in turbot livers, spleens, and head kidneys using RT-PCR. Correlation analysis between the expression of these immune genes before infection and survival rate after challenge assays (period of 14 days) was carried out using SPSS 16.0 software. Results showed that regardless of samples infected with, the expression of immune-related genes in the six F2populations was generally stronger than that in the control and the expression status of most immune genes was higher in the seven experimental groups withoutstress thanin the injected groups. The expression of the remaining six immune genes, except hepcidin, beforeinfection showed a significantly positive correlation with survival rate in livers (< 0.05) and the gene expression of lysozyme and IgM exhibited a highly significant positive correlation (< 0.01). Gene expressions of hepcidin, HSP70, and HSP90 showed a highly significant positive correlation with survival rate in spleens (< 0.01); the expression of HSP70 exhibited a significant positive correlation with survival rate in head kidneys (< 0.05). Therefore, F2selective families with a high survival rate could possess an outstanding resistance againstand the seven immune-related genes could play important roles in bacterial resistance of turbot. We obtained a selective family (No. 23) with a strong resistance against, which could guide selection of turbot strains with disease-resistance trait in the future and provide a reference and theoretical basis for turbot breeding.
;; selective second filial families; immune-related gene; RT-PCR
Mar. 5, 2015
S941
A
1000-3096(2016)09-0009-09
10.11759/hykx20150305002
2015-03-05;
2015-05-07
国家863 计划项目(2012AA10A408-8); 现代农业产业技术体系建设专项基金共同资助(CARS-50-G01); 中国博士后科学基金项目(2015M572096); 山东省自然科学基金项目(ZR2014CP001)
田岳强(1988-), 男, 山东省泰安人, 硕士, 主要从事鱼类遗传育种研究, 电话: 15865385685, E-mail: tyqiang1988@163.com; 马爱军, 通信作者, 电话: 0532-85835103, E-mail: maaj@ysfri.ac.cn
[Foundation: National 863 Program (2012AA10A408-8); Modern Agro-Industry Technology Research System (CARS-50-G01); China Postdoctoral Science Foundation(2015M572096); the Shandong Provincial Natural Science Foundation (ZR2014CP001)]

