诸氏鲻虾虎鱼卵黄蛋白原基因全长cDNA的克隆及表达
余露军, 蔡 磊, 李 舸, 陈小曲, 陈 琳, 李建军
诸氏鲻虾虎鱼卵黄蛋白原基因全长cDNA的克隆及表达
余露军, 蔡 磊, 李 舸, 陈小曲, 陈 琳, 李建军
(广东省实验动物监测所广东省实验动物重点实验室, 广东广州 510663)
为了探讨诸氏鲻虾虎鱼()卵黄蛋白原组织分布及17β-雌二醇(E2)暴露对雄性诸氏鲻虾虎鱼Vg的影响, 作者采用RT-PCR、RACE方法克隆并分析了诸氏鲻虾虎鱼卵黄蛋白原(Vg)基因的全长cDNA序列, 并对Vg在诸氏鲻虾虎鱼体内的组织表达分布及E2诱导后不同时间表达规律进行了研究。结果表明: 获得的Vg cDNA序列全长5 067 bp, 开放阅读框(ORF)含4 992 bp, 编码1 663个氨基酸, 含有信号肽、多丝氨酸区域, 推测其编码氨基酸分子量为186.2 ku, 等电点为9.31。荧光定量PCR结果显示, Vg在诸氏鲻虾虎鱼肝脏中表达量最高。E2诱导后, 诸氏鲻虾虎鱼肝脏中Vg mRNA的表达量第1天达到小高峰, 第3天达到高峰, 第7天开始明显下降, 第11天仍能维持较高水平。本研究成功克隆了诸氏鲻虾虎鱼Vg基因全长cDNA序列, 诸氏鲻虾虎鱼肝脏是Vg主要合成场所, E2诱导雄性诸氏鲻虾虎鱼Vg的表达作为生物标志物用于近海环境雌激素类物质的检测具有良好的应用前景。
诸氏鲻虾虎鱼(); 卵黄蛋白原; cDNA全长; 荧光定量PCR; 17b-雌二醇
卵黄蛋白原(Vitellogenin, Vg)是几乎所有卵生动物中卵黄蛋白(Vitellins, Vn)的前体[1], 为雌性动物特有的蛋白, 在雄性动物体内含量极低或完全没有, 但在雌激素类物质的的诱导下, 雄性动物也能合成卵黄蛋白原[2], 这种受雌激素类物质诱导的特性, 使得卵黄蛋白原被广泛地应用于环境内分泌干扰物的毒性评价, 已成为外源雌激素和内分泌干扰物毒理研究的理想生物标志物[3]。
鱼类是水环境生态链中重要的一环, 是理想的水环境污染物监测生物, 目前已有多种鱼类用于环境雌激素的研究[4-5], 其中斑马鱼()[6]、剑尾鱼()[7]、唐鱼()[8]、青鳉()[9]等多种鱼类实验动物在卵黄蛋白原(Vg)水平开展了相关的研究。河口与近海水域是陆地水流与海洋的交汇处, 也是环境污染物的汇聚地, 但河口鱼类在环境雌激素效应方面的研究较少。诸氏鲻虾虎鱼() 属于鲈形目(Perciformes), 虾虎鱼科(Gobiidae), 鲻虾虎鱼属(), 为暖水性底层小型鱼类, 栖息于河口、咸淡水水域中, 具有体形小、适应盐度范围广、对许多毒物敏感性强的特点[10]。诸氏鲻虾虎鱼作为一种海洋水生实验动物, 已开展海洋污染物的相关毒性评价[11-12]。本研究以诸氏鲻虾虎鱼为实验材料, 克隆了诸氏鲻虾虎鱼Vg基因全长cDNA序列, 并对Vg在诸氏鲻虾虎鱼体内的组织分布及雌激素诱导后不同时间表达规律进行了研究, 为诸氏鲻虾虎鱼应用于近海环境雌激素类污染物的监测提供技术支撑。
1 材料与方法
1.1 实验用鱼
实验用诸氏鲻虾虎为本实验室内繁殖的子9代封闭群(4~5月龄), 半静态方式养殖, 体长23~34 mm,水质条件为盐度25±2, 温度(26±2)℃, 光周期14 h︰10 h (光照︰黑暗)。
1.2 诸氏鲻虾虎鱼Vg全长cDNA扩增及序列分析
总RNA提取: 取3尾雌性诸氏鲻虾虎鱼新鲜肝脏组织并混合, 按Trizol(Invitrogen)试剂盒说明书提取总RNA, 超微量分光光度计(NanoDrop 2000C, Thermo Scientific)测定RNA纯度和浓度, 计算加入的RNA样本量(Total RNA 400 ng), 按照PrimeScriptTMRT reagent Kit(TaKaRa)试剂盒说明书进行反转录合成第一链cDNA。
Vg cDNA克隆: 根据GenBank中已知鱼类黄鳍刺虾虎鱼()(AB088473.1)Vg-530cDNA序列, 合成1对引物PVg(表1)。以第一链cDNA为模板, 进行PCR扩增, 根据获得的Vg基因片段分别设计5′RACE下游巢式引物5′GSP 外侧和5′GSP 内侧、3′RACE上游巢式引物 3′GSP 外侧和3′GSP 内侧(表 1), PCR扩增方法参照刘春等[13]的方法进行, PCR产物经胶回收 (Omega) 纯化后与pMD-19T载体( Takara) 连接, 挑取阳性克隆送上海生工测序。
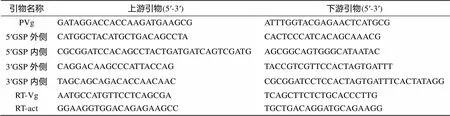
表1 引物序列
序列分析: 测序获得的序列用DNAstar7.1分析软件进行全长拼接, 在GenBank数据库与已知鱼类Vg氨基酸序列进行同源性比较分析, 用MEGA4.0软件构建系统发育进化树。采用在线翻译工具( http: //www.expasy.ch) 对序列进行翻译和蛋白质组分析[14]。
1.3 诸氏鲻虾虎鱼不同组织器官中Vg的表达
随机挑选3尾雌性诸氏鲻虾虎鱼(4~5月龄), 分别取肝、脾、肠、鳃、肌肉、脑、卵巢组织, 取3个平行样品, 按1.2中的方法进行总RNA提取和反转录合成第一链cDNA。
根据诸氏鲻虾虎鱼Vg基因cDNA序列, 用Primer Premier5.0设计荧光定量检测引物RT-Vg和内参基因β-actin的引物RT-act(表1), 采用荧光定量PCR技术(ABI 7500)对诸氏鲻虾虎鱼肝、脾、肠、鳃、肌肉、脑、卵巢组织(=3)中的Vg表达情况进行检测, 并以b-actin为内参基因对数据进行分析[13]。实验数据采用spss17.0软件进行显著性差异分析, excel软件作图。
1.4 雌激素诱导不同时间诸氏鲻虾虎鱼肝脏中Vg的表达
挑选已具备性特征的雄性诸氏鲻虾虎鱼(4~5月龄)暴露于100 μg/L的β-雌二醇[13](溶解于无水乙醇), 每组20尾, 每组3个平行, 同时设置海水对照组, 对照组加入同样浓度的无水乙醇(终浓度<0.01%)。暴露时间为11 d, 每天更换一次试液。每天投喂适量卤虫()无节幼体, 分别在1、3、5、7、9、11 d取3尾鱼肝脏组织混合, 冻存于液氮中。
按1.2中的方法对上述样品进行总RNA提取和反转录合成cDNA模板, 采用荧光定量PCR技术对雌激素诱导后诸氏鲻虾虎鱼肝脏中的Vg进行检测, 检测方法和数据分析同1.3。
2 结果
2.1 诸氏鲻虾虎鱼Vg基因cDNA 序列扩增及结构分析
用DNAStar软件对PCR扩增获得的诸氏鲻虾虎鱼Vg基因核心片段、3′端、5′端序列片段进行拼接, 获得诸氏鲻虾虎鱼Vg基因的全长 cDNA 序列。该序列全长5067 bp, 包含起始密码子ATG、终止密码子TAG及加尾信号AATAAA, 在GenBank库中的登录号为KP162167。鲻虾虎鱼卵黄蛋白原基因cDNA序列含有一个完整的开放阅读框(ORF), 编码1663个氨基酸, N-端的前15个氨基酸为信号肽, 有4个糖基化位点, 其中2个可能是有效的糖基化位点在112~114, 1133~1135。序列还含有一个多聚丝氨酸区(氨基酸位点在1088~1187)。根据推算, 其编码的蛋白分子量为186.2 ku, 等电点为9.31。该基因的核苷酸序列及编码的氨基酸序列如图1。
信号肽位置用水平线标出, 阴影部分为多聚丝氨酸区域, 黑色框为加尾信号
The signal peptide site of vitellogenin is marked by the horizontal line, polyserine domain is indicated by shading, polyadenylation signal is indicated by black border
2.2 诸氏鲻虾虎鱼Vg基因氨基酸同源性比对及系统进化树分析
诸氏鲻虾虎鱼Vg基因编码的氨基酸序列在GenBank数据库中进行检索、比对, 结果显示与同属于虾虎鱼科的黄鳍刺虾虎鱼(BAC06190.1)、矛尾刺虾虎鱼(AAV84912.1)同源性最高, 均为73%, 与小长臂虾虎鱼(AGO64301.1)、北方蓝鳍金枪鱼()(ACX32463.1)、金头鲷()(CDK37743.1)氨基酸同源性分别为59%、52%、50%, 与其他几种鱼类氨基酸同源性为47%~43%(表2)。选取GenBank数据库中15种硬骨鱼类的Vg基因氨基酸序列, 利用MEGA4.0软件构建系统进化树, 分子进化分析表明, 诸氏鲻虾虎鱼与黄鳍刺虾虎鱼、矛尾刺虾虎鱼聚为一支, 亲缘关系最近(图2)。

表2 诸氏鲻虾虎鱼与其他鱼类Vg基因氨基酸同源性比较
节点处数值为自展置信值, 自展重复1000次
The degree of confidence for each branch point was determined by bootstrap analysis (1000 repetitions)
2.3 Vg在诸氏鲻虾虎鱼的组织分布
利用荧光定量RT-PCR方法对雌性诸氏鲻虾虎鱼7个组织中Vg的表达情况结果如图3所示。诸氏鲻虾虎鱼Vg在肝脏中相对表达量最高, 脾、肠中有极微量表达(均小于肝脏表达量的1%), 鳃、脑、肌肉、卵巢中几乎没有检测到表达, 肝中的相对表达量显著高于其他各组织中的相对表达量相比(<0.01)。
2.4 雌激素诱导后诸氏鲻虾虎鱼肝脏中Vg的表达规律
雌激素诱导雄性诸氏鲻虾虎鱼, 不同时间肝脏中Vg的相对表达结果如图4。由图可知, 在试验期间内, E2诱导后各时间点诸氏鲻虾虎鱼肝脏中Vg的相对表达量在雌激素诱导后均显著高于对照组(< 0.01); 诸氏鲻虾虎鱼肝脏中Vg相对表达量第1天即达到小高峰, 第3天相对表达量显著高于第1天相对表达量, 达到高峰(<0.01); 第7天开始明显下降, 相对表达量显著低于第5天相对表达量(<0.05); 至第11天仍能维持较高水平, 但与第7天相比没有显著性差异(>0.05)。
a. 与对照组相比差异极显著(<0.01); b. 与前一时间点相比差异显著(<0.05); c. 与前一时间点相比差异极显著(<0.01)
a. extremely significant difference compared with the control group (<0.01); b. significant difference compared with the former point (<0.05); c. extremely significant difference compared with the former point (<0.01)
3 讨论
3.1 诸氏鲻虾虎鱼Vg基因结构分析
卵黄蛋白原基因大都起源于一个共同的祖先基因, 不同氨基酸功能区域进化速度存在较大差异, 既含进化较快的富含丝氨酸区域, 也有进化速度极慢的高保守结构区域[15]。在种间进行系统进化分析时能表现出很高的分辨率, 因此可以用于进化关系较近的物种间的系统进化研究[16]。本实验从雌性诸氏鲻虾虎鱼肝组织中克隆得到5 067 bp的Vg基因全长cDNA序列, 该序列ORF编码的氨基酸序列与GenBank中登陆的15种鱼类Vg的ORF比对, 与同属于虾虎鱼科的黄鳍刺虾虎鱼、矛尾刺虾虎鱼同源性最高为73%, 与其他13种鱼类同源性为59%~ 43%。以扩增得到的诸氏鲻虾虎鱼Vg氨基酸序列与15种鱼类Vg氨基酸序列构建进化树, 进行系统进化分析, 诸氏鲻虾虎鱼与同为虾虎鱼科的黄鳍刺虾虎鱼、矛尾刺虾虎鱼聚为一支, 其亲缘关系较近, 上述结果表明, 本实验成功克隆了诸氏鲻虾虎鱼Vg全长cDNA序列。
Vg基因是由多个基因编码的相关蛋白组成的一个多基因家族, 鱼类也被证实存在多种形式的Vg[15, 17]。由于 Vg 结构和功能的多样性, 目前Vg没有统一的命名和分类规则, Hiramatsu等[18]根据Vg 结构氨基端脂磷蛋白重链(LvH)-高磷蛋白-脂磷蛋白轻链(LvL)-β组分-羧基端编码序列 (β-c)的区别, 将Vg分为 VgA、VgB和VgC 3类。在不同种类的鱼类中, Vg 分子结构同样具有多样性, 根据卵细胞中降解程度的差异可分为VgA 和 VgB, 但都具有完整的PV结构, VgC结构中则缺乏 PV结构或PV结构较短, 分子量也较小[19]。本研究所得的诸氏鲻虾虎鱼Vg序列编码1663个氨基酸, 明显多于剑尾鱼VgC(1250 aa)、小长臀虾虎鱼VgC(1238aa)编码的氨基酸序列, 且该序列ORF编码的氨基酸序列在GenBank中比对结果显示, 与其编码的氨基酸序列相似性最高的前10种鱼类, 除黄鳍刺虾虎鱼、矛尾刺虾虎鱼Vg没有明确分类外, 其余鱼类均为VgA, 因此所得序列可能为诸氏鲻虾虎鱼VgA。
3.2 诸氏鲻虾虎鱼Vg mRNA表达的组织分布
卵黄蛋白原有内源性卵黄蛋白原合成和外源性卵黄蛋白原合成两种合成方式, 在卵生脊椎动物中, Vg在肝脏内合成, 通过血液循环运输至卵巢, 最后储存在卵母细胞中为胚胎发育提供能量[20-21]。目前多数研究认为肝脏是鱼类卵黄蛋白原合成组织, 鱼类主要进行外源性的卵黄蛋白原合成。Yan等[22]发现斑马鱼和青鳉Vg A基因只在雌鱼肝脏中表达, 在肌肉、肠、卵巢中均无发现。刘春等[13]研究表明, 肝是剑尾鱼Vg C主要合成场所, 表达量最高, 脾、肾、卵巢有微量表达, 脑、肌肉、鳃几乎无表达。本研究用荧光定量PCR方法对诸氏鲻虾虎鱼雌鱼7个组织器官进行了Vg mRNA表达量的检测, 结果显示Vg mRNA在肝脏中表达量最高, 脾、肠中有极微量表达(<1%), 鳃、脑、肌肉、卵巢中几乎没有检测到表达, 表明肝脏是诸氏鲻虾虎鱼Vg合成的主要场所。
3.3 雌二醇诱导后的雄性诸氏鲻虾虎鱼Vg mRNA表达规律
Vg是包括鱼类在内的雌性动物特有的一种蛋白,但在雌激素诱导下雄鱼也能产生该蛋白[23], 鱼类体内Vg这种特性, 使其成为检测外源雌激素和内分泌干扰物的最为普遍的方法之一[24], 多种鱼类开展了水环境雌激素效应相关的研究。刘春等[13]研究发现, 100mg/L的17b-雌二醇(E2)诱导雄性剑尾鱼后, 肝脏Vg mRNA相对表达量在诱导后第1天达到小高峰, 第5天达到高峰, 第9天后维持相对低的表达量。Yan等[22]研究表明, 1mg/L E2诱导后的斑马鱼Vg A mRNA在第2天达到小高峰, 在30 d达到高峰, 0.1mg/L E2诱导后的青鳉Vg A mRNA在第3天和12天达到高峰。黄晔等[6]用250 ng/L E2诱导雄性斑马鱼, 第4天肝脏Vg mRNA才检测到表达。剑尾鱼、斑马鱼、青鳉Vg mRNA表达规律不一致, 除物种不同外, 还可能为E2诱导浓度不同所致。本研究中诸氏鲻虾虎鱼Vg mRNA表达规律与剑尾鱼研究结果相似, 但诸氏鲻虾虎鱼肝脏Vg mRNA表达高峰维持时间更长, 这可能与鱼的种类有关。本实验结果证明, 雌二醇能显著诱导雄性诸氏鲻虾虎鱼Vg的表达, 诸氏鲻虾虎鱼体内Vg作为生物标志物用于近海环境雌激素类物质的检测具有良好的应用前景。
参考文献:
[1] Utarabhand P, Bunlipatanon P. Plasma vitellogenin of grouper(): Isolation and properties[J]. Comparative Biochemistry and Physiology. Part C: Comparative Pharmacology and Toxicology, 1996, 115 (2): 101-110.
[2] 汝少国, 潘宗保, 田华. 鱼类卵黄蛋白的研究进展[J].海洋湖沼通报, 2012, 2: 22-32. Ru Shaoguo, Pan Zongbao, Tian Hua. Review on recent progress about teleost vitellogenins[J]. Transactions of Oceanology and Limnology, 2012, 2: 22-32.
[3] Kime D E, Nash J P, Scott A P. Vitellogencsis as a biomarker of reproductive disruption by xenobiotics[J]. Aquaculture, 1999, 177(1-4): 345-352.
[4] Mills L J, Chichester C. Review of evidence: Are endocrine disrupting chemicals in the aquatic environment impacting fish populations[J]. Sci Total Environ, 2005.343(1-3): 1-34.
[5] 宋文婷, 王志军, 朱智. 基于体内生物测试方法的污水处理过程中环境雌激素去除评价[J]. 安全与环境学报, 2013, 13(1): 23-26. Song Wenting, Wang Zhijun, Zhu Zhi. Evaluation of the environmental estrogens removal from the sewage treatment via an in vivo bioassay [J]. Journal of Safety and Environment, 2013, 13(1): 23-26.
[6] 黄晔, 任华, 孙竹筠, 等. 壬基酚和双酚A对雄性斑马鱼()卵黄蛋白原 mRNA的诱导效应[J]. 生态毒理学报, 2008, 3(3): 274-279. Huang Ye, Ren Hua, Sun Zhuyun, et al. Vitellogenin mRNA expression in male Zebrafish () induced by nonylphenol and bisphenol-A[J]. Asian Journal of Ecotoxicology, 2008, 3(3): 274-279.
[7] 温茹淑, 方展强, 江世贵, 等. 17β-雌二醇对剑尾鱼卵黄蛋白原的诱导研究[J]. 中国实验动物学报, 2007, 15(4): 280-285. Wen Rushu, Fang Zhanqiang, Jiang Shigui et al. Induction of vitellogenin by17-estradiol in swordtail fish ()[J]. Acta Laboratorium Animalis Scientia Sinica, 2007, 15(4): 280-285.
[8] 温茹淑, 方展强, 陈伟庭. 17β-雌二醇对雄性唐鱼卵黄蛋白原的诱导及性腺发育的影响[J]. 动物学研究, 2008, 29(1): 43- 48. Wen Rushu, Fang Zhanqiang, Chen Weiting. Effects of 17β-estradiol on vitellogenin inducement and gonad development in male[J]. Zoological Research, 2008, 29(1): 43- 48.
[9] Kordes C, Rieber E P, Gutzeit H O. An in vitro vitellogenin bioassay for oestrogenic substances in the medaka ()[J]. Aquatic Toxicology, 2002, 58(3-4): 151-164.
[10] 李建军, 杨笑波, 魏社林, 等. 裸项栉虾虎鱼的全人工繁殖及其胚胎发育[J]. 中国实验动物学报, 2008, 16(2): 111-116. Li Jianjun, Yang Xiaobo, Wei Shelin, et al. Complete artificial propagation and embryonic development of[J]. Acta Laboratorium Animalis Scientia Sinica, 2008, 16(2): 111-116.
[11] 李建军, 吴美慧, 叶惠欣, 等. 不同发育期诸氏鲻虾虎鱼对钻井液的敏感性比较[J].中国比较医学杂志, 2013, 4(23): 48-51. Li Jianjun, Wu Meihui, Ye Huixin, et al. Comparison of the sensitivity ofat different developmental stages to drilling fluid[J]. Chinese Journal of Comparative Medicine, 2013, 4(23): 48-51.
[12] 李建军, 林忠婷, 陈小曲, 等. 四种重金属离子对诸氏鲻虾虎鱼的单一和联合毒性[J]. 海洋环境科学, 2014, 33(2): 236-241. Li Jianjun, Lin Zhongting, Chen Xiaoqu, et al. Single and joint toxicity of four heavy metal ions on[J]. Marine Environmental Science, 2014, 33(2): 236-241.
[13] 刘春, 李凯彬, 王芳, 等. 剑尾鱼卵黄蛋白原 C(Vg C)全长cDNA的克隆及表达[J]. 水产学报, 2011, 35(10): 1441-1449. Liu Chun, Li Kaibin, Wang Fang, et al. , The full length cDNA cloning and expression profile of vitellogenin C(Vg C) gene from swordtail fish[J]. Journal of Fisheries of China, 2011, 35(10): 1441-1449.
[14] 宋光年, 金松君, 张继泉, 等. 中国明对虾caspase基因的克隆与表达分析[J]. 海洋科学, 2010, 34(12): 1-7. Song Guangnian, Jin Songjun, Zhang Jiquan, et al. Cloning and expression of a caspase gene in Chinese shrimp[J]. Marin Sciences, 2010, 34(12): 1-7.
[15] 刘春, 李凯彬, 耿冬雨, 等. 剑尾鱼2种卵黄蛋白原全长cDNA的克隆及序列分析[J]. 中国水产科学, 2010, 17(1): 31-43. Liu Chun, Li Kaibin, Geng Dongyu, et al. Cloning and characterization of vitellogenin gene from swordtail fish[J]. Journal of Fishery Sciences of China, 2010, 17(1): 31-43.
[16] Hayward A, Takahashi T, Bendena W G, et al. Comparative genomic and phylogenetic analysis of vitellogenin and other large lipid transfer proteins in metazoans[J]. Febs Letters, 2010, 584(6): 1273-1278.
[17] Miracle A, Ankley G, Lattier D. Expression of two vitellogenin genes(vg1 and vg3) in fathead minnow() liver in response to exposure to steroidal estrogens and androgens[J]. Ecotoxicol Environ Saf, 2006, 63(3): 337-342.
[18] Hiramatsu N, Cheek A O, Sullivan C V, et al. Vitellogenesis and endocrine disruption[J]. Biochemistry and Molecular Biology of Fishes, 2005, 6: 431-471.
[19] Hiramatsu N, Matsubara T, Fujita T, et al. Multiple piscine vitellogenins: biomarkers of fish exposure to estrogenic endocrine disruptors in aquatic environments[J]. Marine Biology, 2006, 149(1): 35-47.
[20] 翟丽丽, 张育辉. 基于环境雌激素评估的卵黄蛋白原研究进展[J]. 生态毒理学报, 2009, 4(3): 332-337. Zhai Lili, Zhang Yuhui. Review on vitellogenin based on estimating environmental estrogen[J]. Asian Journal of Ecotoxicology, 2009, 4(3): 332-337.
[21] Nath P, Sahu R, Kabita S, et al. Vitellogenesis with special emphasis on Indian fishes[J]. Fish Physiology and Biochemistry, 2007, 33(4): 359-366.
[22] Yan T, Tao S, Yew K P, et al. Molecular cloning of zebrafish and medakavitellogenin genes and comparison of their expression in response to 17h-estradiol[J]. Gene, 2004, 328: 25-36.
[23] 宋双双, 安立会, 郑丙辉, 等. 浑河流域野生鲫鱼卵黄蛋白原基因表达[J]. 生态毒理学报, 2013, 8(1): 121-129. Song Shuangshuang, An Lihui, Zheng Binghui, et al. Vitellogenin mRNA expression in wild Crucian carp () from Hun River[J]. Asian Journal of Ecotoxicology, 2013, 8(1): 121-129.
[24] 马陶武, 王子健. 环境内分泌干扰物筛选和测试研究中的鱼类实验动物[J]. 环境科学学报, 2005, 25(2): 135-140. Ma Taowu, Wang Zijian. Fish exprimentalmodel in the screening and testing for the environmental endocrine disruptors[J]. Acta Scientiae Circumstantiae, 2005, 25(2): 135-140.
(本文编辑: 谭雪静)
Full-length cDNA cloning and expression analysis of vitellogenin gene in
YU Lu-jun, CAI Lei, LI Ge, CHEN Xiao-qu, CHEN Lin, LI Jian-jun
(Guangdong Laboratory Animals Monitoring Institute, Key Laboratory of Guangdong Laboratory Animals, Guangzhou 510663, China)
To explore the tissue distribution of the vitellogenin (Vg) gene inand the effect of the pollutant 17β-estradiol on male, the full length of vitellogenin (Vg) cDNA inwas cloned by reverse transcription polymerase chain reaction (RT-PCR) and rapid amplification of cDNA ends (RACE) techniques using total RNA extracted from the liver of female fish. Meanwhile, the expression of Vg mRNA ofwas determined by real-time fluorescent quantitative PCR. The full length of’s Vg cDNA sequence contains 5 067 bp nucleotides, with a complete open reading frame (ORF) of 4 992 bp, which encodes 1 664 amino acid proteins with a deduced protein molecular weight of 186.2 ku. The ORF contains signal peptides and a polyserine domain. The real-time RT-PCR result showed that’s Vg mRNA was primarily detected in the liver. Furthermore, Vg mRNA expression levels at different time points of E2 treatment of male fish were determined.’s Vg mRNA expression levels reached the peak on the third day and then the expression levels declined on the seventh day. These results indicated that the full length of Vg cDNA inwas cloned successfully. This study suggests that Vg in malecan be considered as a valid biomarker for offshore environmental monitoring of estrogenic substances.
; vitellogenin; full-length cDNA; quantitative real-time RT-PCR; 17β-estradiol
Feb. 1, 2015
X171; S917
A
1000-3096(2016)09-0023-09
10.11759//hykx 20150201004
2015-02-01;
2015-04-27
国家科技支撑计划项目(2013BAK11B902); 广东省科技计划项目(2011B010500021, 2012B040302006)
余露军(1982年-), 男, 湖南岳阳人, 工程师, 硕士, 主要从事水生实验动物及其病害方面的研究, 电话: 020-84106815, E-mail: ljyu1212@163.com; 李建军, 通信作者, E-mail: lijianjun1125@126.com
[Foundation: National Key Technology Support Program (2013BAK11B902);Science and Technology Program of Guangdong Province (2011B010500021, 2012B040302006)]

