VEGF、flk-1、bax、 bcl-2在不同类型DR大鼠模型视网膜组织中表达变化的观察
董白霞,包永琴,王振东,王家瑶
(河北医科大学第二医院眼科,河北 石家庄 050000)
·论 著·
VEGF、flk-1、bax、 bcl-2在不同类型DR大鼠模型视网膜组织中表达变化的观察
董白霞,包永琴,王振东,王家瑶
(河北医科大学第二医院眼科,河北 石家庄 050000)
目的观察联合注药法建立的增殖型糖尿病性视网膜病变(proliferative diabetic retinopathy,PDR)大鼠模型视网膜组织中血管内皮生长因子(vascular endothelial growth factor,VEGF)、flk-1、bax、bcl-2的表达变化,确定联合注药法所造大鼠PDR模型的价值。方法Sprague-Dawley大鼠分别采用链脲佐菌素(streptozotocin,STZ)腹腔注射(单纯注药组)和STZ腹腔注射联合VEGF玻璃体注射(联合注药组)制造糖尿病性视网膜病变(diabetic retinopathy,DR)模型,应用免疫组织化学法测定不同时间点各模型组视网膜组织中VEGF、flk-1、bax、bcl-2的表达,应用MIAS1998型图像分析系统测定VEGF、flk-1、bax、bcl-2在视网膜神经节细胞层和内网层的平均光密度值。结果单纯注药组、联合注药组VEGF、flk-1、bax、bcl-2在视网膜除视杆视锥层之外各层均有表达, 前三者在节细胞层和神经纤维层表达最强; bcl-2视杆视锥层内节最强; VEGF表达次强为Müller细胞;bcl-2表达次强为节细胞层和神经纤维层。但所有指标联合注药组表达强度大于单纯注药组。bcl-2单纯注药组8周时间点比2周时间点在节细胞层和神经纤维层表达增强;单纯注药组8周时间点在内网层的表达最强。联合注药组2周时间点节细胞层和神经纤维层表达最强。结论联合注药法建立的DR大鼠模型较单纯注药组更能够代表人类PDR的病理改变,具有一定的科研价值。
糖尿病视网膜病变;血管内皮生长因子类;大鼠
前期研究对链脲佐菌素(Streptozotocin, STZ)腹腔注射诱发的SD(Sprague-Dawley)大鼠糖尿病性视网膜病变(diabetic retinopathy,DR)模型(单纯注药组)和STZ腹腔注射联合血管内皮生长因子(vascular endothelial growth factor,VEGF)玻璃体注射建立的增殖型糖尿病性视网膜病变(proliferative diabetic retinopathy,PDR)模型(联合注药组)荧光素眼底血管造影(fluorescence fundus angiography,FFA)、碳素颗粒在视网膜微血管系统的渗漏情况、CD105免疫组织化学标记增殖的血管内皮细胞、电镜下视网膜组织超微结构损害程度等方面进行了系列观察和比较,发现单纯注药组仅能模拟人类背景期DR的病理损害;而联合注药组则能够代表人类PDR,探索了一种全新的PDR动物模型[1]。为进一步确定此模型在蛋白质和分子水平的变化是否能反映DR的病理过程,拟研究VEGF、flk-1在上述2种模型大鼠视网膜组织中的表达。糖尿病时视网膜神经细胞以凋亡的形式死亡,故采用免疫组织化学法研究凋亡相关基因bax和bcl-2在不同DR大鼠模型视网膜中的表达,以确定联合注药组模型有无科研价值。现报告如下。
1 材料与方法
1.1 实验动物与主要试剂 8周龄健康SD大鼠,雌雄各半,体质量180~250 g。购自河北省实验动物中心。VEGF蛋白购自美国Sigma公司;VEGF、flk-1、bax、bcl-2一抗购自博士德公司;PV-6001/6002免疫组织化学试剂盒购自北京中杉公司。
1.2 方法 STZ(60 mg/kg)腹腔注射制造DR大鼠模型24只。 1个月后 VEGF 0.05 μg/2 μL双眼玻璃体注射12只(联合注药组),等量生理盐水双眼玻璃体注射12只(单纯注药组)。按析因设计的实验研究方法,分为造模方法(单纯注药法、联合注药法)和病程(玻璃体注射VEGF后2周、4周、8周)2个因素。将各个因素的各个水平间排列组合,交叉分组,共6种组合,每种组合选4只动物。每组每个时间点分别处死4只动物,取材双眼球标本,做视网膜组织切片,行VEGF、flk-1、bax、bcl-2免疫组织化学染色检查。
1.3 计算机图像分析 每只鼠每只眼球随机选取视网膜切片2张,每张随机选5个视野,应用MIAS1998型图像分析系统(河北医科大学第三医院实验中心)测定VEGF、flk-1、bax、bcl-2在节细胞层、内网层的平均光密度值,所测数据应用析因设计的单因素方差分析对造模方法和病程对上述4种指标表达的影响进行研究,明确造模方法和病程对其表达影响的作用大小。

2 结 果
2.1VEGF在各组的表达情况
2.1.1 光学显微镜观察 单纯注药组、联合注药组VEGF在视网膜除视杆视锥层之外各层均有表达, 节细胞层和神经纤维层表达最强; 其次为Müller细胞(图1,2)。但联合注药组强度大于单纯注药组。
2.1.2VEGF在节细胞层和内网层表达强弱程度与造模方法、不同病程的关系分析 不同造模方法和病程对VEGF在节细胞层及内网层表达的影响差异均有统计学意义,且两者之间有交互作用。造模方法对VEGF表达影响的作用远大于病程的影响,联合注药法与单纯注药法相比,在2周病程对VEGF在内网层表达的影响差异有统计学意义(P<0.05);在4周、8周病程对VEGF在节细胞层和内网层表达的影响差异均有统计学意义(P<0.05)。2周与4周相比,VEGF在内网层表达差异有统计学意义(P<0.05)。其余差异均无统计学意义(P>0.05)。见表1,2。
表1VEGF在各组神经节细胞层表达的光密度值


造模方法造模后不同时间点2周4周8周单纯注药组 0.29±0.060.25±0.030.33±0.04联合注药组 0.33±0.050.39±0.040.38±0.02A因素(方法)F=40.890 P=0.000B因素(病程)F=4.400 P=0.019交互作用 F=7.460 P=0.002
表2 VEGF在各组内网层表达的光密度值


造模方法造模后不同时间点2周4周8周单纯注药组 0.19±0.020.14±0.020.17±0.02联合注药组 0.29±0.020.28±0.020.22±0.03A因素(方法)F=262.020 P=0.000B因素(病程)F=18.610 P=0.000交互作用 F=17.410 P=0.000
2.2 flk-1在各层的表达 情况
2.2.1 普通光学显微镜观察 flk-1在2个模型组视网膜除视杆视锥层外节以外各层均表达, 节细胞层和神经纤维层表达最强(图3,4)。但联合注药组强度大于单纯注药组。
2.2.2 flk-1在节细胞层和内网层表达强弱程度与造模方法、不同病程的关系分析 造模方法对flk-1在神经节细胞层和内网层表达的影响差异有统计学意义(P<0.05), 病程对flk-1在神经节细胞层和内网层表达的影响差异无统计学意义(P>0.05),但两者之间有交互作用。造模方法对flk-1在节细胞层表达的影响远大于病程的影响,在2周、8周病程不同造模方法对flk-1在节细胞层表达的影响差异有统计学意义(P<0.05),在4周病程对flk-1在节细胞层表达的影响差异无统计学意义(P>0.05)。见表3,4。
表3 flk-1在各组神经节细胞层表达的光密度值


造模方法造模后不同时间点2周4周8周单纯注药组 0.28±0.040.35±0.030.24±0.04联合注药组 0.43±0.060.35±0.040.44±0.05A因素(方法)F=87.890 P=0.000B因素(病程)F=0.670 P=0.518交互作用 F=22.130 P=0.000
表4 flk-1在各组内网层表达的光密度值

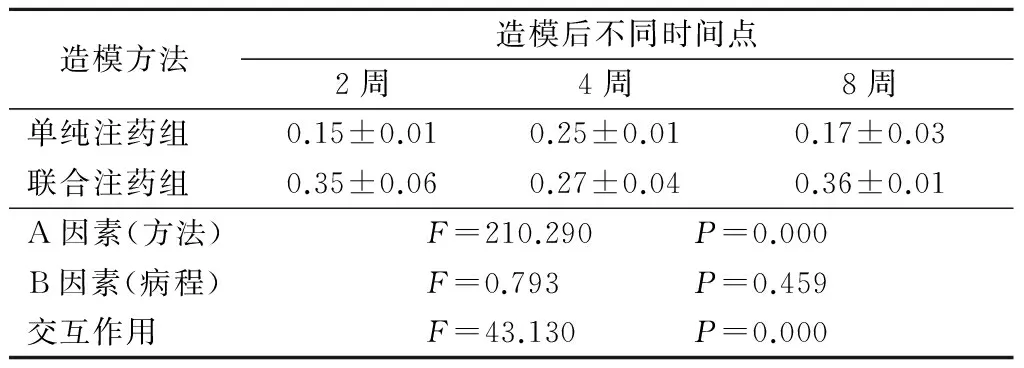
造模方法造模后不同时间点2周4周8周单纯注药组 0.15±0.010.25±0.010.17±0.03联合注药组 0.35±0.060.27±0.040.36±0.01A因素(方法)F=210.290 P=0.000B因素(病程)F=0.793 P=0.459交互作用 F=43.130 P=0.000
2.3 bax在各组的表达情况
2.3.1 普通光学显微镜观察 bax在2个模型组视网膜除视杆视锥层外节以外各层均表达, 节细胞层和神经纤维层表达最强(图5,6)。但联合注药组强度大于单纯注药组。
2.3.2 bax在节细胞层和内网层表达强弱程度与造模方法、不同病程的关系分析 造模方法和病程对bax在神经节细胞层及内网层表达的影响差异有统计学意义(P<0.05),且两者之间有交互作用。造模方法对bax表达影响的作用远大于病程的影响,不同造模方法相比,在2周、4周、8周病程对bax的表达的影响差异均有统计学意义(P<0.05)。2周与4周、4周与8周相比, bax的表达差异均有统计学意义(P<0.05)。VEGF玻璃体腔注射后4周内对bax表达影响的作用大于造模方法的影响,不同造模方法相比,在2周、4周、8周病程对bax的表达的影响差异均有统计学意义(P<0.05)。2周与4周相比, bax的表达差异有统计学意义(P<0.05)。见表5,6。
2.4 bcl-2在各层的表达
2.4.1 普通光学显微镜观察 bcl-2在两模型组视网膜除视杆视锥层外节以外各层均表达, 视杆视锥层内节最强, 节细胞层和神经纤维层次之(图7)。单纯注药组8周时间点比2周时间点在节细胞层和神经纤维层表达增强;单纯注药组8周时间点在内网层的表达最强。联合注药组2周时间点节细胞层和神经纤维层表达最强(图8)。
2.4.2 bcl-2在节细胞层和内网层表达强弱程度与造模方法、不同病程的关系分析 各组间 bcl-2在节细胞层及内网层表达的光密度值差异有统计学意义(P<0.05)。bcl-2在糖尿病病程2周与8周、2周与4周、4周与8周差异均有统计学意义(P<0.05)。见表7,8。
表5 bax在各组神经节细胞层表达的光密度值


造模方法造模后不同时间点2周4周8周单纯注药组 0.27±0.010.34±0.030.44±0.02联合注药组 0.42±0.010.42±0.030.47±0.03A因素(方法)F=124.390 P=0.000B因素(病程)F=82.370 P=0.000交互作用 F=24.310 P=0.000
表6 bax在各组内网层层表达的光密度值


造模方法造模后不同时间点2周4周8周单纯注药组 0.20±0.030.31±0.020.28±0.02联合注药组 0.27±0.010.28±0.010.34±0.01A因素(方法)F=31.320 P=0.000B因素(病程)F=65.000 P=0.000交互作用 F=25.480 P=0.000
表7 bcl-2在各组神经节细胞层表达的光密度值


造模方法造模后不同时间点2周4周8周单纯注药组 0.22±0.020.26±0.020.35±0.02联合注药组 0.50±0.070.22±0.010.29±0.05A因素(方法)F=30.393 P=0.000B因素(病程)F=41.105 P=0.000交互作用 F=98.348 P=0.000
表8 bcl-2在各组内网层表达的光密度值


造模方法造模后不同时间点2周4周8周单纯注药组 0.14±0.010.21±0.010.40±0.03联合注药组 0.47±0.080.24±0.010.28±0.05A因素(方法)F=41.933 P=0.000B因素(病程)F=35.029 P=0.000交互作用 F=125.605 P=0.000
3 讨 论
3.1 VEGF和flk-1表达的变化 VEGF是DR中造成微血管病变的重要因子,在DR的发生发展过程中起至关重要的作用。前期研究表明,糖尿病时VEGF在视网膜的表达随病程进展逐渐增加,其特异性酪氨酸激酶受体——flk-1的表达也随病程进展逐渐增强[2-3]。
为了进一步明确前期所建立的PDR动物模型(联合注药组)在细胞因子及蛋白质水平表达的变化,本研究观察了该模型大鼠的视网膜组织VEGF和flk-1表达的变化,并应用相互对照、析因设计的实验方法,与目前广泛采用的STZ诱发的糖尿病大鼠模型(单纯注药组)的表达结果进行了比较。结果显示:联合注药法较单纯注药法对于VEGF和flk-1在视网膜节细胞层的表达强度有影响;在注射VEGF后4、8周联合注药组与单纯注药组大鼠视网膜节细胞层VEGF的表达光密度值的差异有统计学意义(P<0.05),在VEGF注射后4、8周,联合注药组较单纯注药组VEGF表达增强;在注射VEGF后2、8周2组大鼠视网膜节细胞层flk-1表达的光密度值的差异有统计学意义(P<0.05),在注射VEGF后2、8周,联合注药组较单纯注药组flk-1表达增强;联合注药组大鼠视网膜VEGF表达增强出现在VEGF注射后第4、8周,而flk-1增强则出现在VEGF注射后第2、8周。分析原因可能是:联合注药组玻璃体注射外源性VEGF后抑制了视网膜自身内源性VEGF的分泌,而外源性VEGF因不液化的玻璃体的因素,经视网膜完全吸收需要一定的时间。造模方法和病程对内网层VEGF表达的影响差异均有统计学意义(P<0.05),且两者之间有交互作用。造模方法对VEGF表达影响的作用远大于病程的影响,在注射VEGF后2、4、8周时,联合注药组与单纯注药组大鼠相比,VEGF表达的光密度值增加差异有统计学意义; 随病程进展,在注射VEGF后4周VEGF表达的光密度值降低,差异有统计学意义。出现上述结果的原因是:内网层位于节细胞层的内层,2周时外源性VEGF尚未经视网膜充分吸收,对内网层内源性VEGF的表达还没有造成一定的影响,而在4周时节细胞层VEGF表达增强,内网层表达受抑制,因此出现了4周时内网层VEGF表达减弱的现象。在注射VEGF后2、8周时,联合注药组大鼠视网膜内网层flk-1表达的光密度值均高于相同病程的单纯注药组大鼠。表明联合注药组与单纯注药组相比,视网膜节细胞层和内网层VEGF的表达增加,注射VEGF后4周时内网层VEGF的表达较2周时减少,这与外源性药物在相邻组织吸收后对内源性分泌的抑制有关。伴随着VEGF在注射后4周表达的减少,其特异性flk-1受体的表达也无增加的趋势,直到8周时才增高,二者变化趋势是一致的。
3.2 促凋亡基因bax和抑凋亡基因bcl-2表达的变化 bcl-2基因抑制细胞凋亡的发生[4],对视网膜细胞有保护作用和抑制凋亡的作用[5-6]。bax是bcl-2的同种性蛋白,在细胞凋亡中所起的作用却相反,二者之间的比例决定了细胞的命运是生存还是凋亡[7-8]。bax在糖尿病大鼠[9-10]和人[11]视网膜的表达增加。而bcl-2的改变,存在一些争议:Drel等[12]发现,STZ诱导的大鼠视网膜血管周细胞表达bcl-2降低;糖尿病患者的视网膜Muller细胞表达bcl-2降低[13-14]; Shin等[15]发现糖尿病患者神经视网膜表达bcl-2增加;Cai等[16]则发现视网膜血管内皮细胞表达bcl-2先增加后降低。
不同造模方法和病程对神经节细胞层和内网层bax表达的影响差异均有统计学意义,且两者之间有交互作用。造模方法对节细胞层bax表达影响的作用远大于病程的影响:在注射VEGF后2、4、8周时,联合注药组与单纯注药组大鼠视网膜节细胞层bax表达的光密度值差异有统计学意义。联合注药组表达强于单纯注药组。随病程进展,糖尿病大鼠视网膜节细胞层bax表达的光密度值不断增高,一直持续至注射VEGF后8周。而在内网层则不然,注射VEGF后4周内时间对bax表达影响的作用大于造模方法的影响。注射VEGF后2、4、8周时,2组内网层bax表达的光密度值的差异均有统计学意义。注射VEGF后2、8周时,联合注药组较单纯注药组bax表达增高;注射VEGF后4周时联合注药组较单纯注药组bax表达降低。这表明VEGF影响了bax的表达。注射VEGF后4周内,bax的表达随病程进展增强,这种增强主要与病程有关,而非联合注药的作用。
各组间 bcl-2在节细胞层和内网层表达的光密度值差异均有统计学意义。bcl-2在糖尿病病程2周与8周、2周与4周、4周与8周的差异均有统计学意义(P<0.05)。上述结果表明,注射VEGF后8周内,随病程进展,2个模型组大鼠节细胞层和内网层bcl-2的表达渐增强; 联合注药组在4周时其表达较2周时有所减弱,说明外源性VEGF的注入在短期内可使视网膜组织内保护性因子bcl-2的表达增加;随DR病程进展,糖尿病大鼠视网膜内层bcl-2的表达增加,外源性VEGF则在短期内使得bcl-2的表达增加。
综上所述,DR时视网膜神经细胞有保护作用的bcl-2基因蛋白在视网膜内层的表达增加,这可能是机体对视网膜细胞损伤的一种代偿性保护机制。(本文图见封三)
[1] Rajashekhar G,Ramadan A,Abburi C,et al. Regenerative therapeutic potential of adipose stromal cells in early stage diabetic retinopathy[J]. PLoS One,2014,9(1):e84671.
[2] 董白霞,高福禄,庞晓静.糖尿病小鼠血管内皮生长因子表达与血糖、病程的关系[J].中华眼底病杂志,2000,16(3):182-183.
[3] 董白霞,高福禄,张爱子,等.血管内皮生长因子及其受体在糖尿病小鼠视网膜的表达[J].解剖学杂志,2001,24(5):421-424.
[4] Yoo SH,Yoon YG,Lee JS,et al. Etoposide induces a mixed type of programmed cell death and overcomes the resistance conferred by Bcl-2 in Hep3B hepatoma cells[J]. Int J Oncol,2012,41(4):1443-1454.
[5] Fröhlich M,Jaeger A,Weiss DG,et al. Inhibition of BCL-2 leads to increased apoptosis and delayed neuronal differentiation in human ReNcell VM cells in vitro[J]. Int J Dev Neurosci,2016,48(2):9-17.
[6] Martínez-Moreno CG,vila-Mendoza J,Wu Y,et al. Neuroprotection by GH against excitotoxic-induced cell death in retinal ganglion cells[J]. Gen Comp Endocrinol,2016,234:68-80.
[7] Meichner K,Fogle JE,English L,et al. Expression of Apoptosis-regulating Proteins Bcl-2 and Bax in Lymph Node Aspirates from Dogs with Lymphoma[J]. J Vet Intern Med,2016,30(3):819-826.
[8] Banerjee M,Chattopadhyay S,Choudhuri T,et al. Cytotoxicity and cell cycle arrest induced by andrographolide lead to programmed cell death of MDA-MB-231 breast cancer cell line[J]. J Biomed Sci,2016,23:40.
[9] Yang J,Wang T,Zhang Y,et al. Altered expression of mitofusin 2 in penile tissues of diabetic rats[J]. Andrologia,2014,46(5):522-528.
[10] Zeng K,Wang Y,Yang N,et al. Resveratrol Inhibits Diabetic-Induced Müller Cells Apoptosis through MicroRNA-29b/Specificity Protein 1 Pathway[J]. Mol Neurobiol,2016[Epub ahead of print].
[11] Hao M,Li Y,Lin W,et al. Estrogen prevents high-glucose-induced damage of retinal ganglion cells via mitochondrial pathway[J]. Graefes Arch Clin Exp Ophthalmol,2015,253(1):83-90.
[12] Drel VR,Pacher P,Ali TK,et al. Aldose reductase inhibitor fidarestat counteracts diabetes-associated cataract formation,retinal oxidative-nitrosative stress,glial activation,and apoptosis[J]. Int J Mol Med,2008,21(6):667-676.
[13] Wu M,Yang S,Elliott MH,et al. Oxidative and Endoplasmic Reticulum Stresses Mediate Apoptosis Induced by Modified LDL in Human Retinal Müller Cells[J]. Invest Ophthalmol Vis Sci,2012,53(8):4595-4604.
[14] Han N,Yu L,Song Z,et al. Agmatine protects Müller cells from high-concentration glucose-induced cell damage via N-methyl-D-aspartic acid receptor inhibition[J]. Mol Med Rep,2015,12(1):1098-1106.
[15] Shin ES,Huang Q,Gurel Z,et al. STAT1-mediated Bim expression promotes the apoptosis of retinal pericytes under high glucose conditions[J]. Cell Death Dis,2014,5(1):e986.
[16] Cai J,Ahmad S,Jiang WG,et al. Activation of vascular endothelial growth factor receptor-1 sustains angiogenesis and bcl-2 expression via the phosphatidylinositol 3-kinase pathway in endothelial cells[J]. Diabetes,2003,52(12):2959-2968.
(本文编辑:赵丽洁)
Observation of the expression of VEGF, flk-1, bax and bcl-2 in the retina of different types of DR rat model
DONG Bai-xia, BAO Yong-qin, WANG Zhen-dong, WANG Jia-yao
(Department of Ophthalmology, the Second Hospital of Hebei Medical University, Shijiazhuang 050000, China)
Objective To observe the variation of vascular endothelial growth factor(VEGF), flk-1, bax, bcl-2 expression in PDR rat retina eatablished by symphysial injection and to definite its superiority. Methods Sprague-Dawley rats were made as diabetic retinopathy models by solitary injection with streptozotocin intraperitoneally or symphysial injection with streptozocin intraperitoneally and VEGF intravitreously respectively. Using factorial design empirical method,we observed the variation of VEGF, flk-1, bax, bcl-2 expression in retinas of diabetic rats established by different methods by immunohistochemistry and measured the average optical density value of VEGF, flk-1, bax, bcl-2 in retinal ganglion cell layer and inner plexiform layer by MIAS1998 type image analysis system. Results VEGF,flk-1, bax, bcl-2 were expressed in each layer of retina in both groups except the layer of rods and cones. The front three targets were expressed strongest in the ganglion and nerve fiber layer, while bcl-2 was expressed the strongest in inner segment of the rods and cones layer. The next strongest layer of VEGF expression was the Müller cells while the next strongest layer of bcl-2 expression was the ganglion and nerve fiber layer. All targets expression in symphysial injection groups were stronger than those in solitary injection groups. Bcl-2 expression in ganglion and nerve fiber layer at 8 weeks after VEGF injection was stronger than that at 2 weeks. The strongest bcl-2 expression was in inner plexiform layer at 8 weeks in solitary injection groups, while in symphysial injection groups it was in ganglion and nerve fiber layer at 2 weeks after VEGF injection. Conclusion PDR rat model established by symphysial injection can represent the pathological changes of human PDR and has its scientific research worth.
diabetic retinopathy; vascular endothelial growth factors; rats
2016-07-07;
2016-09-06
董白霞(1975-),女,河北河间人,河北医科大学第
R587.26
A
1007-3205(2016)11-1289-06
10.3969/j.issn.1007-3205.2016.11.013
二医院副主任医师,医学博士,从事眼外伤、眼底病诊治研究。

