果胶-壳聚糖多层修饰脂质体的制备及配方优化
白春清,郑景霞,袁 璐,崔丹丹,陈丽丽,袁美兰,赵 利,*
(1.江西科技师范大学生命科学学院国家大宗淡水鱼加工技术研发分中心,江西南昌 330013;2.南昌大学食品科学与技术国家重点实验室,江西南昌 330047)
果胶-壳聚糖多层修饰脂质体的制备及配方优化
白春清1,郑景霞2,袁 璐1,崔丹丹1,陈丽丽1,袁美兰1,赵 利1,*
(1.江西科技师范大学生命科学学院国家大宗淡水鱼加工技术研发分中心,江西南昌 330013;2.南昌大学食品科学与技术国家重点实验室,江西南昌 330047)
本研究利用壳聚糖、果胶对常规脂质体进行先后修饰构建果胶-壳聚糖多层修饰脂质体(pectin-chitosan coated liposomes,Pe-Ch-Liposomes),以番茄红素为模型药物,系统研究了主要因素对多层修饰脂质体包封率和浊度的影响,并以包封率为指标优化配方。结果表明果胶溶液与壳聚糖溶液的体积及浓度配比均对多层修饰脂质的包封率及浊度有一定的影响,且多层修饰过程可降低由卵磷脂与胆固醇质量比引起的包封率及浊度的差异。正交实验结合单因素分析确定最佳配方为果胶壳聚糖体积比为2∶1,果胶-壳聚糖总浓度为0.2%∶0.2%,卵磷脂与胆固醇质量比为5∶1,番茄红素添加量为2.5 mg。在此条件下制备的多层修饰脂质体的包封率(97.8%)显著高于常规脂质体的包封率(85.4%);粒度分布较为集中,平均粒径为1870.4 nm,多分散系数为0.231。
多层修饰脂质体,番茄红素,果胶,壳聚糖
番茄红素是植物中所含的一种天然色素,多存在于茄科植物西红柿的成熟果实中。它是目前在自然界的植物中被发现的最强抗氧化剂之一,其淬灭单线态氧速率常数是维生素E的100倍,可以有效防治因衰老,免疫力下降引起的各种疾病,如炎症、肿瘤等[1-2]。然而,番茄红素对外界环境极为敏感,易发生降解及异构化,丧失生理活性;水溶性差,直接口服,生物利用度低。因此,开发高效包埋系统是拓展番茄红素应用的关键。
常规脂质体是由磷脂等两亲性分子分散在水中形成的具有类似细胞膜脂质双分子层结构的封闭囊泡。因结构的特殊性可包埋亲水、亲油及两亲性成分。且粒径小、可控释释放、具有提高包埋物稳定性等特点,已被广泛应用于生物医药、化工、食品加工等领域[2-5]。但常规脂质体稳定性差,长期放置易出现聚集、分层、包埋物渗漏等问题[6]。研究表明采用水溶性聚合物对其进行表面修饰可提高其稳定性,目前已有聚乙二醇、壳聚糖等单一聚合物修饰脂质体的大量报道。但由于修饰过程中脂质体与修饰层间的结合力较弱,修饰层结构松散,这种简单修饰所形成的聚合物单层修饰脂质体的贮藏稳定性并不理想[7-9]。因此需要与其它材料复配,进行双层或多层包埋以提高其稳定性。壳聚糖、果胶分别作为天然聚阳、阴离子多糖,因具有良好的乳化性、凝胶性等特性,备受研究者关注,是缓释性载体的常用原料,多用于活性成分的包埋保护[10-15]。本研究拟以带负电荷的脂质体为核心,利用果胶分子中的羧基(-COO-)与壳聚糖分子中的氨基(-NH3+)间静电相互作用及复合作用,在常规脂质体表面进行双层修饰制备壳聚糖、果胶多层修饰构建核壳结构脂质体[10,16]。据文献[15-16]介绍包埋率、粒径分布是衡量载体体系的重要指标,也是影响产品贮藏稳定性的重要因素。而前期预实验发现包埋物的添加量、修饰材料的浓度及配比等因素不仅会影响修饰层的结构,进而影响其对包埋物的包埋效果及贮藏稳定性。
综上,本研究拟利用壳聚糖、果胶二者正、负电荷静电作用层层交替对采用乙醚注入法制备的常规脂质体进行先后修饰构建多层修饰脂质体。并以番茄红素为包埋物研究层层包埋过程对其包埋效果的影响,研究配方中主要因素的影响,优化配方,为多层修饰脂质体开发为功能性成分载体提供参考依据。
1 材料与方法
1.1 材料与仪器
卵磷脂、胆固醇 上海蓝季科技发展有限公司;壳聚糖、果胶、番茄红素 上海阿拉丁生化科技股份有限公司;磷酸氢二钠、磷酸二氢钠、醋酸、无水乙醚 国药集团化学试剂有限公司。以上试剂皆为分析纯。
DF-101S集热式磁力加热搅拌器 巩义市予华仪器有限责任公司;TGL-16G台式离心机 上海菲恰尔分析仪器有限公司;TU-1810紫外可见分光光度计 北京普析通用仪器有限责任公司;HYL-1080激光纳米粒度分析仪 丹东市皓宇科技有限公司;SKF-6超声波发生器 上海科导超声仪器有限公司。
1.2 实验方法
1.2.1 Pe-Ch-Liposomes的制备 首先采用乙醚注入法制备常规脂质体(Liposomes),即以磷脂、胆固醇为膜材(质量比3∶1,总量40 mg)与番茄红素完全溶于20 mL无水乙醚后,将其加入到40 mL pH7.0的磷酸缓冲液中,45 ℃下水合20 min(避光或用锡箔纸包裹)后,超声30 min后,加水定容至40 mL得常规脂质体。然后取10 mL常规脂质体慢慢注入到壳聚糖醋酸溶液中,得壳聚糖修饰脂质体(chitosan-Liposomes,Ch-Liposomes),再将其缓慢注入到果胶溶液中得总体积为40 mL的Pe-Ch-Liposomes。
1.2.2 Pe-Ch-Liposomes的配方优化 首先采用单因素实验分别考察果胶溶液与壳聚糖溶液体积比、果胶溶液与壳聚糖溶液浓度配比、卵磷脂与胆固醇质量比、番茄红素添加量对Pe-Ch-Liposomes包封率和浊度的影响,并在此基础上,选取影响较大的三个因素,以包封率为指标,采用正交实验优化配方,并测定最优配方下样品的包封率及粒径。
1.2.3 果胶溶液与壳聚糖溶液体积比对Pe-Ch-Liposomes包封率及浊度的影响 设定果胶溶液与壳聚糖溶液体积比分别为1∶2、1∶1、3∶2、2∶1、3∶1、4∶1,在果胶溶液浓度与壳聚糖溶液浓度配比为0.2%~0.1%,卵磷脂与胆固醇质量比为3∶1,番茄红素添加量为5 mg(每100 mL Pe-Ch-Liposomes)条件下制备Pe-Ch-Liposomes,分别测定样品的包封率及浊度。
1.2.4 果胶溶液与壳聚糖溶液浓度配比对Pe-Ch-Liposomes包封率及浊度的影响 设定果胶溶液浓度与壳聚糖溶液浓度配比分别为0.3%∶0.2%、0.3%∶0.1%、0.2%∶0.2%、0.2%∶0.1%、0.1%∶0.05%、0.05%∶0.05%、0.05%∶0.01%,在卵磷脂与胆固醇质量比为3∶1,番茄红素添加量为5 mg(每100 mL Pe-Ch-Liposomes)及1.2.3选定的果胶溶液与壳聚糖溶液体积比条件下制备Pe-Ch-Liposomes,分别测定样品的包封率及浊度。
1.2.5 卵磷脂与胆固醇质量比对Pe-Ch-Liposomes包封率及浊度的影响 设定卵磷脂与胆固醇质量比分别为:1∶1、3∶1、5∶1、7∶1、9∶1,在番茄红素添加量为5 mg(每100 mL Pe-Ch-Liposomes),1.2.3选定的果胶溶液与壳聚糖溶液体积比,1.2.4选定的果胶溶液浓度与壳聚糖溶液浓度配比条件下制备Pe-Ch-Liposomes,分别测定样品的包封率及浊度。
1.2.6 番茄红素添加量对Pe-Ch-Liposomes包封率及浊度的影响 设定每100 mL Pe-Ch-Liposomes中番茄红素的添加量分别为:0.5、1.0、1.5、2.5、5、7.5、10 mg,在1.2.3选定的果胶溶液与壳聚糖溶液体积比,1.2.4选定的果胶溶液浓度与壳聚糖溶液浓度配比,1.2.5选定的卵磷脂与胆固醇质量比条件下制备Pe-Ch-Liposomes,分别测定样品的包封率及浊度。
1.2.7 配方优化 根据单因素实验的结果,选取影响较大的三个因素(A卵磷脂与胆固醇质量比、B果胶溶液与壳聚糖溶液体积比、C果胶溶液与壳聚糖溶液浓度配比),以包封率为指标按照表1进行正交实验,优化配方,并测定最佳配方下样品的包封率及粒径分布。

表1 L9(33)工艺正交设计因素水平表Table 1 L9(33)orthogonal design factor level table
1.2.8 包封率的测定 准确移取2 mL番茄红素脂质体,加入 2 mL正己烷,在3000 r/min下离心40 s,移取上清液;再次加入2 mL正己烷,于3000 r/min下离心40 s。如此重复2次,合并上清液于10 mL容量瓶中,以正己烷定容,于471 nm下检测吸光度A0,对照标准曲线方程C=0.4375A0,计算游离番茄红素质量C[17-18]。然后根据以下公式,计算番茄红素脂质体的包封率,其中体系中番茄红素总量为样品中含有的番茄红素总量来计算:
包封率(%)=[1-(游离番茄红素/体系中番茄红素总量)]×100
1.2.9 浊度的测定 取适量脂质体于比色皿中,以蒸馏水为空白测定样品在500 nm处的吸光度,吸光度越大表示粒度越小。
1.2.10 粒径的测定 取适量脂质体于比色皿中,采用HYL-1080激光纳米粒度分析仪测定脂质体的粒径大小和粒度分布。
1.3 数据的统计处理
实验数据采用origin 8.0软件进行绘图,数值以3次实验的均值±标准偏差表示。
2 结果与讨论
2.1 果胶溶液与壳聚糖溶液体积比对Pe-Ch-Liposomes包封率及浊度的影响

图1 果胶溶液与壳聚糖溶液体积比 对Pe-Ch-Liposomes包封率及浊度的影响Fig.1 The effects of pectin solution to chitosan solution volume ratio on the encapsulation efficiency and turbidity of Pe-Ch-Liposomes
图1显示不同果胶溶液与壳聚糖溶液体积比所制备的Pe-Ch-Liposomes的包封率在78.8%~85.4%之间,且当二者体积比低于2∶1时,随着果胶溶液体积的增大包封率逐渐提高,之后果胶溶液体积的增加反而导致包封率降低,在二者体积比为2∶1时包封率出现最大值。样品的浊度测定值越大,表示粒径越小,从图1也可发现改变果胶溶液与壳聚糖溶液体积比对浊度的影响较小,但其对浊度的影响与体积比对包封率的影响呈现相似的趋势,即在体积比为2∶1时出现最大的浊度值,即此时样品粒径最小。前期(<2∶1)包封率的提高及粒径的减小,说明壳聚糖修饰的脂质体虽能提高脂质体包封率,但所形成的修饰层较为松散,加入果胶,通过二者的静电相互作用,发生交联,使修饰层致密的同时将游离的番茄红素包埋,提高了包埋率。而随着果胶溶液添加量的提高,壳聚糖层裸露-NH3+被大量中和,果胶与壳聚糖间的静电相互作用减弱,修饰层结构松散,从而引起粒径变大。而过多果胶溶液的加入可能会导致修饰层脱落,其影响一方面会产生部分未修饰脂质体,降低体系粒径;另一方面修饰层脱落的同时可能会连带破坏脂质体双分子层结构,引起被脂质双分子层包埋的部分番茄红素释放,体系包埋率下降。
2.2 果胶溶液与壳聚糖溶液浓度配比对Pe-Ch-Liposomes包封率及浊度的影响
由于每次制备出的Pe-Ch-Liposomes总体积为40 mL,且果胶溶液与壳聚糖溶液体积比为2∶1,则果胶溶液-壳聚糖溶液浓度配比为0.05%∶0.01%,0.05%∶0.05%,0.1%∶0.05%,0.2%∶0.1%,0.2%∶0.2%,0.3%∶0.1%,0.3%∶0.2%分别对应最终制备出的Pe-Ch-Liposomes修饰层总质量浓度分别为:0.0275%,0.0375%,0.0625%,0.125%,0.15%,0.175%,0.2%。从图2可以看出随着修饰层总质量浓度的增加,包封率及浊度值均呈现先增大后降低的趋势。即在一定浓度范围内,修饰层浓度的增加有利于将游离的番茄红素进行包埋,也促进修饰材料在脂质体表面形成更为致密的修饰层,导致包封率提高,粒径变小。但修饰层增大到一定程度后,包封率和粒径分别有所降低和升高,但包封率仍高于未修饰脂质体。这可能是源于果胶与壳聚糖间的相互连接更为紧密的同时,降低了壳聚糖与脂质体间的相互作用,致使在脂质体与壳聚糖层间包埋的番茄红素有所渗漏,而壳聚糖与脂质体间作用力的降低,使二者之间的连接减弱,间距加大导致粒径变大。
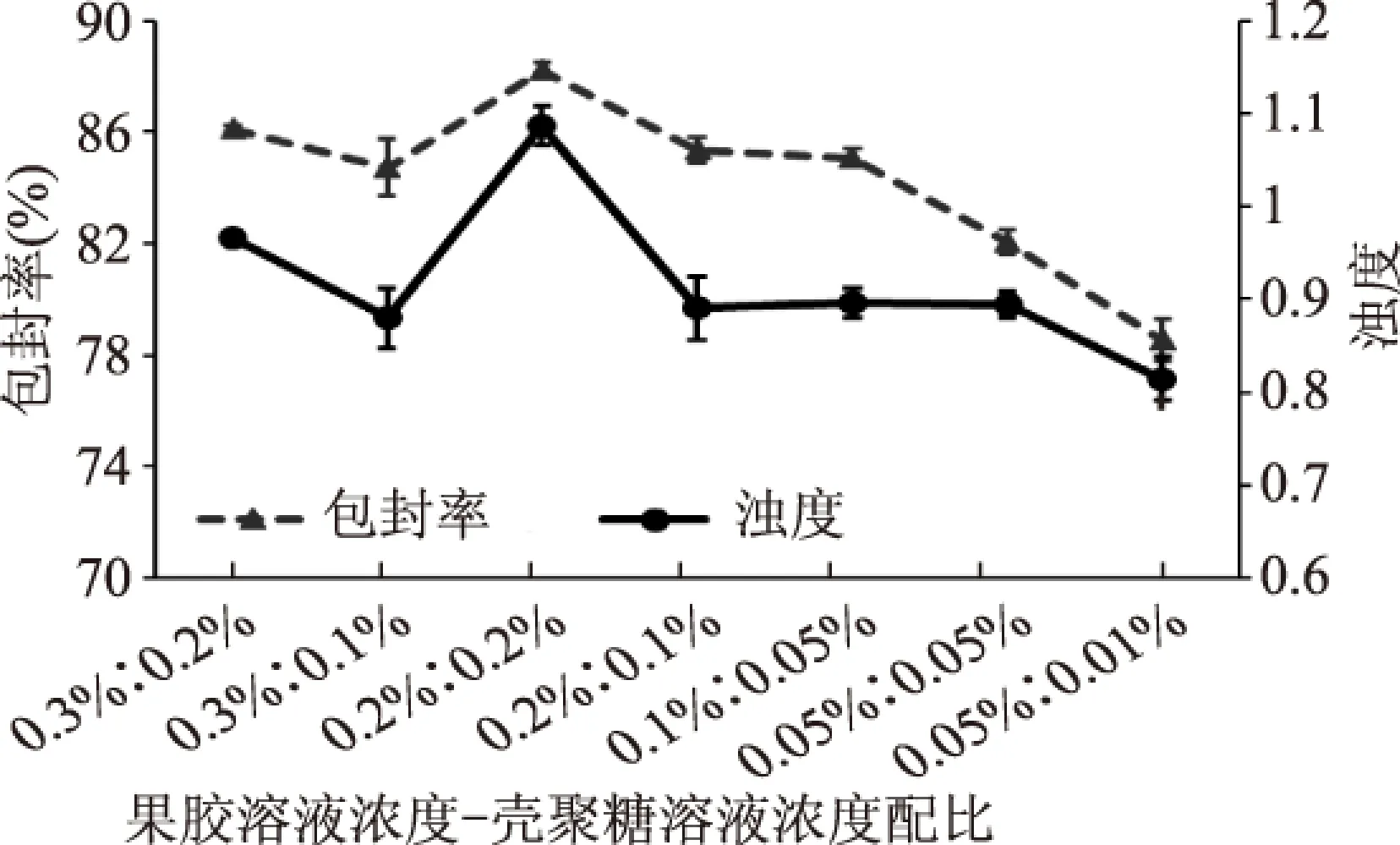
图2 果胶溶液与壳聚糖溶液浓度 对Pe-Ch-Liposomes包封率及浊度的影响Fig.2 The effects of pectin solution and chitosan solution concentrations on the encapsulation efficiency and turbidity of Pe-Ch-Liposomes
从图2也可看出,在果胶-壳聚糖浓度比例相同的条件下,提高果胶和壳聚糖浓度有利于提高包封率,同时降低粒径大小。如当果胶与壳聚糖浓度比为1∶1时,果胶-壳聚糖浓度0.05%~0.05%和0.2%~0.2%制备的脂质体包封率分别为82.06%,88.23%。同时也说明当壳聚糖浓度一定时,在一定范围内提高果胶的浓度,有利于提高包封率,而果胶浓度过大反而使包埋率降低:当壳聚糖溶液浓度为0.05%时,果胶溶液浓度为0.05%样品的包封率小于果胶溶液浓度为0.1%样品的包封率;当壳聚糖浓度增大至0.1%时,果胶溶液浓度为0.3%样品的包封率略大于果胶溶液浓度为0.2%样品的包封率;而壳聚糖溶液浓度为0.2%时,果胶溶液浓度为0.3%样品的包封率小于果胶浓度为0.2%样品的包封率;即壳聚糖溶液与果胶溶液的浓度及其配比是否合理大大影响保证脂质体的包封率。
2.3 卵磷脂与胆固醇质量比对Pe-Ch-Liposomes包封率及浊度的影响
图3为不同的卵磷脂与胆固醇质量比制备的常规脂质体、壳聚糖修饰脂质体及Pe-Ch-Liposomes包封率数据分析图。从图3可得知,卵磷脂与胆固醇质量比对三种脂质体的包封率都有一定的影响,且其对常规脂质体的影响最大,当质量比为7∶1时常规脂质体包封率仅为28.2%,而质量比为5∶1时为86%。研究表明胆固醇具有加固脂质双分子层膜,减弱膜的流动性,进而降低渗漏率的作用,前者(7∶1)较低的包封率,可能是因为胆固醇含量太低,导致脂质双分子流动性大,容易受外界冲击(超声处理)降低包封率。同时也可发现脂质体表面修饰有利于提高包封率,虽然不同质量比制备的同一类脂质体间存在一定的差异,但随着修饰层的增多都呈增大的趋势,且由于卵磷脂胆固醇质量比导致的包封率差异随着修饰层的增多逐渐变小。如经过果胶、壳聚糖共同修饰后的Pe-Ch-Liposomes包封率间没有显著性差异。这种现象说明在修饰过程可将游离的番茄的红素包埋在各修饰层间及修饰层与脂质体间[6]。
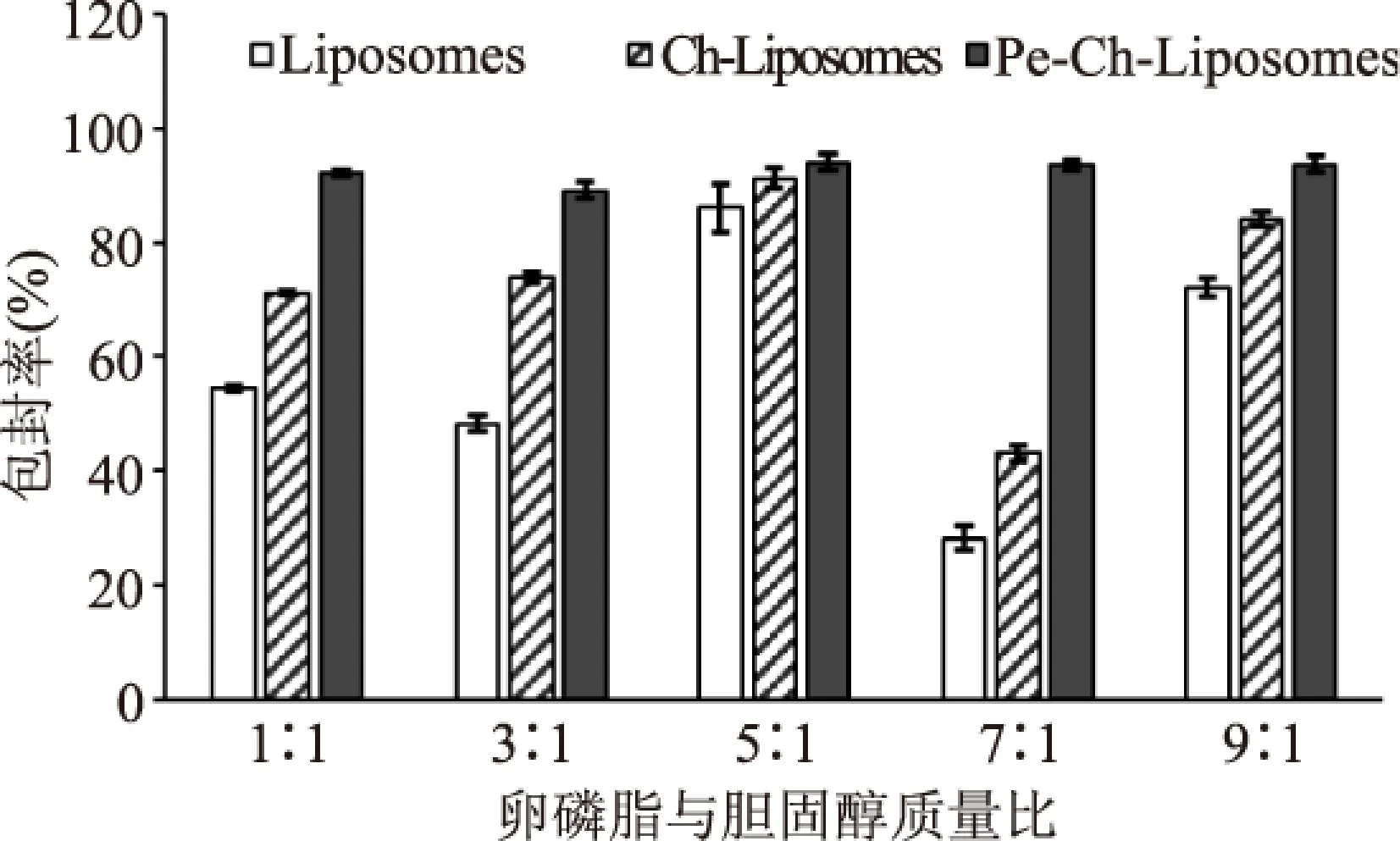
图3 卵磷脂与胆固醇质量比 对Pe-Ch-Liposomes包封率及浊度的影响Fig.3 The effects of lecithin to cholesterol mass ratio on the encapsulation efficiency of Pe-Ch-Liposomes
图4为不同卵磷脂胆固醇质量比制备的三种脂质体浊度值。卵磷脂与胆固醇质量比与浊度值并没有呈现明显的依赖性增多或减少的规律,但同一卵磷脂与胆固醇质量比下制备的脂质体的浊度值都呈现Pe-Ch-Liposome
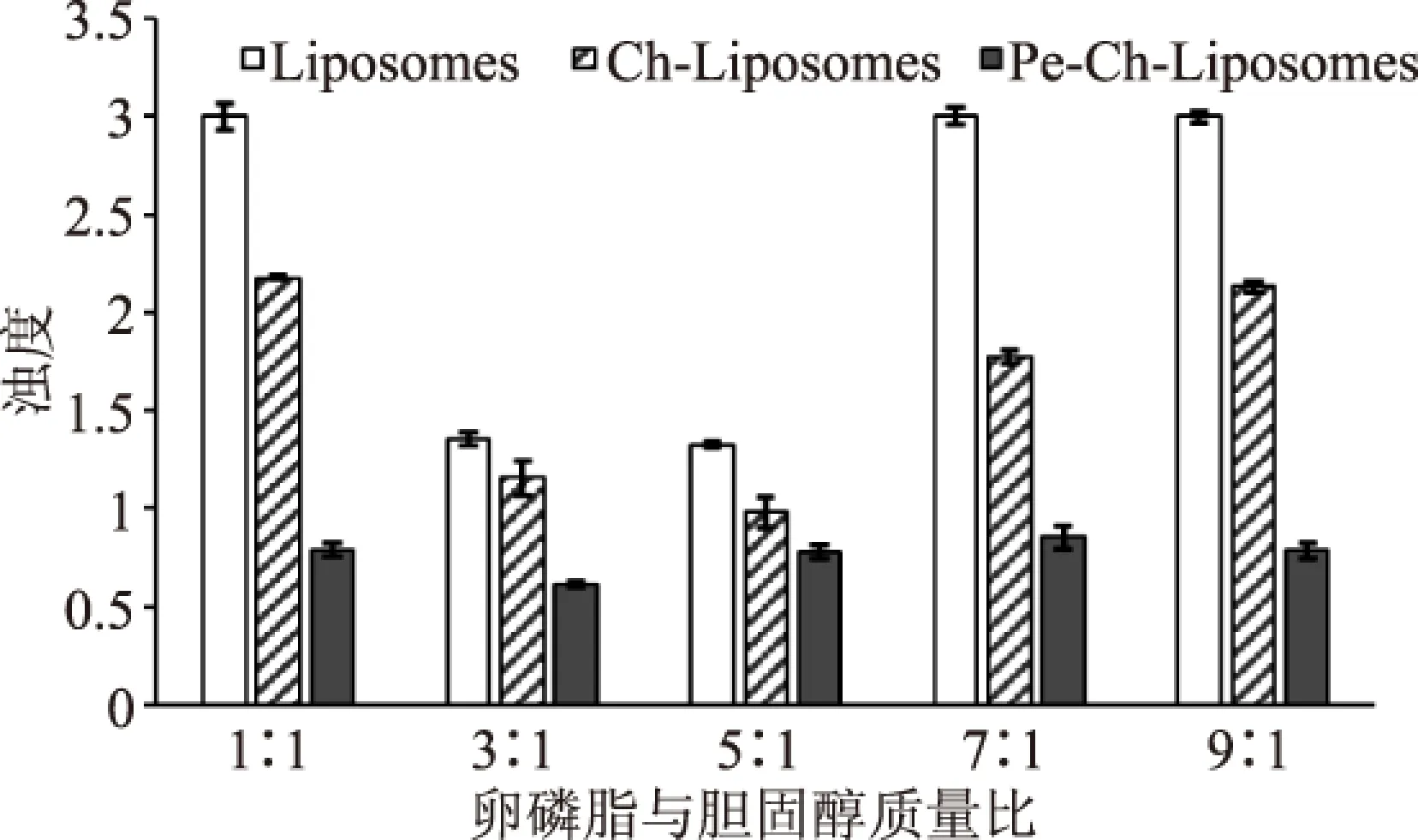
图4 卵磷脂与胆固醇质量比 对Pe-Ch-Liposomes浊度的影响Fig.4 The effects of lecithin to cholesterol mass ratio on the turbidity of Pe-Ch-Liposomes
常规脂质体包封率较高组,因大量番茄红素受到脂质体、壳聚糖及果胶的缓释作用,在贮藏过程中可能具有较高的保留率;虽其对应的粒径较大,但单囊脂质体相对多囊脂质体更为稳定,即综合考虑选取质量比为3∶1、5∶1和7∶1进行后期实验。
2.4 番茄红素添加量对Pe-Ch-Liposomes包封率及浊度的影响
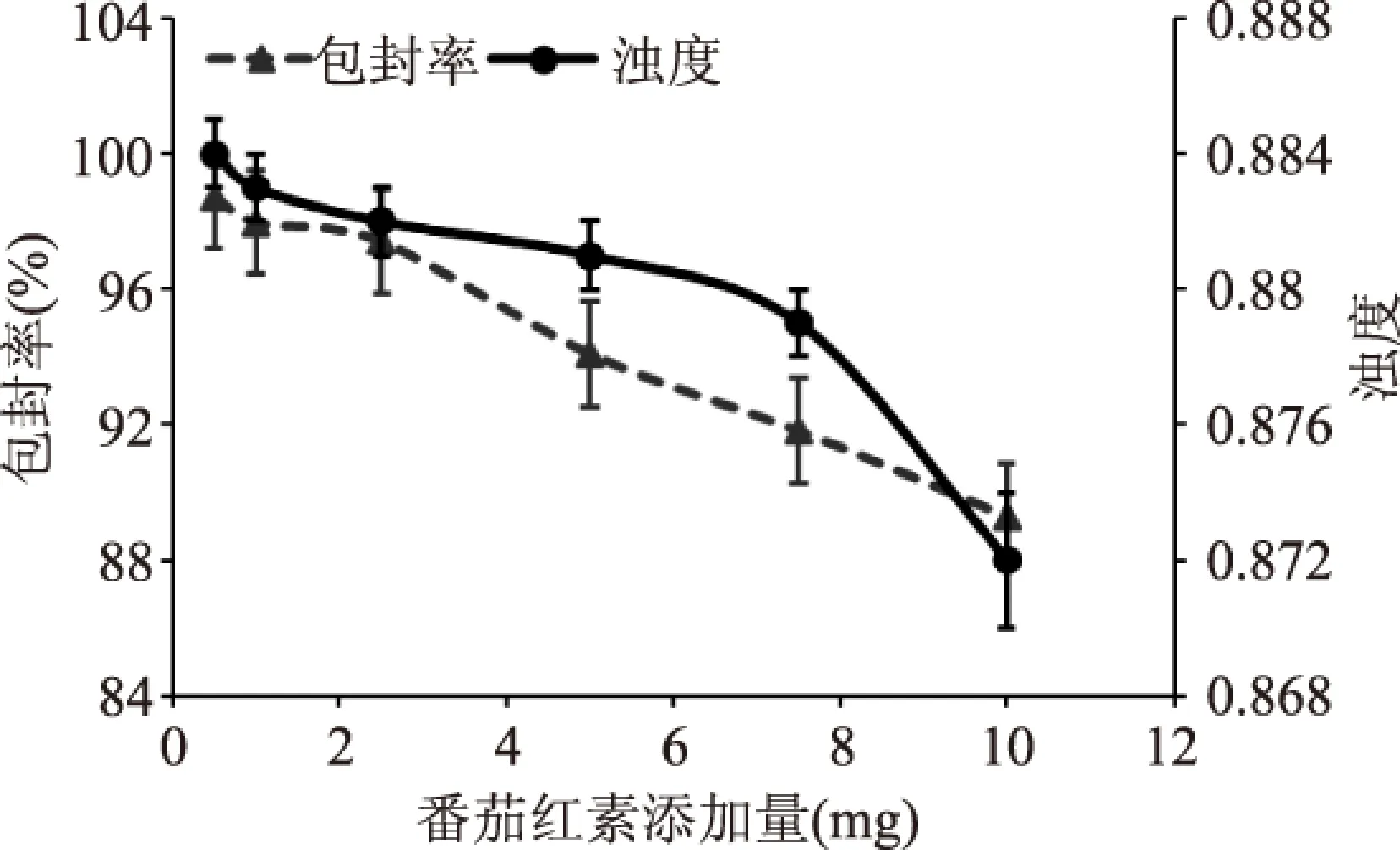
图5 番茄红素添加量 对Pe-Ch-Liposomes包封率及浊度的影响Fig.5 The effects of lycopene addition on the encapsulation efficiency and turbidity of Pe-Ch-Liposomes
由图5可知,随着番茄红素添加量的增多所制备的Pe-Ch-Liposomes包封率呈整体下降趋势,在添加量为0.5~2.5 mg范围内降低幅度较小,数值之间差异不大,当添加量>5 mg时包封率与番茄红素添加量呈明显的负相关关系。在添加量为0.5~7.5 mg范围内,浊度变化不大,数值之间没有显著性差异,当添加量为10 mg时浊度有所降低。因此,为了保证高包埋率的条件下,载量较高,选取添加量为2.5 mg进行配方优化。
2.5 工艺优化的结果及讨论
由表2可知A、B、C三个因素对Pe-Ch-Liposomes包封率影响顺序为B>C>A,最佳组合为A2B2C2,即经正交实验优化后的最佳工艺条件为:果胶溶液与壳聚糖溶液体积比为2∶1;果胶溶液与壳聚糖溶液浓度配比为0.2%∶0.2%,卵磷脂与胆固醇质量比为5∶1,番茄红素添加量2.5 mg。
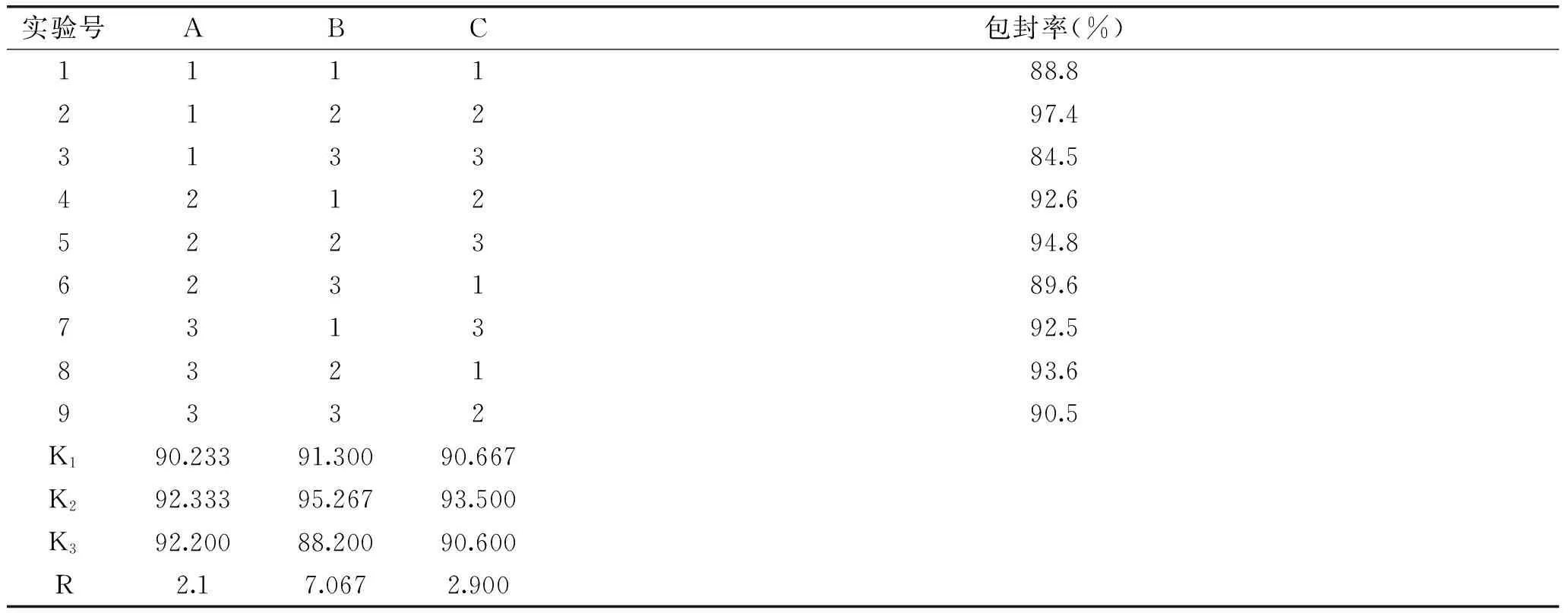
表2 L9(33)正交实验结果Table 2 Results of L9(33)orthogonal experiment
按照该配方制备常规脂质体(未修饰脂质体)、壳聚糖修饰脂质体和壳聚糖果胶修饰脂质体,然后根据番茄红素标准曲线和包封率公式分别求得各自的包封率如图6所示。由图6可以直观地看出经过壳聚糖修饰后的脂质体较常规脂质体包封率更好,且包封率有显著的提高,包封率由85.4%提升到了93.7%;在壳聚糖修饰脂质体的基础上再用果胶修饰后包封率也相对提高(97.8%),由此可以说明壳聚糖和果胶能够使脂质体的稳定性有所改善,提高其包封率。

图6 番茄红素脂质体的包封率Fig.6 The encapsulation efficiency of liposomes containing lycopene
图7为按照最佳配方所制备的Pe-Ch-Liposomes粒度分布图,从图7可发现其粒度分布为双峰分布,平均粒径为1870.4 nm,多分散系数为0.231即分布较为集中。
3 小结
多层修饰过程可提高脂质体体系的包埋率,即可将游离的番茄红素包裹在修饰层间及修饰层与脂质体间,多层修饰过程可减少由于卵磷脂与胆固醇质量比引起的包封率及浊度差异。
果胶、壳聚糖间要满足适宜的比例、浓度才能制备粒径小,且包封率高的多层修饰脂质体。
正交实验表明主要因素对包封率的影响大小顺序为果胶壳聚糖体积比>果胶壳聚糖浓度配比>卵磷脂与胆固醇质量比,正交实验优化后的最佳配方为果胶壳聚糖体积比为2∶1;果胶壳聚糖总浓度为0.2%~0.2%,卵磷脂与胆固醇质量比为5∶1。在此条件下制备的修饰脂质体包封率为97.8%,平均粒径为 1870.4 nm。
[1]Lila A A,Nawata K,Shimizu K,et al. Use of polyglycerol(PG),instead of polyethylene glycol(PEG)prevents induction of the accelerated blood clearance phenomenonagainst long-circulating liposomes upon repeated administration[J]. International Journal of Pharmaceutics,2013,456(1):235-242.
[2]Carine S,Alia J,Hatem F,et al. Preparation and characterization of clove essential oil-loaded liposomes[J]. Food Chemistry,2015,178(3):52-62.
[3]Bai C Q,Liu Y Z,Luo G W,et al. Preparation of coix seed oil liposomes by five different methods and their properties comparison investigation[J]. Journal of Dispersion Science and Technology,2015,36(1):136-145.
[4]Nahar K,Absar S,Gupta N,et al. Peptide-coated liposomal fasudil enhances site specific vasodilation in pulmonary arterial hypertension[J]. Molecular Pharmaceutics,2014,11(12):4374-4384.
[5]Mota L D,de Barros A L B,Fuscaldi L L,et al. Long-Circulating and pH-Sensitive Liposome Preparation Trapping a Radiotracer for Inflammation Site Detection[J]. Journal of Nanoscience and Nanotechnology,2015(6):4149-4158.
[6]Liu W L,Liu J H,Liu W,et al. Improved physical andinvitrodigestion stability of a polyelectrolyte delivery system based on layer-by-layer self-assembly alginate-chitosan coatednanoliposomes[J]. Journal of Agricultural and Food Chemistry,2013,61(17):4133-4144.
[7]Chen M X,Li B K,Yin D K,et al. Layer-by-layer assembly of chitosan stabilized multilayered liposomes for paclitaxel delivery[J]. Carbohydrate Polymers,2014,111(20):298-304.
[8]白春清. 羧甲基壳聚糖包覆薏苡仁油前体脂质体的制备稳定性及体外释放研究[D]. 南昌:南昌大学,2011.
[9]Bigucci F,Luppi B,Cerchiara T,et al. Chitosan/pectin polyelectrolyte complexes:selection of suitable preparative conditions for colon-specific delivery of vancomycin[J]. European Journal of Pharmaceutical Sciences,2008,35(1):435-441.
[10]Ciobanu B C,Cadinoiu A N,Popa M,et al. Modulated release from liposomes entrapped in chitosan/gelatin hydrogels[J]. Materials Science and Engineering,2014,43(1):383-391.
[11]Nahar K,Absar S,Gupta N,et al. Peptide-coated liposomal fasudil enhances site specific vasodilation in pulmonary arterial hypertension[J]. Molecular Pharmaceutics,2014,11(1):4374-4384.
[12]刘珍,邹立强,刘伟,等. 层层自组装法制备双重修饰脂质体及其体外消化稳定性[J]. 食品科学,2014,15(1):5-10.
[13]Xin L,Cao J Q,Liu C,et al. Evaluation of rMETase-loaded stealth PLGA/liposomes modified with Anti-CAGE scFV for treatment of gastric carcinoma[J]. Journal of Biomedical Nanotechnology,2015,11(1):1153-1161.
[14]Supper S,Anton N,Boisclair J,et al. Chitosan/glucose 1-phosphate as new stable in situ forming depot system for controlled drug delivery[J]. European Journal of Pharmaceutics and Biopharmaceutics,2014,88(1):361-373.
[15]Kavianinia I,Plieger P G,Kandile N G,et al.Invitroevaluation of spray-dried chitosan microspheres crosslinked with pyromellitic dianhydride for oral colon-specific delivery of protein drugs[J]. Journal of Applied Polymer Science,2014,131(15):4401-4404.
[16]Butnariu M V,Giuchici C V. The use of some nanoemulsions based on aqueous propol is and lycopene extract in the skin’s protective mechanisms against UVA radiation[J]. Journal of Nanobiotechnology,2014,9(1):3-11.
[17]Choksi P M,Joshi V Y. A Review on lycopene-extraction,purification,stability and applications[J]. International Journal of Food Properties,2007,10(1):289-298.
[18]孔祥辉.番茄红素脂质体的制备及其生物利用率的研究[D]. 无锡:江南大学,2009.
Preparation of pectin-chitosan layer by layer modified liposomes and the formula optimization
BAI Chun-qing1,ZHENG Jing-xia2,YUAN Lu1,CUI Dan-dan1,CHEN Li-li1,YUAN Mei-lan1,ZHAO Li1,*
(1.College of Life Science,Jiangxi Science and Technology Normal University,Nanchang 330013,China;2.Nanchang University,State Key Laboratory of Food Science and Technology,Nanchang University,Nanchang 330047,China)
Inthisresearchpectin-chitosanlayerbylayermodifiedliposomesweresuccessfullyprepared.Theeffectsofmainfactorsontheencapsulationefficiencyandturbiditywereevaluated,andoptimalformulawasobtainedbyorthogonalexperimentsusingencapsulationefficiencyasthemainindex.Theresultsindicatedthatthevolumeratioandconcentrationratioofpectinsolutiontochitosansolutionhadsignificanteffectsontheencapsulationefficiencyandturbidityofpectin-chitosanlayerbylayermodifiedliposomes.Theprocessofmodificationcoulddiminishthepropertiesdifferencesaffectedbythemassratiooflecithintocholesterol.Theoptimalformulawasthevolumeratioofpectinsolutiontochitosansolution2∶1,concentrationsofpectinsolutionandchitosansolution0.2%∶0.2%,themassratiooflecithintocholesterol5∶1,additionamountoflycopene2.5mg.Theencapsulationefficiencyoftheoptimizedpectin-chitosanmodifiedliposomeswassignificantlyhigherthanthatofconventionalliposomes,whichwas97.8%and85.4%forthem,respectively,theparticlesizedistributionoftheobtainedpectin-chitosanmodifiedliposomeswasnarrowwiththemeanparticlesizeof1870.4nmandpolydispersityindexof0.231.
layerbylayermodifiedliposome;lycopene;pectin;chitosan
2016-05-16
白春清(1984-),女,博士,讲师,研究方向:新型脂质体开发与特性研究,E-mail:chunqingbai01@aliyun.com。
*通讯作者:赵利(1967-),女,博士,教授,研究方向:食品化学,E-mail:lizhao618@hotmail.com。
国家自然科学基金地区项目(31560465);江西省自然科学基金资助项目 (20151BAB214023,20161BAB204190) ;江西省大宗淡水鱼产业技术体系项目(JXARS-04-赣中片);江西省教育厅青年项目(GJJ150803)。
TS218
A
1002-0306(2016)21-0049-06
10.13386/j.issn1002-0306.2016.21.001

