猴头菇多糖粗提液的壳聚糖法脱蛋白及分离纯化研究
易晓敏,周春晖,黄惠华,*
(1.华南理工大学食品科学与工程学院,广东广州 510640;2.广东太阳神集团有限公司,广东广州 510665)
猴头菇多糖粗提液的壳聚糖法脱蛋白及分离纯化研究
易晓敏1,周春晖2,黄惠华1,*
(1.华南理工大学食品科学与工程学院,广东广州 510640;2.广东太阳神集团有限公司,广东广州 510665)
研究了料液比(v/v)、pH、时间及处理次数对猴头菇多糖粗提液壳聚糖法脱蛋白的影响,得到了壳聚糖法脱蛋白的最优工艺,并通过柱层析对猴头菇多糖进行了分离纯化。优化的壳聚糖法脱蛋白工艺为:料液比50∶1,pH为粗提液本身的pH,4 ℃条件下静置2 h,处理次数为1次;此时蛋白质去除率为60.11%±0.47%,多糖损失率为11.16%±0.48%,壳聚糖残留率为1.01%±0.005%,蛋白质去除率比Sevage法提高11.67%,且多糖损失率降低了80.87%。猴头菇粗多糖经DEAE Sepharose Fast Flow柱层析分离得到两种多糖HEP-Ⅰ和HEP-Ⅱ,Sephadex G-75柱层析、紫外检测得出HEP-Ⅰ和HEP-Ⅱ均为成分均一的多糖,红外检测得出HEP-Ⅰ为同时含有吡喃环和呋喃环的糖类物质,而HEP-Ⅱ为含有吡喃环的糖类物质。壳聚糖法脱蛋白工艺合理可行,分离纯化后的猴头菇多糖成分均一。
猴头菇多糖,壳聚糖法,脱蛋白,柱层析,分离纯化
猴头菇(Hericiumerincaceus)是在我国广泛分布的药食同源菌,它营养丰富,含蛋白质、脂肪、可溶性糖、氨基酸及Fe、Ca、Mg、Zn等多种人体必需的矿物质[1]。现代研究表明猴头菇含有多种活性成分,包括多糖、萜类、生物碱、酚类化合物等。其中猴头菇多糖因为具有良好的免疫调节、抗肿瘤、护胃等生理活性而备受关注,相关的保健品也深受消费者的喜爱[2-4]。目前相关的猴头菇产品多用提取液制备而成,制品中除了含有多糖,还含有蛋白质等杂成分,杂成分的存在,除了影响产品的质量外,对于阐明猴头菇中的功能成分有干扰作用。因此对猴头菇多糖提取物进行分离纯化对提高相关产品的质量具有重要的意义。
目前,多糖常用的脱蛋白方法主要有Sevage法、三氯乙酸法、盐酸法、氢氧化钠法等[5],而酸碱的添加易使多糖的结构和活性受到影响,有机溶剂的使用会引起有毒有害物质的残留,影响到产品的安全性而不能应用于食品的加工生产。壳聚糖是一种天然的阳离子多糖,对蛋白质有络合和吸附作用,且具有提高免疫细胞活性、抗肿瘤、抗菌、降血压、抗氧化等生物活性,无毒无害、可食用[6-7]。柱层析是进一步分离纯化多糖的常用手段,常用的用于分离多糖的柱层析填料有葡聚糖凝胶系列及琼脂糖凝胶系列,而DEAE Sepharose Fast Flow是高流速的琼脂糖凝胶,具有分离速度快,分离效果好的特点[8-9]。本研究选择壳聚糖对猴头菇多糖粗提液进行脱蛋白,旨在寻求绿色环保、可应用于食品加工的脱蛋白方法,并采用DEAE Sepharose Fast Flow进行柱层析分离纯化,为多糖相关保健食品的生产及研究提供参考。
1 材料与方法
1.1 材料与仪器
猴头菇 产自福建省古田县,经干燥粉碎后过80目筛备用;壳聚糖(脱乙酰度≥ 90%,生化试剂BC)上海伯奥生物科技有限公司;DEAE Sepharose Fast Flow,Sephadex G-75 美国GE;D315大孔弱碱性阴离子交换树脂 郑州勤实科技有限公司;其他试剂均为国产分析纯。
HH-4数显恒温水浴锅,HJ-6A磁力加热搅拌器 常州普天仪器制造有限公司;JW-3021HR高速冷冻离心机 安徽嘉文仪器装备有限公司;UV-1800紫外可见分光光度计 日本岛津公司;XW-80A旋涡混合器,BSZ-160F电脑自动部份收集器,HL-2B数显恒流泵,层析柱(1.6 cm×20 cm) 上海精科实业有限公司;旋转蒸发器 上海亚荣生化仪器;LGJ-10冷冻干燥机 北京松源华兴科技发展有限公司;VERTEX70傅立叶红外光谱仪 德国Bruker公司。
1.2 实验方法
1.2.1 猴头菇多糖粗提液的制备 猴头菇粉末样品称重后与蒸馏水以1∶20(g/mL)的料液比混合均匀,在85 ℃水浴搅拌提取5 h,3000 r/min离心15 min,即得到猴头菇多糖粗提液[10]。
1.2.2 猴头菇多糖壳聚糖法脱蛋白工艺 取20 mL猴头菇多糖粗提液,在一定的料液比、pH、静置时间和处理次数的条件下,对粗提液进行脱蛋白,3000 r/min离心10 min,取上清液,分别测定蛋白质去除率、多糖损失率和壳聚糖残留率。
1.2.2.1 料液比对壳聚糖法脱蛋白的影响 取20 mL猴头菇多糖粗提液,添加壳聚糖溶液,pH为粗提液本身的pH(pH为5.85~5.90),旋涡振荡2 min,常温静止10 min,离心取上清液,研究不同料液比(v/v,多糖粗提液/壳聚糖溶液,壳聚糖溶液浓度为2.5%,以1%醋酸溶液配制)20∶1、30∶1、40∶1、50∶1、60∶1对壳聚糖法脱蛋白的影响。
1.2.2.2 pH对壳聚糖法脱蛋白的影响 取20 mL猴头菇多糖粗提液,以料液比50∶1混合,以0.1 mol/L HCl、0.1 mol/L NaOH溶液调节溶液的pH,旋涡振荡2 min,常温静止10 min,离心取上清液,研究不同pH4.0、5.0、6.0、7.0、8.0对壳聚糖法脱蛋白的影响。
1.2.2.3 静置时间对壳聚糖法脱蛋白的影响 取20 mL猴头菇多糖粗提液,以料液比50∶1混合,pH为粗提液本身的pH,旋涡振荡2 min,4 ℃条件下静置一段时间,离心取上清液,研究4 ℃条件下不同静置时间0、1、2、3、4 h对壳聚糖法脱蛋白的影响。
1.2.2.4 处理次数对壳聚糖法脱蛋白的影响 取20 mL猴头菇多糖粗提液,以料液比50∶1混合,pH为粗提液本身的pH,旋涡振荡2 min,常温放置10 min,离心取上清液,再重复处理,处理结束后4 ℃条件下放置2 h,再离心取上清液,比较处理次数为1、2、3、4、5次对壳聚糖法脱蛋白的影响。
1.2.3 Sevage法脱蛋白 取20 mL猴头菇多糖粗提液,与Sevage试剂(氯仿∶正丁醇=5∶1(v/v))以4∶1(v/v)的比例混合10 min,3000 r/min离心10 min,取上清液,重复上述处理1、2、3、4、5次,测定蛋白质去除率和多糖损失率[11]。
1.2.4 蛋白质去除率、多糖损失率及壳聚糖残留率的测定
1.2.4.1 蛋白质去除率的测定 采用考马斯亮蓝法以牛血清白蛋白为标准品测定蛋白质含量,以595 nm为测定波长,得出标准曲线方程。蛋白质去除率的计算如式(1):
式(1)
式中:x1-粗提液的蛋白质浓度(mg/mL),x2-脱蛋白后溶液的蛋白质浓度(mg/mL),b1-粗提液测定时的稀释倍数,b2-脱蛋白后溶液测定时的稀释倍数,V1-粗提液的体积(mL),V2-脱蛋白后溶液的体积(mL)。
1.2.4.2 多糖损失率的测定 采用苯酚-硫酸法以葡萄糖为标准品测定总糖含量,以490 nm为测定波长,得出标准曲线方程。采用DNS法以葡萄糖为标准品测定还原糖含量,以540 nm为测定波长,得出标准曲线方程。猴头菇多糖含量和猴头菇多糖损失率按式(2)、式(3)计算:
猴头菇多糖含量m(mg)=(x1b1-x2b2)×V
式(2)
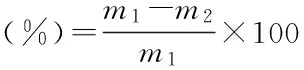
式(3)
式中:x1-总糖浓度(mg/mL),x2-还原糖浓度(mg/mL),b1-测定总糖时的稀释倍数,b2-测定还原糖时的稀释倍数,V-溶液的总体积(mL),m1-粗提液的多糖含量(mg),m2-脱蛋白后溶液的多糖含量(mg)。
1.2.4.3 壳聚糖残留率的测定 采用水溶苯胺蓝褪色光度法测定脱蛋白后提取液中的壳聚糖含量[12]。以壳聚糖为标准品测定壳聚糖含量,以610nm为测定波长,得出标准曲线方程。猴头菇多糖提取液的壳聚糖残留率的计算如式(4):
式(4)
式中:x1-粗提液测定时的壳聚糖浓度(mg/mL),x2-脱蛋白后溶液测定时的壳聚糖浓度(mg/mL),b1-粗提液测定时的稀释倍数,b2-脱蛋白后溶液测定时的稀释倍数,V1-粗提液的体积(mL),V2-脱蛋白后溶液的体积(mL)。
1.2.5 猴头菇粗多糖的制备 猴头菇多糖提取工艺按1.2.1进行,粗提液经浓缩、壳聚糖法脱蛋白后,采用终浓度为80%乙醇溶液醇沉过夜,离心取沉淀溶解,采用D315大孔树脂进行脱色[13],过滤后取滤液进行透析,-50 ℃下冷冻干燥36 h,得到猴头菇粗多糖HEP。
1.2.6 猴头菇粗多糖的DEAE Sepharose Fast Flow柱层析分离纯化 取猴头菇粗多糖30 mg在1 mL蒸馏水中溶解,配制成浓度为30 mg/mL的上样液,上样体积为1 mL,分别以蒸馏水、0.1、0.2、0.3、0.4、0.5、1 mol/L的NaCl溶液为洗脱液进行洗脱,洗脱流速为1 mL/min,每管收集5 mL,每个梯度溶液分别收集50管[9]。采用苯酚-硫酸法逐管检测,以管数为横坐标,490 nm处的吸光值为纵坐标,绘制洗脱曲线得到相应洗脱组分。收集各组分溶液,透析后冻干得到样品。
1.2.7 猴头菇多糖纯度分析
1.2.7.1 Sephadex G-75柱层析 对DEAE Sepharose Fast Flow柱层析分离得到的样品进行Sephadex G-75柱层析,上样浓度为50 mg/mL,上样体积为2 mL,以蒸馏水为洗脱液进行洗脱,洗脱流速为0.5 mL/min,每管收集5 mL,收集50管[14]。按1.2.6得到相应纯化样品。
1.2.7.2 紫外扫描分析 采用UV-1800紫外可见分光光度计对猴头菇多糖溶液(180 μg/mL)在200~800 nm下进行扫描,绘制紫外光谱图[15]。
1.2.7.3 碘-碘化钾反应 取1 mg/mL的多糖溶液,加入1 mL I2-KI溶液,混合,以1 mg/mL的可溶性淀粉为阳性对照,观察颜色的变化。
1.2.8 红外光谱分析 采用KBr压片法得到猴头菇多糖红外图谱。取3 mg猴头菇多糖与100 mg干燥后的KBr粉末研磨混合均匀,压成薄片,傅里叶变换红外光谱仪扫描测定,扫描波长为4000~400 cm-1[16]。
2 结果与分析
2.1 标准曲线方程
2.1.1 测定蛋白质含量的标准曲线方程 y=8.075x+0.012,R2=0.997,其中x为牛血清白蛋白的质量浓度(mg/mL);y为吸光度。
2.1.2 测定总糖含量的标准曲线方程 y=13.240x-0.001,R2=0.999,其中x为葡萄糖的质量浓度(mg/mL),y为吸光度。
2.1.3 测定单糖含量的标准曲线方程 y=1.260x-0.016,R2=0.999。其中x为葡萄糖的质量浓度(mg/mL),y为吸光度。
2.1.4 测定壳聚糖含量的标准曲线方程 y=-70.26x+0.012,R2=0.998,其中x为壳聚糖的质量浓度(mg/mL),y为吸光度。
2.2 壳聚糖法的脱蛋白
2.2.1 料液比对壳聚糖法脱蛋白的影响 由图1可知,当料液比在20∶1~60∶1范围内,随着料液比的增加,蛋白质去除率呈现先增大后平稳的趋势,在料液比为50∶1时达到最高值。多糖损失率呈现缓慢增加的趋势,壳聚糖残留率呈平缓减少的趋势。料液比为20∶1时的蛋白质去除率几乎为0%,说明较低的料液比不利于壳聚糖与蛋白质的吸附,反而引入了蛋白质;较高的料液比有利于吸附作用,且减少壳聚糖的残留。
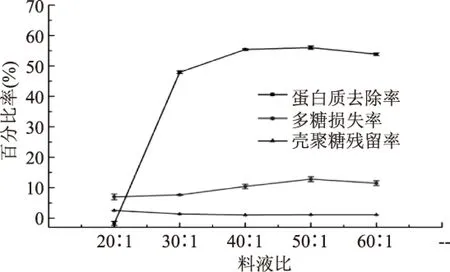
图1 料液比对壳聚糖法脱蛋白的影响Fig.1 The influence of ratio of extract to chitosan solvent on protein removal by chitosan method
2.2.2 pH对壳聚糖法脱蛋白的影响 由图2可知,当pH在4.0~8.0范围内,随着pH的增加,蛋白质去除率呈现先增大后减少的趋势,在pH为6.0时达到最高值,多糖损失率呈现缓慢增加的趋势,壳聚糖残留率则保持稳定。通过对比图1与图2的多糖损失率可看出,由于pH的调节,多糖损失率明显增加,说明酸碱度的变化可能引起猴头菇多糖的水解,增加多糖的损失。随着溶液pH的升高,蛋白质所带的负电荷增加,容易被带正电荷的壳聚糖吸附,但随着溶液中OH-浓度的升高,降低了壳聚糖对蛋白质负电荷的吸附能力,造成蛋白质去除率的降低[17]。经测定得猴头菇多糖粗提液的pH为5.80~5.90,与pH6.0接近,且蛋白质去除率更高,说明壳聚糖法脱蛋白的最佳pH在5.0~6.0之间,为了保留较好的脱蛋白效果,同时简化脱蛋白工艺,因此在采用壳聚糖法脱蛋白时可避免pH的调节。

图2 pH对壳聚糖法脱蛋白的影响Fig.2 The influence of pH on protein removal by chitosan method
2.2.3 静置时间对壳聚糖法脱蛋白的影响 由图3可知,当脱蛋白处理后的提取液在4 ℃条件中放置0~4 h范围内,随着时间的增加,蛋白质去除率呈现先增大后平稳的趋势,在时间为2 h时达到最高值,多糖损失率呈现先减少后增加的趋势,壳聚糖残留率则保持稳定。

图3 静置时间对壳聚糖法脱蛋白的影响Fig.3 The influence of time on protein removal by chitosan method
2.2.4 处理次数对壳聚糖法脱蛋白的影响 由图4可知,当处理次数在1~5次范围内,随着处理次数的增加,蛋白质去除率呈现下降而后平稳的趋势,在处理次数为1次时达到最高值,多糖损失率呈现缓慢增加的趋势,壳聚糖残留率呈缓慢增加的趋势。蛋白质去除率随着处理次数增加而降低,可能是由于壳聚糖不纯,经测定得出所使用的壳聚糖中蛋白质含量为50.07%±0.66%,而经第一次处理后,再次加入的壳聚糖溶液引入了蛋白质,且由于壳聚糖的残留,溶液中料液比发生了变化,影响了壳聚糖法脱蛋白的效果,而导致蛋白质去除率的降低。
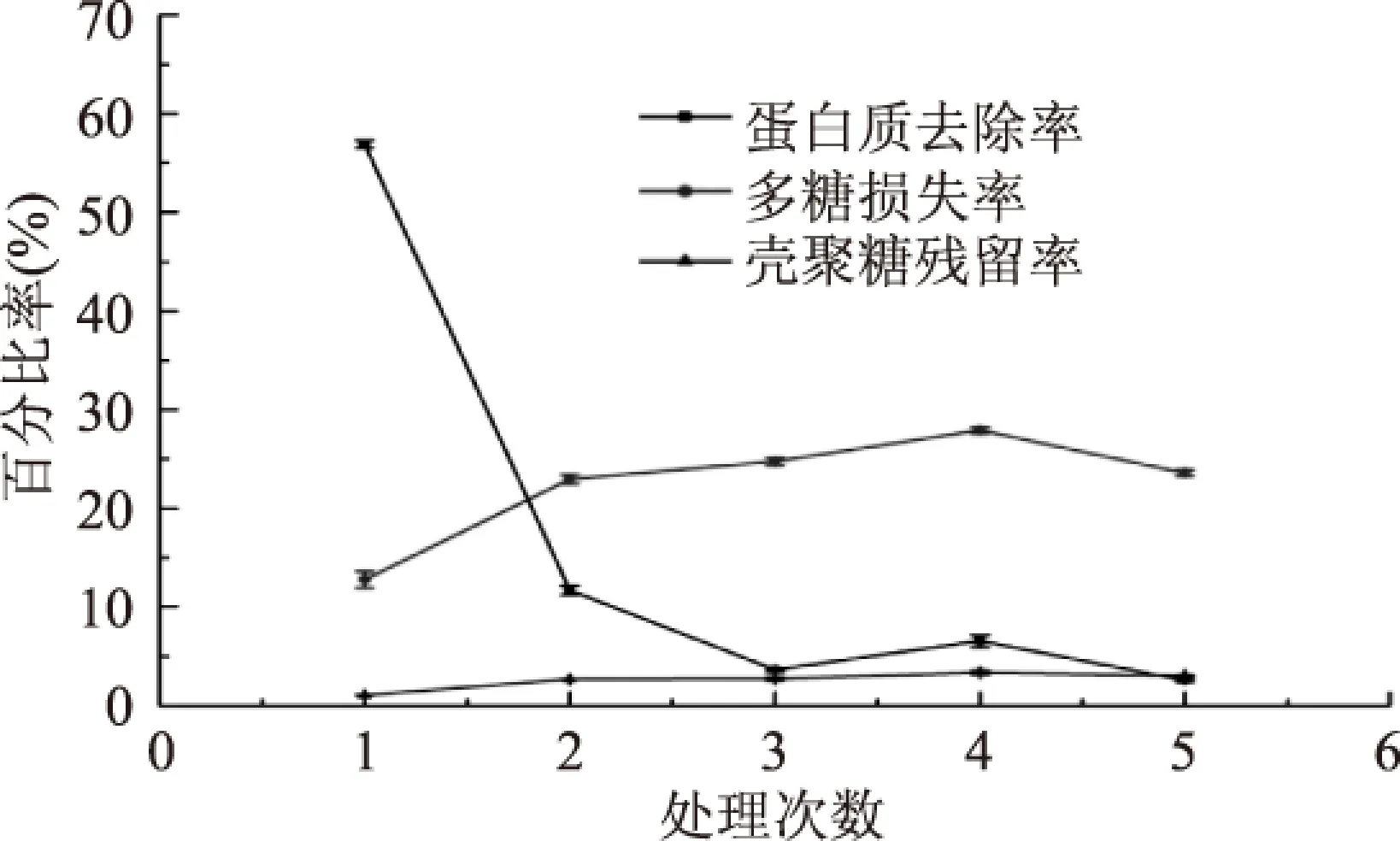
图4 处理次数对壳聚糖法脱蛋白的影响Fig.4 The influence of frequency on protein removal by chitosan method
综合分析四个因素的影响,可知,壳聚糖法脱蛋白最佳方案为料液比为50∶1,pH为粗提液本身的pH,4 ℃静置2 h,处理次数为1次;蛋白质去除率为60.11%±0.47%,猴头菇多糖损失率为11.16%±0.48%,壳聚糖残留率为1.01%±0.005%。
2.3 壳聚糖法脱蛋白与Sevage法脱蛋白的比较
由图5可知,在处理次数为1~5次范围内,随着处理次数的增加,Sevage法的蛋白质去除率呈现先增大后平稳的趋势,当处理次数为5次时,达到最高值;猴头菇多糖损失率呈现增加的趋势。在此范围内,Sevage法脱蛋白最佳处理次数为5次,蛋白质去除率为53.83%±0.35%,猴头菇多糖损失率为58.34%±0.62%。由图6可知,相比之下,壳聚糖法脱蛋白的蛋白质去除率比Sevage法的蛋白质去除率提高了11.67%,且多糖损失率降低了80.87%,可见,壳聚糖法脱蛋白在去除蛋白质的同时,能够更好的保留了猴头菇多糖在提取液中的含量。

图5 Sevage法脱蛋白Fig.5 Protein removal by Sevage method
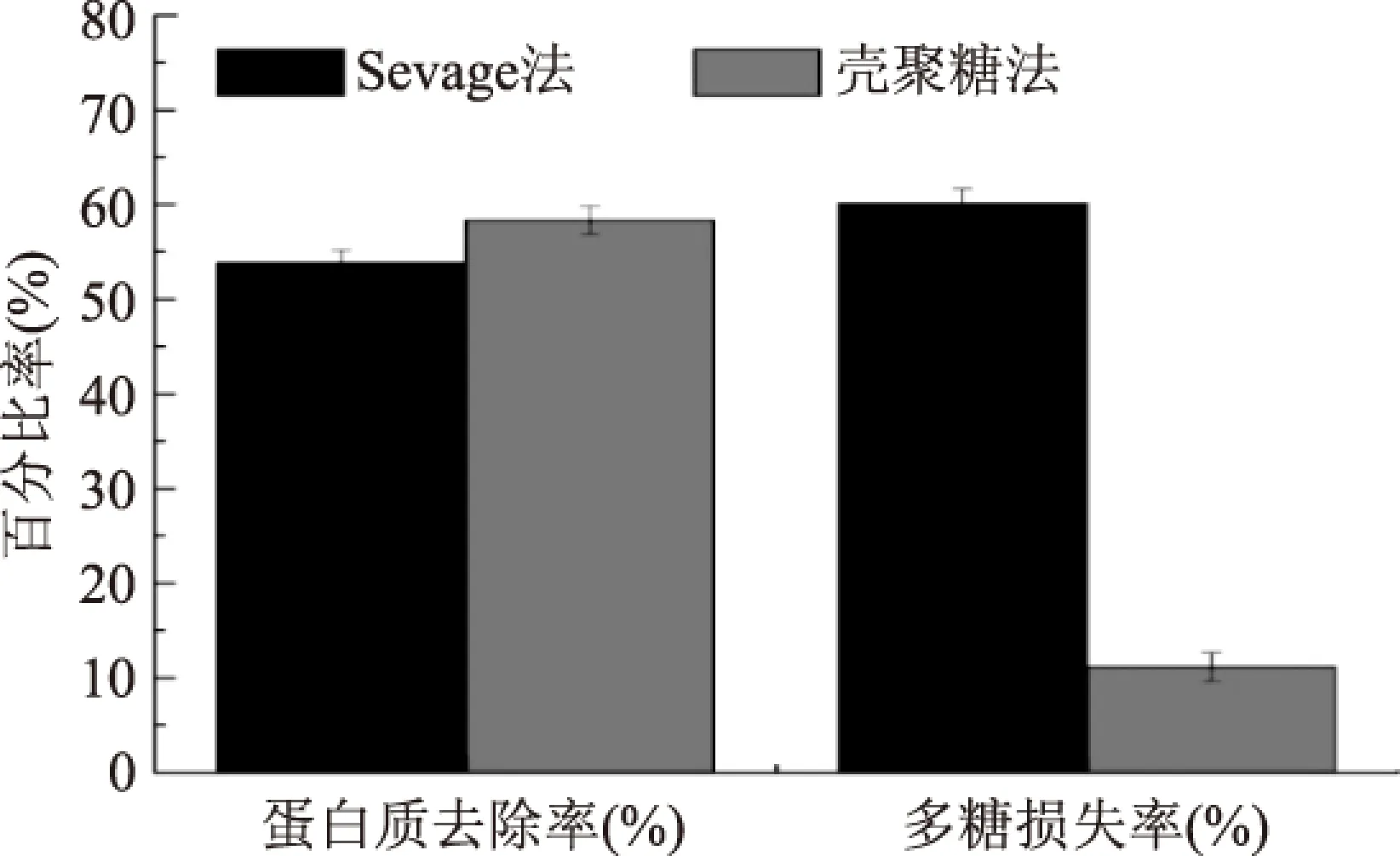
图6 壳聚糖法脱蛋白与Sevage法脱蛋白的比较Fig.6 The comparison between chitosan method and Sevage method
2.4 猴头菇粗多糖的DEAE Sepharose Fast Flow柱层析分离纯化
图7的洗脱曲线显示有2个吸收峰,分别出现在蒸馏水洗脱和0.1 mol/L NaCl溶液的洗脱条件下,收集各吸收峰对应的管数(4~6管,54~59管),透析后冷冻干燥得到多糖的分别命名为HEP-Ⅰ和HEP-Ⅱ。

图7 DEAE Sepharose Fast Flow柱层析洗脱曲线Fig.7 The elution curve of DEAE Sepharose Fast Flow column chromatogram
2.5 猴头菇多糖的纯度分析
2.5.1 Sephadex G-75柱层析洗脱曲线 由图8可知,两条洗脱曲线分别只有一个对称的吸收峰,说明猴头菇粗多糖经过DEAE Sepharose Fast Flow 所得的糖分HEP-Ⅰ和HEP-Ⅱ为均一多糖。
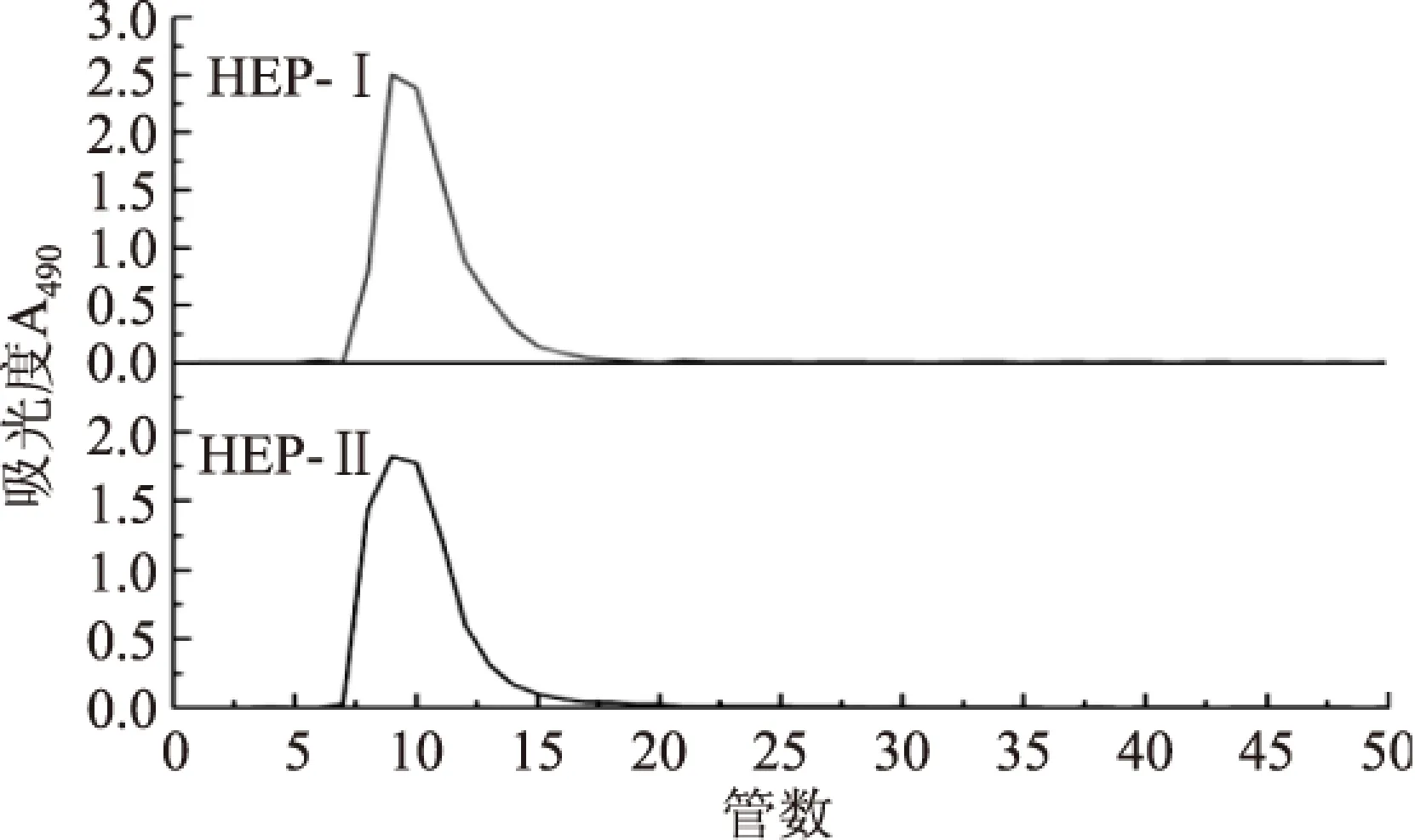
图8 HEP-Ⅰ、HEP-Ⅱ的Sephadex G-75柱层析洗脱曲线Fig.8 The elution curve of Sephadex G-75 column chromatogram of HEP-Ⅰand HEP-Ⅱ
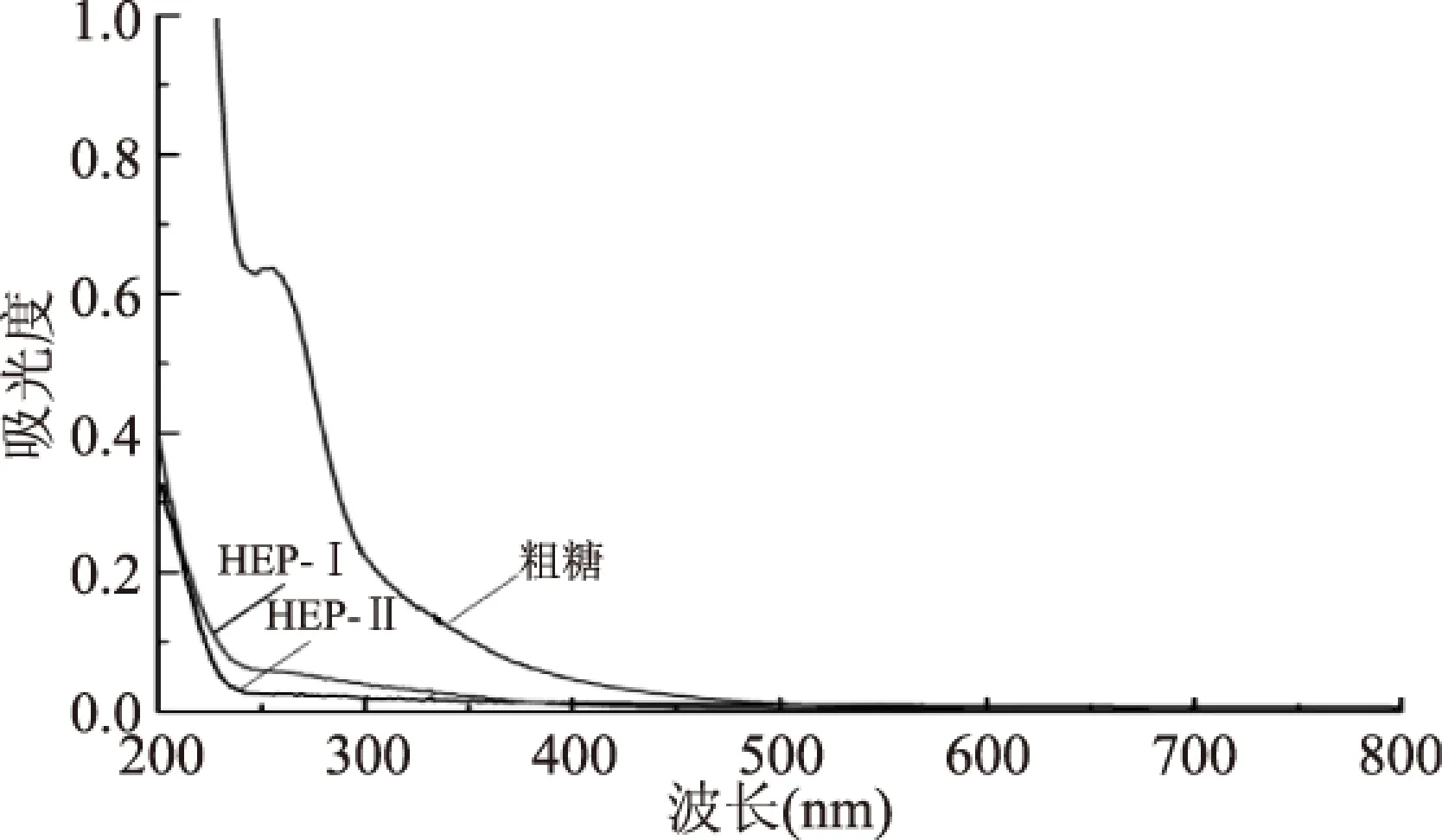
图9 HEP-Ⅰ、HEP-Ⅱ的紫外扫描图谱Fig.9 UV scanning spectrum of HEP-Ⅰ and HEP-Ⅱ
2.5.2 紫外扫描分析 260、280 nm处的吸收峰通常是大分子多肽、蛋白质及核酸等成分的特征吸收峰。由图9可知,通过与粗糖的对比,猴头菇多糖HEP-Ⅰ、HEP-Ⅱ在260、280 nm处的吸光值均明显降低,且均没有吸收峰出现,说明猴头菇多糖HEP-Ⅰ、HEP-Ⅱ基本不含大分子多肽、蛋白质和核酸。
2.5.3 碘-碘化钾反应 与淀粉溶液对比,猴头菇多糖HEP-Ⅰ、HEP-Ⅱ加入碘-碘化钾溶液后,静置30 min,没有明显的蓝色变化,说明HEP-Ⅰ、HEP-Ⅱ均不含淀粉。
2.6 红外光谱分析
猴头菇多糖HEP-Ⅰ、HEP-Ⅱ的红外光谱如图10所示,HEP-Ⅰ的3402.31 cm-1和HEP-Ⅱ的3400.74 cm-1处均为糖分子的O-H键伸缩振动引起的吸收峰;HEP-Ⅰ的1371.32 cm-1和HEP-Ⅱ的1374.11 cm-1处的吸收峰为C-H的变角振动造成;这些都是糖类物质的特征吸收峰。HEP-Ⅰ的2922.87 cm-1和HEP-Ⅱ的2923.69 cm-1处的吸收峰则由-CH2或-CH3的振动产生;HEP-Ⅰ的1647.00 cm-1和HEP-Ⅱ的1646.38 cm-1处的吸收峰为分子中的结合水引起;HEP-Ⅰ的1420.06 cm-1和HEP-Ⅱ的1420.67 cm-1处的吸收峰为-COOH的C-O伸缩振动产生;HEP-Ⅰ和HEP-Ⅱ在1000~1200 cm-1之间的一组强烈吸收峰是吡喃环中C-O-C键以及C-O-H的吸收;HEP-Ⅰ的916.23 cm-1和HEP-Ⅱ的918.53 cm-1处的吸收峰为吡喃环的非对称环伸缩振动引起;而HEP-Ⅰ的804.75 cm-1为呋喃糖的C-H变角振动造成;说明HEP-Ⅱ可能为同时含有吡喃环和呋喃环的糖类物质,而HEP-Ⅱ可能为含有吡喃环的糖类物质[18-19]。
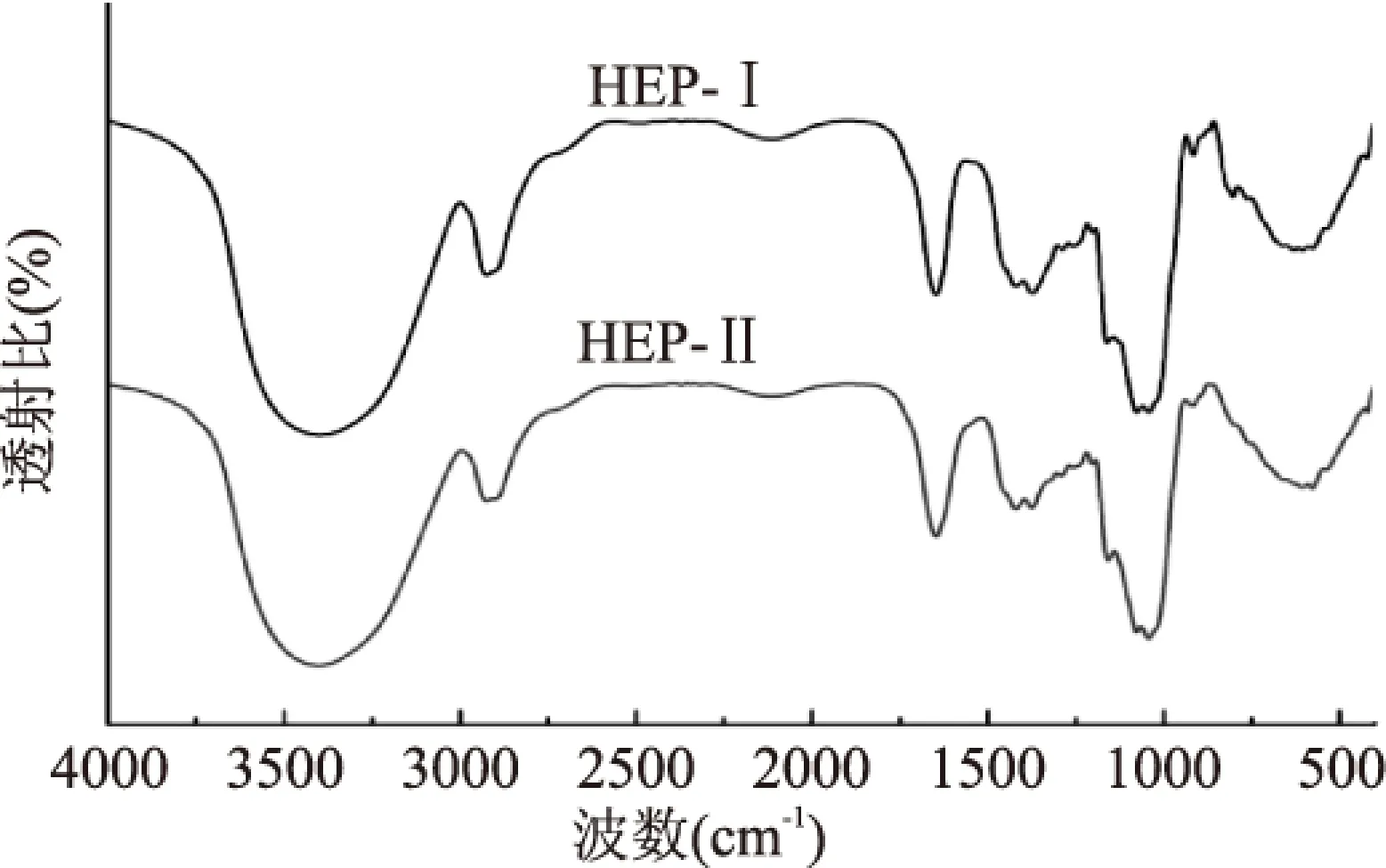
图10 HEP-Ⅰ、HEP-Ⅱ的红外光谱Fig.10 Infrared Spectroscopy of HEP-Ⅰand HEP-Ⅱ
3 结论
采用壳聚糖法对猴头菇多糖粗提液进行脱蛋白的研究表明:壳聚糖法脱蛋白最佳方案为料液比50∶1,放置于4 ℃条件下2 h,再离心取上清液;脱蛋白去除率为60.11%±0.47%,猴头菇多糖损失率为11.16%±0.48%,壳聚糖残留率为1.01%±0.005%。此方法的蛋白质去除率较Sevage法提高了11.67%,且多糖损失率降低了80.87%。采用DEAE Sepharose Fast Flow柱层析对猴头菇粗多糖进行分离纯化,得到两种多糖HEP-Ⅰ和HEP-Ⅱ。Sephadex G-75柱层析表明其为均一多糖,紫外扫描显示均无蛋白质组分,碘-碘化钾反应说明均不含淀粉,说明猴头菇多糖HEP-Ⅰ和HEP-Ⅱ为均一多糖。红外光谱显示HEP-Ⅰ为同时含有吡喃环和呋喃环的糖类物质,HEP-Ⅱ为含有吡喃环的糖类物质。
[1]Yang Z,Qian L,Guanghua M,et al. Optimization of enzyme-assisted extraction and characterization of polysaccharides fromHericiumerinaceus[J].Carbohydrate Polymers,2014,101(30):606- 613.
[2]Shyang-Chwen Sh,Ying L,Meng-Shiou L,et al. Immunomodulatory effects of polysaccharides isolated fromHericiumerinaceuson dendritic cells[J].Process Biochemistry,2013,48(9):1402-1408.
[3]Mingxing W,Yang G,Duoduo X,et al.A polysaccharide from cultured mycelium ofHericiumerinaceusandits anti-chronic atrophic gastritis activity[J].International Journal of Biological Macromolecules,2015,81(8):656-661.
[4]Guang L,Kai Y,Fushuang L,et al.Anticancer potential ofHericiumerinaceusextracts against human gastrointestinal cancers[J].Journal of Ethnopharmacology,2014,153(2):521-530.[5]王珊,黄胜阳.植物多糖提取液脱蛋白方法的研究进展[J].食品科技,2012,37(9):188-191.
[6]Cong K,Essy K F,Dan L,et al.Chitosan-based adsorption and freeze deproteinization:Improved extraction and purification of synthetic colorants from protein-rich food samples[J].Food Chemistry,2015,188(12):240-247.
[7]Cruz-Romero M C,Murphy T,Morris M,et al. Antimicrobial activity of chitosan,organic acids and nano-sized solubilisates for potential use in smart antimicrobially-active packaging for potential food applications[J].Food Control,2013,34(2):393-397.
[8]娄翠,汤顺清.海带岩藻多糖的分离纯化及结构特性的初步研究[J].食品工业科技.2012,33(4):135-138.
[9]何钢,刘嵬,李会萍,等.银杏叶多糖分离纯化、结构鉴定及抗氧化活性研究[J].食品工业科技.2015,36(22):81-86.
[10]秦培鹏,刘涛. 猴头菌多糖热水浸提工艺研究[J].安徽农业科学,2014,42(15):4784-4786.
[11]张萍,贺茂萍,殷力,等.石榴皮多糖的Sevage法除蛋白工艺研究[J].食品科技,2013,38(12):219-222.
[12]马卫兴.水溶苯胺蓝褪色光度法测定壳聚糖的含量[J]. 时珍国医国药,2009,20(7):1647-1648.
[13]蒋俊.猴头菌多糖提取、脱色工艺及生物活性的研究[D]. 南京:南京农业大学,2012.
[14]刘芳,陈贵堂,胡秋辉,等.金针菇锌多糖分离纯化及其结构特征[J].食品科学,2014,35(5):1-7.
[15]陶俊,文汉.油茶籽多糖分离纯化和结构分析[J].食品工业科技,2011,32(6):132-135.
[16]Hao L H,Chen L,Zhong N,et al. Separation,purification and structure of burdock oligosaccharides[J].Chem J Chin Univ,2005,26(7):1242-1247.
[17]闫亚丽,刁瑞丽,陈庆森,等.壳聚糖法分离纯化酪蛋白糖巨肽[J].食品科学,2012,33(20):89-93.
[18]Zuo F Z,Guo Y L,Hui J P,et al. Antioxidant and hepatoprotective potential of endo-polysaccharides fromHericiumerinaceusgrown on tofu whey[J].International Journal of Biological Macromolecules,2012,51(5):1140- 1146.
[19]Yang Z,Yao C,Qian L,et al. Preparation,characterization,and anti-Helicobacter pylori activity of Bi3+-Hericiumerinaceuspolysaccharide complex[J].Carbohydrate Polymers,2014,110(9):231-237.
Protein removal and purification by chitosan method ofHericiumerincaceuspolysaccharide extract
YI Xiao-min1,ZHOU Chun-hui2,HUANG Hui-hua1,*
(1.School of Food Science and Engineering,South China University of Technology,Guangzhou 510640,China;2.Guangdong Apollo Co.,Ltd.,Guangzhou 510665,China)
Effectsofsolid-liquidratio(v/v),pH,timeandfrequencyonproteinremovalfromHericium erincaceuspolysaccharideextractbychitosanmethodwerestudied,andtheoptimumconditionswereobtained,theHericium erincaceuspolysaccharidewasisolatedandpurifiedbycolumnchromatography.Theresultsshowedthattheoptimumconditionsweretheratioofextracttochitosansolvent(v/v)was50∶1,originalpH,andtimeof2hforatime.Undersuchcondition,theremovalrateofproteinreachedabout60.11%±0.47%,whichwashigherthanSevagemethodby11.67%andthelossrateofpolysaccharideswasdecreasedtoabout11.16%±0.48%,whichwaslowerthanSevagemethodby80.87%,andtheresidualofchitosanwasdetectedabout1.01%±0.005%.Twokindsofpolysaccharide,HEP-ⅠandHEP-Ⅱ,wereisolatedandpurifiedfromthecrudeHericium erinaceuspolysaccharidebyDEAESepharoseFastFlowcolumnchromatography.SephadexG-75columnchromatography,UVspectrophotometer,andFouriertransforminfraredspectroscopywereusedtoanalyzeHEP-ⅠandHEP-Ⅱ.TheresultsshowedthatbothofHEP-ⅠandHEP-Ⅱwereinuniqueform.AndHEP-Ⅰcontaincarbohydratepyranringandfuranring,whileHEP-Ⅱonlycontaincarbohydratepyranring.Chitosanmethodwasreasonablypracticable,andHericium erinaceuspolysaccharidewasinhighpurityaftercolumnchromatography.
Hericium erincaceuspolysaccharides;chitosanmethod;proteinremoval;columnchromatography;purification
2016-04-25
易晓敏(1991-),女,硕士研究生,研究方向:食品科学,E-mail:yi_xiaomin91@163.com。
*通讯作者:黄惠华(1954-),男,博士,教授,研究方向:农产品深加工及高值化,E-mail:fehhuang@scut.edu.cn。
广东省科技计划项目(2013B090600008)。
TS201.1
A
1002-0306(2016)21-0119-06
10.13386/j.issn1002-0306.2016.21.015

