苹果根皮素糖基转移酶酶学特性研究
徐 颖,樊明涛,张庭静,董 梅,黄 佳
(1.陕西科技大学食品与生物工程学院,陕西西安 710021;2.西北农林科技大学食品科学与工程学院,陕西杨凌 712100)
苹果根皮素糖基转移酶酶学特性研究
徐 颖1,2,樊明涛2,*,张庭静2,董 梅2,黄 佳2
(1.陕西科技大学食品与生物工程学院,陕西西安 710021;2.西北农林科技大学食品科学与工程学院,陕西杨凌 712100)
以苹果果皮为原料,通过饱和硫酸铵沉淀、DEAE-Sepharose阴离子交换法和Sephadex G75凝胶过滤色谱纯化,获得纯化后的根皮素糖基转移酶,其比酶活达到632.0 U/mg,纯化倍数为71.0倍,回收率达到42.6%。SDS-PAGE鉴定其表观分子量为50 ku。酶的最适pH为8.5,pH7.0~9.0有利于保持酶的稳定性。最适温度为45 ℃。以根皮素为底物测定的Km为3.16 μmol/L,Vmax为0.77 nM/min·mg蛋白。金属离子在反应体系的终浓度为5 mmol/L时,Ca2+和Mg2+对该苹果根皮素糖基转移酶有促进作用,Na+和K+作用不明显,Al3+、Cu2+、Mn2+和Zn2+有显著的抑制作用,Cu2+的抑制作用最强(p<0.05)。结论:根皮素糖基转移酶具有较好的碱稳定性和热稳定性,在根皮苷的酶法合成方面具有应用潜力。
苹果根皮素糖基转移酶,纯化,酶学性质
糖基转移酶(glycosyltransferase,GT,EC 2.4.x.y)是将核苷酸-糖供体中的单糖分子转移到其他的碳水化合物、蛋白或脂分子上,形成糖苷键。糖基化是植物体内一种重要的翻译后修饰过程,通过调节细胞重要代谢物的水平、活性在植物自动调节方面起重要作用[1-2]。同时,也是决定天然产物生物活性和生物利用度的重要因素之一[3-4]。
根皮苷是苹果的特征多酚,具有抗氧化性[5]、清除体内自由基[6]、降低血糖[7]、抑菌[8]等多种生物活性。但仅存在于石柯属(Lithocarpus polystachyus)[9],蔷薇属(Rosa canina)[10]等植物中,且含量低。UDPG:根皮素-2′-O-糖基转移酶催化根皮素生成根皮苷,且为根皮苷生物合成的关键酶。对该酶进行分离纯化及酶学特性研究,为体外合成根皮苷提供一种途径。但目前对该酶的特性报道较少,本研究以苹果果皮为原料,采用饱和硫酸铵盐析、DEAE阴离子交换法、Sephadex G75凝胶过滤色谱法分离纯化得到根皮素糖基转移酶。对酶的最适pH、pH稳定性、最适温度、温度稳定性及酶反应动力学参数进行研究,为该酶在食品工业的应用提供理论基础。
1 材料与方法
1.1 材料与仪器
富士(Fuji)苹果 陕西西安杨凌,果皮用锡箔纸包裹,液氮速冻,-80 ℃保存备用;根皮苷标准品(纯度>99.9%),尿苷二磷酸葡萄糖(UDPG)美国Sigma公司;根皮素,二硫苏糖醇(DTT) 德国Merck公司;交联聚乙烯吡咯烷酮(PVPP),聚乙二醇PEG20,000,丙烯酰胺,甲叉双丙烯酰胺,过硫酸铵,溴酚蓝,十二烷基硫酸钠(SDS),四甲基乙二胺(TEMED),考马斯亮兰G-250、R-250 美国Amresco公司;色谱甲醇 TEDIA公司;其他试剂为分析纯。
AKTA Purifier100蛋白纯化仪 瑞典Amersham Biosciences公司;LC-20AT液相色谱仪,该系统配有SPD-M20A光电二极管阵列检测器,CTO-20A柱温箱,SIL-20A自动进样器,DGU-20A5在线脱气装置 日本岛津公司;cp2245型分析天平 德国Sartorius公司;Milli-Q超纯水仪 美国Millipore公司;MDF-U53V型-80 ℃超低温冰箱 日本Sanyo公司;HC-3018R型高速冷冻离心机 安徽中科中佳科学仪器公司;液氮罐 四川东亚低温容器公司。
1.2 实验方法
1.2.1 糖基转移酶提取纯化方法
1.2.1.1 硫酸铵盐析 参照陈欣等[11]方法。称取冻于-80 ℃的苹果果皮1 g,置于用液氮预冷的研钵中,研成粉末,加0.5 g石英砂和0.5 g PVPP,混匀,加10 mL提取液(0.1 mol/L Tris-HCl,pH8.1,5 mmol/L DTT,5 mmol/L EDTA),研磨20 min,12000 r/min 4 ℃离心20 min,上清液在冰浴中边搅拌边缓慢加入硫酸铵粉末至30%饱和度,静置3 h,12000 r/min转速下4 ℃离心20 min,上清液在冰浴中边搅拌边缓慢加入硫酸铵粉末至80%饱和度,静置3 h,12000 r/min 4 ℃离心20 min,沉淀用0.02 mol/L Tris-HCl(pH8.1)缓冲液重新溶解,4 ℃过夜透析,得粗酶液。
1.2.1.2 DEAE阴离子交换(DEAE-Sepharose Fast Flow anion-exchange) 柱子型号为HiTrap DEAE-Sepharose Fast Flow column(1 mL,Amersham Biosciences);低盐缓冲液(A):20 mmol/L Tris-HCl buffer,pH8.5,高盐缓冲液(B):20 mmol/L Tris-HCl buffer,pH8.5,1 mol/L NaCl;缓冲液使用前用0.22 μm滤膜过滤,防止堵塞系统或柱子。
将粗酶液过0.22 μm滤膜,注射到 AKTA蛋白纯化系统,用0~0.5 mol/L NaCl以1 mL/min进行线性洗脱,每管收集1 mL洗脱液,检测各个洗脱峰峰值管洗脱液的根皮素糖基转移酶酶活,将有酶活的部分进行合并,转入透析袋(截留分子量MWCO 0.8~1.4 ku)用PEG 20,000在4 ℃进行浓缩。浓缩酶液用于凝胶过滤。
1.2.1.3 凝胶过滤色谱 柱子型号为SuperdexTM75 10/300 GL column(24 mL,Amersham Biosciences)。将过DEAE阴离子柱后收集的浓缩酶液注射到 AKTA蛋白纯化系统,使用凝胶柱进行纯化。用缓冲液(0.02 mol/L Tris-HCl buffer,pH8.5)以1 mL/min流速进行洗脱,每管收集1 mL洗脱液。检测各个洗脱峰峰值管洗脱液的根皮素糖基转移酶酶活,合并有酶活的部分,转入透析袋(截留分子量MWCO 0.8~1.4 ku)用PEG 20,000在4 ℃进行浓缩,存放在-20 ℃用于作SDS-PAGE验证和酶学特性分析。
1.2.2 酶活测定 根皮素糖基转移酶酶活以尿苷二磷酸葡萄糖(UDPG)和根皮素的反应来测定。反应体系如表1。

表1 反应体系Table 1 Reaction system
30 ℃水浴反应1 h,用60 μL冰乙酸终止反应。反应液经0.45 μm滤膜过滤后,用HPLC定量测定反应产物根皮苷[12]。在pH7.5,30 ℃条件下,每mg蛋白每min生成1 μg根皮苷所需的酶量为1比酶活单位(U/mg)。以牛血清蛋白为标准,用考马斯亮蓝法测定蛋白质含量。
1.2.3 聚丙烯酰胺凝胶电泳(SDS-PAGE) 方法参照《分子克隆实验指南(第3版)》[13]。
1.2.4 酶学性质
1.2.4.1 pH对酶活及稳定性的影响 分别在4.0、4.6、5.0、5.6的50 mmol/L醋酸-醋酸钠缓冲液,6.0、6.5、7.0、7.5的50 mmol/L磷酸二氢钾-磷酸氢二钾缓冲液,8.0、8.5、9.0、9.5、10.0的50 mmol/L Tris-HCl缓冲液中测定酶活,以确定根皮素糖基转移酶的最适pH。
1.2.4.2 pH稳定性实验 共设置3组,调节每组酶液的pH,分别为4.0、5.0、6.0、7.0、8.0、9.0、10.0,使每组酶液分别置于4、25、50 ℃下保温1 h,测定其酶活,以每组中未处理的酶液做对照,计算相对酶活。
1.2.4.3 温度对酶活的影响 分别在25、30、35、40、45、50、60 ℃下,测定其酶活,以相对酶活最高值为100%,计算相对酶活。
1.2.4.4 酶的热稳定性 将等量酶液分别置于40、50、60 ℃保温,每隔30 min,取样测酶活,以未处理的酶液为对照,计算相对酶活。
1.2.4.5 金属离子对酶活的影响 在酶的反应液中加入金属离子Al3+、Ca2+、Mg2+、Cu2+、Mn2+、Zn2+、Na+和 K+,金属离子的最终浓度为5 mmol/L,测定其酶活,以未加金属离子的酶活为100%,计算相对酶活。

表2 苹果根皮素糖基转移酶的纯化Table 2 Purification of MdP2’GT from apple peel
注:a总酶活=比酶活×总蛋白;b纯化倍数=比酶活/粗酶比酶活;c回收率(%)=(总酶活/粗酶总酶活)×100。
1.2.4.6 酶促反应动力学参数的测定 纯化的根皮素糖基转移酶与不同浓度的根皮素反应后测定其酶活,以Linewear-Burk双倒数作图法[14](袁勤生和赵健2005),以根皮素浓度的倒数为横坐标,反应速率的倒数为纵坐标,求出该酶对底物的Km值和Vmax值。
2 结果与讨论
2.1 苹果根皮素糖基转移酶的纯化
经离子交换层析色谱和凝胶过滤色谱分离得到具有MdP2’GT活性的蛋白,SDS-PAGE 电泳分析显示,在电泳图上只出现一条蛋白带,表观分子量为50 ku(图1)。植物糖基转移酶的分子量绝大部分的分子量集中在45 ku到60 ku之间[15]。Nagashima 等[16]从黄芩细胞悬液中纯化的UDP-葡萄糖醛酸酯:黄芩素-7-O-糖基转移酶经SDS-PAGE鉴定出分子量为52 ku。本研究得到的苹果根皮素糖基转移酶蛋白分子量介于此范围之内。
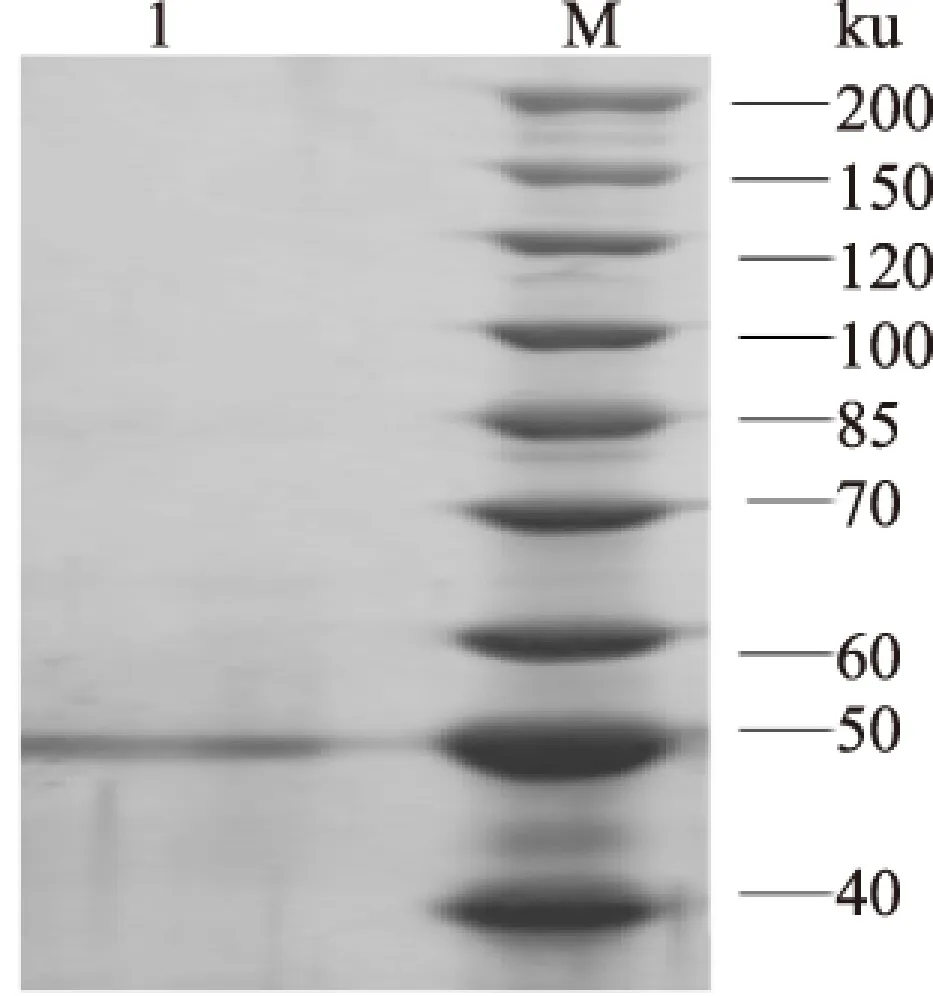
图1 纯化后MdP2’GT 的SDS-PAGE电泳图Fig.1 SDS-PAGE of purified MdP2’GT 1-纯酶,M-蛋白marker。
如表2,经80%饱和硫酸铵盐析、DEAE阴离子交换法、Sephadex G75凝胶过滤色谱法分离纯化,比酶活达到632.0 U/mg,纯化倍数为71.0倍,回收率达到42.6%。
2.2 酶学特性
酶反应液中pH通过影响酶的带电特性来影响酶的活性中心与底物的结合能力,从而影响酶的催化活性。适宜的pH条件能够促进底物与酶的结合,有利于酶的催化作用。从图2可以看出苹果根皮素糖基转移酶在偏酸性至中性条件下(pH4.0~7.0),相对酶活均较低,只有最高酶活的23.57%~32.06%。pH大于7.0,相对酶活迅速升高,pH为8.5酶活最高,而后随pH增大,相对酶活迅速降低。因此MdP2’GT最适pH为8.5。Gosch等[17]研究的苹果和梨的根皮素糖基转移酶的最适pH7.0~8.0,本结果虽然与这篇文献不完全一致,但表明MdP2’GT在偏碱性条件下酶活较高。
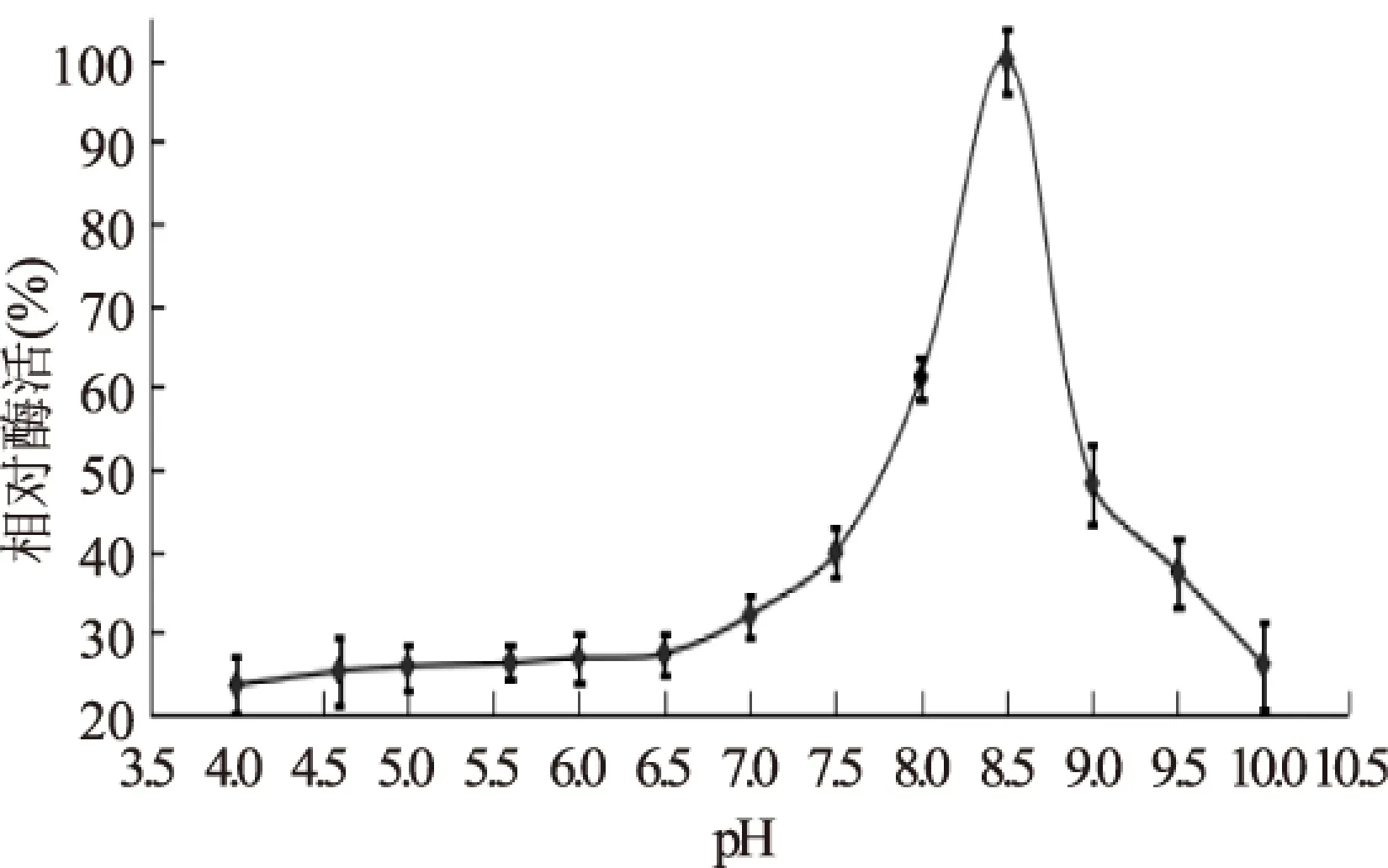
图2 pH对MdP2’GT酶活的影响Fig.2 Effect of pH on MdP2’GT activity
由图3可知,在3个温度下随pH升高,MdP2’GT相对酶活都升高,pH8.0时最高,即最稳定,之后,随pH升高,相对酶活降低。说明pH7.0~9.0,有利于保持酶的稳定性。pH低于7.0或高于9.0时,酶活都会迅速下降。pH4.0~6.0范围内,4 ℃时相对酶活显著高于25 ℃和50 ℃的酶活(p<0.05),说明低温有利于酶的稳定。
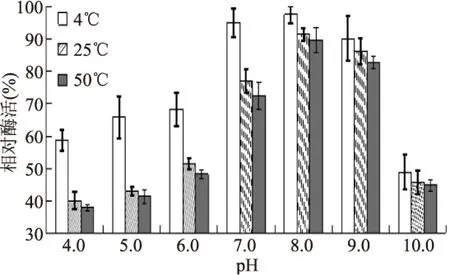
图3 MdP2’GT pH稳定性Fig.3 pH stability of MdP2’GT
如图4所示,苹果根皮素糖基转移酶最适温度为45 ℃,与Gosch等[17]研究的根皮素糖基转移酶的最适温度一致。温度为40 ℃,相对酶活为68.14%,温度为50 ℃,相对酶活66.28%。随温度升高,相对酶活迅速降低,这主要是由酶变性引起的酶活降低。
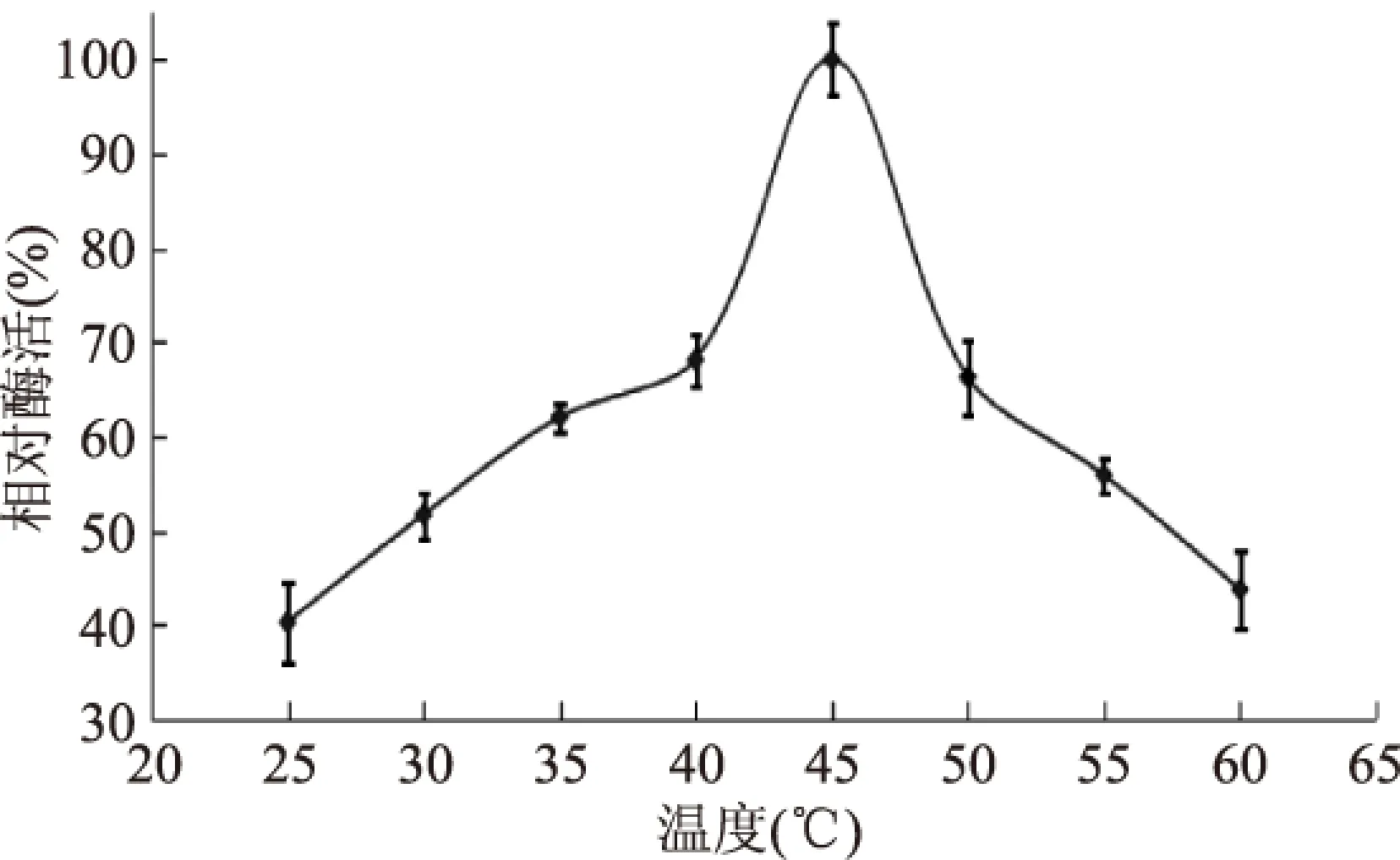
图4 温度对糖基转移酶酶活的影响Fig.4 Effect of temperature on MdP2’GT activity
如图5所示,在40、50和60 ℃三个温度下,苹果根皮素糖基转移酶都是随保温时间的延长,酶活降低,且温度越高,酶活损失的越多。在40、50、60 ℃保温2 h后,酶活分别降为83.9%、66.1%和51.2%。说明该酶在40 ℃下较稳定,40 ℃以上,酶活迅速降低。
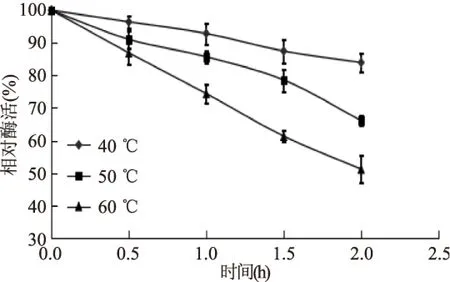
图5 酶的热稳定性Fig.5 Thermal stability of MdP2’GT
当金属离子在反应体系的终浓度为5 mmol/L时,Ca2+和Mg2+对苹果根皮素糖基转移酶酶活有促进作用。Yue[18]报道Ca2+和Mg2+对三七(Panax notoginseng)悬浮细胞中的UDPG:人参皂苷Rd糖基转移酶(UGRdGT)有促进作用。Na+和K+作用不明显,Al3+、Cu2+、Mn2+和Zn2+有显著的抑制作用,Cu2+的抑制作用最强。Fukuchi-Mizutani[19]报道三花龙胆(Gentiana triflora)UDPG:花青素-3′-O-糖基转移酶酶活被Al3+抑制20%。此外,长春花(Catharanthus roseus)的龙胆酸葡萄糖基转移酶都强烈的被 Zn2+抑制[20]。绿毛山柳菊(Hieracium pilosella)的木樨草素糖基转移酶UGT90A7 和UGT95A1活性被Cu2+完全抑制[21]。
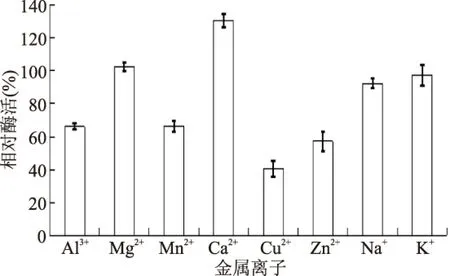
图6 金属离子对酶活的影响Fig.6 Effect of cations at 5 mmol/L on MdP2’GT activity
纯化的根皮素糖基转移酶与不同浓度的根皮素反应后测定其酶活,以根皮素浓度的倒数为横坐标,反应速率的倒数为纵坐标,作Linewear-Burk双倒数曲线,如图7,得到回归方程为
以根皮素为底物该酶的Km为3.16μmol/L,Vmax为0.77nM/min·mg蛋白。这与Noguchi等[22]得到的结论相似,该作者从大豆(Glycinemax)苗根部提取异黄酮糖基转移酶(UDP-glucose:isoflavone7-O-glucosyltransferase),得出以染料木素为底物的Km值为3.6μmol/L。
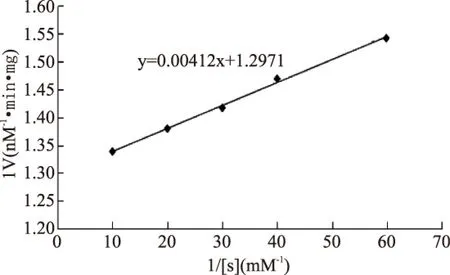
图7 MdP2’GT双倒数曲线Fig.7 Linewear-Burk curve for MdP2’GT
3 结论
本研究从苹果果皮分离纯化得到苹果根皮素糖基转移酶,经SDS-PAGE鉴定其表观分子量为50 ku。该酶最适pH8.5,在pH7.0~9.0范围内,有利于保持酶的稳定性,最适温度45 ℃,该酶在40 ℃下较稳定。当金属离子在反应体系的终浓度为5 mmol/L时,Ca2+和Mg2+对酶活有促进作用。该酶具有较好的碱稳定性和热稳定性,本研究为体外酶法合成根皮苷提供理论基础。
[1]Breton C,Fournel-Gigleux S,Palcic M. Recent structures,evolution and mechanisms of glycosyltransferases[J].Current Opinion in Structural Biology,2012,22(5):540-549.
[2]Gachon C,Langlois-Meurinne M,Saindrenan P. Plant secondary metabolism glycosyl-transferases:the emerging functional analysis[J]. Trends Plant Sci,2005,10(11):542-549.
[3]Choi S,Kim H,Yoon Y,et al. Glycosyltransferase and its application to glycodiversification of natural products[J]. Journal of Industrial and Engineering Chemistry,2012,18(4):1208-1212.
[4]Palcic M. Glycosyltransferases as biocatalysts[J]. Current Opinion in Chemical Biology,2011,15(2):226-233.
[5]Vieira F,Borges G,Copetti C,et al. Phenolic compounds and antioxidant activity of the apple flesh and peel of eleven cultivars grown in Brazil[J]. Sci Hort,2011,128(3):261-266.
[6]Ran J,Fan M,Li Y,et al. Optimisation of ultrasonic-assisted extraction of polyphenols from apple peel employing cellulase enzymolysis. Int J Food Sci Technol,2013,48(5):910-917.
[7]Gosch C,Halbwirth H,Stich K. Phloridzin:Biosynthesis,distribution and physiological relevance in plants[J]. Phytochemistry,2010,71(8-9):838-843.
[8]Schovánková J. Opatova H. Changes in phenols composition and activity of phenylalanine-ammonia lyase in apples after fungal infections[J]. Horticultural Science,2011,38(1):1-10.
[9]Dong H,Li M,Zhu F,et al. Inhibitory potential of trilobatin from Lithocarpus polystachyus Rehd againstα-glucosidase andα-amylase linked to type 2 diabetes[J].Food Chemistry,2012,130(2):261-266.
[10]Yan G,Li S,Hu J,et al.Phenolic constituents from the roots of Rosa laevigata(Rosaceae)[J]. Biochemical Systematics & Ecology,2014,52(52):23-26.
[11]陈欣,薛轶,刘吉华,等. 人参毛状根糖基转移酶的分离纯化及酶学性质研究[J].药物生物技术,2009,16(1):50-54.
[12]徐颖,樊明涛,冉军舰,等. 不同品种苹果籽总酚含量与抗氧化相关性研究[J]. 食品科学,2015,36(1):79-83.
[13]萨姆布鲁克J,拉塞尔 DW,黄培堂(译).分子克隆实验指南(第3版)[M].北京:科学出版社,2002.
[14]袁勤生,赵健. 酶与酶工程[M].上海:华东理工大学出版社,2005.
[15]Vogt T,Jones P. Glycosyltransferases in plant natural product synthesis:characterization of a supergene family[J].Trends in Plant Science,2000,5(9):380-386.
[16]Nagashima S,Hirotani M,Yoshikawa T.Purification and characterization of UDP-glucuronate:baicalein 7-O-glucuronosyltransferase from Scutellaria baicalensis Georgi. cell suspension cultures[J]. Phytochemistry,2000,53(5):533-538.
[17]Gosch C,Halbwirth H,Schneider B,et al. Cloning and heterologous expression of glycosyltransferases from Malus x domestica and Pyrus communis,which convert phloretin to phloretin 2’-O-glucoside(phloridzin)[J]. Plant Sci,2010,178(3):299-306.
[18]Yue C,Zhong J. Purification and characterization of UDPG:ginsenoside Rd glucosyltransferase from suspended cells of Panax notoginseng[J].Process Biochem,2005,40(12):3742-3748.
[19]Fukuchi-Mizutani M,Okuhara H,Fukui Y,et al. Biochemical and Molecular Characterization of a Novel UDP-Glucose:Anthocyanin 3’-O-Glucosyltransferase,a key enzyme for blue anthocyanin biosynthesis,from Gentian[J]. Plant Physiology,2003,132(3):1652-1663.
[20]Yamane S,Shimoda K,Watanabe K,et al. Purification and characterization of gentisic acid glucosyltransferase from the cultured cells of Catharanthus roseus[J]. J Mol Catal B-Enzym,2002,17(2):59-63.
[21]Witte S,Moco S,Vervoort J,et al. Recombinant expression and functional characterisation of regiospecific flavonoid glucosyltransferases from Hieracium pilosella L[J]. Planta,2009,229(5):1135-1146.
[22]Noguchi A,Saito A,Homma Y,et al. A UDP-glucose:isoflavone 7-O-glucosyltransferase from the roots of soybean(Glycine max)seedlings. Purification,gene cloning,phylogenetics,and an implication for an alternative strategy of enzyme catalysis[J]. Journal of Biological Chemistry,2007,282(32):23581-23590.
Study on the enzymatic properties of Uridine Diphosphate Glucose:phloretin-2′-O-glycosyltransferase fromMalusxDomestica
XU Ying1,2,FAN Ming-tao2,*,ZHANG Ting-jing2,DONG Mei2,HUANG Jia2
(1.School of Food and Biological Engineering,Shaanxi University of Science &Technology,Xi’an 710021,China;2.College of Food Science and Engineering,Northwest A & F University,Yangling 712100,China)
UridineDiphosphateGlucose:phloretin-2′-O-glycosyltransferasefromMalus x Domestica(MdP2’GT)waspurifiedusingtheammoniumsulfateprecipitation,DEAE-Sepharoseanion-exchangeandSephadexG75gelfiltrationchromatographyprocedurestoapparenthomogeneity.Specificactivityforpurifiedenzymewas632.0U/mg.Thepurficationfoldwas71.0andrecoveryratewas42.6%.Themolecularweightwasestimatedtobe50kubySDS-PAGE.ThepurifiedenzymecatalyzedtheglycosylationreactionwithoptimalactivityatpH8.5andwasstableoverarangeofpH7.0~9.0.Theoptimaltemperatureforenzymeactivitywas45 ℃.TheKmvalueforMdP2’GTwasdeterminedtobe3.16μmol/L,andVmaxwas0.77nM/min·mgprotein.Attheconcentrationof5mmol/L,MdP2’GTwasfoundtobeactivatedbythepresenceofCa2+andMg2+ions.TheactivityofMdP2’GTwasnotapparentlyaffectedbyNa+orK+,butitwassignificantlyinhibitedbyAl3+,Cu2+,Mn2+andZn2+.TheinhibitioneffectofCu2+wasthestrongest(p<0.05).MdP2’GTexhibitspHstabilityunderalkalineconditionandthermalstability,whichhaspotentialapplicationsintherespectofenzymaticsynthesisofphloridzin.
UDPG:phloretin-2′-O-glycosyltransferasefromMalus x Domestica;purfication;enzymaticproperty
2016-05-10
徐颖(1978-),女,博士研究生,讲师,主要从事食品生物技术研究,E-mail:xuying@sust.edu.cn。
*通讯作者:樊明涛(1963-),男,博士,教授,主要从事食品生物技术研究,E-mail:fanmt@nwsuaf.edu.cn。
高等学校博士学科点专项科研基金项目(20130204110032);陕西科技大学科研启动金-自然科学预研基金(2016BJ-21)。
TS201.2
A
1002-0306(2016)21-0178-05
10.13386/j.issn1002-0306.2016.21.026

