响应面法优化酶解罗非鱼皮制备抗氧化肽的工艺研究
胡 晓,吴 静,2,王子怀,2,李来好,*,杨贤庆,吴燕燕,林婉玲,陈胜军,黄 卉,姚建玲
(1.中国水产科学研究院南海水产研究所,农业部水产品加工重点实验室,国家水产品加工技术研发中心,广东广州 510300;2.上海海洋大学食品学院,上海 201306;3.广州医科大学附属第二医院,广东广州 510260)
响应面法优化酶解罗非鱼皮制备抗氧化肽的工艺研究
胡 晓1,吴 静1,2,王子怀1,2,李来好1,*,杨贤庆1,吴燕燕1,林婉玲1,陈胜军1,黄 卉1,姚建玲3
(1.中国水产科学研究院南海水产研究所,农业部水产品加工重点实验室,国家水产品加工技术研发中心,广东广州 510300;2.上海海洋大学食品学院,上海 201306;3.广州医科大学附属第二医院,广东广州 510260)
采用响应面分析法对酶法水解罗非鱼皮制备抗氧化肽的工艺条件进行优化。以水解度、DPPH自由基与OH自由基半抑制浓度(IC50)、还原力为评价指标,分析比较了商业蛋白酶中的酸性蛋白酶、中性蛋白酶、碱性蛋白酶、胰蛋白酶、菠萝蛋白酶及木瓜蛋白酶对罗非鱼皮的水解效果及其产物的抗氧化活性,筛选出碱性蛋白酶为最佳水解用酶,并利用响应面分析法对罗非鱼皮酶解条件予以了优化,最终确立的最佳酶解工艺为:pH10.00、反应时间4 h、温度40 ℃、料液比0.38 g/mL,在此条件下产物的还原力为1.054,与模型预测值相吻合,表明了响应面法的有效性。
罗非鱼皮,酶解,抗氧化,响应面法
我国是罗非鱼养殖大国,罗非鱼资源极为丰富,其产量位居世界首位[1-2]。目前,罗非鱼的加工主要以冻全鱼与冻鱼片为主,加工产品的品种较为单一,且其加工过程中会产生大量富含蛋白质的加工副产物,如鱼皮、鱼鳞、鱼骨等。该加工副产物大多用作饲料或肥料,其蛋白质资源未得到充分开发与利用,大大限制了罗非鱼蛋白质的精深加工与高值化利用水平的提升[3-4]。抗氧化肽属小分子物质,其大多由2~20个氨基酸通过特殊序列组成。水产蛋白的肽链中一般蕴含着抗氧化肽功能区,当通过合适的蛋白酶剪切释放后可表现出抗氧化活性。与其他抗氧化剂相比较,天然抗氧化肽具有更高的安全性,且容易被人体消化、吸收,生物利用率更高[5-6]。目前的研究发现,罗非鱼皮中含有抗氧化活性成分[7-9],可以用来制备抗氧化产物。

表1 不同蛋白酶酶解实验条件[10]Table 1 The hydrolytic conditions of enzymes[10]
本研究以罗非鱼皮为原料,以DPPH自由基、OH自由基的清除效果及还原力大小为评价指标,从6种商业酶中筛选出水解罗非鱼皮制备抗氧化活性肽的最佳用酶,在单因素的技术上,应用响应面法优化酶解制备罗非鱼皮抗氧化肽的工艺,旨在为罗非鱼皮的精深加工及高值化利用提供理论依据。
1 材料与方法
1.1 材料与仪器
罗非鱼 购于广州华润万家超市,鲜活即杀,将鱼肉与鱼皮分离,绞碎,-18 ℃冻藏备用。
酸性蛋白酶(≥15000 NFU/mg)、中性蛋白酶(≥100 U/mg)、碱性蛋白酶(21万U/g)、胰蛋白酶(≥250 U/mg)、菠萝蛋白酶(≥120 U/mg)、木瓜蛋白酶(≥800 U/mg) 广州齐云生物技术有限公司;1,1-二苯基-2-三硝基苯肼(DPPH) 美国sigma公司;其他试剂均为分析纯,广州化学试剂厂。
DS-1高速组织捣碎机 上海标本模型厂;DK-S24型恒温水浴锅 上海森信实验仪器厂有限公司;BS224S型电子精密天平 德国Sartorius公司;Delta320精密pH计 梅特勒-托利多仪器(上海)有限公司;HH-4型数显恒温水浴锅 常州澳华仪器有限公司;KjeltecTM2300型蛋白自动分析仪 丹麦FOSS仪器有限公司;3K30型高速冷冻离心机 德国Sigma公司;Synergy H1型酶标仪 美国伯腾仪器有限公司;Akku-drive电位滴定仪 德国赫施曼公司。
1.2 实验方法
1.2.1 罗非鱼皮最佳水解酶的选择 选用酸性蛋白酶、中性蛋白酶、碱性蛋白酶、菠萝蛋白酶、木瓜蛋白酶及胰蛋白酶这6种酶在其各自的最适温度、pH条件下对罗非鱼皮进行水解(水解条件见表1),酶解时间为4 h,冷却后于4 ℃、10000 r/min冷冻离心20 min,取上清液抽滤后即为实验所用的酶解产物。分别测定各酶解产物的水解度、DPPH自由基与OH自由基半抑制浓度(IC50)以及还原力,综合比较后选取一种效果相对较好的酶,综合预实验中单因素实验所得结果进行响应面优化实验。
1.2.2 罗非鱼皮酶解液的水解度测定 采用甲醛电位滴定法[11]测定酶解液中游离氨基态氮含量,半微量凯氏定氮法测定原料总氮含量。
水解度(DH)(%)=酶解液中游离氨基态氮含量/原料总氮含量×100
1.2.3 DPPH自由基清除能力的测定 参照Baen等[12]的方法稍作修改。取2 mL样液,加入0.15 mol/L DPPH(95%乙醇溶解),混匀后于室温下避光反应30 min,在517 nm处测得其吸光值Ai,空白组为2 mL 95%乙醇溶液代替DPPH溶液,加入2 mL样液混匀,在517 nm处测得其吸光值Aj,对照组为2 mL DPPH溶液加入2 mL 95%乙醇,在517 nm处测得其吸光值A0。对样品溶液做梯度稀释,测定不同浓度下的自由基清除率,经线性回归后计算出自由基清除率为50%时的浓度,即IC50值。清除率按以下公式进行计算:
清除率(%)=[1-(Ai-Aj)/A0]×100
式中:A0为对照组吸光值;Ai为样品组吸光值;Aj为空白组吸光值。
1.2.4 OH自由基清除能力的测定 参照Jin等[13]的方法并略作修改。损伤管:取0.6 mL 5 mmol/L邻二氮菲的无水乙醇溶液,先加入0.4 mL 0.15 mol/L的磷酸盐缓冲液(pH7.40)和0.6 mL 0.75 mmol/L的FeSO4,再加入2 mL样品液混匀后,最后加入0.4 mL 0.1%(v/v)的H2O2摇匀,37 ℃下水浴60 min后在536 nm处测定得吸光值为A样品;以去离子水代替样品和H2O2溶液重复上述操作,在536 nm处测得其吸光值为A未损伤;以去离子水代替样品液来重复以上操作,在536 nm处测得吸光度A损伤。对样品溶液做梯度稀释,测定不同浓度下的自由基清除率,经线性回归后计算出自由基清除率为50%时的蛋白浓度,即IC50值。清除率按如下公式进行计算:
清除率(%)=(A样品-A损伤)/(A未损伤-A损伤)×100
式中:A样品为样品组的吸光值;A损伤为损伤管的吸光值;A未损伤为未损伤管的吸光值。
1.2.5 还原力测定 参照Ahmadi等[14]的方法并略有修改。取2 mL酶解液,加入2 mL 0.2 mol/L pH6.6的磷酸缓冲液和2 mL质量分数为1%的铁氰化钾K3Fe(CN)6溶液混匀,在50 ℃水浴锅内保温20 min,加入质量分数为10%的三氯乙酸(TCA)溶液2 mL,震荡混匀后离心(10000 r/mim,10 min)。取2 mL离心后上清液,加入2 mL去离子水和0.4 mL质量分数为0.1%的FeCl3溶液,震荡混匀后50 ℃水浴10 min,等至体系溶液由黄色变为蓝色后在700 nm处测定其吸光度。用去离子水代替样品作为空白对照。
1.2.6 响应面分析实验 在蛋白酶水解底物的过程中,影响酶解反应的因素有反应体系的pH、温度、反应时间、及料液比等。因此,根据在单因素实验中所得结果(pH、酶解时间、酶解温度、料液比对酶解产物的抗氧化活性影响较大,而酶用量影响较小,且pH在10.0,酶解时间在4 h,酶解温度45 ℃,料液比0.38时酶解产物各抗氧化活性最大)选择pH、温度、反应时间和料液比四个因素予以优化。在单因素实验基础上,以还原力为响应值,选择pH(A),时间(B),温度(C),料液比(D)4个变量,采用四因素三水平的Box-Behnken设计(BBD),进行响应面分析实验,响应面中心组合设计实验因素编码值见表2。

表2 BBD响应面分析各因素编码值和实际值Table 2 Independent variables and their coded actual values in BBD
2 结果与讨论
2.1 不同蛋白酶的水解效果比较分析
由图1可知,罗非鱼皮在经不同蛋白酶酶解后的水解度差异较大,其中酸性蛋白酶水解罗非鱼皮的效果较差,水解度仅为6.64%,菠萝蛋白酶与碱性蛋白酶水解罗非鱼皮的效果较好,水解度分别为11.9%、11.4%。在相似酶解条件下,马赛蕊等[15]用木瓜蛋白酶水解罗非鱼肉蛋白,水解度为20.85%。罗非鱼皮水解度相对较低,其原因可能是鱼皮中胶原蛋白含量较高,而胶原蛋白具有三螺旋结构,结构较为致密,与鱼肉相比较难被蛋白酶水解[16]。

图1 不同蛋白酶的水解度Fig.1 Degree of hydrolysis ofdifferent proteases
2.2 罗非鱼皮不同蛋白酶水解产物的抗氧化活性
2.2.1 罗非鱼皮不同蛋白酶水解产物的DPPH自由基清除能力 将6种酶水解罗非鱼皮得到的酶解物作梯度稀释,测定各酶解物清除DPPH自由基半抑制浓度(IC50)以表征其抗氧化能力,结果如图2所示。由图2可知,各蛋白酶水解罗非鱼皮得到的产物对DPPH自由基均表现出一定的清除活性,其中酸性蛋白酶、中性蛋白酶和胰蛋白酶水解产物其清除DPPH自由基IC50值较高,从而表明这三种酶解产物清除DPPH自由基的活性较其他酶解产物要差,而碱性蛋白酶水解产物的IC50值最低,为6.34 mg/mL,表明其对DPPH自由基清除活性最好。夏光华等[17]用包括碱性蛋白酶在内的三种酶水解罗非鱼皮胶原蛋白制得的抗氧化活性肽,其清除DPPH自由基的 IC50为10.78 mg/mL,可见本实验中的酶解产物活性较高。

图2 不同蛋白酶水解产物的 DPPH自由基半抑制浓度(IC50)Fig.2 Scavenging DPPH radical IC50 of tilapia skin hydrolysates
2.2.2 罗非鱼皮不同蛋白酶水解产物OH自由基清除能力 本文采用Fe2+/H2O2体系通过Fenton反应生成OH自由基,对各酶解物进行梯度稀释,测定各酶解物清除OH自由基的半抑制浓度(IC50)以表征其抗氧化能力。如图3所示,碱性蛋白酶水解产物清除OH自由基的IC50值最低,为11.13 mg/mL,其余各酶解物清除OH自由基IC50值均大于15 mg/mL。陈卉卉等[18]报道了木瓜蛋白酶水解东海海参胶原蛋白得到的抗氧化肽活性相对较强,其清除OH自由基的IC50为27.8 mg/mL;白仁奥等[19]采用铁氧化邻二氮菲法考察了文蛤在风味蛋白酶和木瓜蛋白酶双酶复合酶解条件下,酶解产物的OH自由基清除效果,其IC50值为3.47 mg/mL。不同水产蛋白的酶解产物在清除OH自由基能力方面存在较大差异,这与水产蛋白肽链中的氨基酸序列以及所用蛋白酶的酶切位点和水解程度密切相关。

图3 不同罗非鱼皮酶解液OH自由基半抑制浓度(IC50)Fig.3 Scavenging ·OH radical IC50 of tilapia skin hydrolysates
2.2.3 罗非鱼皮不同蛋白酶水解产物的还原力 各酶解产物的还原力如图4所示。由图4可知,各酶解物中,酸性蛋白酶、菠萝蛋白酶以及胰蛋白酶水解产物的还原力相对较差,碱性蛋白酶水解物的还原力最高,其值为0.892。张风等[20]采用响应面法优化了酶解虾头虾壳蛋白质制备抗氧化肽的工艺,在优化后的最佳工艺条件下酶解产物的还原力为0.77,低于罗非鱼皮碱性蛋白酶水解产物。

图4 不同罗非鱼皮酶解液的还原能力Fig.4 Reductive activity of tilapia skin hydrolysates
综上所述,在罗非鱼皮6种蛋白酶水解产物中,碱性蛋白酶水解物对DPPH自由基、OH自由基的清除能力以及还原力均为最强,水解度也较高。由此可见在各酶的最适条件下,碱性蛋白酶水解罗非鱼皮制备抗氧化活性肽的效果最佳。这很可能是因为碱性蛋白酶在水解天然蛋白质时较其他酶有更广泛的酶切位点,其水解出来的短肽序列以及终端氨基酸与许多生物活性相关,其中包括抗氧化活性[21]。此外结合水解度测定结果可以看到,不同蛋白酶水解产物的抗氧化活性与其水解度之间不呈正相关。目前已经见诸报道的大多数抗氧化活性肽的分子量都低于10 u[22],但这并不意味着酶解产物的水解度越高、分子量越小,其抗氧化活性就越强,如Klompong等[23]研究金带细鲹酶解物时,均发现随着水解度增加产物的还原力反而下降。这是因为肽类的氨基酸组成种类、数量及其排列顺序都对其抗氧化活性有重要影响[24]。因此,根据以上实验结果,根据在预实验中单因素实验所得结果选定碱性蛋白酶作为实验用酶并采用响应面法对酶解工艺进行优化。
2.3 响应面分析
2.3.1 响应面实验设计及结果 由表3可知,该实验共有27个实验点,包括12个析因点和3个零点,每个实验点重复3次,根据实验结果来优化4个变量。

表3 BBD响应面实验设计与结果Table 3 Experimental design and results of BBD response surface
注:表中还原力用3次测定平均值±标准差表示(n=3)。2.3.2 回归方程的建立和方差分析 根据表3实验结果计算得到二次回归方程(1)
y=-19.77296-0.094375A+1.68967B+0.60733C+22.022D+0.048AB+0.01135AC-0.099AD-0.0126BC-1.086BD-0.0576CD-0.027802A2-0.16271B2-0.00711333C2-19.20533D2
式(1)
其中A、B、C、D分别代表pH、时间、温度、料液比的各编码值。通过回归方程(1)反映出各因子与响应值之间的关系,具体方差分析结果见表4。

表4 BBD响应面实验结果方差分析Table 4 ANOVA for response surface quadratic model of BBD
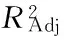
2.3.3 响应面图结果 根据回归方程(1),绘制出三维响应面分析图,分别见图5~图10。

图5 pH和酶解时间对响应值的影响Fig.5 Effect of pH and Hydrolysis Time on Response Value
由图5可知,当pH一定时,响应值随酶解时间的延长而下降。这可能是因为随着时间的延长许多有活性的多肽又逐渐被水解成活性较弱的短肽或氨基酸,造成体系的抗氧化活性下降。反应时间一定时,反应体系pH的改变对响应值影响不大,但整体上是有显著影响的。

图6 pH和温度对响应值的影响Fig.6 Effect of pH and Temperature on Response Value
由图6可知,pH和温度的交互作用对结果影响显著,pH和温度的变化对响应值影响较大,过高或过低的pH及温度都可能降低酶解产物的还原力。

图7 pH和料液比对响应值的影响Fig.7 Effect of pH and Substrate Concentration on Response Value
由图7可知,当pH一定时,响应值随料液比的增大先增大再减小,这是由于当料液比低即加水量大,这意味着溶液中酶的浓度下降,作用于底物的有效酶活降低,从而影响到产物的生成;而浓度高时即加水量小,此时溶液较为粘稠,对反应体系中pH的调节和酶的溶解及均匀混合产生不利影响,因而也造成目标产物中活性成分下降,从而使响应值降低。

图8 酶解时间和温度对响应值的影响Fig.8 Effect of Hydrolysis Time and Temperature on Response Value
图8显示了酶解时间和温度的交互作用,由图可见,时间一定时,响应值随温度升高先增大后减小,表明了过高或过低的温度均影响到酶的活性而不利于其水解底物产生目标物。一定的温度下,响应值随酶解时间延长先升高后降低。

图9 酶解时间和料液比对响应值的影响Fig.9 Effect of Hydrolysis Time and Substrate Concentration on Response Value
由图9可知,其等高线呈椭圆型,表明料液比和酶解时间之间的交互影响较好,该结论与表4回归方程的方差分析结果相一致。

图10 温度和料液比对响应值的影响Fig.10 Effect of Hydrolysis Temperature and Substrate Concentration on Response Value
从图10中可以看出,当温度一定时,料液比的改变对响应值的影响较大。对温度和料液比交互的方差分析结果为不显著,但由图可知,其等高线呈近椭圆型,表明料液比和温度间仍存在一定的交互作用。
2.3.4 验证性实验 根据Design Expert Software(version 8.0.5)软件分析得到碱性蛋白酶水解罗非鱼皮制备抗氧化活性肽的最佳酶解反应条件为:pH10.0、反应时间4 h、温度40 ℃、料液比0.38 g/mL,所得酶解液的还原力最高,为1.000。在最优水解条件下,进行了3组重复性实验,测得优化后的罗非鱼皮蛋白抗氧化活性肽的还原力为1.054±0.057,与模型预测值并无显著性差异(p>0.05),表明实验确定的模型条件可以用于预测实际值。
3 结论
本文以罗非鱼皮为原料,DPPH自由基、OH自由基和还原力为指标,从6种商业酶中筛选出水解罗非鱼皮制备抗氧化活性肽的最适用酶为碱性蛋白酶,其水解度为11.45%,对DPPH自由基和OH自由基的半抑制浓度分别为6.34 mg/mL和11.13 mg/mL,还原力为0.892。
利用响应面分析中心组合设计实验优化碱性蛋白酶水解罗非鱼皮制备抗氧化活性肽的工艺,得到最优酶解条件为:pH10.00、反应时间4 h、温度40 ℃、料液比0.38 g/mL,在此条件下所得酶解物的还原力最高,其值为1.054。优化后罗非鱼皮蛋白抗氧化活性肽的还原力较优化前确有提高。
[1]陈胜军,李来好,杨贤庆,等. 我国罗非鱼产业现状分析及提高罗非鱼出口竞争力的措施[J].南方水产,2007,3(1):75-80.
[2]赵海军,杨彬彬,郝跃,等. 我国罗非鱼出口现状及对策[J].食品安全质量检测学报,2015,6(12):5100-5106.
[3]陈胜军,李来好,杨贤庆,等. 罗非鱼综合加工利用与质量安全控制技术研究进展[J].南方水产科学,2011,7(4):85-90.
[4]叶小燕,曾少葵,余文国,等. 罗非鱼皮营养成分分析及鱼皮明胶提取工艺的探讨[J].南方水产,2008,4(5):54-60.
[5]李致瑜,张翀,田玉庭,等. 大黄鱼内脏抗氧化肽的稳定性研究[J].现代食品科技,2016,32(1):1-11.
[6]王晶,吴燕燕,李来好,等. 合浦珠母贝肉酶解产物的抗氧化稳定性与功能特性[J].食品工业科技,2014,35(13):67-75.
[7]段宙位,申铉日,蔡锦红,等. 罗非鱼皮色素的提取分离及其抗氧化作用研究[J]. 食品研究与开发,2011,32(9):16-20.
[8]庄永亮,张玉锋. 罗非鱼鱼皮抗氧化肽的制备及分离纯化[J]. 昆明理工大学学报:自然科学版,2014,39(1):88-93.
[9]夏光华,申铉日. 罗非鱼鱼皮胶原蛋白抗氧化肽的制备[J]. 渔业科技创新与发展方式转变——2011 年中国水产学会学术年会论文摘要集,2011.
[10]Sung D E,Lee J,Han Y,et al.Effects of enzymatic hydrolysis of buckwheat protein on antigenicity and allergenicity[J]. Nutrition Research and Practice,2014,8(3):278-283.
[11]杨贤庆,吴静,胡晓,等. 响应面法优化酶解鸢乌贼制备抗氧化肽的工艺研究[J].食品工业科技,2016,37(11):242-248.
[12]Bae S H,Suh H J. Antioxidant activities of five different mulberry cultivars in Korea[J]. LWT-Food Science and Technology,2007,40(6):955-962.
[13]Jin Ming,Cai Yaxin,Li Jinrong,et al. 1-10Phenanthroline-Fe2+oxidative assay of hydroxyl radical produced by H2O2/Fe2+[J]. Progress in Biochemistry and Biophysics,1996,23(6):553-555.
[14]Ahmadi F,Kadivar M,Shahedi M. Antioxidant activity of KelussiaodoratissimaMozaff in model and food systems[J]. Food Chemistry,2007,105(1):57-64.
[15]马赛蕊,胡晓,吴燕燕,等. 罗非鱼肉蛋白酶解液的抗氧化活性[J]. 食品科学,2012,33(19):52-56.
[16]刘小玲,林莹,尹秀华,等. 罗非鱼皮胶原肽的制备及抗氧化活性研究[J].食品与机械,2007,23(3):92-95.
[17]夏光华,申铉日,蔡锦红,等. 三酶法制备罗非鱼鱼皮胶原蛋白抗氧化肽及活性研究[J]. 食品科学,2012,33(23):175-179.
[18]陈卉卉,于平,励建荣. 东海海参胶原蛋白多肽的制备及清除自由基功能研究[J]. 中国食品学报,2010(1):19-25.
[19]白仁奥,马英,何传波,等. 文蛤蛋白酶解条件的优化及酶解产物体外抗氧化活性的分析[J]. 中国农学通报,2013,29(11):44-49.
[20]张风,夏旭,周爱梅,等. 虾头虾壳蛋白质酶解制备抗氧化肽的研究[J].南方水产科学,2015,11(6):79-87.
[21]Hyun C K,Shin H K. Utilization of bovine blood plasma proteins for the production of angiotensin I converting enzyme inhibitory peptides[J]. Process Biochemistry,2000,36(1):65-71.
[22]SilaA,Bougatef,A. Antioxidant peptides from marine by-products:Isolation,identification and application in food systems[J]. Journal of Functional Foods,2016,21:10-26.
[23]Klompong V,Benjakul S,Kantachote D,et al. Antioxidative activity and functional properties of protein hydrolysate of yellow stripe trevally(Selaroidesleptolepis)as influenced by the degree of hydrolysis and enzyme type[J]. Food chemistry,2007,102(4):1317-1327.
[24]Lu R-R,Qian P,Sun Z,et al. Hempseed protein derived antioxidative peptides:Purification,identification and protection from hydrogen peroxide-induced apoptosis in PC12 cells[J]. Food Chemistry,2010,123(4):1210-1218.
Optimization of preparation of Tilapia skin antioxidative peptides with enzymatic hydrolysis by response surface methodology
HU Xiao1,WU Jing1,2,WANG Zi-huai1,2,LI Lai-hao1,*,YANG Xian-qing1,WU Yan-yan1,LIN Wan-ling1,CHEN Sheng-jun1,HUANG Hui1,YAO Jian-ling3
(1.South China Sea Fisheries Research Institute,Chinese Academy of Fishery Sciences,Key Laboratory of Aquatic Product Processing,Ministry of Agriculture;National R&D Center for Aquatic Product Processing,Guangzhou 510300,China;2.College of Food Science and Technology,Shanghai Ocean University,Shanghai 201306,China;3.The Second Affiliated Hospital of Guangzhou Medical University,Guangzhou 510260,China)
ResponsesurfacemethodswereusedtooptimizethehydrolysisconditionsofTilapiaskinforproductionofantioxidantpeptides.HalfinhibitoryconcentrationsofDPPHradical,hydroxylfreeradicalandreducingpowercapacitywereselectedastheindexestocomparetheeffectofhydrolysisandproductantioxidantactivityof6kindsofcommercialenzymes(acidprotease,neutralprotease,alkalineprotease,trypsin,bromelainandpapain).Theresultshowedalkalineproteasewasoptimumenzyme.Thenthehydrolysisconditionswasoptimizedbyresponsesurfacemethodology.ThehydrolysisconditionswerepH10.00,hydrolysistimeof4h,hydrolysistemperatureof40 ℃,ratioofmaterialtowaterof0.38g/mL.Undersuchconditions,thereducingpowerwas1.054,whichwasconsistentwiththemodelprediction.
tilapiaskin;enzymolysis;antioxidant;responsesurfacemethodology
2016-04-27
胡晓(1981-),男,博士,副研究员,研究方向:食品生物技术、水产品加工与质量安全,E-mail:wjjingwu@126.com。
*通讯作者:李来好(1963-),男,博士,研究员,研究方向:水产品加工与质量安全,E-mail:laihaoli@163.com。
国家现代农业产业技术体系建设专项(CARS-49);国家自然科学基金青年科学基金项目(31301454);中国水产科学研究院基本科研业务费专项项目(2016ZD10);“十二五”国家科技支撑计划项目(2012BAD28B06);广东省海洋渔业科技与产业发展专项科技攻关与研发项目(A201401C02,Z2015008);农业部水产品加工重点实验室开放基金课题(NYJG201405)。
TS254.9
B
1002-0306(2016)21-0195-07
10.13386/j.issn1002-0306.2016.21.029

