野生枝瑚菌多糖的提取及单糖组成分析
徐红霞,蒋媛媛,洪雅雯,应铁进
(浙江大学食品科学与营养系,浙江杭州 310058)
野生枝瑚菌多糖的提取及单糖组成分析
徐红霞,蒋媛媛,洪雅雯,应铁进*
(浙江大学食品科学与营养系,浙江杭州 310058)
为探索野生枝瑚菌多糖水浸提的最佳条件,在单因素实验基础上,采用合理的实验设计方案,应用响应面分析法优化野生枝瑚菌多糖的提取条件,并采用柱前衍生高效液相色谱法测定野生枝瑚菌多糖的单糖组成。根据回归分析得到野生枝瑚菌粗多糖的最佳提取条件为温度91 ℃,水料比32∶1(mL/g),时间3.2 h,在此条件下野生枝瑚菌多糖得率为1.97%。高效液相色谱分析结果表明枝瑚菌多糖由甘露糖、核糖、葡萄糖、半乳糖、木糖、岩藻糖六种单糖组成,各组分摩尔比为:45.8∶10.6∶76.4∶8.53∶4.63∶5.24。实验结果表明,响应面法对野生枝瑚菌多糖的提取条件优化合理可行,PMP-HPLC法,可用于测定野生枝瑚菌多糖中单糖的组成。
响应面分析法,野生枝瑚菌多糖,提取工艺,单糖组成
食用菌多糖是食用菌子实体,或菌丝中存在的一类活性多糖,具有广泛的药理活性[1]和保健作用。食用菌多糖具有抗肿瘤、抗氧化、抗病毒、调节免疫机能、降血脂等生物活性[2],具有很好的研究与开发价值。
野生枝瑚菌(Ramariasp.)又名扫帚菌,刷把菌,属于非褶菌目,枝瑚菌科,枝瑚菌属,是一种常见的真菌科类,子实体中等大小,多分枝形成稠密的细枝,呈珊瑚状,夏秋季在山区云杉等针叶林中地上的落叶层或枯枝,落果上群生,往往密集在一起,该科各属含有很多别具风味的食用菌,是我国野生食用菌资源中宝贵的组成部分[3]。据报导部分枝瑚菌对小白鼠肉瘤(S-180)和艾氏癌(EC)有较强抑制作用[4],所以该类真菌很有研究价值。目前国内外对枝瑚菌多糖提取工艺的研究报道较少[5-6],而且未见关于枝瑚菌多糖单糖组成的报道。本研究以采自贵州的野生枝瑚菌为原料,在单因素实验的基础上进行响应面优化实验,以多糖得率为指标研究枝瑚菌多糖的最佳提取工艺,并采用柱前衍生高效液相色谱法测其单糖组成。为今后进一步研究和开发野生枝瑚菌资源提供理论依据。
1 材料与方法
1.1 材料与仪器
野生枝瑚菌鲜品购于贵州婷婷野生食用菌批发中心,晾干备用;葡萄糖,无水乙醇,浓硫酸,苯酚,三氯甲烷,正丁醇,三氟乙酸,1-苯基-3-甲基-5-吡唑啉酮(PMP),氢氧化钠,盐酸 均为分析纯;乙腈 色谱纯,单糖标品购自sigma公司。
TU-1810紫外-可见分光光度计 普析通用;SHZ-D(Ⅲ)循环水真空泵 杭州明远仪器有限公司;HH-S电热恒温水浴锅 上海博讯实业有限公司;电热鼓风干燥箱 上海福玛实验设备有限公司;飞利浦搅拌机 飞利浦家庭电器有限公司;高效液相色谱仪LC-20AD 日本岛津。
1.2 提取方法及纯化
野生枝瑚菌干品→去杂,洗净→50 ℃烘干至恒重→热水浸提→离心抽滤,收集水提液→减压浓缩→加入三倍体积无水乙醇4 ℃醇沉过夜→离心收集沉淀→低温烘干得多糖粗提物[7]
将粗提物溶于水,经sevage法除蛋白,AB-8大孔吸附树脂脱色,透析后冷冻干燥,用于单糖组成分析。
1.3 多糖含量测定
多糖含量的测量方法选用苯酚-硫酸法[8-10]。每组实验重复3次。
多糖得率(%)=(m/M)×100
注:m-多糖粗提物质量;M-样品质量。
1.4 单因素实验
本实验在水料比20∶1 (mL/g),提取时间2 h,提取一次的前提下,提取温度分别选60、70、80、90、100 ℃这五个水平进行实验;在提取温度为80 ℃,提取时间2 h,提取一次的前提下,水料比分别选10∶1、20∶1、30∶1、40∶1、50∶1(mL/g)这五个水平进行实验;在提取温度为80 ℃,水料比20∶1,提取一次的前提下,提取时间分别选1、2、3、4、5 h这五个水平进行实验;在提取温度为80 ℃,在水料比20∶1 (mL/g),提取时间2 h的前提下,以上一次提取多糖后的残渣为原料进行提取,分别计算提取一次、提取两次、提取三次、提取四次多糖的得率。每组平行三次,计算野生枝瑚菌多糖得率。
1.5 响应面优化实验
[11-13]的方法,根据单因素实验结果,通过Design-Expert8.0.6软件,采用Box-benhnken中心组合实验设计,采用三因素三水平响应面分析法,以确定最优提取工艺,响应值Y为多糖得率(%)。
因素及水平见表1。
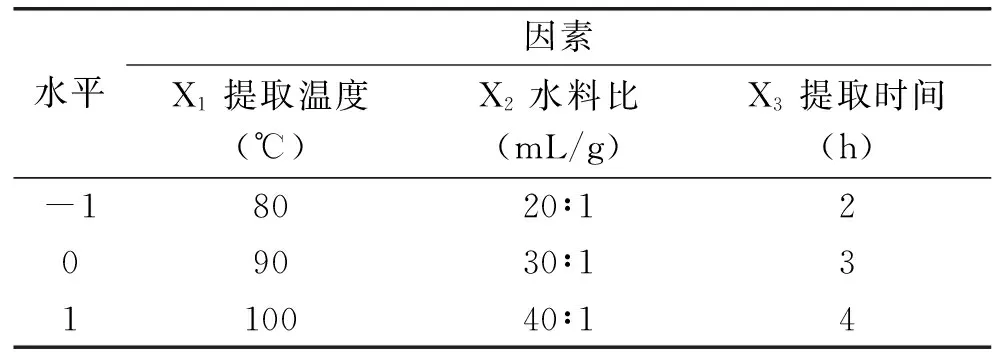
表1 响应面分析因素水平编码表Table 1 Experiment factors,level and code
1.6 野生枝瑚菌多糖的单糖组成分析
衍生物的制备[14-15]:称取5 mg多糖于具塞试管,加2 mL 2 mol/L三氟乙酸(TFA),混匀封管,110 ℃水解4 h。减压蒸干,再加甲醇3 mL蒸干,重复三次,除尽TFA,加0.5 mL水溶解,离心,取100 μL上清液于离心管,加入100 μL 0.5 mol/L的PMP-甲醇溶液,100 μL 0.3 mol/L的氢氧化钠混合均匀,然后70 ℃水浴30 min,取出冷却,加入100 μL 0.3 mol/L的盐酸中和,加1 mL水和1 mL氯仿萃取,弃去氯仿层,共萃取3次,上清液过0.45 μm滤膜转移到进样瓶备用。
衍生物的液相色谱条件:紫外检测器 250 nm,流速 1.0 mol/min,柱温 25 ℃,进样体积10 μL,运行时间35 min。
流动相A:15%乙腈+0.05 mol/L磷酸缓冲液(KH2PO4-NaOH,pH6.9)
流动相B:40%乙腈+0.05 mol/L磷酸缓冲液(KH2PO4-NaOH,pH6.9)
梯度模式:时间梯度0→10→25→30 min,对应溶剂B质量浓度梯度0→18%→25%→30%。
对照标准单糖:葡糖糖(Glu)、甘露糖(Man)、半乳糖(Gal)、核糖(Rib)、鼠李糖(Rha)、木糖(Xyl)、岩藻糖(Fuc)做同样处理。
1.7 数据统计分析
运用SPSS16.0对数据进行统计分析,并用Origin8.0作图。
2 结果与分析
2.1 单因素实验结果与分析
2.1.1 提取温度对多糖得率的影响 由图1可以看出,在60~90 ℃范围内,随着温度的升高多糖的得率逐渐增加,当温度超过90 ℃后,多糖的得率开始下降。这主要是由于在高温作用下,水溶性多糖的结构遭到破坏,造成多糖得率下降。因此适宜的提取温度为90 ℃左右。
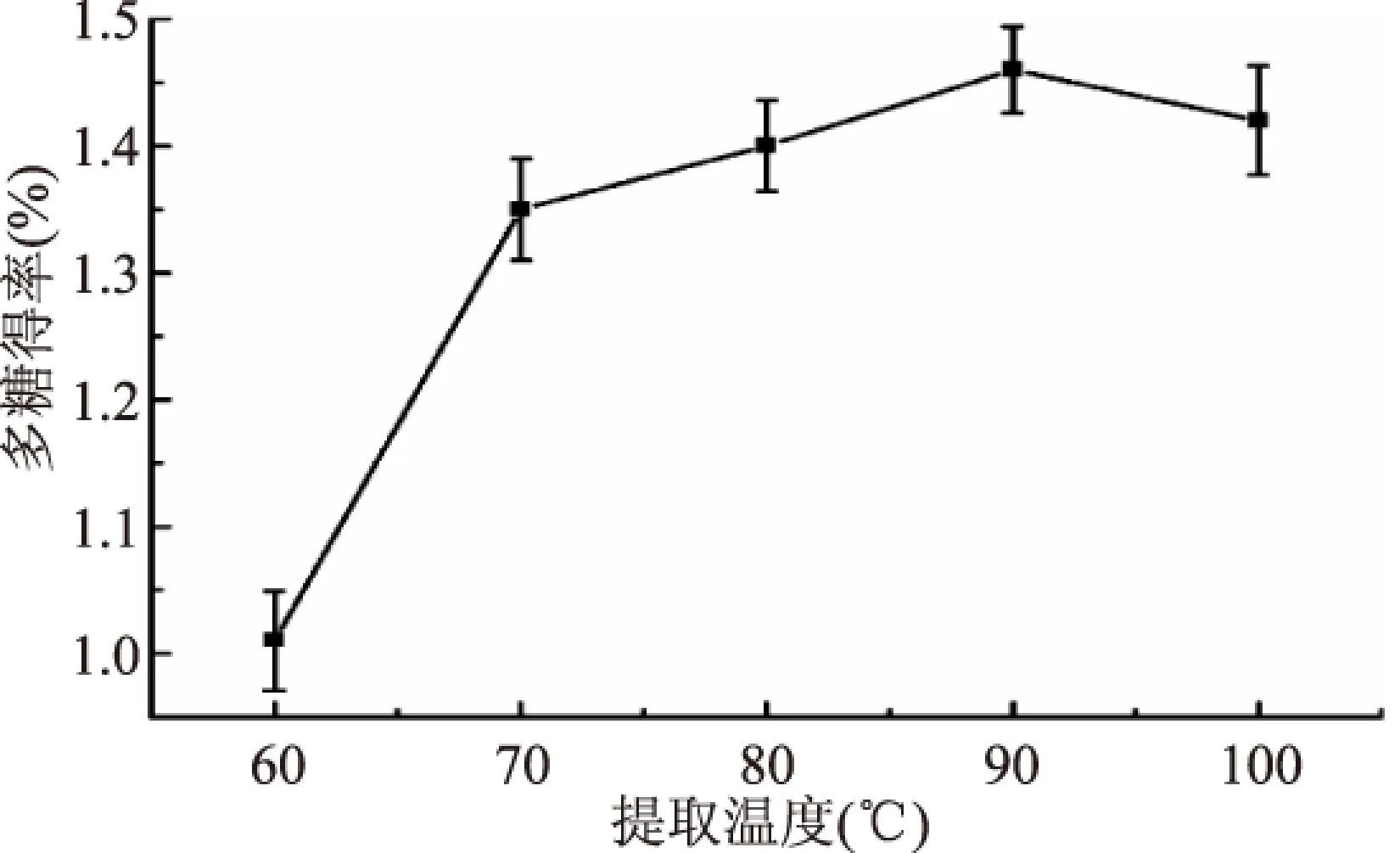
图1 提取温度对多糖得率的影响Fig.1 Effect of temperature on extraction yield of polysaccharides
2.1.2 水料比对多糖得率的影响 由图2可知,在一定范围内,多糖得率随水料比的升高而逐渐增多,而当水料比超过30∶1 (mL/g)时多糖的得率开始下降,水料比太小物料无法充分溶解导致得率偏低,水量多些有利于多糖的扩散传质,但水量过多也会增加后续蒸发浓缩时间,从实验结果可知水料比30∶1 (mL/g)较为合适。
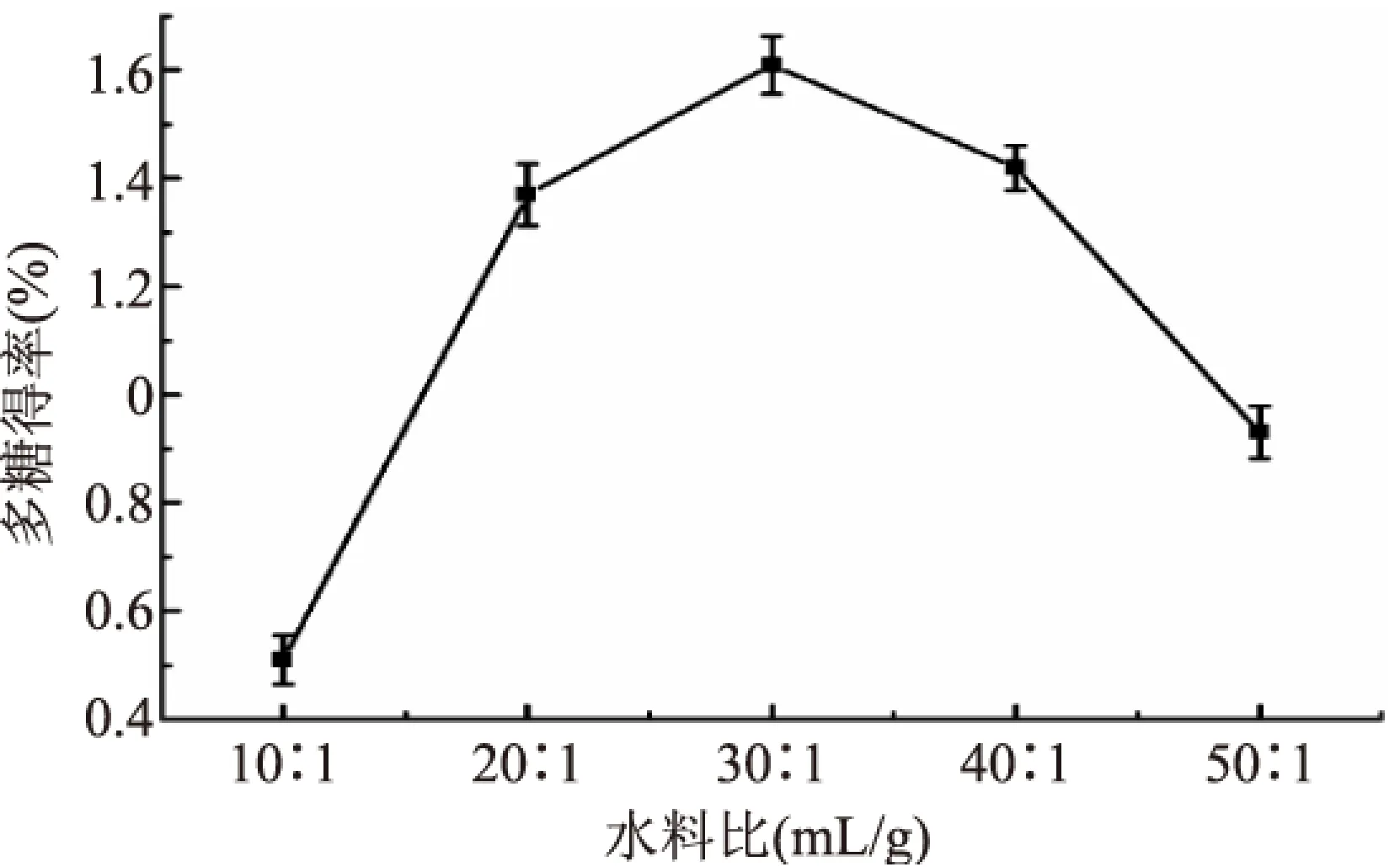
图2 水料比对多糖得率的影响Fig.2 Effect of ratios of water to materials on extraction yield of polysacchariedes
2.1.3 提取时间对多糖得率的影响 由图3可知,多糖得率随时间的延长而增加,到3 h到达最大值随后开始下降,因此提取时间在3 h左右为宜。时间过短多糖溶解不充分未被充分提取,时间过长又容易引起多糖降解及结构的变化,甚至使其中的五碳环或六碳环裂解而转变为可溶于乙醇的单糖、寡糖或低聚糖,在醇沉过程中有所损失,最终会导致多糖得率的下降[16]。
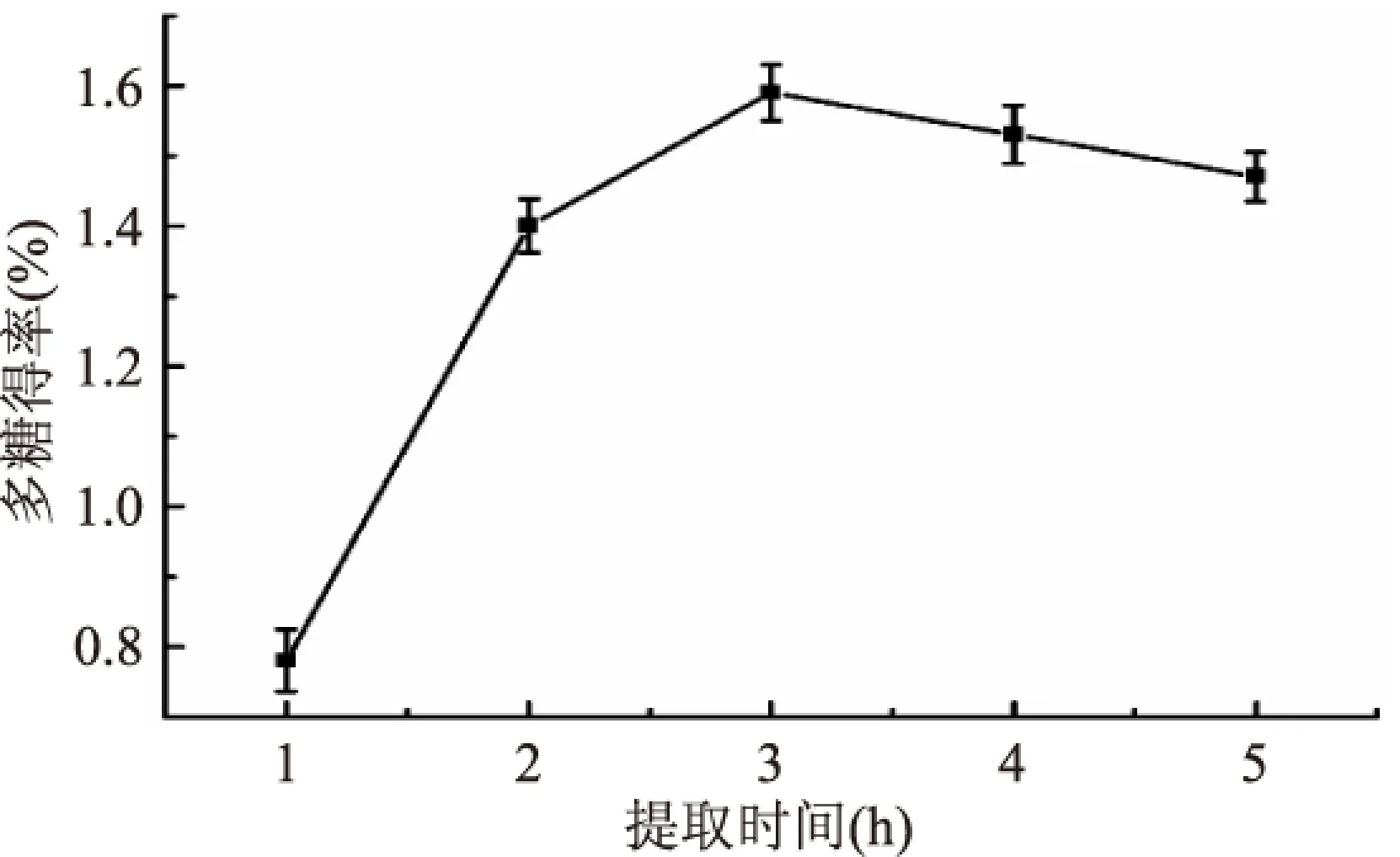
图3 提取时间对多糖得率的影响Fig.3 Effect of time on extraction yield of polysacchariedes
2.1.4 提取次数对多糖得率的影响 由图4可以看出提取一次就可以把大部分的多糖提取出来,而且增加提取次数不但耗能而且耗时,从节能省耗、减少操作工序考虑提取一次即可。

图4 提取次数对多糖得率的影响Fig.4 Effect of the extract times on the yield of polysaccharides
2.2 响应面分析结果
采用Design-Expert软件,对实验结果进行回归分析,实验方案及结果见表2,分析结果见表3。
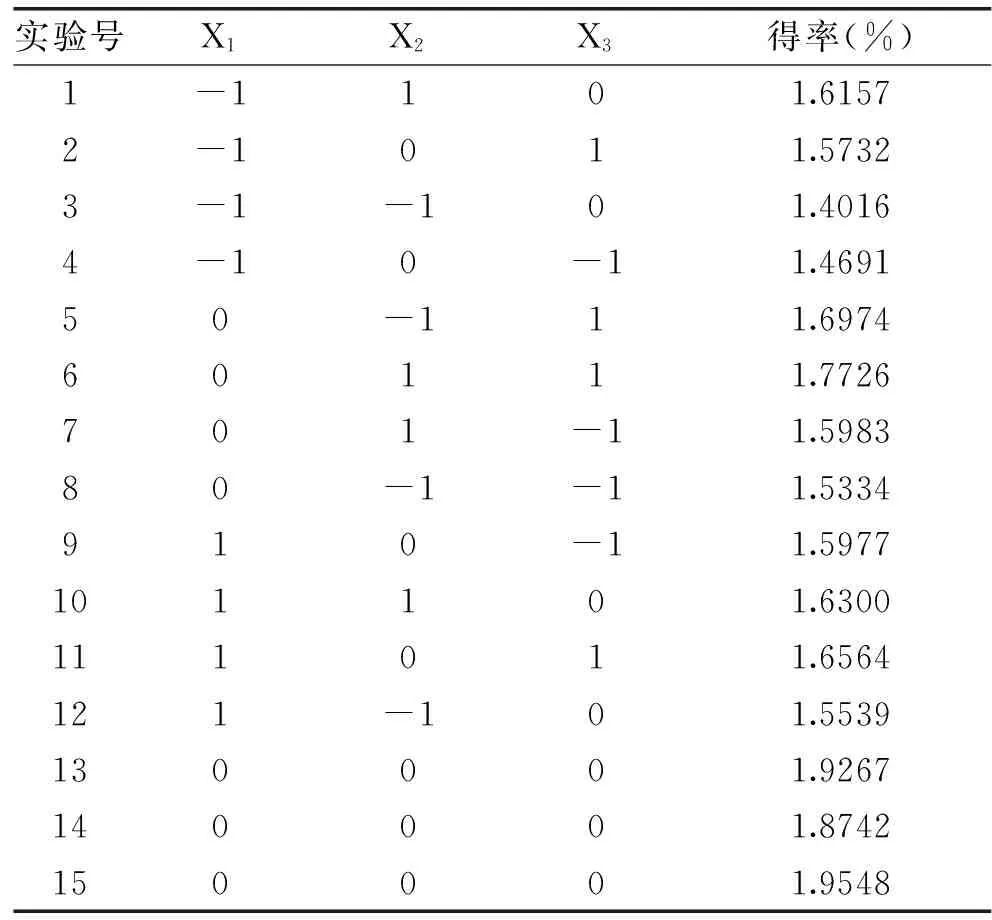
表2 响应面实验安排及结果Table 2 RSM design and polysaccharides yield
注:共有15个实验,其中1~12为析因实验,13~15为中心实验,用以估计误差。
三个因子经过拟合得到的回归方程为:Y(%)=1.92+0.041X1+0.054X2+0.069X3-0.034X1X2+1.15×10-3X1X3+2.575×10-3X2X3-0.23X12-0.14X22-0.13X32
将建立的回归模型中的任一因素固定在零水平,得到另外2个因素的交互影响结果。
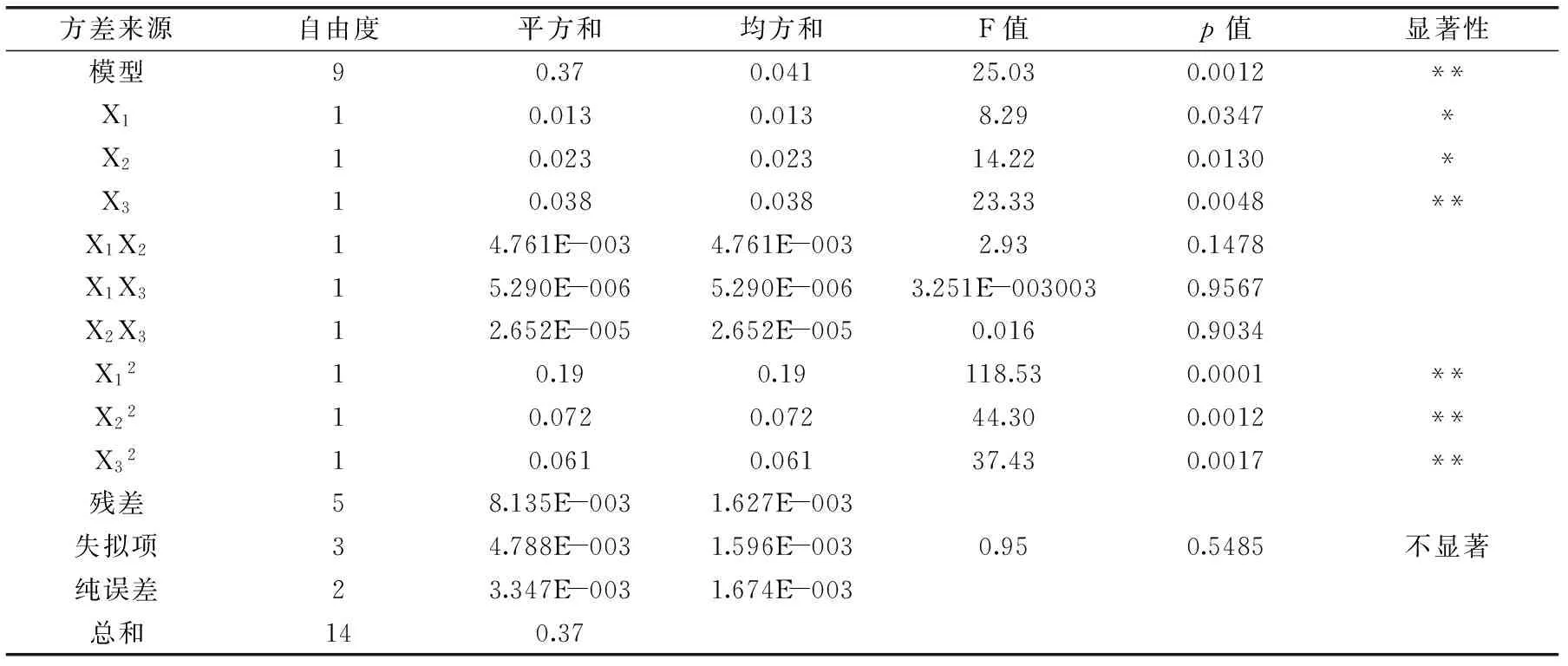
表3 回归方程方差分析表Table 3 Analysis of variance of regression equation
2.2.1 温度和水料比对多糖得率的影响 图5是温度和水料比交互作用对多糖得率的影响。由图可知温度和水料比两者的交互作用比较明显,当温度不变时,野生枝瑚菌多糖的得率随着水料比的增大表现为先上升后下降,当水料比不变时,多糖得率随温度的升高表现为先上升后下降。从图中响应面的最高点和等值线可以看出在所选范围内存在极值,既是响应面的最高点也是等值线最小椭圆的中心点。
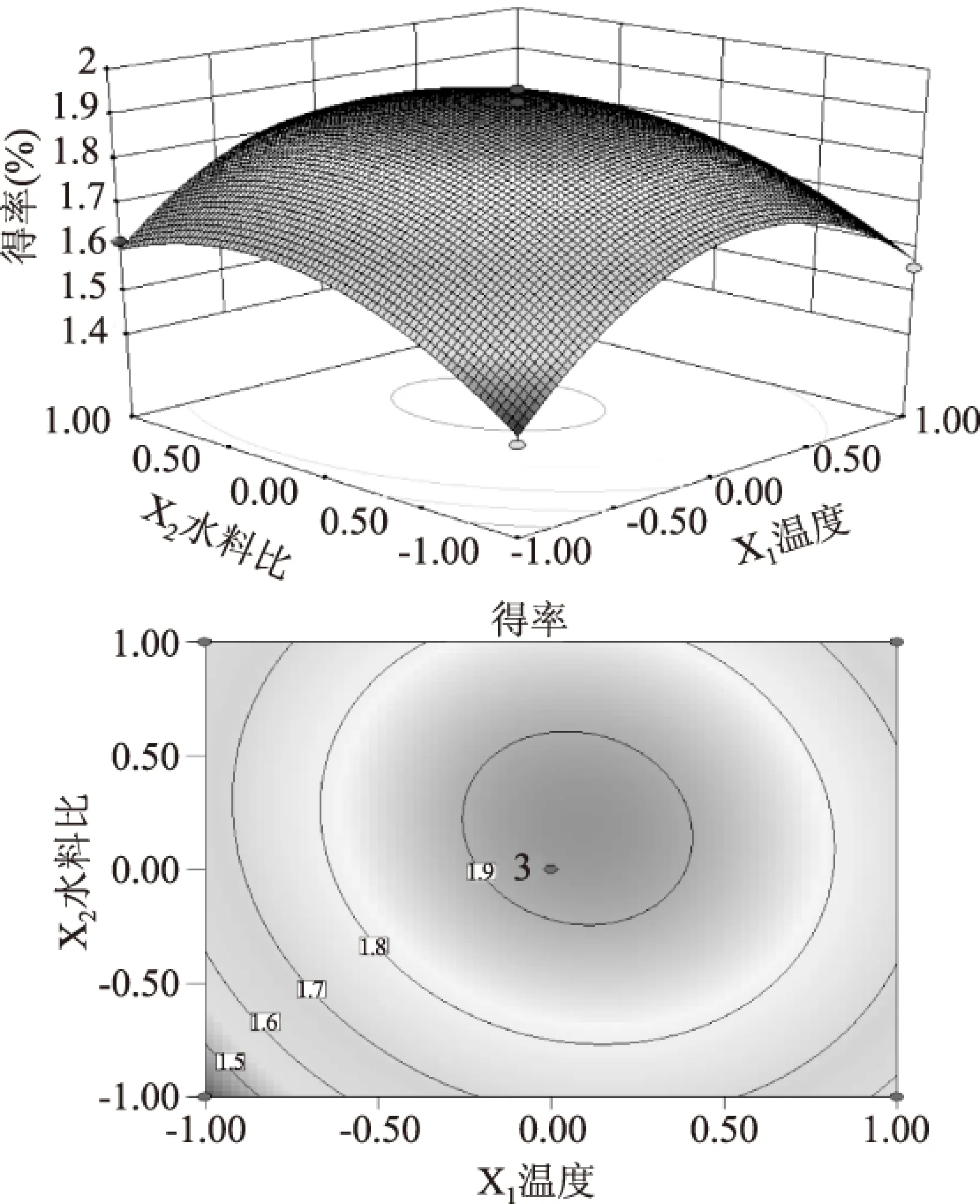
图5 浸提温度、水料比及其交互作用 对多糖得率的影响的响应面和等高线Fig.5 Response surface diagram and contour plot of extraction temperature and extraction time on Y
2.2.2 温度和时间对多糖得率的影响 图6可以看出当水料比为20∶1(mL/g)时,随着时间的增加多糖得率也逐渐增大,而后稍有下降,随着温度的升高多糖得率先增加后下降,多糖得率的变化速率显示时间的效应大于温度。提取温度过高、时间过长会导致一些大分子多糖降解。

图6 浸提温度和时间对多糖得率的影响响应面和等值线图Fig.6 Response surface diagram and contour plot of extraction temperature and extraction time on Y
2.2.3 水料比和时间对多糖得率的影响 由图7可以看出,相对于水料比,浸提时间对野生枝瑚菌多糖得率的影响较为显著,表现为曲线较陡,等高线密集,随着水料比的增加多糖得率先增加后减小,水料比适宜细胞升温快,细胞壁能较快破裂,多糖得率高,随着液料比增加细胞升温缓慢,破壁效应减小,多糖得率降低。因此提取时间不宜过长水料比不宜过大。
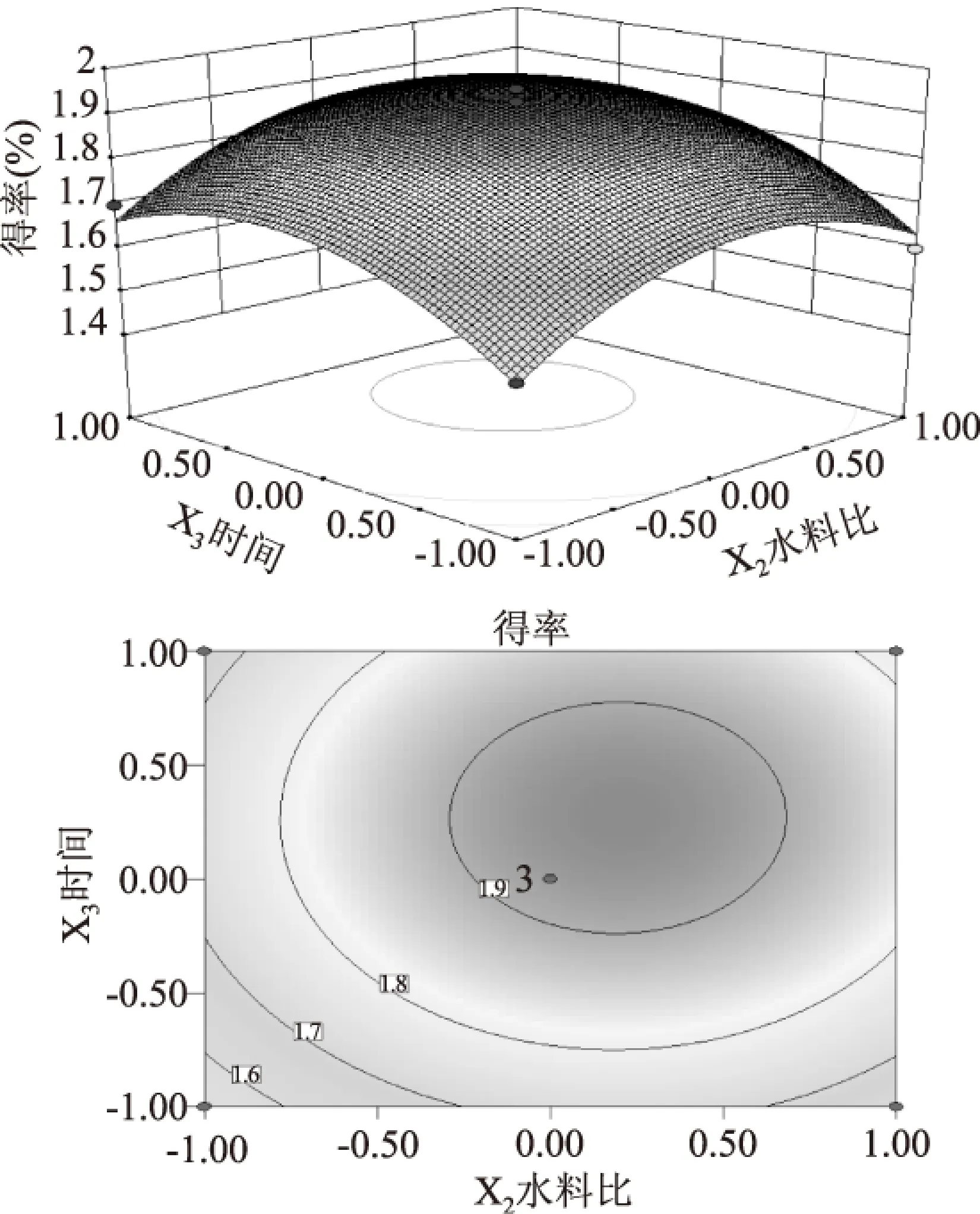
图7 水料比和时间对多糖得率影响的响应面和等值线图Fig.7 Response surface diagram and contour plot of water to materials ratio and extraction time on Y
2.2.4 最佳工艺参数的确定 由Design-Expert 8.0.6软件分析得到最大响应值(Y)时,X1,X2,X3对应的编码值分别为0.08,0.19,0.27。与其对应的野生枝瑚菌粗多糖的最佳提取条件为提取温度90.8 ℃,水料比31.9∶1(mL/g),提取时间3.27 h,在此条件下野生枝瑚菌粗多糖得率的理论值为1.9358%,为了检验响应面法的可行性,采用得到的最佳提取条件进行野生枝瑚菌粗多糖提取的验证实验。考虑到实际可操作性,将优化参数设置为提取温度91 ℃,水料比32∶1(mL/g),提取时间3.2 h。
采用上述优化参数提取野生枝瑚菌多糖,测得3次验证实验结果平均值为1.9663%,与理论值相差0.031%,相差不大。因此响应面法优化得到的野生枝瑚菌粗多糖的提取工艺参数是可行的。
2.3 野生枝瑚菌多糖的单糖组成分析
经柱前衍生化高效液相色谱分析得到野生枝瑚菌多糖由甘露糖、核糖、葡萄糖、半乳糖、木糖、岩藻糖六种单糖组成,各组分摩尔比为:45.8∶10.6∶76.4∶8.53∶4.63∶5.24。野生枝瑚菌多糖主要由甘露糖和葡萄糖两种单糖组成。
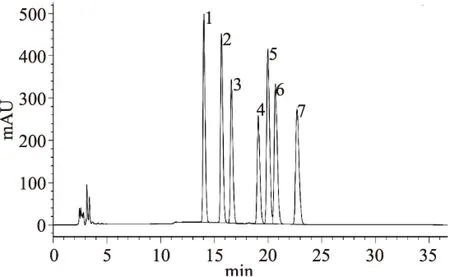
图8 7种单糖标品混合物的高效液相色谱图Fig.8 The HPLC chromatograms of mixture of seven standard monosaccharide注:1.甘露糖;2.核糖;3.鼠李糖;4.葡萄糖; 5.半乳糖;6.木糖;7.岩藻糖,图9同。
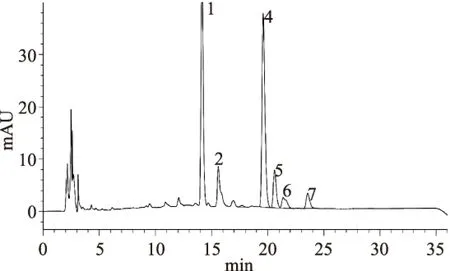
图9 枝瑚菌多糖高效液相色谱图Fig.9 The HPLC chromatograms of Ramaria mushroom polysaccharide
3 结论
通过单因素实验设计,以及在单因素实验基础上通过三因素三水平响应面法实验,应用Design-Expert8.0.6软件,采用Box-Behnken Design建立野生枝瑚菌多糖提取的数学模型为:Y(%)=1.92+0.041X1+0.054X2+0.069X3-0.034X1X2+1.15×10-3X1X3+2.57510-3X2X3-0.23X12-0.14X22-0.13X32;提取工艺的优化参数为提取温度91 ℃,水料比32∶1(mL/g),提取时间3.2 h。按此条件提取野生枝瑚菌多糖得率为1.97%,与理论值相对误差仅1.58%,说明建立的模型能很好的预测各因素与多糖得率之间的关系,响应面分析法优化野生枝瑚菌多糖的提取工艺是可行的。
运用高效液相色谱法对野生枝瑚菌多糖的单糖组分进行分析表明,枝瑚菌多糖由甘露糖、核糖、葡萄糖、半乳糖、木糖、岩藻糖六种单糖组成,各组分摩尔比为:45.8∶10.6∶76.4∶8.53∶4.63∶5.24。
参考文献
[1]葛玉,肖红,张欣,等. 真菌多糖的研究开发现状[J]. 食品研究与开发,2005,26(1):23-25.
[2]钟耀广,刘长江,林楠,等. 食用菌活性成分研究现状[J]. 食品研究与开发,2007,28(10):170-172.
[3]中国大型真菌[M]. 郑州:河南科学技术出版社,2000.
[4]卯晓岚.食用珊瑚菌[J].中国食用菌,1987,6(1):22-24.
[5]苏凤贤,杨全文,李彩霞,等. 密枝瑚菌多糖提取工艺参数优化[J]. 天然产物研究与开发,2011,23(4):751-754.
[6]李华,窦晓兰,陆启玉. 葡萄状枝瑚茵粗多糖的提取及其清除 DPPH 自由基活性[J]. 食用菌学报,2012,19(3):69-72.
[7]陈耀华,陈健. 响应面法优化鸡枞菌多糖的提取工艺[J]. 现代食品科技,2012,28(5):541-544.
[8]贺红星,张霁红,赵瑛,等. 苯酚-硫酸法测定普鲁兰含量[J]. 农产品加工. 学刊,2008(12):15-18.
[9]王超,张曜武. 苯酚-硫酸法的改进发展[J]. 天津化工,2011,25(6):16-18.
[10]刘涛,尼珍,陈蓉. 苯酚-浓硫酸法测定西藏天麻中多糖含量的条件优化[J]. 广东农业科学,2011,38(8):132-134.
[11]刘振学,黄仁和,田爱民. 实验设计与数据处理[M]. 北京:化学工业出版社,2005.
[12]Quan Y,Yang S,Wan J,et al. Optimization for the extraction of polysaccharides from Nostoc commune and its antioxidant and antibacterial activities[J]. Journal of the Taiwan Institute of Chemical Engineers,2015.
[13]秦俊哲,程伟,张慧洋. 响应面法优化桑黄菌丝体多糖的热水提取工艺[J]. 食品科技,2012(2):218-221.
[14]冯学珍,陈颖,伍善广. 石莼多糖的单糖组成成分分析[J]. 食品工业科技,2014,35(7):91-94.
[15]伍善广,冯学珍,陈颖,等. 高效液相色谱法测定金钱菇多糖的单糖组成[J]. 广西植物,2014,2:010.
[16]Zhao B,Zhang J,Guo X,et al. Microwave-assisted extraction,chemical characterization of polysaccharides from Lilium davidii var. unicolor Salisb and its antioxidant activities evaluation[J]. Food Hydrocolloids,2013,31(2):346-356.
Extraction and analysis of monosaccharide compositions of wildRamariasp. polysaccharide
XU Hong-xia,JIANG Yuan-yuan,HONG Ya-wen,YING Tie-jin*
(Department of Food Science and Nutrition,Zhejiang University,Hangzhou 310058,China)
TooptimizetheextractionconditionsforthepolysaccharidesfromRamariasp.,basedonthesinglefactortrials,theresponsesurfacemethodologywereapplied.Usingthehighperformanceliquidchromatographyforthedeterminationofthemonosaccharidecomposition.Theresultsshowedthattheoptimumextractionconditionswasasfollows:temperature91 ℃,water-to-material-ratio32∶1(mL/g),time3.2h.Undertheseconditions,theactualextactionratewas1.97%.ThePMP-HPLCresultsshowedthattheRamariasp.polysaccharideswascomposedofmannose,ribose,glucose,galatose,xylose,andfucoseandtheirmolarratiowasabout45.8∶10.6∶76.4∶8.53∶4.63∶5.24.Conclusion:TheRSMmethodcouldbeusedforoptimizingtheextractionconditionofRamariasp.polysaccharidesandthePMP-HPLCmethodcouldbeusedfordeterminationofpolysaccharidecompositions.
surfaceresponsemethodology;wildRamariasp.polysaccharide;extractiontechnique;momosaccharidecomposition
2016-05-30
徐红霞(1991-),女,硕士研究生,研究方向:天然产物活性成分,E-mail:hongxiaxu35@163.com。
*通讯作者:应铁进(1958-),男,博士,教授,研究方向:农产品采后生理和储运保鲜,E-mail:tjying@zju.edu.cn。
浙江大学馥莉食品研究院资助项目(KY201405)。
TS201.1
B
1002-0306(2016)21-0255-05
10.13386/j.issn1002-0306.2016.21.040

